p-ERK1/2在抗体介导的慢性排斥反应患者移植肾组织中的表达及意义
2015-03-24王保瑶陈怀周邹和群眭维国
晏 强,姜 华,王保瑶,陈怀周,董 力,邹和群,眭维国
肾脏替代治疗专栏
·论著·
p-ERK1/2在抗体介导的慢性排斥反应患者移植肾组织中的表达及意义
晏 强,姜 华,王保瑶,陈怀周,董 力,邹和群,眭维国
目的 探讨移植肾组织中磷酸化细胞外信号调节激酶(p-ERK)1/2的表达,并分析其与肾间质纤维化及肾小管萎缩(interstitial fibrosis and tubular atrophy, IF/TA)的关系。方法 检测解放军181医院全军器官移植与透析治疗中心收治的120例病理诊断符合抗体介导的慢性排斥反应(chronic antibody-mediated rejection, ABMR)患者移植肾组织中p-ERK1/2、TGF-β1和Ⅳ型胶原的表达情况,并进行半定量分析,分析p-ERK1/2表达与TGF-β1、Ⅳ型胶原表达的相关性,以及p-ERK1/2与IF/TA病理分级的相关性;以10例正常肾组织作为对照组。结果 ABMR患者移植肾组织中p-ERK1/2、TGF-β1和Ⅳ型胶原表达量均比正常肾组织明显增加(P<0.05),并随着IF/TA病理分级增加呈递增趋势(r=0.938、0.926、0.937,P<0.05)。移植肾组织中p-ERK1/2表达与TGF-β1、Ⅳ型胶原表达呈显著正相关(r=0.864、0.878,P<0.01)。结论 p-ERK1/2和TGF-β1可能促进了肾移植患者移植肾细胞外基质(ECM)异常沉积,而导致移植肾纤维化,p-ERK1/2在ABMR所致移植肾纤维化过程中起重要作用。
肾移植;磷酸化细胞外调节激酶1/2;抗体介导的慢性排斥反应;转化生长因子-β1;Ⅳ型胶原;肾间质纤维化及肾小管萎缩
肾移植是目前治疗肾功能不全尿毒症期肾病(ESRD)最有效的方法,可极大提高患者的生存率和生活质量,随着移植技术的不断完善和新型免疫抑制剂的出现,使得移植后急性排斥反应发生率明显下降,患者短期存活率明显升高,但移植肾半寿期及长期存活率提高不明显。抗体介导的慢性排斥反应(chronic antibody-mediated rejection, ABMR)已经成为阻碍移植肾长期存活的主要原因之一,其病理变化主要表现为:移植肾间质纤维化及肾小管萎缩(interstitial fibrosis and tubular atrophy, IF/TA),包括免疫和非免疫因素,免疫因素指急、慢性排斥反应,非免疫因素指高血压、糖尿病、高血脂等,均可导致慢性移植肾功能不全(chronic renal allograft dysfunction, CRAD)。ABMR是CRAD的免疫性因素[1-2],影响移植肾的长期成活。肾间质纤维化是多种细胞、细胞因子、炎性介质等诸多因子相互作用导致细胞外基质(ECM)代谢失衡,在肾间质异常沉积所致,是一个非常复杂的过程,至今移植肾纤维化发生、发展的关键步骤和确切发病机制尚未得到完全阐明。本研究采用免疫组化方法对移植肾中几种与纤维化密切相关的生物活性因子包括磷酸化细胞外信号调节激酶(p-ERK)1/2、转化生长因子-β(transforming growth factor-β, TGF-β)1及Ⅳ型胶原进行半定量分析,探讨p-ERK1/2与纤维化的金指标TGF-β1及Ⅳ型胶原之间的相关性及p-ERK1/2与IF/TA的关系,研究p-ERK1/2在ABMR发病中的作用机制。
1 材料与方法
1.1 对象与分组 收集2006年1月—2013年7月解放军181医院全军器官移植与透析治疗中心收治的ESRD肾移植患者,术后出现肌酐进行性升高和顽固性蛋白尿,行移植肾穿刺活检术,病理结果排除急性排斥反应、钙调磷酸酶抑制剂[环孢素(CsA)或他克莫司(FK506)]中毒、肾小球肾炎复发等特征性病理改变,提示以IF/TA为特点的非特异性病理改变,并按照Banff 2009移植肾病理分级诊断标准[3],病理诊断为ABMR的移植肾组织标本120例,男68例,年龄(47±6)岁;女52例,年龄(44±8)岁。肾穿刺时间为肾移植术后1.0~10.5年,通过移植肾彩超、FK506或CsA血药浓度及T淋巴细胞亚群等实验检测,排除急性排斥反应、CsA中毒、移植肾血管狭窄、感染等导致移植肾功能慢性损伤的可能性疾病。所有供、受者血型相同,淋巴细胞毒交叉配型试验(CDC)<10%,群体反应性抗体(PRA)<10%,HLA-A、B、Dr位点至少有2个位点相配。以10例正常肾组织标本作为对照组,病理检查未见异常,男6例,年龄(37±5)岁;女4例,年龄(39±6)岁。两组年龄、性别差异无统计学意义(P>0.05),具有可比性。
1.2 病理诊断分级 按照Banff 2009移植肾病理分级诊断标准[3]将移植肾IF/TA的严重程度分为Ⅰ级:轻度IF/TA(<25%的皮质受累),Ⅱ级:中度IF/TA(26%~50%的皮质受累),Ⅲ级:重度IF/TA(>50%的皮质受累)。ABMR的病理组织学特征为[1]:①C4d(+),循环中存在抗供者抗体(DSA);②IF/TA和(或)肾小球基底膜增厚,呈双轨征改变;③肾小管周围毛细血管基底膜多层改变和(或)动脉纤维性内膜增厚。
1.3 材料与试剂 p-ERK1/2鼠抗人单克隆抗体,1∶200稀释(Santa Cruz公司产品,编号:SC-7383);兔抗人TGF-β1多克隆抗体、工作液(福建福州迈新试剂公司产品,编号:RAB-0238);鼠抗人Ⅳ型胶原单抗、工作液(福建福州迈新试剂公司产品,编号:MAB-0025);兔抗人C4d多克隆抗体、工作液(Santa Cruz公司产品,编号:ZA-0415)
1.4 方法 免疫组化染色采用EnVision法,常规石蜡切片3 μm,常规烤片,脱水,3%过氧化氢阻断内源性过氧化氢酶,微波抗原修复15 min,滴加一抗(p-ERK1/2鼠抗人单克隆抗体,1∶200稀释;兔抗人TGF-β1多克隆抗体;鼠抗人Ⅳ型胶原单抗;兔抗人C4d多克隆抗体),4℃过夜,PBS液冲洗后滴加兔抗鼠二抗,37℃温箱孵育30 min,PBS液冲洗,DAB显色,苏木素复染,脱水,封片,观察。对照组以PBS缓冲液替代一抗作为阴性对照。
1.5 半定量分析 采用德国Leica(DMR+Q550型)真彩色病理图像分析系统对染色结果进行半定量分析。随机选取10个不连续(避开肾小球和大血管)的肾小管间质视野(×400,HPF),每例肾小管总数>60个。使用ImagePro-Plus 6.0软件计算阳性表达面积,以肾小管上皮细胞及间质细胞胞浆内出现浅黄、棕黄、黄褐色颗粒为阳性。测定视野中肾小管间质阳性表达面积与视野内肾小管间质总面积(去除肾小管管腔)的比值,取其均值代表此例患者某种成分在肾小管和间质的相对含量。
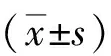
2 结果
2.1 病理组织学改变 ABMR所致CRAD移植肾组织学改变主要表现为:HE染色见近端小管肿胀,管腔狭窄、闭锁,间质灶性小管萎缩,炎症细胞浸润(以单个核细胞为主),可见蛋白管型(图1A);PASM染色见小球系膜增殖,包曼囊壁增厚,小球毛细血管腔狭窄,基底膜增厚,见双轨征(图1B);Masson染色见肾小球硬化,包曼囊壁纤维化,肾间质纤维化(图1C)。
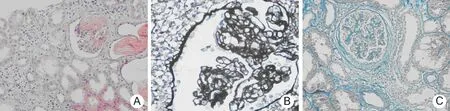
图1 抗体介导的慢性排斥反应所致慢性移植肾功能不全移植肾组织病理学改变(×400)
2.2 p-ERK1/2、TGF-β1和Ⅳ型胶原的表达
2.2.1 p-ERK1/2的表达:正常肾组织中无或仅有极少量p-ERK1/2表达;CRAD患者移植肾组织中p-ERK1/2表达明显增加,主要表达于肾小管上皮细胞和间质细胞的胞质中;随间质病变程度的加重,p-ERK1/2表达显著增加。见图2。
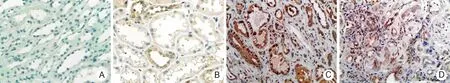
图2 磷酸化细胞外信号调节激酶1/2正常肾组织及抗体介导的慢性排斥反应所致慢性移植肾功能不全移植肾组织中的表达(EnVision×400)
2.2.2 TGF-β1和Ⅳ型胶原的表达:在正常肾组织中,TGF-β1主要表达于肾小管上皮细胞胞浆中,多呈弱阳性,而Ⅳ型胶原主要分布在肾小球、肾小管基底膜及包曼囊壁和系膜区,在肾间质中有少量散在分布,肾小管上皮细胞中未见表达。在ABMR患者移植肾组织中,TGF-β1在间质成纤维细胞胞浆中、小管上皮细胞及间质基质区多呈阳性表达,部分肾小球包曼囊壁亦有表达(图3);Ⅳ型胶原除在肾小球、肾小管基底膜及包曼囊壁和系膜区的表达较正常肾组织有所增加外,在肾间质中表达亦显著增加,而且在小血管周围和管壁中也有表达,肾小管上皮细胞中则无表达(图4)。
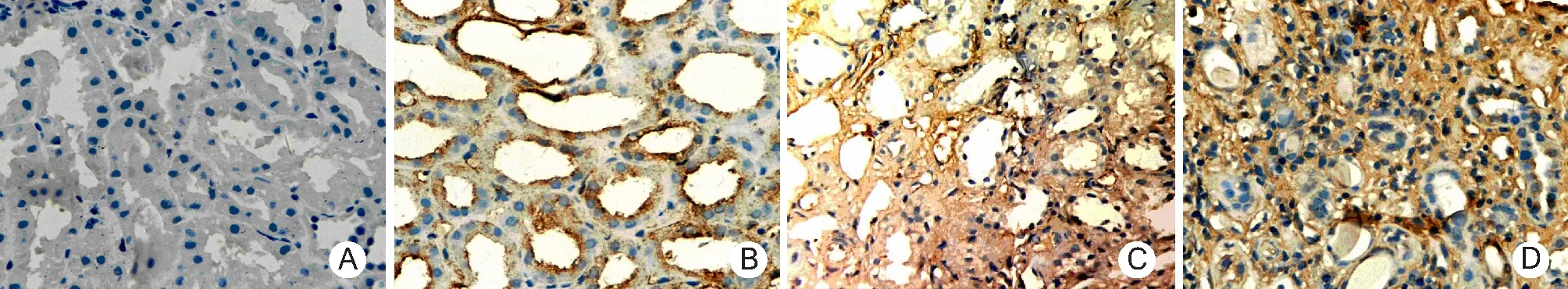
图3 转化生长因子-β1在抗体介导的慢性排斥反应所致慢性移植肾功能不全移植肾组织中的表达(EnVision×400)
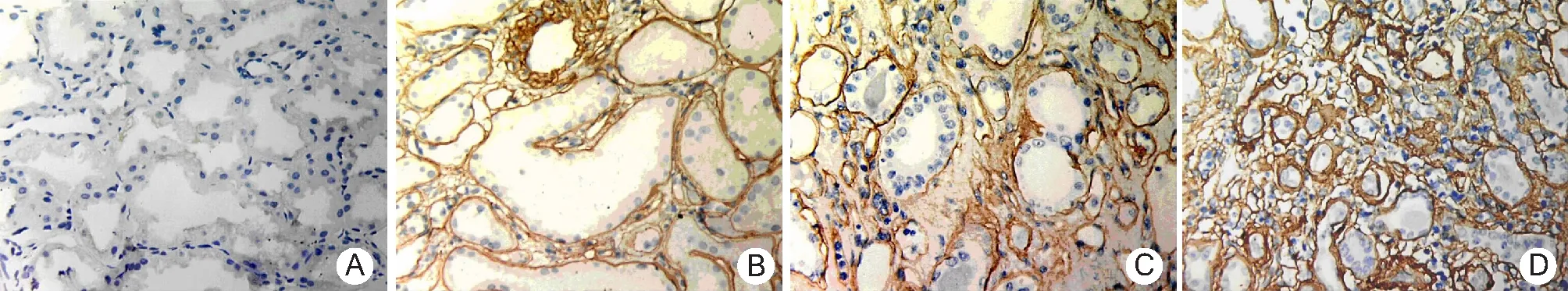
图4 Ⅳ型胶原在抗体介导的慢性排斥反应所致慢性移植肾功能不全移植肾组织中的表达(EnVision×400)
2.3 ABMR病理分级与p-ERK1/2、TGF-β1和Ⅳ型胶原表达的关系 ABMR各级肾移植患者肾小管间质中p-ERK1/2、TGF-β1和Ⅳ型胶原的表达量比正常肾组织明显增多,且随着间质病变程度的加重,上述指标的表达量呈递增趋势,差异均有统计学意义(P<0.05),见表1。
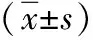
表1 正常肾组织及ABMR各级移植肾组织肾小管间质中p-ERK1/2、TGF-β1和Ⅳ型胶原表达比较
注:p-ERK 1/2为磷酸化细胞外信号调节激酶1/2,TGF-β1为转化生长因子-β1;IF/TA为肾间质纤维化及肾小管萎缩;与正常肾组织比较,aP<0.05;与IF/TA Ⅰ级比较,cP<0.05;与IF/TA II级比较,eP<0.05
2.4 相关性分析 ABMR移植肾组织中p-ERK1/2、TGF-β1和Ⅳ型胶原的表达随IF/TA病理分级的增加呈递增趋势,并与IF/TA病理分级呈显著正相关(r=0.938、0.926、0.937,P<0.01)。线性相关分析结果显示,肾小管间质p-ERK1/2表达分别与TGF-β1、Ⅳ型胶原表达呈显著正相关(r=0.864、0.878,P<0.01)。
3 讨论
TGF-β1是各种肾脏疾病所引起的肾小球硬化及肾间质纤维化发生、发展的必需因子[4],参与了细胞生长、分化及ECM的代谢。当组织受到炎性损伤时可引起TGF-β1合成增多、降解减少,从而导致胶原及蛋白聚糖等ECM的快速聚集。有文献报道,在慢性移植肾肾病(CAN)患者移植肾组织中,IF/TA的程度随着TGF-β1表达的增加而加重,TGF-β1的表达水平与Ⅳ型胶原的量呈正相关,证实了TGF-β1可通过Ⅳ型胶原在移植肾间质中的异常沉积导致移植肾间质的纤维化,从而导致CRAD的发生[5]。进一步的研究发现,在ABMR引起的CRAD患者中,TGF-β1可能通过诱导细胞外信号调节激酶(ERK)活化为p-ERK1/2[6],介导IF/TA的发生,参与CRAD的发生和发展。
ERK通路属于丝裂原激活的蛋白激酶(MAPK)通路系统,是将细胞外信号传递到细胞内的信号通路之一,主要由3个蛋白激酶级联组成,分别为丝裂原活化的蛋白激酶激酶激酶(MAP3K)、丝裂原活化的蛋白激酶激酶(MAPKK)和ERK,ERK信号通路的主要激活途径为Ras/Raf/MEK/ERK[7]。活化后的ERK(p-ERK1/2)将生长因子、化学因子等胞外信号转移到细胞内,从而调节细胞的增殖和分化[8]。在肿瘤细胞浸润的相关研究中发现,ERK在介导上皮细胞间充质转化(EMT)的过程中发挥着重要的作用[9],但在CRAD进展中的作用机制尚未得到阐明,亦罕见报道。
本研究观察到,p-ERK1/2在正常肾组织中表达微弱或未见表达,而在ABMR引起的CRAD患者移植肾组织中表达明显增强,并随着IF/TA病理分级的增加而增多,病变越重处p-ERK1/2的染色越深,表达越多;同时在ABMR所致CRAD的移植肾组织中,TGF-β1和Ⅳ型胶原的表达亦较正常肾组织明显增加,且二者表达均与p-ERK1/2的表达呈显著正相关。
肾小管EMT可引起ECM的异常沉积,是导致肾间质纤维化发生的重要机制之一[10],EMT与移植肾IF/TA的发生有关,是移植肾IF/TA发生的中间阶段[11]。EMT在肾纤维化中所起的作用已经在体外培养的细胞动物肾病模型及人体肾脏相关疾病的研究中得到证实[12]。目前已知在众多调节EMT发生的因素中TGF-β1是最主要的。Xie等[13]对小鼠近端肾小管上皮细胞的研究中发现,ERK通路的活化是TGF-β1介导EMT发生所必需的。在对特发性肺纤维化的研究中发现,抑制MAPK/ERK信号通路后,可明显缓解成纤维细胞生长因子-1(FGF-1)对TGF-β1诱导EMT发生的刺激作用[14]。Zhou等[15]对ERBB2/HER2结合蛋白(Erbin)的研究中发现,Erbin的高表达可阻断TGF-β1/ERK信号通路,抑制TGF-β1诱导的EMT的发生,而抑制Erbin的表达、增强ERK的磷酸化水平,并促进TGF-β1诱导的EMT的发生,TGF-β1通过ERK依赖的途径诱导EMT的发生。本研究中TGF-β1在移植肾中的表达与p-ERK1/2的表达呈显著正相关,笔者推测,在ABMR引起的CRAD的发病机制中,ERK可能作为TGF-β1的下游信号分子,活化为P-ERK1/2后进入细胞内,介导了TGF-β1调节EMT的发生,并在导致IF/TA的过程中起着重要作用。Hsyashida等[16]研究发现,TGF-β1可以通过活化MAPK/ERK信号通路诱导肾小球系膜细胞I型胶原的表达,这种作用可被丝裂原细胞外激酶(MEK)抑制剂PD98059及ERK显性失活所阻断,MAPK/ERK信号通路的活化不仅参与了TGF-β1的表达,同时介导了TGF-β1的病理生理过程,从而形成恶性循环,加重了肾脏纤维化。p-ERK1/2还对于TGF-β1下游效应分子Smad信号通路的传导有增效作用,能促进胶原纤维化的产生[17]。结合本研究结果,ERK作为TGF-β1的下游信号分子,不仅可通过非经典的TGF-β1/ERK信号通路被TGF-β1活化,促进p-ERK1/2表达的增加,进而介导移植肾EMT的发生,还能参与到经典的TGF-β1/Smad信号通路中,对胶原纤维的产生起到增效作用,加重肾间质纤维化。因此,在ABMR引起CRAD的发病机制中,TGF-β1的高表达可能增强了下游信号分子ERK的激活和胶原纤维的产生,p-ERK1/2在介导TGF-β1所致移植肾间质纤维化的过程中起重要作用。
ERK作为TGF-β1发挥致纤维化作用的下游信号分子,在移植肾纤维化的发生、发展过程中具有中心环节作用[15]。虽然TGF-β1对于ERK的活化、EMT的发生起开关作用,似乎可通过阻断TGF-β1来缓解移植肾间质纤维化的发生,但已有研究表明,TGF-β1还是一个抗炎细胞因子,因此,在人体长时间阻断TGF -β1可能会导致炎症的发生,而产生不利的结果[18]。而ERK在正常生理条件下激活表达低,且作用相对单一,因此,如果进一步研究能确立p-ERK1/2表达增加参与CRAD IF/TA的发病机制,把抑制ERK的磷酸化作为一个新的治疗靶点,可在一定程度上缓解ABMR引起的移植肾纤维化,为延缓CRAD的发生提供新的思路。
[1] 蔡俊超,庆欣,谭建明,等.抗体介导的排斥反应研究中的热点问题[J].中华移植杂志(电子版),2012,6(2):88.
[2] 郭晖.抗体介导的排斥反应病理学研究概要[J].中华移植杂志(电子版),2012,6(2):138-143.
[3] Sis B, Mengel M, Haas M,etal. Banff '09 meeting report: antibody mediated graft deterioration and implementation of Banff working groups[J].Am J Transplant, 2010,10(3):464-471.
[4] Liu Y. Epithelial to mesenchymal transition in renal fibrogenesis: pathologic significance, molecular mechanism, and therapeutic intervention[J].J Am Soc Nephrol, 2004,15(1):1-12.
[5] Fan J M, Ng Y Y, Hill P A,etal. Transforming growth factor-beta regulates tubular epithelial-myofibroblast transdifferentiation in vitro[J].Kidney Int, 1999,56(4):1455-1467.
[6] Hough C, Radu M, Doré J J. Tgf-beta induced Erk phosphorylation of smad linker region regulates smad signaling[J].PLoS One, 2012,7(8):e42513.
[7] Kim S D, Yagnik G, Cunningham M L,etal. MAPK/ERK signaling pathway analysis in primary osteoblasts from patients with nonsyndromic sagittal craniosynostosis[J].Cleft Palate Craniofac J, 2014,51(1):115-119.
[8] Naz S, Ranganathan P, Bodapati P,etal. Regulation of S100A2 expression by TGF-beta-induced MEK/ERK signalling and its role in cell migration/invasion[J].Biochem J, 2012,447(1):81-91.
[9] Fuxe J, Vincent T, Garcia de Herreros A. Transcriptional crosstalk between TGF-beta and stem cell pathways in tumor cell invasion: role of EMT promoting Smad complexes[J].Cell Cycle, 2010,9(12):2363-2374.
[10]Yang J, Liu Y. Dissection of key events in tubular epithelial to myofibroblast transition and its implications in renal interstitial fibrosis[J].Am J Pathol, 2001,159(4):1465-1475.
[11]Vongwiwatana A, Tasanarong A, Rayner D C,etal. Epithelial to mesenchymal transition during late deterioration of human kidney transplants: the role of tubular cells in fibrogenesis[J].Am J Transplant, 2005,5(6):1367-1374.
[12]Rastaldi M P, Ferrario F, Giardino L,etal. Epithelial-mesenchymal transition of tubular epithelial cells in human renal biopsies[J].Kidney Int, 2002,62(1):137-146.
[13]Xie L, Law B K, Chytil A M,etal. Activation of the Erk pathway is required for TGF-beta1-induced EMT in vitro[J].Neoplasia, 2004,6(5):603-610.
[14]RamosC,BecerrilC,MontanoM,etal.FGF-1revertsepithelial-mesenchymaltransitioninducedbyTGF-{beta}1throughMAPK/ERKkinasepathway[J].AmJPhysiolLungCellMolPhysiol,2010,299(2):L222-L231.
[15]Zhou Q, Zeng R, Xu C,etal. Erbin inhibits TGF-beta1-induced EMT in renal tubular epithelial cells through an ERK-dependent pathway[J].J Mol Med (Berl), 2012,90(5):563-574.
[16]Hayashida T, Poncelet A C, Hubchak S C,etal. TGF-beta1 activates MAP kinase in human mesangial cells: a possible role in collagen expression[J].Kidney Int, 1999,56(5):1710-1720.
[17]Li W, Cui M, Wei Y,etal. Inhibition of the expression of TGF-β1 and CTGF in human mesangial cells by exendin-4, a glucagon-like peptide-1receptor agonist[J]. Cell Physiol Biochem, 2013,30(3):749-757.
[18]Pan M M, Zhang M H, Ni H F,etal. Inhibition of TGF-β1/Smad signal pathway is involved in the effect of Cordyceps sinensis against renal fibrosis in 5/6 nephrectomy rats[J].Food Chem Toxicol, 2013,58:487-494.
Expression and Significance of p-ERK1/2 in Transplanted Renal Tissues of Patients with Chronic Antibody-mediated Rejection
YAN Qiang1, JIANG Hua2, WANG Bao-yao1, CHEN Huai-zhou1, DONG Li1, ZOU He-qun3, SUI Wei-guo1
(1. Department of Nephrology Center of Organ Transplantation and Dialysis of PLA Key Laboratory of Metabolic Diseases of Guangxi, 181 Hospital of PLA, Guilin, Guangxi 541002, China; 2. Department of Urology, the Fifth Affiliated Hospital of Zunyi Medical College, Zhuhai, Guangdong 519100, China; 3. Department of Nephrology, the Third Affiliated Hospital of Southern Medical University, Guangzhou 510630, China)
Objective To investigate the expression of phosphorylated extracellular signal-regulated kinase 1/2 (p-ERK1/2) in transplanted renal tissues, and to analyze its relationships with interstitial fibrosis and tubular atrophy (IF/TA). Methods The expressions of p-ERK1/2, TGF-β1 and collagen Ⅳ in transplanted renal tissues of 120 pathologically diagnosed patients with chronic antibody-mediated rejection (ABMR) were detected, and the semiquantitative analysis was also performed to analyze relationships between p-ERK1/2 and TGF-β1 or collagen Ⅳ, and the relationships between p-ERK1/2 and the IF/TA pathological grading. A total of 10 healthy renal tissues were used as control group.Results Compared with those in control group, the expressions of p-ERK1/2, TGF-β1 and collagen Ⅳ were significantly higher in transplanted renal tissues of patients with ABMR (P<0.05), and the expressions increased with the increasing pathological grade of IF/TA (r=0.938, 0.926, 0.937,P<0.05). The p-ERK1/2 expression was positively correlated with the TGF-β1 and collagen Ⅳ expressions (r=0.864, 0.878,P<0.01). Conclusion The p-ERK1/2 and TGF-β1 expressions may promote the abnormal sedimentation of renal extracellular matrix (ECM) in transplanted renal tissues of patients with chronic ABMR, which can induce renal fibrosis, and the p-ERK1/2 plays an important role in the process of allograft fibrosis.
Kidney transplantation; Phosphorylated extracellular signal-regulated kinase 1/2; Chronic antibody- mediated rejection; Transforming growth factor-β1; Collagen Ⅳ; Interstitial fibrosis and tubular atrophy
国家自然科学基金(81270840);高等学校博士学科点专项科研基金(20124433110020);广西自然科学基金(2011GXNSFB018105);广西卫生厅自筹经费科研课题(Z2014533)
541002 桂林,解放军181医院肾脏科 全军器官移植与透析治疗中心 广西代谢性疾病研究重点实验室(晏强、王保瑶、陈怀周、董力、眭维国);519100 广东 珠海,遵义医学院第五附属医院泌尿外科(姜华);510630 广州,南方医科大学附属三院肾内科(邹和群)
眭维国,suiwg@163.com
R692.5
A
2095-140X(2015)08-0001-05
10.3969/j.issn.2095-140X.2015.08.001
2015-06-11 修回时间:2015-06-30)
