芹菜素对肺癌细胞氨肽酶N抑制作用机制的研究
2015-03-24周云峰付欢欢肖江卫
周云峰,罗 飞,付欢欢,肖江卫,廖 娟
肿瘤基础与临床
·论著·
芹菜素对肺癌细胞氨肽酶N抑制作用机制的研究
周云峰,罗 飞,付欢欢,肖江卫,廖 娟
目的 探讨芹菜素对肺癌细胞氨肽酶N活性的影响及其对肺癌细胞A549生长抑制作用的机制。方法 采用酶抑制动力学方法,观察芹菜素对氨肽酶N的抑制作用和延滞时间;进行肺癌细胞A549和肺正常细胞MRC-5生长的抑制试验;通过锌离子螯合实验和分子对接研究芹菜素与氨肽酶N的相互作用机制。结果 芹菜素能够对肺癌细胞A549的生长产生抑制作用,对正常细胞MRC-5具有较低的毒性,且是一种可逆的竞争型氨肽酶N抑制剂[半数抑制浓度(IC50)为(71.22±2.43)μmol/L];锌离子螯合实验和分子模拟结果表明,芹菜素能够优先结合到氨肽酶N的活性中心锌离子附近,并与催化基团His383和Glu350形成氢键。结论 芹菜素是一种竞争性的氨肽酶N抑制剂,能够特异性地对肺癌细胞A549的生长起到抑制作用。
芹菜素;肺癌细胞A549;氨肽酶N;抑制作用;分子模拟
肿瘤的生长、侵袭和转移是一个复杂的多步骤过程,包括肿瘤细胞的分裂和增殖、细胞外基质的降解、肿瘤细胞穿过基底膜进入血管系统、随循环系统扩散、在继发组织器官定位生长、转移癌继续扩散等过程[1]。氨肽酶N在机体组织细胞之间的生理调节和信号传递过程中起着至关重要的作用,其功能和作用因其存在的位置不同而有差异,尤其氨肽酶N在肺癌细胞演进过程中的各个环节都起到了作用[2-5],为肺癌细胞的生长提供了便利条件,这意味着氨肽酶N抑制剂可以有效地抑制肺癌细胞的生长,进而预防肿瘤细胞的转移和传播。芹菜素是一种低毒、非诱变性的黄酮类物质[6],存在于许多蔬菜和水果中[7]。研究报道,芹菜素具有预防肿瘤的作用,在体外细胞和体内肿瘤模型中,其可以促进金属螯合,清除自由基以及激活Ⅱ相解毒酶[8],可抑制肿瘤细胞的增殖[9],尤其是可显著抑制前列腺癌CA-HPV-10细胞和人类鳞状细胞癌A431细胞的生长,而对人类正常前列腺上皮细胞和人类正常表皮角质化细胞抑制作用很弱,表现出特异性抗肿瘤作用。芹菜素已被发现可以抑制非小细胞肺癌A549和H460细胞的增殖以及在裸鼠中抑制其肿瘤生长和血管生成。为了探明芹菜素的抗癌作用是否与其对氨肽酶N的抑制作用有关,本研究将对芹菜素对氨肽酶N的抑制作用机制进行研究,并分析芹菜素螯合金属锌离子的作用,利用分子对接技术探讨芹菜素与氨肽酶N的相互作用机制,最后对芹菜素特异性抑制非小细胞肺癌A549细胞生长的作用进行探讨,为芹菜素在功能性医药领域的开发和应用提供基础数据。
1 材料与方法
1.1 仪器与试剂 UV-2450型紫外-可见分光光度计(日本岛津公司);酶标仪SpectraMax Plus384(美谷分子公司);pHS-3C型酸度计(上海雷磁仪器厂);AUTODOCK4.2分子对接软件。四甲基偶氮唑盐( MTT,5×103mg/L,PBS配制)购自北京鼎国昌盛生物技术有限责任公司。生物安全柜型号: HR40-ⅡA2 Haier;芹菜素(色谱纯,阿拉丁试剂,高效液相色谱图见图1)、氨肽酶N(Sigma公司) (分析纯,阿拉丁试剂);L-亮氨酞-P-硝基苯胺(分析纯,Sigma公司);贝他定(分析纯,Sigma公司)。人正常肺细胞MRC-5和人肺癌细胞A549(中国科学院上海生命科学研究院细胞资源中心)在本实验室进行培养,所有溶液均用去离子水配制。

图1 芹菜素高效液相色谱图
1.2 实验方法
1.2.1 芹菜素对氨肽酶N的抑制作用:芹菜素和氨肽酶N在37℃下、pH 6.8的磷酸盐(50 mmol/L)缓冲体系中下孵化3 h后,加入L-亮氨酞-P-硝基苯胺,利用UV-2450型紫外-可见分光光度计的动力学/时间软件测定405 nm处吸光度(OD)值的变化[10],计算抑制率和半数抑制浓度(IC50)。抑制率(%)=(1-R/R0)×100%,其中R0为无抑制剂时的OD值变化的斜率,R为在含有不同浓度芹菜素的体系中的OD变化的斜率,以贝他定为阳性对照。
1.2.2 锌离子螯合率的测定:取不同浓度的芹菜素溶液,向其中加入一定量的硫酸锌溶液,充分振摇使其反应完全,在离心机上以4000 r/min速度离心20 min后,将上清液倒入一锥形瓶中,用EDTA标定上清液中剩余的锌离子,从而得出锌离子螯合率。标定方法参考文献[11]。锌离子螯合率(%)=(反应体系中锌离子总量-EDTA标定出的锌离子总量反应体系中锌离子总量)/反应体系中锌离子的总量×100%。
1.2.3 芹菜素对MRC-5和A549细胞生长抑制试验:将对数生长期的MRC-5和A549细胞用0.25%胰蛋白酶消化单细胞,重悬于新鲜生长培养液中;细胞接种于96孔培养板;置37℃、5%CO2培养箱中培养过夜;根据实验设计,处理96孔板中的细胞,继续置37℃、5% CO2培养箱中培养,不同浓度的芹菜素和贝他定处理24 h后,直接于每孔中加入溴化3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溶液[12],37℃孵育2~4 h;室温静置至沉淀完全溶解(约10 min),用酶标仪(检测波长570 nm)检测各孔OD值。取复孔平均值,计算细胞生长抑制率及IC50。抑制率(%)=空白OD值-抑制剂OD值/空白OD值×100%。
1.2.4 分子对接:利用AUTODOCK 4.2分子模拟软件对芹菜素和氨肽酶N进行分子对接;氨肽酶N(PDB:4FKE)从RCSB Protein Data Bank (http://www.rcsb.org/pdb)获取,芹菜素三维分子晶体由Sybyl×1.1(Tripos Inc., St. Louis, USA)软件画出[13-14]。分子对接前对配体芹菜素素和受体氨肽酶N进行结构和能量优化(去水,加氢和加电),设定autogrid box参数78 Å×78 Å×78 Å,grid spacing 设置为0.78 Å;选择autodock 计算方法为LGA,其他参数默认设置,对接100次,输出结果应用PyMoL软件分析。
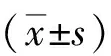
2 结果
2.1 对氨肽酶N活性的抑制作用 随着芹菜素和贝他定浓度的增加,氨肽酶N的活性呈现不断降低的趋势,直到贝他定的浓度达到150 μmol/L、芹菜素的浓度达到200 μmol/L后,氨肽酶N的相对活性趋于平缓,解析芹菜素和贝他定的IC50分别为(71.22±2.43)μmol/L和(52.32±2.31)μmol/L(图2);结合图3可以看出,随着芹菜素浓度的增加,氨肽酶N活性的迟滞时间稳步上升,当其浓度达到50 μmol/L,延滞时间趋于稳定,而贝他定对氨肽酶N活性的延滞时间低于芹菜素。

图2 芹菜素对氨肽酶N的抑制作用
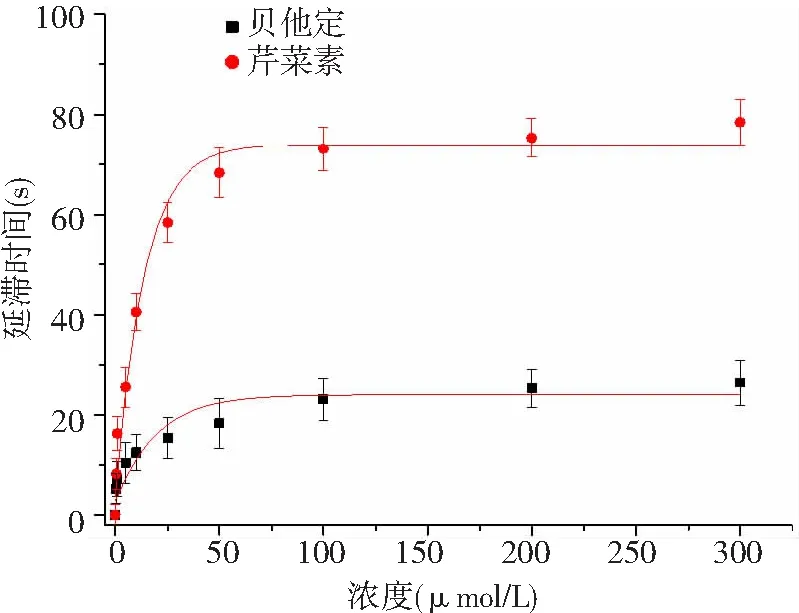
图3 芹菜素对氨肽酶N延滞时间的作用
2.2 对锌离子的螯合能力 芹菜素对锌离子的螯合能力远强于阳性对照贝他定,当浓度大于50 μmol/L时,芹菜素的锌离子螯合率趋于稳定(图4),与其对氨肽酶N延滞时间的作用相似。
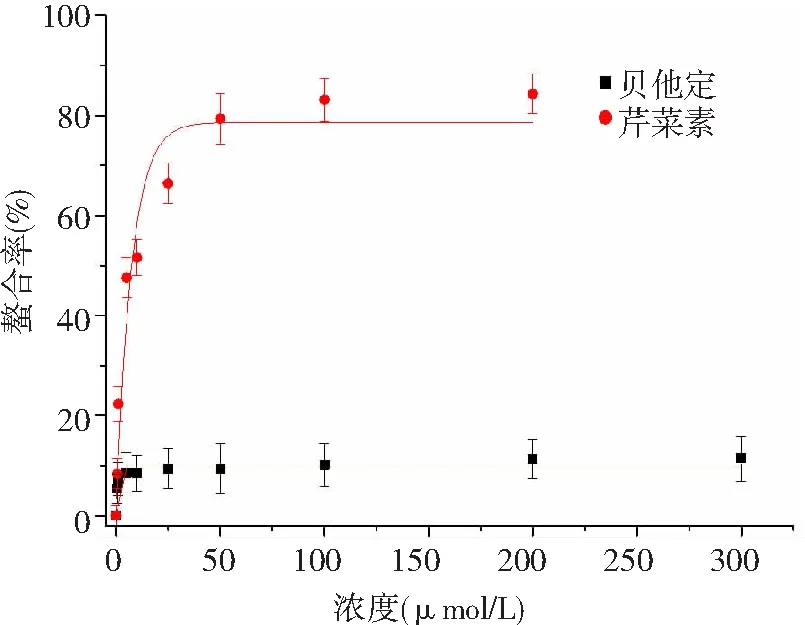
图4 芹菜素对锌离子螯合能力测定
2.3 与氨肽酶N的分子对接 从100次运行结果中选取了对接区域最多的和能量最低的位点作为研究对象,如图5所示,芹菜素结合到了氨肽酶N锌离子活性中心附近,嵌插到了催化中心的氨基酸残基(Ala3 48, Glu350, His383, Glu384和Tyr472)[12]周围,并与His383和Glu350形成氢键。
图5 芹菜素与氨肽酶N的分子对接
2.4 对MRC-5和A549细胞生长的抑制作用 随着浓度的增加,芹菜素和贝他定都表现了良好的抑制肺癌A549细胞生长的能力,计算芹菜素和贝他定对A549细胞生长IC50为(65.43±2.32)μmol/L和(53.32±3.43)μmol/L;芹菜素对正常肺MRC-5细胞生长的抑制能力低于贝他定。见图6、7。
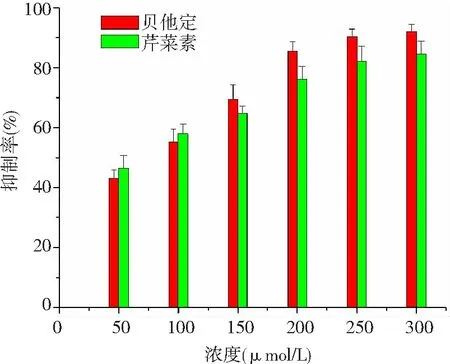
图6 芹菜素对人肺癌A549细胞生长的作用
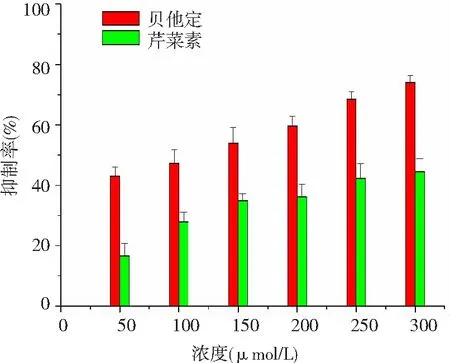
图7 芹菜素对人正常肺MRC-5细胞生长的作用
3 讨论
氨肽酶N是贝他定主要的作用靶点,贝他定可诱导多种肿瘤细胞的凋亡,本研究以人肺癌细胞A549为靶细胞,研究芹菜素对人肺癌细胞A549生长的抑制作用。实验结果显示,芹菜素能够对氨肽酶N产生抑制作用,与阳性对照贝他定相比差别不大,且A549细胞生长的抑制活性与体外抑酶实验的趋势相一致,芹菜素对氨肽酶N和A549细胞生长的抑制作用都存在浓度依赖性,但两种抑制剂对正常肺MRC-5细胞的抑制作用相比存在差异,为进一步探讨这种差异是否与对氨肽酶N的抑制机制有关,引用了分子对接技术和锌离子螯合实验。
近年来分子模拟技术发展迅速并在多个学科领域得到了广泛的的应用,在药物设计领域根据形状、空间和性质互补理论,用于病毒、药物作用机制的研究。通过分子对接能形象地表现出抑制剂与酶蛋白的作用位置和作用力类型,还能得到结合能等其他信息。本文采用模拟退火和遗传算法来寻找受体和配体的最佳结合位置,用半经验自由能计算方法来评价受体和配体之间的匹配情况;锌离子螯合实验表明,芹菜素能够结合到氨肽酶N的活性中心锌离子周围,与底物竞争氨肽酶N的活性区域和改变酶的结构,并与活性中心残基形成氢键,属于典型的竞争型酶抑制剂[15]。
酶抑制剂是一类可以与酶结合并降低酶活性的分子、作用于或影响酶的活性中心或必需基团导致酶活性下降或丧失而降低酶促反应速率的物质,抑制剂对酶的抑制类型分为不可逆性抑制和可逆性抑制,而可逆性抑制主要有竞争性和非竞争性两种,竞争性抑制是抑制剂与底物竞争酶的活性位点,而非竞争性抑制是通过干扰酶活性区域的形成,阻碍底物进入活性位点,降低酶的活性。此外抑制剂与酶的结合强弱、结合方式等直接关系到其对酶的抑制作用、药物的治疗效应及药物的不良反应[15]。与贝他定不同,芹菜素对酶的抑制作用呈现可逆的竞争性作用时,可根据酶活性的高低有效控制其剂量,选择性、可逆性地降低酶的活性;当正常细胞中的氨肽酶N含量正常时,芹菜素不会对其活性有太大影响,而贝他定会以不可逆的抑制方式使酶失活,从而导致正常细胞死亡。
[1] Yang X M, Zhang X M, Fu M L,etal. Targeting the Tumor Microenvironment with Interferon-β Bridges Innate and Adaptive Immune Responses[J].Cancer Cell, 2014,25(1):37-48.
[2] Liu C, Yang Y, Chen L.etal. A unified mechanism for aminopeptidase N-based tumor cell motility and tumor-homing therapy[J].J Biol Chem, 2014,289(50):34520-34529.
[3] Aroonkesorn A, Pootanakit K, Katzenmeier G,etal. Two specific membrane-bound aminopeptidase N isoforms fromAedes aegypti larvae serve as functional receptors for theBacillus thuringiensis Cry4Ba toxin implicating counterpart specificity[J].Biochem Biophys Res Commun, 2015,461(2):300-306.
[4] Miska K B, Fetterer R H, Wong E A,etal. The mRNA expression of amino acid transporters, aminopeptidase N, and the di- and tri-peptide transporter PepT1 in the embryo of the domesticated chicken (Gallus gallus) shows developmental regulation[J].Poultry Science, 2014,93(9):2262-2270.
[5] Larsen S L, Pedersen L O, Buus S,etal. Antitumor effect of a humanized antibody against aminopeptidase N in mouse tumor models[J].Eur Res J, 2014,44(58):2700-2706.
[6] Isoda H, Motojima H, Onaga S,etal. Analysis of the erythroid differentiation effect of flavonoid apigenin on K562 human chronic leukemia cells[J].Chem Biol Interact, 2014,220(5):269-277.
[7] Horinaka M, Yoshida T, Shiraishi T,etal. Flavonoid apigenin inhibits lipopolysaccharide-induced inflammatory response through multiple mechanisms in macrophages[J].PLoS One, 2014,9(9):945-951.
[8] Middleton E Jr, KandaswamiI C, Theoharides T C. The effects of plant flavonoids on mammalian cells: implications forinflammation, heart disease, and cancer[J].Pharmacol Rev, 2013,52(4):673-751.
[9] 辛丽丽.从自噬调控探讨清热活血方及芹菜素对肺腺癌细胞A549的作用机制[D].南京:南京中医药大学,2014.
[10]高春艳,聂珍贵,王俊亚,等.木犀草素对脑胶质瘤细胞氨肽酶N活性影响[J].中国公共卫生,2015,31(3):334-337.
[11]张智,于震,王振宇,等.落叶松多酚与钙、锌离子螯合能力研究[J].食品科技,2014,24(3):154-158.
[12]Angius F, Floris A. Liposomes and MTT cell viability assay: An incompatible affair[J].Toxicology in Vitro, 2015,29(2):314-319.
[13]Yan J, Zhang G, Pan J,etal. α-Glucosidase inhibition by luteolin: Kinetics, interaction and molecular docking[J].Int J Biol Macromol, 2014,64(3):213-223.
[14]Hu Y H, Liu X, Jia Y L,etal. Inhibitory kinetics of chlorocinnamic acids on mushroom?tyrosinase[J].J Biosci Bioeng, 2014,117(2):142-146.
[15]Yan J, Zhang G, Hu Y,etal. Effect of luteolin on xanthine oxidase: Inhibition kinetics and interaction mechanism merging with docking simulation[J].Food Chem, 2013,141(4):3766-3773.
Inhibitory Mechanisms of Apigenin on Aminopeptidase N of Lung Cancer Cells
ZHOU Yun-fenga, LUO Feib, FU Huan-huana, XIAO Jiang-weic, LIAO Juand
(a. Department of Cardio-Thoracic Surgery, b. Department of Pharmacy, c. the First Department of General Surgery, d. Department of Internal Medicine, Affiliated Hospital of North Sichuan Medical University, Nanchong, Sichuan 637000, China)
Objective To investigate the effect of Apigenin on the Aminopeptidase N (APN) activity of lung cancer cells and inhibitory mechanisms for mouse hepatitis virus A549 (A549) growth. Methods The inhibition effect and lag time of Apigenin on APN were analyzed using enzyme inhibition and kinetic method. The inhibitory tests of the growth of lung cancer cell A549 and lung normal cell MRC-5 were performed, and the interaction mechanisms of Apigenin on APN was performed by zinc chelation experiment and molecular docking. Results Apigenin had the inhibitory effect on the growth of lung cancer cell A549 and little toxicity to normal lung cell MRC-5, and it was a reversible and competitive inhibitor [inhibitory concentration 50 (IC50): (71.22±2.43)μmol/L]; zinc chelation experiment and molecular docking showed that Apigenin combined with Zn ions in APN active center preferentially, and formed hydrogen bonds with catalytic groups of His383 and Glu350. Conclusion Apigenin is a competitive APN inhibitor, and it has a special inhibitory effect on the growth of lung cancer cells A549.
Apigenin; Lung cancer cells A549; Aminopeptidase N; Inhibitory effect; Molecular mimicry
囯家自然科学基金(81270561)
637000 四川 南充,川北医学院附属医院胸心外科(周云峰、付欢欢),药剂科(罗飞),普外一科(肖江卫),消化内科(廖娟)
R285.5;R-332
A
2095-140X(2015)08-0021-04
10.3969/j.issn.2095-140X.2015.08.006
2015-06-16 修回时间:2015-07-03)
