钛表面TiO2纳米管抗菌覆膜药物释放动力学表征及其抗菌活性体外研究
2015-03-24冯明光刘忠堂王立强杨海涛王海洋秦士新
冯明光,刘忠堂,王立强,徐 丽,杨海涛,王 健,王海洋,秦士新
钛表面TiO2纳米管抗菌覆膜药物释放动力学表征及其抗菌活性体外研究
冯明光1,刘忠堂2,王立强3,徐 丽1,杨海涛1,王 健1,王海洋1,秦士新1
目的 明确钛表面TiO2纳米管抗菌覆膜药物释放动力学特征,并通过体外试验测试其抗菌活性。方法 电化学氧化法在钛金属表面构建TiO2纳米管表层,利用冻干法加载庆大霉素,在磷酸盐缓冲液中进行药物释放动力学研究。选择标准表皮葡萄球菌菌株,分别在负载和未负载药物纳米管及纯钛3种钛表面进行培养,通过观察细菌粘附和活性菌落存活情况进行表面抗菌活性对比研究。结果 NTS-G庆大霉素药物释放可分为两部分:初始突发释放和后期缓慢释放,初始释放浓度为51.50 μg/mL,第6 h为73.13 μg/ml,大多数负载的庆大霉素大约在9 h内释放。经过一个爆发性初始释放后,庆大霉素从纳米管释放呈现一个平台期,释放量几乎保持不变,维持在89.10 μg/ml水平。3种钛表面体外抗菌活性检测发现,TiO2纳米管抗菌覆膜假体表面死亡细菌菌落显著增加(P<0.05)。结论 钛表面TiO2纳米管抗菌覆膜为人工关节相关感染预防提供了新途径,骨科植入材料表面纳米管抗生素覆膜具有广泛的应用潜力。
TiO2纳米管;庆大霉素;药物释放动力学;表皮葡萄球菌;抗菌活性
感染与假体松动并列为导致人工关节假体失败的两大原因[1-3]。尽管制定有严格的消毒程序,初次人工关节置换术后感染率依然高达1%~4%[4,5]。细菌黏附是细菌生物膜形成前提,也是感染发生的最重要环节[6]。假体表面细菌膜一旦形成,治疗非常困难,因此防止细菌在假体表面黏附是预防感染的关键[6,7]。鉴于抗生素全身使用存在生物利用度差、效价低、缺乏选择性和生物毒性等缺点[8]。抗生素局部使用被认为更加安全、有效[9,10]。抗生素骨水泥已在骨水泥型假体置换术的感染预防和治疗中被广泛应用[11]。非骨水泥假体尚未建立起有效的局部感染预防体系,而非骨水泥假体在临床的应用逐渐成为主流[12]。20世纪70年代,Buchholz等[13]提出药物传递系统概念为其指引了方向。纳米技术的研究与应用,特别是纳米结构孔隙直径、孔隙率的可控性以及纳米表面优良的生物学功能特性使之成为药物载体控释系统研究热点[14,15]。其中,钛金属表面电化学阳极氧化生成的二氧化钛纳米管阵列尤为引人关注[16,17]。钛表面二氧化钛纳米管阵列可作为一种新型纳米管药物控释载体[5,18,19]。Popat等[19]报道负载庆大霉素纳米管体外可减少细菌的黏附、提高成骨细胞功能。然而,其纳米管药物负载特性及其药物释放动力学特征、抗菌活性尚未见文献报道。
本研究采用电化学氧化法在钛假体表面构建TiO2纳米管药物控释系统,采用冻干法加载庆大霉素,在磷酸盐缓冲盐水中进行药物释放动力学,并对有负载抗生素纳米管进行体外抗菌性能评估。
1 材料与方法
1.1 材料 99.5%纯钛片(直径10 mm,厚度1 mm), HNO3与HF混合液(1∶1),电解液(0.5% NH4F和10%蒸馏水的乙二醇),丙酮,去离子水,庆大霉素(Sigma-Aldrich公司,美国),磷酸盐缓冲盐水(PBS; Sigma),甘油培养液,LB培养液(Sigma-Aldrich公司),表皮葡萄球菌(ATCC35984)(上海复旦大学医学院医学分子病毒学重点实验室菌株);扫描电子显微镜(S-3400,日立)冷冻干燥系统(LABCONCO-7753072),12孔板(美国),紫外线分光光度计(德国)。
1.2 TiO2纳米管抗菌覆膜药物释放动力学表征
1.2.1 钛假体表面TiO2纳米管制备和药物负载 99.5%纯钛片电化学阳极化处理之前先行超声处理,用丙酮除去表面油污。然后放入HNO3和HF混合液(1∶1)中化学抛光60 s,离子水清洗后放入电解液中进行电化学氧化处理。按照林文涛等[20]报道方法在金属钛片表面生成长度200 nm、直径80 nm钛纳米管样覆层(NTS),电子显微镜扫描观察。去离子水清洗、干燥后备用。进行抗菌和细胞培养实验前使用紫外线照射消毒。
庆大霉素采用冷冻真空干燥法加载[19]。庆大霉素加入PBS中配制成浓度为100 mg/L溶液。抽取溶液25 μl没过NTS表面,轻轻震荡以确保药液均匀覆盖,后置入冷冻干燥系统中,在-45 ℃真空下冷冻、干燥2 h。重复上述加载步骤,直到钛纳米管负载庆大霉素量至2 mg,形成负载庆大霉素纳米管抗菌覆膜(NTS-G)。最后一次干燥步骤完成后,用1 ml PBS迅速漂洗去除钛片表面过量药物备用。
1.2.2 纳米抗菌覆膜药物释放动力学测定 NTS-G药物释放动力学选择标准方法表征[19]。简言之,在盛有500 μl PBS的 12孔板中各自浸入1片NTS-G,置于室温下、转速为70的轨道上匀速震荡,在规定时间间隔内依次抽送200 μl样品进行药物释放量测定。每次抽送后即刻加入等量PBS恢复到500 μl。抽取溶液浓度采用紫外线分光光度计分析,标定值设为332 nm。记录各时间段溶液中庆大霉素释放浓度值,创建NTS-G的标准浓度释放曲线。PBS中庆大霉素浓度即可根据标准曲线进行确定。
1.3 纳米管抗菌覆膜的体外抗菌作用
1.3.1 细菌培养 使用表皮葡萄球菌(ATCC35984)进行抗菌能力评价。体外研究前,将培养基中的菌株置于37 ℃培养24 h,使细菌浓度增殖至107CFU(菌落单位)/ml。细菌浓度通过光学密度测量法评估。
1.3.2 细菌黏附 细菌粘附试验在Cp-Ti、NTS和NTS-G三种材料表面进行,细菌孵育、增殖期间将三种钛片用3 ml无菌PBS洗涤3次。从浓度为107CFU/ml细菌悬浮液中,各抽取1 ml和每类样品一起加载至LB培养基,在37 ℃环境下培养6 h。观察培养基细菌生长情况(图1)。
1.4 统计学处理 采用SPSS 13.0软件进行统计分析。假定庆大霉素涂层可将感染率降低50%,体外实验被可视为具有统计学意义(P<0.05)。
2 结 果
2.1 NTS和NTS-G电镜扫描形态特征 图2A、B表示直径为80纳米的NTS的SEM图像。图2C显示NTS-G表面SEM图像。碳纳米管表面加载庆大霉素后保持了纳米管状结构。

图1 纳米管抗菌覆膜的体外抗菌试验培养基细菌生长
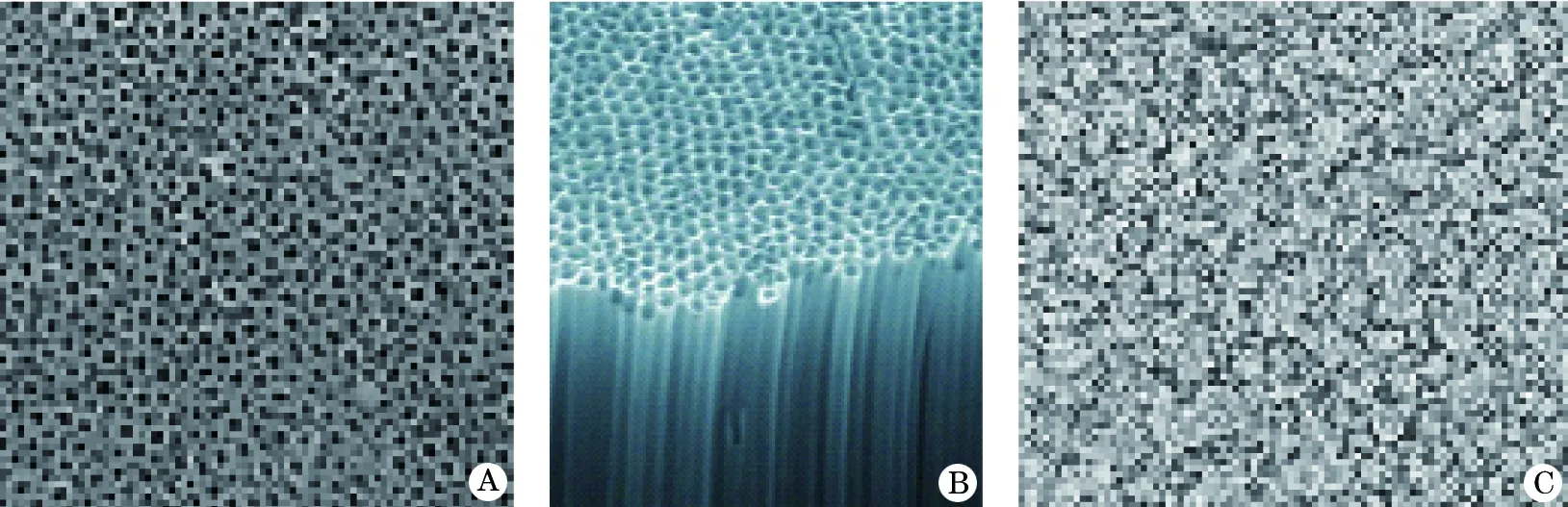
图2 NTS与NTS-G电子显微镜观察
2.2 药物负载和释放 图3显示NTS-G的庆大霉素药物释放数据示意图。NTS-G中药物释放可分为两部分:初始突发释放和后期缓慢释放。体外NTS-G庆大霉素初始释放浓度为51.50 μg,第6 h释放庆大霉素量为73.13 μg/ml,大多数负载的庆大霉素大约在9 h内释放。经过一个爆发性初始释放后,庆大霉素从纳米管释放呈现一个平台期,释放量几乎保持不变,维持在89.10 μg水平。
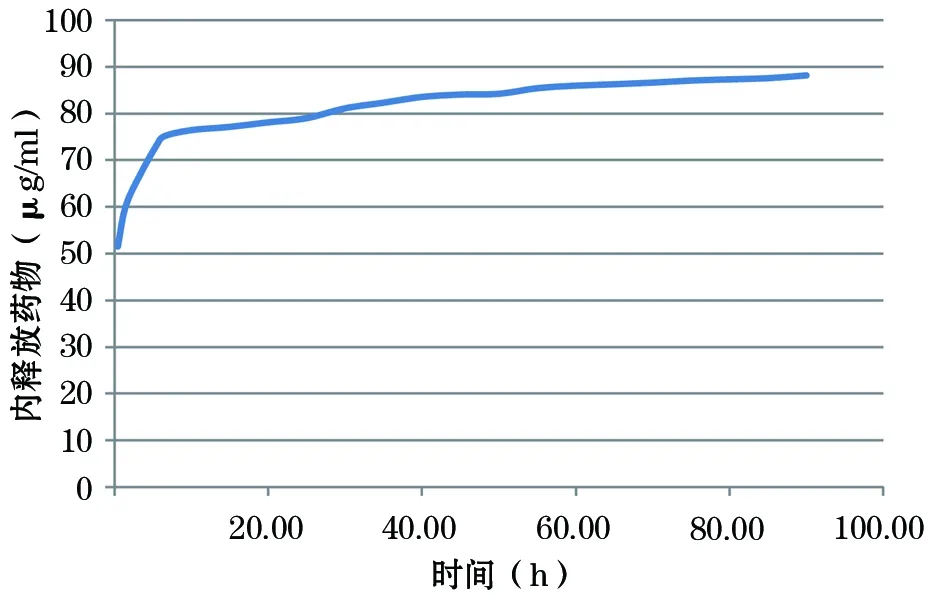
图3 TiO2纳米管庆大霉素覆膜药物释放动力学特征
2.3 体外抗菌能力 本实验菌株表皮葡萄球菌389庆大霉素最小抑菌浓度(MIC=16 μg/ml)。3种不同钛片的培养基细菌菌落黏附情况如图1A-C所示,6 h培养后结果表明,NTS-G能够有效降低细菌的黏附,其表面细菌黏附数量(0.05 CFUs/ml)显著少于Cp-Ti表面(0.8 CFUs/ml)或NTS表面(0.8 CFUs/ml),NTS-G组与在NTS和Cp-Ti相比较差异有统计意义(P<0.01)。在NTS-G的表面上或在培养液中没有观察到活的细菌生长。在另外两个Cp-Ti和NTS表面及细菌培养基上,可以观察到活细菌生长。但NTS表面细菌黏附数量少于Cp-Ti表面的细菌黏附数量,在降低感染率方面NTS优于Cp-Ti,NTS和Cp-Ti组之间差异无统计学意义。
3 讨 论
相对于全身给药,局部抗生素使用在置入物相关感染预防中具有更多优势。细菌黏附是细菌生物膜形成的前提,也是感染发生的一个最重要环节[6]。研究表明,假体置入后的6 h是一个“决定性时期”,也是感染预防获得长期成功的关键[4,21]。相对于骨水泥假体较为成熟的抗生素骨水泥感染局部预防策略,非骨水泥假体尚未建立起有效的局部感染预防体系。人工关节假体表面抗生素负载,特别是钛纳米管药物缓释系统研究,为其提供了可行性方向。
Popat等[19]发现,直径为80 nm纳米管药物负载量更大,且能获得较低和持久药物释放。Wen等[20]比较研究80、120、160、200 nm等直径NTS-G最大药物负载和药物释放动力学特征,显示所有直径NTS-G初始都呈现爆发性释放,庆大霉素初始释放浓度都能有效杀灭手术过程黏附至假体表面的细菌。同时,研究发现NTS具有抑制细菌黏附作用,直径为80 nm的纳米管表面显现出更强大的抑制细菌黏附和生物膜形成特性[20,23]。药物载体材料组织相容性和合适的药物释放系统模型,以及其在体内骨组织药物疗效,被确认是局部药物释放系统研究必须首先解决的关键问题[24,25]。钛是人工关节假体常用制备材料,且研究表明纳米化处理钛表面骨整合能力明显增加[6,26]。因此,笔者选择直径为80 nm纳米管作为NTS-G药物负载和药物释放动力学研究的载体。
选择庆大霉素被选为加载药物有如下几个原因:(1)它可有效对抗大人工置换术后感染常见类型的细菌,如金黄色葡萄球菌和表皮葡萄球菌[27];(2)庆大霉素价值低廉[28]。为了延长药物释放时间,我们制造TNTS具有较大直径和表面,且将庆大霉素负载提升到2 mg水平。
假体置入后6 h是防止细菌黏附、到置换长期成功的至关重要的“决定性时期”[4,21]。本研究NTS-G庆大霉素药物释放数据显示,NTS-G表面药物释放特征与其他报告类似[20],可分为初始突发释放和后期缓慢释放两部分。体外庆大霉素从NTS-G初始释放浓度为51.50 μg,NTS-G初始突发释放的庆大霉素初始浓度足以有效杀死在手术过程中黏附于假体表面的细菌。第6小时释放庆大霉素量为73.13 μg/ml,大大超出表皮黄色葡萄球菌的MIC,且NTS-G负载庆大霉素的大多数大约在9 h内释放,可以明显增强局部的初始抗菌效应。同时,经过一个爆发性初始释放后,庆大霉素从纳米管释放呈现一个平台期,释放量几乎保持不变,在90 h时其释放浓度依然可达89.10 μg/ml。表明药物从NTS-G表面快速释放模式对于抑制细菌的入侵和防止植入区域的早期污染可以取到重要预防作用。
然而,体外药物释放模式难以简明地反映体内药物释放动力学特征。假体置入股骨髓腔后,其表面主要为血液或血肿所包围(如全髋关节置换术中的股骨假体)的一个封闭的环境中。血肿,血液在血管外局部以液体形式聚集,难以迅速更新。因此,药物释放动力学,主要取决于周围血肿动态变化。
本研究检测3种不同钛片细菌菌落黏附情况,结果表明NTS-G能够有效降低细菌的黏附,其表面细菌黏附数量显著少于Cp-Ti或NTS表面,NTS-G组与在NTS和Cp-Ti相比比较有显著的统计意义(P<0.01)。在NTS-G的表面上或在培养液中没有观察到活的细菌生长。在另外两个Cp-Ti和NTS表面及细菌培养基上,可以观察到活细菌生长,但NTS表面细菌黏附少于前者。体外研究表明,NTS-G可以显著抑制细菌的黏附和生物膜的形成,而无庆大霉素负载的纳米管也出现温和的抗菌能力。
NTS制备、庆大霉素药物负载、释放动力学和NTS-G体外抑菌试验表明,NTS可以作为非骨水泥人工关节假体表面局部感染预防的抗生素药物缓释载体,基于TiO2纳米管建立局部抗生素负载载体进行人工关节置入物相关感染的预防是一个很有吸引力的战略选择。
[1] Zhang Hangzhou, Yu Sun, Ang Tian,etal. Improved antibacterial activity and biocompatibility on vancomycin-loaded TiO2nanotubes: in vivo and in vitro studies[J].International Journal of Nanomedicine, 2013(8):4379-4389.
[2] Bozic K J, Lau E, Chiu V,etal. The epidemiology of revision total knee arthroplasty in the United States[J]. ClinOrthopRelat Res,2010,468(1):45-51.
[3] Puckett S D, Taylor E, Raimondo T,etal. The relationship between the nanostructure of titanium surfaces and bacterial attachment[J]. Biomaterials,2010,31(4):706-713.
[4] Hetrick E M, Schoenfsch M H. Reducing implant-related infections: active release strategies[J]. ChemSoc Rev,2006,35(9):780-789.
[5] Kurtz S M, Lau E, Schmier J,etal. Infection burden for hip and knee arthroplasty in the United States[J]. J Arthroplasty,2008,23(7):984-991.
[6] Ribeiro M, Monteiro F J, Ferraz M P. Infection of orthopedic implants with emphasis on bacterial adhesion process and techniques used in studying bacterial-material interactions[J]. Biomatter,2012,2(4):176-194.
[7] Costerton J W, Stewart P S, Greenberg E P. Bacterial bioflms: a common cause of persistent infections[J].Science, 1999,284(5418):1318-1322.
[8] Davies D. Understanding bioflm resistance to antibacterial agents[J]. Nat Rev Drug Discov, 2003,2(2):114-122.
[9] Popat K C, Eltgroth M, LaTempa T J,etal. Titania nanotubes: a novel platform for drug-eluting coatings for medical implants[J].Small,2007,3(11):1878-1881.
[10] Diefenbeck M, Mückley T, Hofmann G O. Prophylaxis and treatment of implant-related infections by local application of antibiotics[J]. Injury,2006,37(2):95-104.
[11] Gulati K, Aw M S, Findlay D,etal. Local drug delivery to the bone bydrug-releasing implants: perspectives of nano-engineered titania nanotube arrays[J].TherDeliv,2012,3(7):857-873.
[12] Berger R A, Jacobs J J, Quigley L R,etal. Primary cementlessacetabular reconstruction in patients younger than 50 years old. 7- to 11-year results[J]. ClinOrthopRelat Res, 1997,(344):216-226.
[13] Porter J R, Ruckh T T, Popat K C. Bone tissue engineering: a review in bone biomimetics and drug delivery strategies[J].BiotechnolProg, 2009, 25(6):1539-1560.
[14] Wu P, Grainger D W. Drug/device combinations for local drug therapies and infection prophylaxis[J].Biomaterials,2006,27(11):2450-2467.
[15] Liu H, Webster T J. Nanomedicine for implants: a review of studies and necessary experimental tools[J]. Biomaterials,2007,28(2):354-369.
[16] Ghicov A, Schmuki P. Self-ordering electrochemistry: a review on growth and functionality of TiO2 nanotubes and other self-aligned MO(x) structures[J].ChemCommun(Camb),2009,(20):2791-2808.
[17] Losic D, Simovic S. Self-ordered nanopore and nanotube platforms for drug delivery applications[J]. Expert Opin Drug Deliv,2009,6(12): 1363-1381.
[18] Gulati K, Aw M S, Losic D. Drug-eluting Ti wires with titania nanotube arrays for bone fxation and reduced bone infection[J]. Nanoscale Res Lett,2011,(6):571.
[19] Popat K C, Eltgroth M, Latempa T J,etal. Decreased Staphylococcus Epidermis adhesion and increased osteoblast functional-ity on antibiotic-loaded titania nanotubes[J]. Biomaterials,2007,28(32): 4880-4888.
[20] Wen taolin,hong lueTan,Zhaoling Duan,etal: Inhibited bacterial bioflm formation and improved osteogenic activity on gentamicin-loaded titania nanotubes with various diameters[J]. International Journal of Nanomedicine,2014,(9):1215-1230.
[21] Neoh K G, Hu X, Zheng D,etal. Balancing osteoblast functions and bacterial adhesion on functionalized titanium surfaces[J].Biomaterials, 2012,33(10):2813-2822.
[22] Ercan B, Taylor E, Alpaslan E,etal. Diameter of titanium nanotubes influences anti-bacterial efficacy[J]. Nanotechnology,2011,22(29):292-295.
[23] Arciola C R, Campoccia D, Speziale P,etal. Bioflm formation in Staphylococcus implant infections. A review of molecular mechanisms and implications for bioflm-resistant materials[J]. Biomaterials,2012,33(26):5967-5982.
[24] Soundrapandian C, Sa B, Datta S. Organic-inorganic composites for bone drug delivery[J]. AAPS Pharm Sci Tech, 2009,10(4):1158-1171.
[25] Simchi A, Tamjid E, Pishbin F,etal. Recent progress in inorganic and composite coatings with bactericidal capability for orthopaedic applications[J].Nanomedicine,2011,7(1):22-39.
[26] Bjursten L M, Rasmusson L, Oh S,etal. Titanium dioxide nanotubes enhance bone bonding in vivo[J]. J Biomed Mater Res A,2010,92(3):1218-1224.
[27] Arciola C R, Campoccia D, Gamberini S,etal. Antibiotic resistance in exopolysaccharide-forming Staphylococcus epidermidis clinical isolates from orthopaedic implant infections[J]. Biomaterials, 2005,26(33):6530-6535.
[28] Rathbone C R, Cross J D, Brown K V,etal. Effect of various concentrations of antibiotics on osteogenic cell viability and activity[J]. J Orthop Res, 2011,29(7):1070-1074.
(2015-04-22收稿 2015-06-07修回)
(责任编辑 张 楠)
Drug-release kinetics characterization of gentamicin from TiO2nanotubes and its antibacterial activityinvitro
FENG Mingguang1,LIU Zhongtang2, WANG Liqiang3, XU Li1, YANG Haitao1, WANG Jian1, WANG Haiyang1,and QING Shixin1.
1.Department of Orthopedics, Shanghai Municipal Corps Hospital Chinese People’s Armed Police Force, Shanghai 201103, China;2.Department of Orthopedics, the Sixth People’s Hospital, Shanghai Jiaotong University, Shanghai 200233,China;3.College of Materials Science and Engineering, Shanghai Jiaotong University, Shanghai 200240, China
Objective To determine the release kinetics of gentamicin from the TiO2nanotubes(TNS-G), and to detect its antibacterial activityinvitro. Methods TiO2nanotubes (NTS) were fabricated on the titanium surface by electrochemical anodization. These nanotubes were loaded with gentamicin using a lyophilization method and vacuum drying, and its pharmacokinetics was detected in phosphate buffer.Staphylococcusaureuswas used to study the antibacterial properties of the NTS-G. There were three study groups: the commercially pure titanium(Cp-Ti)group, the NTS group, and the NTS-G group.We compared the antibacterial efficacy with each other by bacterial adhesion and colony counting in bacterial culture. Results Drug release of NTS-G could be divided into two parts: initial burst release and relatively slow release.The fast initial concentration was 51.50 μg/ml , and 73.13 μg/ml at the 6 th hours. Most of load gentamicin was released within approximately 9 hours.In the second phase, different drug release kinetics were observed, with very slow and linearly increasing cumulative release over a period of 90 h. The drug concentration was maintained at about 89.10 μg/ml. We found that NTS-G could significantly inhibit bacterial adhesion and bioflm formation, compared with Cp-Ti or NTS, (P<0.05). Conclusions Titanium dioxide nanotubes loaded with antibiotics can deliver a high concentration of antibiotics locally at a specifc site, thereby providing a new strategy to prevent implant-associated infections.
TiO2nanotubes; gentamicin; Drug-release kinetics;Staphylococcusepidermidis; antibacterial activity
国家自然科学基金(81171738);上海市卫生局(2011201)
冯明光,硕士,副主任医师,E-mail:mingguang-feng@126
1.201103,武警上海总队医院骨科;2.200233,上海交通大学附属第六人民医院;3.200240,上海交通大学材料科学与工程学院
刘忠堂,E-mail:surgeon_liu@163.com
R68
