MSL抗菌肽对绿脓杆菌和金黄色葡萄球菌细胞膜的损伤作用研究
2015-03-24刘艳环李海涛朱言柱张润祥肖佳美苗利光
刘艳环,李海涛,朱言柱,张润祥,肖佳美,苗利光
(中国农业科学院特产研究所,长春 130112)
抗菌肽是生物体抵御病原微生物入侵而产生的一种多肽类物质,是生物先天性免疫防御系统的重要组成部分[1]。在各种动物、植物、细菌、真菌中广泛存在[2,3]。抗菌肽不仅具有杀菌作用,还具有抗病毒、抗真菌、免疫调节及抗肿瘤等多种生物学活性[4~8]。目前,抗菌肽已成为药理学、生理学等领域和医药食品、临床等行业的研究热点。抗菌肽的作用靶点决定其抗菌方式和强度,不同种抗菌肽对细菌的作用机制不同[9~13]。前期研究中我们研制出一种理化性质稳定、体内外抗菌活性较强的抗菌多肽MSL抗菌肽(以下简称MSL)[14,15]。本试验通过抗菌肽作用于细菌后检测胞外蛋白质浓度的变化和通过透射电镜对细菌细胞超微结构变化的观察研究,明确该种抗菌肽对细菌细胞膜结构的损伤作用,为确定其作用靶点提供依据。
1 材料与方法
1.1 抗菌肽
MSL(中国农业科学院特产研究所经济动物疫病研究室研制,纯度>95%)。
1.2 试验菌株
金黄色葡萄球菌(CVCC26003,中国兽医药品监察所);绿脓杆菌(PAK/2pfs,中国农业科学院特产研究所疫病研究室保存)。
1.3 主要试剂及仪器
BCA蛋白质浓度检测试剂盒[生工生物工程(上海)股份有限公司];透射电子显微镜(H7650,Hitachi公司);酶标仪(VERSA max,MolecylarDevices公司)。
1.4 MSL作用于细菌后胞外蛋白质浓度的检测与分析
分别将绿脓杆菌和金黄色葡萄球菌接种于营养肉汤培养基中,37℃培养至对数生长期,取菌液,5000r/min离心5min,弃上清,收集沉淀,用生理盐水稀释菌浓度至1×108个/mL,取制备好的菌液0.1mL至EP管中,加入MSL至终浓度为1×MIC,混匀,于37℃保温孵育,分别于0min、10min、20min、30min、40min、50min、60min、120min、180min、240min离心收集上清液。用蛋白质浓度检测试剂盒检测各时间点蛋白浓度,分析蛋白浓度变化规律。
1.5 MSL作用于细菌的透射电镜观察
分别将金黄色葡萄球菌和绿脓杆菌接种于营养肉汤培养基中,37℃培养至对数生长期(OD 0.6~0.8),取菌液,5000r/min离心10min,弃上清,收集沉淀,用10mmol/L磷酸缓冲液(pH 7.2)冲冼2次,用PBS调节细菌浓度至1.5×108个/mL,将制备好的菌液取0.5mL至EP管中,然后加入纯化的MSL至终浓度为1×MIC,混匀,于37℃保温孵育60min,离心收集菌体,PBS缓冲液洗涤菌体3次。将适量无菌水加入菌悬液,调整细菌浓度至108个/mL。
取上述菌悬液与等量的2%磷钨酸钠水溶液在载玻片上混合染色30s。用无菌吸管吸取混合菌悬液滴在铜网膜上。经2min~3min后,用滤纸吸去多余水分,待样品干燥后,置低倍光学显微镜下检查,选取菌体分布均匀的铜网作为观察样本,透射电镜观察分析样本并记录、拍照。
2 结果与分析
2.1 MSL作用于细菌后胞外蛋白质浓度的变化规律与分析
利用酶标仪在562nm波长条件下检测标准品及绿脓杆菌和葡萄球菌样品各时间点的OD值,通过标准品OD值及相应浓度值做图后,计算出样品各时间点OD值对应的蛋白质浓度值。以蛋白质浓度为Y轴、各时间点为X轴做图,见图1、图2。
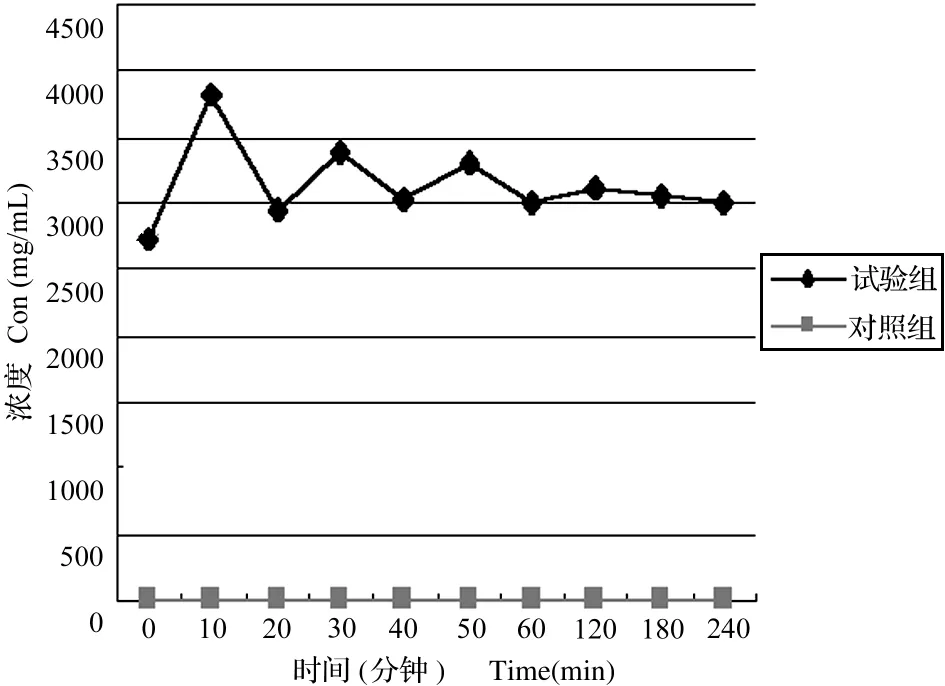
图1 MSL作用于绿脓杆菌后胞外蛋白质浓度的变化
Fig.1TheconcentrationofextracellularproteinofpseudomonasaeruginosawithMSL

图2 MSL作用于金黄色葡萄球菌后胞外蛋白质浓度的变化
Fig.2TheconcentrationofextracellularproteinofstaphylococcusaureuswithMSL
由图可见,MSL与2种细菌接触后可立即引起蛋白质浓度提高,短时间内又有所下降,反复几次后蛋白质浓度基本稳定在明显高于MSL未作用于菌体时的浓度值。可以确定,MSL可损伤细菌膜结构,引发胞液外流,蛋白质浓度升高。胞液中除各种蛋白质外,还含有各种酶和其他物质,造成蛋白质部分被分解,引起蛋白质浓度发生上述变化。
2.2 MSL作用于细菌后的透射电镜观察分析结果
透射电镜观察结果显示,MSL对绿脓杆菌和金黄色葡萄球菌均具有明显的破坏作用,正常对照组的细菌菌体表面超微结构致密均匀,细胞壁及细胞膜结构完整,胞质内电子密度较高且均匀,菌体周围菌毛层结构完整、清晰。MSL在1个MIC浓度作用60min后,细菌细胞壁遭破坏,细胞壁和胞浆内电子密度降低,细胞壁和细胞膜剥离,呈现不规则的圆形凸起,菌毛结构混乱,有的脱落,细胞质内部不均匀,染色质聚集,严重者细胞崩解结构不清(图3、图4)。

a.正常绿脓杆菌细胞;b、c.MSL作用后的绿脓杆菌细胞

a.正常金黄色葡萄球菌细胞;b、c.MSL作用后的金黄色葡萄球菌细胞
3 讨论
抗菌肽因具有广泛的生物学功能,特别是广谱的抗菌功能而成为研究的热点。目前,抗菌肽的抗菌机理仍然没有研究清楚,原因是各种抗菌肽的抗菌方式不同。多数研究者认为,抗菌肽主要是通过与细菌上的受体作用而发挥抗菌作用,如细菌的细胞膜、细胞内的基因组DNA或RNA、菌体的功能蛋白等,其中对细胞膜的作用研究最清楚[10~14]。
本研究选取革兰氏阴性细菌绿脓杆菌和革兰氏阳性细菌金黄色葡萄球菌,研究MSL的作用靶点,分析该抗菌肽对革兰氏阴性细菌和革兰氏阳性细菌膜结构的作用及作用差异。通过透射电镜观察发现,MSL对革兰氏阴性和阳性菌细胞膜均具有一定程度的破坏作用,并能作用于胞内物质引发染色质聚集,对2种细菌损伤程度无明显区别。
细菌细胞中存在多种蛋白酶,在细胞内的分布有各自特定的区域,在细胞质中含量最高,在细胞膜、周质、外膜等也有分布。蛋白酶在细胞代谢中具有组成自身防御体系、降解无用蛋白质等重要生理功能。本研究通过检测标准品及被抗菌肽作用的绿脓杆菌和金黄色葡萄球菌样品各时间点的蛋白质浓度发现,MSL与细菌接触后可立即引起蛋白质浓度提高,短时间内又有所下降,反复几次后蛋白质浓度基本稳定在明显高于MSL未作用于菌体时的浓度值。可以确定,MSL可损伤细菌膜结构,引发胞液外流,同时,胞液中的蛋白酶造成蛋白质部分被分解,引起蛋白质浓度发生上述变化。上述研究证明,细菌细胞膜是MSL作用的主要靶点之一。
[1]Parachin NS,Mulder KC,Viana AA,et al.Expression systems for heterologous production of antimicrobial peptides[J].Peptides,2012,38(2):446-456.
[2]McGhee JD,von Hippel PH.Theoretical aspects of DNA-protein interactions:co-operative and non-co-operative binding of large ligands to a one-dimensional homogeneous lattice[J].J Mol Biol,1974,86(2):469-489.
[3]Baruah H,Rector CL,Monnier SM,et al.Mechanism of action of non-cisplatin type DNA-targeted platinum anticancer agents:DNA interactions of novel acridinylthioureas and their platinum conjugates[J].Biochem Pharmacol,2002,64(2):191-200.
[4]Theis T,Stahl U.Antifungal proteins:targets,mechanisms and prospective applications[J].Cell Mol Life Sci,2004,61(4):437-455.
[5]Andersen JH,Jenssen H,Sandvik K,et al.Anti-HSV activity of lactoferrin and lactoferricin is dependent on the presence of heparan sulphate at the cell surface[J].J Med Virol,2004,74(2):262-271.
[6]Wang G,Watson KM,Peterkofsky A,et al.Identification of novel human immunodeficiency virus type 1-inhibitory peptides based on the antimicrobial peptide database[J].Antimicrob Agents Chemother,2010,54(3):1343-1346.
[7]McPhee JB,Scott MG,Hancock RE.Design of host defence peptides for antimicrobial and immunity enhancing activities[J].Comb Chem High Throughput Screen,2005,8(3):257-272.
[8]Papo N,Shai Y.Host defense peptides as new weapons in cancer treatment[J].Cell Mol Life Sci,2005,62(7-8):784-790.
[9]Mader JS,Hoskin DW.Cationic antimicrobial peptides as novel cytotoxic agents for cancer treatment[J].Expert Opin Investig Drugs,2006,15(8):933-946.
[10]Epand RM,Epand RF.Modulation of membrane curvature by peptides[J].Biopolymers,2000,55(5):358-363.
[11]Epand RM,Vogel HJ.Diversity of antimicrobial peptides and their mechanisms of action[J].Biochimica et Biophysica Acta,1999,1462(1/2):11-28.
[12]Park CB,Kim HS,Kim SC.Mechanism of action of the antimicrobial peptide buforin Ⅱ:buforin Ⅱ kills microorganisms by penetrating the cell membrane and inhibiting cellular functions[J].Biochem Biophys Res Commun,1998,244(1):253-257.
[13]Brogden KA.Antimicrobial peptides:pore formers or metabolic inhibitors in bacteria?[J].Nat Rev Microbiol,2005,3(3):238-250.
[14]Patrzykat A,Friedrich CL,Zhang L,et al.Sublethal concentrations of pleurocidin-derived antimicrobial peptides inhibit macromolecular synthesis in Escherichia coli[J].Antimicrob Agents Chemother,2002,46(3):605-614.
[15]Rozkov A1,Enfors SO.Analysis and control of proteolysis of recombinant proteins in Escherichia coli[J].Adv Biochem Eng Biotechnol,2004,89:163-195.
