山羊MSTN基因多态性与主要经济性状的关联分析
2015-03-23闵令江丰艳妮李美玉
闵令江,丰艳妮,李 兰,李美玉
(青岛农业大学动物科技学院,青岛 266109)
山羊MSTN基因多态性与主要经济性状的关联分析
闵令江*,丰艳妮,李 兰,李美玉
(青岛农业大学动物科技学院,青岛 266109)
为研究山羊生长抑制素(Myostatin,MSTN)基因的多态性及其与主要经济性状的关系,以山羊为材料,利用PCR-RFLP和PCR-SSCP技术检测了MSTN基因的多态性,分析了其群体遗传结构,并探讨了基因多态性与多个体重、体尺及屠体性状的关系。结果表明,MSTN基因5′调控区-662 bp处C→T转换导致7个群体有TaqⅠ多态,表现CC、CT、TT 3种基因型。波尔山羊CC基因型频率比3个地方品种的CC频率要高,而TT型相反。波尔山羊的等位基因C频率较T高,而地方品种T比C高。除纯种波尔山羊外,其他5个群体均处于Hardy-Weinberg非平衡状态(P<0.01);SSCP检测外显子3后发现,7个群体均存在NN、NM、MM 3种基因型,均没有CT-NN和CT-NM型个体,并且在波尔山羊中也没TT-NN和TT-NM型,F1也没有TT-NM型,3个地方品种中也未检测到TT-MM型个体。MSTN基因的5′调控区对断奶重、净肉重有极显著影响(P<0.01),CC型极显著或显著大于TT型;该位点与后躯肉重也有关(P<0.01),但基因型间差异均不显著(P>0.05)。以上3个指标上均发现有CC>CT>TT的规律。同时该位点对肝重也有显著影响(P<0.05),CT型显著大于TT型(P<0.05)。MSTN基因的外显子3对净肉重、后躯肉重和肝重有极显著效应(P<0.01),MM极显著或显著地大于NN型,并且在数值上表现为MM>NM>NN;5′调控区和外显子3的交互作用对断奶重、后躯肉重和肝重有显著影响(P<0.05), CC-MM型比其他组合基因型表现更重的断奶重、后躯肉重和肝重。以上结果表明:MSTN基因的5′调控区和外显子3的不同分子特征,可用于山羊相应肉用性状的分子标记辅助选择,加速育种进程。
山羊;MSTN基因;体重性状;体尺性状;屠体性状
Myostatin(MSTN)即肌肉生长抑制素,又称生长分化因子-8(GDF-8),为转化生长因子β超家族(TGF-β) 的成员。MSTN是骨骼肌生长的负调控因子,许多研究证明MSTN基因的表达量与肌肉重量变化呈负相关,该基因C端活性区缺失的小鼠比杂合体和野生型的重约30%,表现出“双肌现象”[1],在牛上也证明了这一现象[2]。在皮埃蒙特双肌牛上发现MSTN基因外显子3(G→A)、外显子1(C→A) 发生突变,造成双肌牛比普通牛肌肉增加20%~25%[3];E.Casas等[4]也证明了MSTN基因外显子3的G→A突变与出生重、断奶重等有关系,而渤海黑牛外显子3的G→A和C→T突变与头长、胸围和腰角宽有关[5]。李绍华等[6]发现猪MSTN基因外显子3的A→G突变也与肉用性状密切相关。朱智等[7]发现鸡MSTN基因外显子1的多态与屠宰率有关,后来温彦涛等[8]进一步证明外显子1的 G→C突变对胸肌重和腿肌重有显著影响,张跟喜等[9]也发现外显子SNPs与边鸡的体重有关。这些说明肌肉生长与MSTN基因外显子的SNP有着密切关系。顾志良等[10]发现骨骼肌生长速度在较大差异的肉鸡和蛋鸡MSTNmRNA表达水平有较大的差异,而MSTNmRNA表达量在太湖鹅与皖西白鹅间也存在差异,且在皖西白鹅中与体重和腿肌重显著负相关[11]。MSTN5′调控区的C→G和A→G与边鸡的体重相关[12-13],对高邮鸭而言,C→G对腹脂率有显著影响[14]。对猪MSTN基因5′调控区而言,Y.L.Jiang等[15]发现T→A突变与猪后期日增重和大白猪的初生重有关,于灵芝等[16]也发现与早期体重和日增重有关,刘晓琴等[17]却发现与猪的出生重和断奶重显著相关,而关学敏等[18]发现其仅与出生重有关,吴俊红等[19]却发现其与猪肌纤维直径、肩部背膘厚等显著相关。另外,在家兔中也发现该基因5′调控区T→ C突变有增加活体重、提高胴体重、前腿重、背腰重、后腿重和皮重的效应[20]。以上结果均说明MSTN基因5'调控区和编码区在动物的肉用性能调控上发挥着重要作用。除5′调控区和外显子3之外,3′-UTR的突变也对中国草原红牛的净肉率和眼肌面积有影响[21],而内含子1的 C→T突变对草原红牛的净肉率有显著影响[22]。MSTN除对肌肉生长发育有重大影响外,对脂肪沉积[23-25]、肌肉萎缩[26]、肌肉再生[27]等也有重要作用。
与牛猪禽研究相比,对羊的报道不多,且以研究多态性为主,与经济性状的关联分析较少。研究表明,比利时Texel双肌绵羊与普通的绵羊(Romarow)相比,其MSTN基因的编码区没有碱基的差异[28];研究发现,双肌臀性状对羊的初生重、断奶重以及断奶后日增重没有影响,B.A.Freking等[29]也认为双肌臀性状不影响任何生长率,但使内脏器官的重量降低。刘铮铸等[30]发现,山羊MSTN基因内含子2的C→A颠换与断奶重显著相关,而T→C颠换与出生重有关。
以上报道多单独研究了MSTN基因的5′调控区或外显子3多态性与牛、猪或禽生产性状的关系,本试验以山羊为研究对象,联合分析了MSTN基因的5′调控区和外显子3多态性与体重、体尺及屠体性状的关系,以期更准确地了解MSTN基因对生产性能的影响,以期用于山羊的生产实践和标记辅助育种。
1 材料与方法
1.1 试验动物及试剂
99只波尔山羊、50只鲁北白山羊及其杂交后代来自东营绵野,30只文登奶山羊来自文登得钲,45只崂山奶山羊来自青岛奥特,饲喂以青贮、羊草为主、辅以精料,选择健康、记录齐全的羊只为试验用羊;TaqDNA聚合酶购自上海普洛麦格公司,蛋白酶K、纯化和回收试剂盒(DV807A、DV805A)购自宝生物工程公司,DGL 2000 DNA Marker购自北京鼎国生物公司。
1.2 生产性状及其指标
由于时间关系,F2代仅涉及到6月龄前指标。关联分析时,在引进与纯繁波尔山羊群体间将差异不显著(P>0.05)的指标进行合并处理。体尺性状有体高、体长、胸围、管围、胸深。体重指标包括初生重、断奶重(3月龄)、周岁重(仅波尔山羊)。屠体性状(10月龄)仅涉及F1代,指标有眼肌面积、GR值、肝重、后腿肉重、腰肉重、肩肉重、前躯肉重和后躯肉重。
1.3 样本的采集、DNA提取及检测
在山羊耳朵内侧少毛处用剪耳钳取少量组织样,放入70% 乙醇中并用封口膜封好管口,带回实验室放于-80℃冰箱保存。采用酚氯仿抽提法提取DNA,并用紫外分光光度计和琼脂糖凝胶电泳检测DNA的浓度和质量。
1.4 引物设计与PCR反应
扩增山羊MSTN基因5′侧翼区部分序列的引物、PCR反应体系及条件参考文献[31]。根据MSTN序列(Accession No.:AY032689)设计外显子3的引物,其序列:F:5′-GAAGTCAAGGTAACAGACAC-3′,R:5′-CCACAGCGATCTACTACCATG-3′。反应体系:10×PCR Buffer 2.5 μL,2.5 mmol·L-1dNTPs 2.0 μL,5 mmol·L-1MgCl22.5 μL,1 μmol·L-1引物1.0 μL,5 U·μL-1Taq酶 0.2 μL,50 ng·μL-1DNA模板 1.0 μL,补去离子水至25 μL。反应条件: 94 ℃预变性4 min; 94 ℃变性30 s, 60 ℃退火45 s, 72 ℃延伸1 min,循环40次; 72 ℃延伸10 min。
1.5 基因分型
酶切反应体系按说明书进行,在37℃恒温循环器中消化后电泳。SSCP用北京六一DYCZ-24F垂直电泳槽以8%丙烯酰胺凝胶电泳,其结果用0.1%的AgNO3染色,显色后用hp4500c扫描仪扫描成像。
1.6 统计分析模型
考虑到MSTN基因的5′调控区和外显子3的功能和关系,构建了如下联合分析模型,以期获得该基因对生产性状的更准确遗传效应,计算软件为 SAS(8.1)。
式中,Yijnmk表示第k个山羊的性状观察值;μ为总体均数;Bi为第i个品种(群体)效应;Sj表示第j个性别效应;Pn表示山羊MSTN基因5′调控区第n个基因型效应;Em表示山羊MSTN基因外显子3第m个基因型效应;(PE)nm表示Pn与Em的交互效应;εijnmk为第k个观察值的随机误差。
2 结 果
2.1 山羊MSTN基因5′调控区多态性
在比对分析的基础上,选用TaqⅠ、PshBⅠ、HinfⅠ、XspⅠ、HaeⅢ等酶切分析,结果表明,选用内切酶均可产生预期大小的酶切片段,但除TaqⅠ以外,其他均未发现多态性。酶切电泳后出现的多态图谱见图1。在7个群体中均产生了3种基因型。测序结果表明在-662 bp处存在C→T转换,TaqⅠ识别位点的丢失(T/CGA→TTGA)是产生多态性的原因,序列分析具体情况参考文献[31]。定义等位基因T:仅有1 134 bp带;等位基因C:包含470和874 bp两条带。

M.DGL 2000 marker;1,9.TT;4,8.CC;2,3,5-7,10.TC图1 山羊MSTN基因5′调控区TaqⅠ酶切图Fig.1 Band patterns of PCR products digested with TaqⅠfor 5′-regulatory region of MSTN gene in goats
2.2 群体遗传结构分析
山羊MSTN基因5′调控区基因型统计结果如表1。在7个群体中均检测到3种基因型,其中纯种波尔山羊的CC基因型频率比3个地方品种的CC频率要高,而TT型频率则比3个地方品种低,纯种波尔山羊以TT个体为最少,而地方品种以CT杂合型个体为最少。所有个体中,以CC型居多,占到49.7%,而CT和TT型个体数目则相差不多,分别占到23.4%和26.9%。纯种波尔山羊的等位基因C频率较高,而地方品种以等位基因T的频率较高。
表1 山羊MSTN基因5′调控区基因型及等位基因频率
Table 1 Distribution of allele and genotype frequencies in the 5′-regulatory region ofMSTNgene in goats
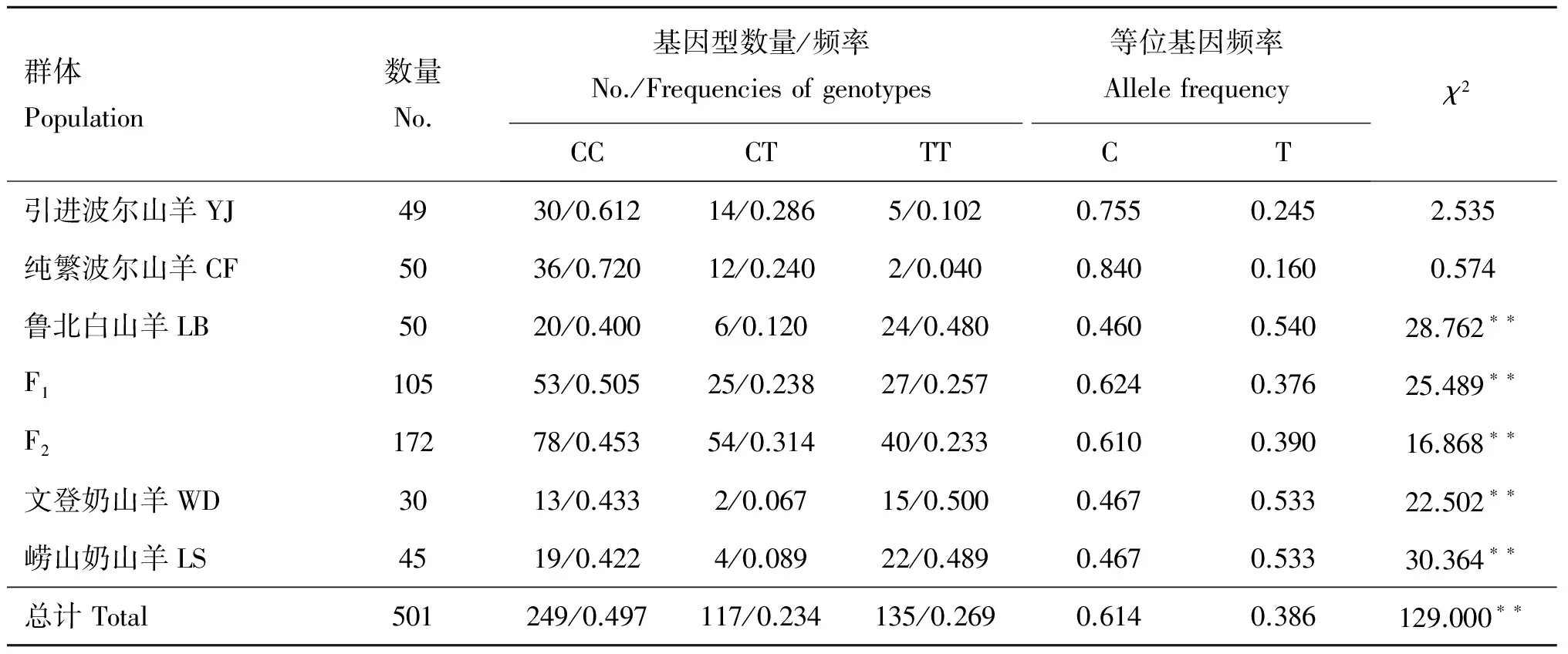
群体Population数量No.基因型数量/频率No./Frequenciesofgenotypes等位基因频率AllelefrequencyCCCTTTCTχ2引进波尔山羊YJ4930/0.61214/0.2865/0.1020.7550.2452.535纯繁波尔山羊CF5036/0.72012/0.2402/0.0400.8400.1600.574鲁北白山羊LB5020/0.4006/0.12024/0.4800.4600.54028.762∗∗F110553/0.50525/0.23827/0.2570.6240.37625.489∗∗F217278/0.45354/0.31440/0.2330.6100.39016.868∗∗文登奶山羊WD3013/0.4332/0.06715/0.5000.4670.53322.502∗∗崂山奶山羊LS4519/0.4224/0.08922/0.4890.4670.53330.364∗∗总计Total501249/0.497117/0.234135/0.2690.6140.386129.000∗∗


2.3 双位点联合群体遗传结构分析
以SSCP技术检测了MSTN基因外显子3,结果发现存在3种基因型NN、NM和MM,不同群体MSTN基因5′调控区和外显子3的双标记基因型统计分析结果如表2所示。结果显示,不同群体均没有发现CT-NN和CT-NM型个体,并且在波尔山羊中也没发现TT-NN和TT-NM型个体的存在,在F1群体中也没有TT-NM型个体。就全体山羊存在的基因型而讲,其频率也存在较大的差异,从0.080(TT-MM)到0.246(CC-NM)不等。但TT-MM型频率在不同群体存在很大差别,在3个地方品种中未检测到TT-MM型个体,而F1群体却达到了0.190,在7个群体中,F1群体CC-NM型频率是最高的,达到0.343。
表2 山羊MSTN基因双标记基因型频率
Table 2 Distribution of genotype frequencies in theMSTNgene in different goat populations
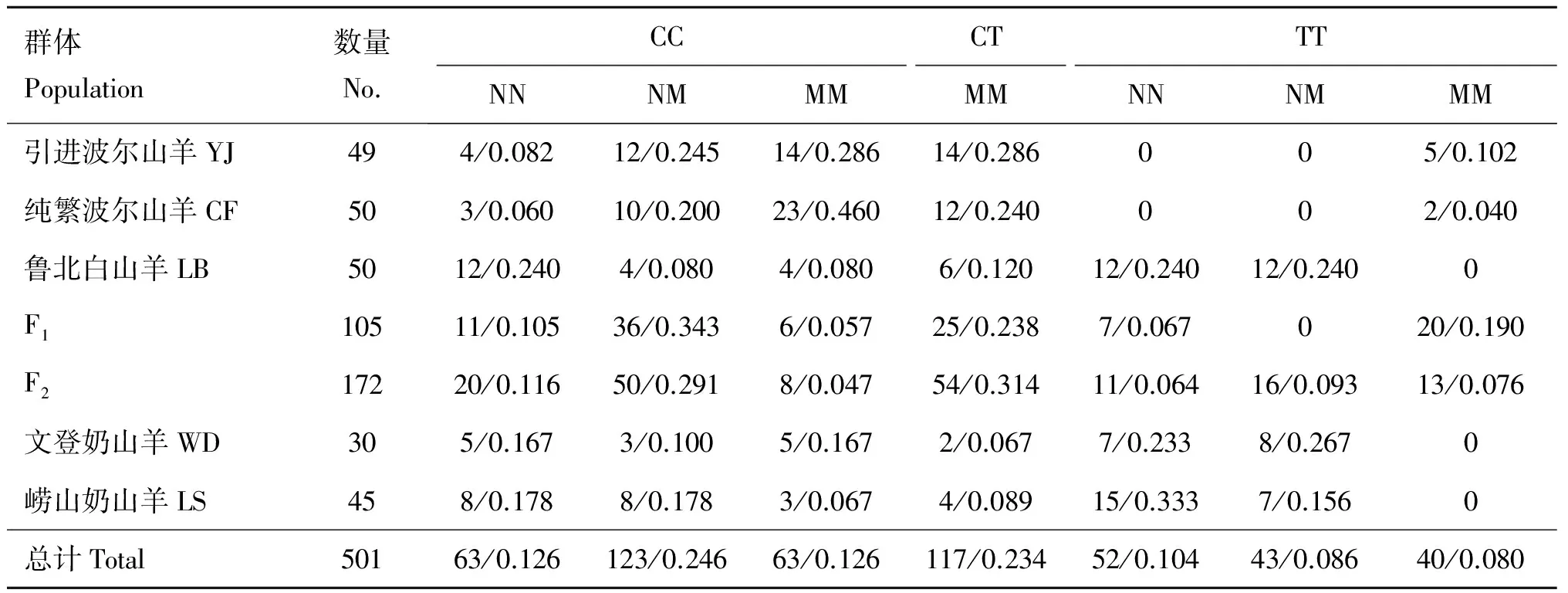
群体Population数量No.CCCTTTNNNMMMMMNNNMMM引进波尔山羊YJ494/0.08212/0.24514/0.28614/0.286005/0.102纯繁波尔山羊CF503/0.06010/0.20023/0.46012/0.240002/0.040鲁北白山羊LB5012/0.2404/0.0804/0.0806/0.12012/0.24012/0.2400F110511/0.10536/0.3436/0.05725/0.2387/0.067020/0.190F217220/0.11650/0.2918/0.04754/0.31411/0.06416/0.09313/0.076文登奶山羊WD305/0.1673/0.1005/0.1672/0.0677/0.2338/0.2670崂山奶山羊LS458/0.1788/0.1783/0.0674/0.08915/0.3337/0.1560总计Total50163/0.126123/0.24663/0.126117/0.23452/0.10443/0.08640/0.080
2.4 山羊MSTN基因双标记对体重、体尺和屠体性状的效应
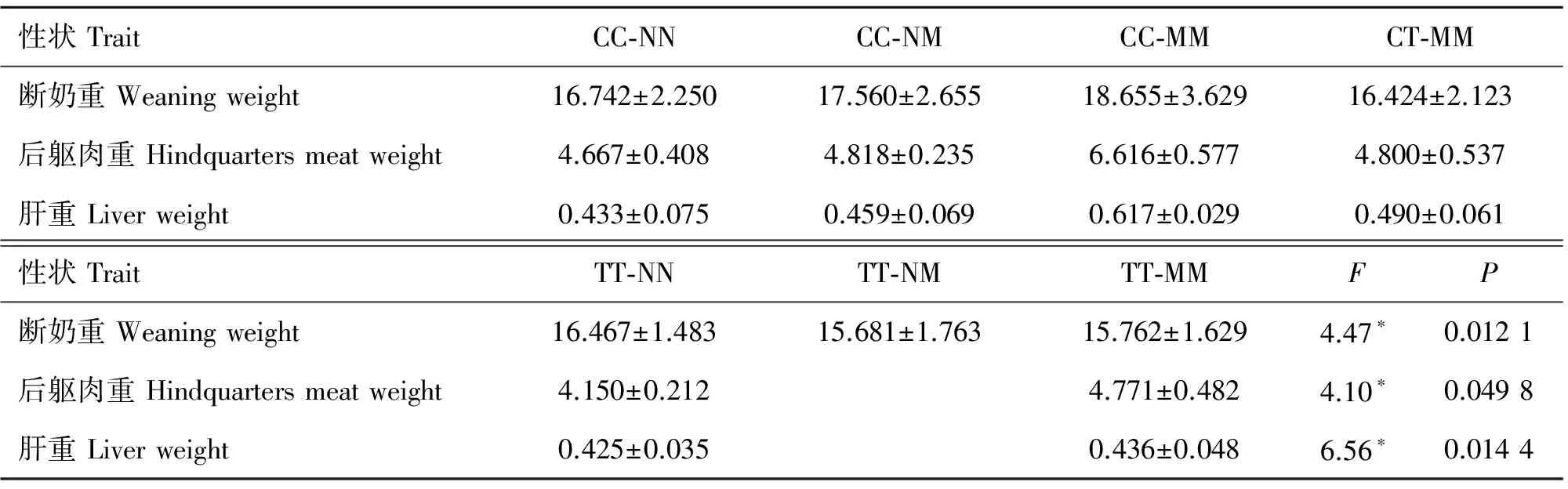
对体高、体长、胸围、胸深、管围进行最小二乘分析后发现,MSTN基因双标记对3、10和12月龄体尺指标的影响均不显著(P>0.05)。对检测的所有体重、屠体指标统计分析后发现,在断奶重上,MSTN基因5′调控区对其有极显著影响(P<0.01),外显子3对断奶重没有影响(P>0.05),而二者的交互作用对断奶重有显著影响(P<0.05),CC型极显著地大于TT型(P<0.01),CT型断奶重也大于TT型,但差异不显著(P>0.05),同时CC-MM型比其他组合基因型表现更大的断奶重;10月龄净肉重上,MSTN基因5′调控区和外显子3对其有极显著影响(P<0.01),而交互作用没有显著影响(P>0.05),CC型净肉重显著地大于TT型(P<0.05),其他基因型之间不存在显著差异(P>0.05),MM型净肉重极显著地大于NN型(P<0.01),NN型显著小于NM型(P<0.05),NM的净肉重也小于MM型,但是差异不显著(P>0.05);MSTN基因5′调控区对后躯肉重有显著效应(P<0.01),但是不同基因型间并没有显著差异(P>0.05),外显子3对后躯肉重也有极显著影响(P<0.01),MM型显著地大于NN型,NM型后躯肉重尽管也大于NN型,但是未见显著差异(P>0.05),同时两个标记的交互作用对后躯肉重也有显著遗传效应(P<0.05),CC-MM是后躯肉重的最佳组合基因型,表达最高的后躯肉重。具体见表3、表4和表5。
表3 山羊MSTN基因5′调控区对体重和屠体性状的效应分析
Table 3 The effect ofMSTNgene 5′-regulatory region on body weight and carcass traits in goats

性状TraitCCCTTTF值P值断奶重Weaningweight17.686±2.930aA16.424±2.123bB15.916±1.633bB8.38∗∗0.0003净肉重Meatweight13.269±1.168a13.080±1.053ab12.761±0.894b12.76∗∗<0.0001后躯肉重Hindquartersmeatweight4.938±0.551a4.800±0.537a4.633±0.505a13.44∗∗<0.0001肝重Liverweight0.471±0.085ab0.490±0.061a0.433±0.043b4.19∗0.0224
不同大写字母表示极显著水平(α=0.01);不同小写字母表示显著水平(α=0.05);同一字母表示差异不显著。*.表示影响显著(P<0.05);**.表示影响极显著(P<0.01)。表4同
The different capital letters meansα=0.01;The different small letters meansα=0.05;The same superscript mean insignificant difference at the same α value.*.Indicates the significant difference(P<0.05);**.Indicates the significant difference(P<0.01).The same as Table4
表4 山羊MSTN基因外显子3对体重和屠体性状的效应分析
Table 4 The effect ofMSTNgene exon 3 on body weight and carcass traits in goats

性状TraitNNNMMMF值P值净肉重Meatweight12.561±0.993bB13.079±0.916aAB13.292±1.181aA13.32∗∗<0.0001后躯肉重Hindquartersmeatweight4.538±0.427b4.818±0.235ab4.995±0.707a15.33∗∗<0.0001肝重Liverweight0.431±0.065b0.459±0.069ab0.490±0.079a6.06∗∗0.0051
表5 山羊MSTN基因双标记交互效应分析
Table 5 Interaction between exon 3 and 5′-regulatory region ofMSTNgene in goats
性状TraitCC⁃NNCC⁃NMCC⁃MMCT⁃MM断奶重Weaningweight16.742±2.25017.560±2.65518.655±3.62916.424±2.123后躯肉重Hindquartersmeatweight4.667±0.4084.818±0.2356.616±0.5774.800±0.537肝重Liverweight0.433±0.0750.459±0.0690.617±0.0290.490±0.061性状TraitTT⁃NNTT⁃NMTT⁃MMFP断奶重Weaningweight16.467±1.48315.681±1.76315.762±1.6294.47∗0.0121后躯肉重Hindquartersmeatweight4.150±0.2124.771±0.4824.10∗0.0498肝重Liverweight0.425±0.0350.436±0.0486.56∗0.0144
*.表示交互效应对性状有显著影响(P<0.05)
*.Indicates the effect of interaction on the trait was significant(P<0.05)
山羊MSTN基因5′调控区与肝重存在显著相关关系(P<0.05),外显子3对其有极显著影响(P<0.01),二者的互作对其也有显著效果(P<0.05),CT型肝重显著地大于TT型(P<0.05),其他基因型之间没有显著差异(P>0.05)(表3);外显子3位点MM型肝重显著地大于NN(P<0.05),NM型肝重尽管也大于NN型,但是没有显著差异(P>0.05)(表4);在二者的组合基因型中,CC-MM表现出最大的肝重(表5),为最佳组合型,利于羊肝生产。
3 讨 论
MSTN基因以其在调控肌肉、脂肪等方面的作用,受到畜牧、医学等业内人士的广泛关注。畜牧业主要关注两方面:一是如何获得与证明对生产有利的MSTN基因突变体,二是怎样使MSTN基因正常的个体不能有效发挥其正常功能。MSTN基因的正常功能主要是调节动物骨骼肌的总量,并使之能够维持适当的比例[32],因此通过开发抑制剂或新型饲料添加剂等途径,封阻其功能,或许成为利用大多数个体生产更多产品的可行途径。同时,利用基因重组技术可获得MSTN基因缺失的其他超级动物或通过检测MSTN基因,寻找对生产有利的突变个体,亦是育种工作者培育产肉率高畜禽的一种有效途径,本研究结果为尝试山羊该方面的育种提供了部分理论参考。
检测的两个MSTN基因位点分别出现CC、CT、TT和NN、NM、MM 3种基因型,并且在7个群体中普遍存在,但是纯种波尔山羊的等位基因C、M频率较高,而地方品种以等位基因T、N的频率较高。这种差异是基因型分布与品种或群体存在极显著相关关系的直接反映(P<0.01):LB、WD和LS间基因型分布差异不显著(P>0.05);YJ与CF间基因型分布差异也不显著(P>0.05)。因此,推测这可能与品种或经济用途有关,并且χ2适合性检验表明纯种波尔山羊群体处于Hardy-Weinberg平衡状态(P>0.05),这或许能够说明波尔山羊以其明显的肉用性能,在长期的选育中使等位基因C、M已基本固定,维持在一个比较理想的水平。因此,进一步推测等位基因C、M可能与波尔山羊的生产性能有关。另外,基因多态性与环境,尤其是与营养的关系问题,目前普遍认为与动物营养有关的基因,如维生素D受体基因、亚甲基四氢叶酸还原酶基因、载脂蛋白基因等的多态性会影响相应营养素的利用,反之,并没有证据表明营养素会引起相应基因多态性的出现或改变,尤其是饲养管理条件,如不同饲养场地。对于动物生产性能来讲,遗传起到决定性作用,对某一性状,尤其是数量性状是多个基因和同一基因的不同构件间综合作用的结果;环境因素固然重要,其作用会同遗传因素得以体现。因此,本研究在构建统计模型时考虑了品种、性别、不同基因型及其交互效应。
将山羊MSTN基因的两个标记位点一起分析时发现,在所研究的群体中均没有CT-NN和CT-NM型个体,并且在波尔山羊中也没发现TT-NN和TT-NM型个体的存在,在F1群体中也没有TT-NM型个体,在3个地方品种中未检测到TT-MM型个体。这可能是抽样不均匀、样本数目少或由于两位点不同基因型间的遗传共适应差异引起的,当然,也不能排除与其他基因间连锁不平衡或相邻的两个如此紧密的标记位点间异常连锁情况或遗传共适应与连锁的协同作用的可能性。
本研究对山羊体重性状与MSTN5′调控区和外显子3的多态性做了分析,发现MSTN基因5′调控区与断奶重有直接相关(P<0.01),外显子3与断奶重没有直接的相关关系(P>0.05),不过外显子3和5′调控区的交互作用对断奶重有显著影响(P<0.05),体现为CC-MM型比其他组合基因型表现更重的断奶重。这与5′调控区的突变与边鸡体重相关[12-13]、与猪早期体重和日增重有关[16]、与猪的断奶重显著相关[17]有类似的结论。MSTN基因5′调控区SNPs与鸡的初生重有关(P<0.05)[25],也对猪的出生重有影响[15,17-18],但在山羊上我们没有发现MSTN基因5′调控区与初生重有关,这可能与物种或群体规模有关,具体需要进一步的验证。E.Casas等[4]研究表明,MSTN基因外显子3的突变不仅造成比利时蓝牛和皮埃蒙特牛的双肌性状,而且也能使牛初生重和周岁重增加,H.Arnold等[33]也有类似结论,认为突变导致双肌性状的同时,也能提高初生重。这与本研究的结果:外显子3与初生重、断奶重、10月龄屠宰活重及周岁重没有直接相关关系不一致。这可能说明存在物种间的差异或者尽管山羊外显子3发生两处突变,但是发挥作用可能要受到其他未知因素的调控或影响。另外,本研究发现MSTN基因5′调控区和外显子3对山羊3、10和12月龄的体高、体长、胸围、胸深、管围体尺指标的影响均不显著,但是刘桂芬等[5]却发现渤海黑牛的胸围指标与外显子3的多态性有关,这可能是由于物种或年龄不同所导致。
A.C.McPherron等[34]通过基因敲除技术使小鼠的MSTN基因的C端生物活性区缺失得到纯合体小鼠,其肩、臀部的肌肉明显肥大,肌肉量显著增加,而本研究发现山羊MSTN基因两个位点及其互作均与肩肉重无关(P>0.05),这可能是由于物种不同所致。但是本研究结果同时表明山羊MSTN基因5′调控区和外显子3对10月龄净肉重和后躯肉重均有影响,这与A.C.McPherron等[34]和乔西波等[20]对屠体性状的研究结果基本吻合。
本研究表明,山羊MSTN基因5′调控区、外显子3及其交互作用与肝重存在相关性,不过在其他动物方面还未见类似报道。但是有些研究证明MSTN及其基因与脂肪的代谢之间存在关系。MSTN基因突变纯合体小鼠与对照组比平均体脂肪减少70%,并随年龄的增加,其脂肪的沉积能力降低。J.Lin等[24]从敲除MSTN基因的小鼠与野生型比较中发现前者肌肉增加的同时,脂肪量减少,导致瘦素分泌也相应地减少。Z.Gu等[25]以鸡为试验材料证明了MSTN基因也与脂肪有关,基因型间腹脂重和腹脂率有显著差异(P<0.05)。这些结果可能在一定程度上暗示了肝功能与脂肪累积的复杂关系。
勿庸置疑,肝与脂肪之间有着密切的关系:脂肪的合成和释放﹑脂肪酸分解﹑酮体生成与氧化﹑胆固醇与磷脂的合成﹑脂蛋白合成和运输等均在肝内进行。本研究和他人的研究表明,MSTN基因对肝和脂肪有影响,那么MSTN基因有没有通过肝发挥对脂肪的影响呢?这是否就是顾志良等所推测的:通过合成代谢的间接方式实现,即通过调节体内能量代谢的平衡来协调脂肪在体内的沉积,同时顾志良等还推测:MSTN可能作为细胞因子分泌到血液中,通过相应循环到达脂肪细胞,然后直接作用于脂肪细胞从而发挥影响脂肪代谢的作用;另外,也不能排除通过调节由肌细胞或神经细胞分泌的其他细胞因子来直接或间接的达到控制脂肪的可能性。A.C.McPherron等[23]也提出过类似看法:MSTN抑制脂肪沉积的机制可能是MSTN直接作用于脂肪组织,调节其代谢过程或骨骼肌中MSTN信号缺乏间接影响了脂肪组织。但是本研究认为有些资料倾向于表明MSTN对脂肪的直接作用。H.S.Kim等[35]用MSTN处理3T3-L1细胞时,前脂细胞的体外分化会受到它的影响。另外,在脂肪组织中也检测到MSTN基因的表达。总之,目前对MSTN如何控制脂肪代谢还知之甚少,基本上停留在推测阶段。对MSTN与肝和脂肪之间的关系进行深入研究有助于了解MSTN控制脂肪代谢的机理。尽管本研究结果表明:山羊MSTN基因5′调控区、外显子3及其交互作用对肝重存有显著影响,但是山羊MSTN基因在肝中表达情况有待研究,目前为止尚未发现表达产物[36]。不过已经证实MSTN基因在猪的肝、脂肪组织、脑、舌、心、肺、脾、小肠、肾和骨髓等组织中也有少量表达,在鸡胚的肝中没有MSTN基因的表达产物[37]。
山羊MSTN基因多态性与生产性状关联分析表明,MSTN基因影响了断奶重、净肉重、后躯肉重和肝重4个指标上,5′调控区对其均有单独效应,外显子3对断奶重没有独立效应,在净肉重上,5′调控区和外显子3对其互作效应不显著。这可能初步说明调控和被调控之间的作用发挥的方式是复杂的,这有助于理解基因调控表达的分子机理。
[1] HAMRICK M W,MCPHERRON A C,LOVEJOY C O,et al.Femoral morphology and cross-sectional geometry of adult myostatin-deficient mice[J].Bone,2000,27(3):343-349.
[2] OLDHAM J M,MARTYN J A K,SHARMA M,et al.Molecular expression of myostatin and MyoD is greater in double-muscled than normal-muscled cattle fetuses[J].AmJPhysiol,2001,280(5):R1488-R1493.
[3] MCPHERRON A C,LEE S J.Double muscling in cattle due to mutations in the myostatin gene[J].ProcNatlAcadSciUSA,1997,94(23):12457-12461.
[4] CASAS E,KEELE J W,FAHRENKRUG S C,et al.Quantitative analysis of birth,weaning,and yearling weights and calving difficulty in Piedmontese crossbreds segregating an inactive myostatin allele[J].JAnimSci,1999,77(7):1686-1692.
[5] 刘桂芬,万发春,刘晓牧,等.渤海黑牛MSTN基因多态性位点与体尺性状的关联性分析[J].华北农学报,2011,26(1):17-21. LIU G F,WAN F C,LIU X M.et al.Analysis of the association between polymorphisms ofMSTNgene and body size indexes in Chinese Bohai Black cattle[J].ActaAgriculturaeBoreali-Sinica,2011,26(1):17-21.(in Chinese)
[6] 李绍华,熊远著,郑 嵘,等.猪MSTN基因多态性及其SNPs的研究[J].遗传学报,2002,29(4):326-331. LI S H,XIONG Y Z,ZHENG R,et al.Polymorphism of porcinemyostatingene[J].ActaGeneticaSinica,2002,29(4):326-331.(in Chinese)
[7] 朱 智,吴登俊,徐宁迎.鸡Myostatin 基因单核苷酸多态性及其对屠体性状的遗传效应分析[J].遗传,2007,29(5):593-598. ZHU Z,WU D J,XU N Y.SNPs ofmyostatingene and its genetic effects on carcass traits in chicken[J].Hereditas,2007,29(5):593-598.(in Chinese)
[8] 温彦涛,武子寅,赵振华,等.鸡MSTN基因多态性及其与屠体性状的关联分析[J].中国家禽,2012,34(16):29-32,36. WEN Y T,WU Z Y,ZHAO Z H,et al.Polymorphisms in exon 1 ofmyostatingene and its relationship with carcass traits in chicken[J].ChinaPoultry,2012,34(16):29-32,36.(in Chinese)
[9] 张跟喜,丁馥香,是燕萍,等.肌肉生长抑制素基因(MSTN)外显子1的多态性及其与边鸡生长性状的关联分析[J].农业生物技术学报,2011,19(1):122-127. ZHANG G X,DING F X,SHI Y P,et al.Polymorphisms in exon 1 of themyostatingene(MSTN) and its relationship with growth traits in Bian chicken[J].JournalofAgriculturalBiotechnology,2011,19(1):122-127.(in Chinese)
[10] 顾志良,张海峰,张大海,等.鸡Myostatin基因的单核昔酸多态性的群体遗传学分析[J].遗传学报,2002,29(7):599-606. GU Z L,ZHANG H F,ZHU D H,et al.Single nucleotide polymorphism analysis of the chickenmyostatingene in different chicken Lines[J].ActaGeneticaSinica,2002,29(7):599-606.(in Chinese)
[11] 汤青萍,宋 迟,章双杰,等.太湖鹅与皖西白鹅IGF-I和MSTN mRNA表达与屠宰性状相关性分析[J].东北农业大学学报,2013,44(9):51-56. TANG Q P,SONG C,ZHANG S J,et al.Gene expression profile ofIGF-I,MSTNmRNA and their correlation with carcass traits in Taihu goose and Wanxi goose(CarassiusauratusGibelio) using UPLC/Q-TOF MS[J].JournalofNortheastAgriculturalUniversity,2013,44(9):51-56.(in Chinese)
[12] 张跟喜,曹宁贤,丁馥香,等.边鸡MSTN基因C.234位点对生长性状的遗传效应分析[J].中国兽医学报,2013,33(9):1470-1474. ZHANG G X,CAO N X,DING F X,et al.Genetic effect of the C.234 locus of theMSTNgene on growth traits in Bian chicken[J].ChineseJournalofVeterinaryScience,2013,33(9):1470-1474.(in Chinese)
[13] 刘 艳,纽广林,张跟喜,等.肌肉生长抑制素基因5′调控区的多态性对边鸡生长和繁殖性状的遗传效应[J].中国家禽,2013,35(2):11-14. LIU Y,NIU G L,ZHANG G X,et al.Polymorphisms in 5′-regulatory region ofmyostatingene and its association with growth and reproduction traits in Bian chicken[J].ChinaPoultry,2013,35(2):11-14.(in Chinese)
[14] 赵南南,陈永华,刘 倩,等.高邮鸭肌肉生长抑制素基因(MSTN) 5′调控区多态性与生长及腹脂率的关联分析[J].畜牧与兽医,2013,45(7):9-13. ZHAO N N,CHEN Y H,LIU Q,et al.Association of theMSTN-5′ regulatory region polymorphisms with body weights and abdominal fat rates in the Gaoyou duck[J].AnimalHusbandry&VeterinaryMedicine,2013,45(7):9-13.(in Chinese)
[15] JIANG Y L,LI N,FAN X Z,et al.Associations of T→A mutation in the promoter region ofmyostatingene with birth weight in Yorkshire pigs[J].Asian-AustJAnimSci,2002,15(11):1543-1545.
[16] 于灵芝,唐 辉,王继英,等.肌肉生长抑制素基因5′调控区的多态性与大白猪的早期生长有关[J].中国科学C辑:生命科学,2007,37(4):435-440. YU L Z,TANG H,WANG J Y,et al.Association of theMSTN-5′ regulatory region polymorphisms with growth traits in swine[J].ScienceinChina(Series C:Life Sciences),2007,37(4):435-440.(in Chinese)
[17] 刘晓琴,马喜山,唐中林,等.猪MSTN基因的多态性和生长性状关联分析[J].畜牧兽医学报,2013,44(7):1063-1069. LIU X Q,MA X S,TANG Z L,et al.Polymorphism ofMSTNgene and its association with growth traits in porcine[J].ActaVeterinariaetZootechnicaSinica,2013,44(7):1063-1069.(in Chinese)
[18] 关学敏,张艳英,郭传甲,等.猪肌肉生长抑制素基因5′调控区的突变与生产性能的相关分析[J].西北农业学报,2006,15(2):7-9. GUAN X M,ZHANG Y Y,GUO C J,et al.Relationship of mutation in the promoter region of myostatin gene with growth traits in swine[J].ActaAgriculturaeBoreali-OccidentalisSinica,2006,15(2):7-9.(in Chinese)
[19] 吴俊红,武艳群,赵晓枫,等.Myostatin基因5′调控区的多态与猪生长性能的关系[J].畜牧兽医学报,2009,40(5):617-621. WU J H,WU Y Q,ZHAO X F,et al.Relationship polymorphism of 5′ regulatory region of porcineMSTNand growth performance[J].ActaVeterinariaetZootechnicaSinica,2009,40(5):617-621.(in Chinese)
[20] 乔西波,徐凯勇,李 标,等.家兔肌肉生长抑制素基因多态性及其遗传效应分析[J].山东农业大学学报(自然科学版),2012,43(2):247-251. QIAO X B,XU K Y,LI B,et al.Polymorphism and genetic effects of myostatin gene in rabbits[J].JournalofShandongAgriculturalUniversity(NaturalScienceEdition),2012,43(2):247-251.(in Chinese)
[21] 郭振刚,张立春,曹 阳,等.中国草原红牛肌肉生长抑制素基因3′-UTR多态性及其与屠宰性状的关联性分析[J].中国畜牧兽医,2013,40(10):184-188. GUO Z G,ZHANG L C,CAO Y,et al.Correlations analysis between polymorphism of 3′-UTR inMSTNgene and slaughter traits of China red steppe[J].ChinaAnimalHusbandry&VeterinaryMedicine,2013,40(10):184-188.(in Chinese)
[22] 张 胜,张永宏,高 妍,等.草原红牛肌生成抑制素基因内含子1多态性及部分屠宰性状的相关性分析[J].中国兽医学报,2010,30(11):1157-1161. ZHANG S,ZHANG Y H,GAO Y,et al.Polymorphism of myostatin intron 1 gene and its associations with several carcass traits in red steppe[J].ChineseJournalofVeterinaryScience,2010,30(11):1157-1161.(in Chinese)
[23] McPHERRON A C,LEE S J.Suppression of body fat accumulation in myostatin-deficient mice[J].JClinInvest,2002,109(5):595-601.
[24] LIN J,ARNOLD H B,DELLA-FERA M A,et al.Myostatin knockout in mice increases myogenesis and decreases adipogenesis[J].BiochemBiophysResCommun,2002,291(3):701-706.
[25] GU Z,ZHU D,LI N,et al.The single nucleotide polymorphisms of the chicken myostatin gene are associated with skeletal muscle and adipose growth[J].SciChinaCLifeSci,2004,47(1):25-30.
[26] REARDON K A,DAVIS J,KAPSA R M I,et al.Myostatin,insulin-like growth factor-1,and leukemia inhibitory factor mRNAs are upregulated in chronic human disuse muscle atrophy[J].MuscleNerve,2001,24(7):893-899.
[27] KIRK S,OLDHAM J,KAMBADUR R,et al.Myostatin regulation during skeletal muscle regeneration[J].JCellPhysiol,2000,184(3):356-363.
[28] MARCQ F.Inestigating the role of myostatin in the determinison of the double muscling characterining Balgian Texel sheep[J].AnimGenet,1998,21(suppl.1):52.
[29] FREKING B A,KEELE J W,NIELSEN M K,et al.Evolution the ovine callipyge locus:Genotypic effects on growth,slaughter and carcass traits[J].JAnimSci,1998,76(10):2549-2559.
[30] 刘铮铸,李祥龙,巩元芳,等.MSTN基因内含子2多态性与山羊体重性状相关研究[J].畜牧兽医学报,2006,37(8):745-748. LIU Z Z,LI X L,GONG Y F,et al.Relationship between polymorphism of goatMSTNgene intron 2 and body weight[J].ActaVeterinariaetZootechnicaSinica,2006,37(8):745-748.(in Chinese)
[31] 王春光,丰艳妮,李美玉,等.山羊MSTN基因5′侧翼区序列克隆与分析[J].青岛农业大学学报(自然科学版),2014,31(3):162-166. WANG C G,FENG Y N,LI M Y,et al.Cloning and sequence analysis about the 5′ flanking region ofMSTNgene in goat[J].JournalofQingdaoAgriculturalUniversity(NaturalScience),2014,31(3):162-166.(in Chinese)
[32] LEE S J,MCPHERRON A C.Myostatin and the control of skeletal muscle mass:commentary[J].CurrOpinGenetDev,1999,9(5):604-607.
[33] ARNOLD H,DELLA-FERA M A,BAILE C A.Review of myostatin history,physiology and applications[J].IntArchBiosci,2001,2001:1014-1022.
[34] McPHERRON A C,LAWLER A M,LEE S J.Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily members[J].Nature,1997,387:83-90.[35] KIM H S,LIANG L,DEAN R G,et al.Inhibition of preadipocyte differentiation by myostatin treatment in 3T3-L1 cultures[J].BiochemBiophysResCommun,2001,281(4):902-906.
[36] 尹 阔,任述强,徐国江,等.南疆不同品种绵羊MSTN基因克隆及其组织表达谱分析[J].塔里木大学学报,2011,23(2):1-7. YIN K,REN S Q,XU G J,et al.Molecular cloning and expression profile of myostatin from sheep in the south of Xinjiang[J].JournalofTarimUniversity,2011,23(2):1-7.(in Chinese)
[37] KUBOTA K,SATO F,ARAMAKI S,et al.Ubiquitous expression of myostatin in chicken embryonic tissues:its high expression in testis and ovary[J].CompBiochemPhysiolAMolIntegrPhysiol,2007,148(3):550-555.
(编辑 郭云雁)
Associations ofMSTNGene’s Polymorphisms with Some Economic Traits in Goats
MIN Ling-jiang*,FENG Yan-ni,LI Lan,LI Mei-yu
(CollegeofAnimalScienceandTechnology,QingdaoAgriculturalUniversity,Qingdao266109,China)
This experiment was designed to study the polymorphisms ofMyostatin(MSTN) gene and its effects on body weight,body measurement and carcass traits in goats.The polymorphisms of 5′-regulatory region and exon 3 ofMSTNgene in some goat populations were detected by PCR-RFLP and PCR-SSCP in the present study,respectively.The results showed that:The transition(C→T) at -662 bp in the 5′- regulatory region leaded to polymorphisms ofTaqⅠ and there were CC,CT and TT genotypes in the 7 populations.The frequency of genotype CC in Boer goat was higher than that in the 3 indigenous goat populations,but the frequency of genotype TT in Boer goat was lower than that in the 3 indigenous goat populations.The frequency of allele C was higher than that of allele T in the Boer goats,while it was contrary in the 3 indigenous goat populations.Except for Boer goat populations,5 other populations were at Hardy-Weinberg nonequilibrium(P<0.01).Three genotypes NN,NM and MM were found in exon 3 ofMSTNgene in 7 populations.The individuals with genotype CT-NN and CT-NM were not detected in the 7 populations.The individuals with genotype TT-NN and TT-NM were not detected in Boer goats,and the individuals with genotype TT-NM were also not found in F1.Furthermore,individuals with genotype TT-MM were also not observed in 3 indigenous goat populations.The correlations between the polymorphisms ofMSTNgene 5′-regulatory region and weaning weight,meat weight and hindquarters meat weight were very significant(P<0.01).The average values of weaning weight and meat weight of individuals with genotype CC were significantly higher than that of individuals with genotype TT(P<0.01 in weaning weight,P<0.05 in meat weight) and the average values of hindquarters meat weight were not significantly different among different genotypes(P>0.05).The average values of weaning weight,meat weight and hindquarters meat weight in genotypes CC,CT and TT decreased in turn.At the same time,the significant correlations between the polymorphisms ofMSTNgene 5′-regulatory region and liver weight was found(P<0.05).The average values of liver weight of individuals with genotype CT was significantly higher than that of individuals with genotype TT and the significant difference in liver weight among other genotypes were not observed(P>0.05).The significant correlations between the polymorphisms of exon 3 and meat weight,hindquarters meat weight and liver weight were observed(P<0.01).The genetic effects for genotypes were MM>NM>NN and the average values of meat weight,hindquarters meat weight and liver weight of individuals with genotype MM were significantly higher than that of individuals with genotype NN(P<0.01 in meat weight,P<0.05 in hindquarters meat weight and liver weight).The genetic interaction between exon 3 and 5′-regulatory region affected significantly weaning weight,hindquarters meat weight and liver weight(P<0.05).The average values of the 3 indexes of individuals with genotype CC-MM were the highest among the compound genotypes.Therefore,the differentMSTNgenotypes might be used as molecular genetic marker to select body weight,body measurement or carcass traits in goats.
goat;MSTNgene;body weight trait;body measurement trait;carcass trait
10.11843/j.issn.0366-6964.2015.09.005
2014-05-22
山东省现代农业产业技术体系羊创新团队项目(SDAIT-09-011-08);山东省农业良种工程项目(2011186)
闵令江(1970-),男,山东沂水人,博士,教授,主要从事动物生产与繁育研究
*通信作者:闵令江,E-mail:mlj2963@126.com
S827;S813.3
A
0366-6964(2015)09-1515-10
