茵陈蒿汤上调树突状细胞Axl 抑制慢加急性肝衰竭大鼠肝脏树突状细胞凋亡*
2015-03-23曹承楼孙克伟
曹承楼 孙克伟 胡 莉 陈 斌
1.安徽中医药大学第一附属医院肝病科 (安徽 合肥,230031) 2.湖南中医药大学第一附属医院肝病科
慢加急性肝衰竭(ACLF)是在慢性肝病基础上出现的急性肝功能失代偿,表现为慢性肝病病理损害的基础上,发生新的程度不等的肝细胞坏死性病变,是严重威胁慢性肝病患者,尤其是慢性病毒性肝炎患者的疾病。ACLF 属中医黄疸病范畴,茵陈蒿汤作为治疗阳黄病的经典方剂,常作为基础方药用于ACLF 的治疗中。但其治疗的现代药理作用机制远未阐明。我们拟从DC 的凋亡及Axl 信号对凋亡的调控作用探讨其作用机理,以揭示其治疗ACLF 的免疫病理机制。
1 材料与方法
1.1 实验动物 SPF 级雄性Wistar 大鼠70 只,体重150~200g,购于湖南斯莱克景达实验动物有限责任公司,质量合格证No.43006700000440。动物饲育于中南大学附属湘雅三医院动物实验中心,实验动物设施许可证号SYXK(湘)2010-001,实验动物设施使用证明号No.00044537。实验前1 周领取动物,每笼2~3 只分笼饲养,自由进食与饮水。
1.2 药物及主要试剂与设备 茵陈蒿汤液配方比例为茵陈蒿18g、大黄6g、栀子12g,购于湖南中医医药大学第一附属医院中药房(茵陈蒿产地:河北;大黄产地:四川;栀子产地:湖南),水煎煮浓缩成生药含量为0.9g/ml 的药液。牛血清白蛋白、脂多糖(LPS)(Biosharp 公司产品);D-氨基半乳糖(D-Gal)(Sigma 公司产品);肝功能检测试剂盒(日立高新技术公司产品);Tunel细胞凋亡原位检测试剂盒(南京凯基生物公司产品);免疫组化检测试剂盒、辣根酶标记抗地高辛抗体(北京中杉金桥公司产品);CD123 抗体(Santa Cruz 公司产品);CD11c 抗体(Abcam 公司产品);自动生化分析仪(日立LABOSPECT003 公司产品)。
1.3 动物分组与处理 70 只大鼠分6 只正常组,其余64 只先制作免疫性肝纤维化模型,具体方法为每次取0.5ml 牛血清白蛋白乳化液(含牛血清白蛋白4mg)皮下多点注射致敏,共4 次(间隔14、10、10d)。然后采用尾静脉注射牛血清白蛋白攻击,每周两次,牛血清白蛋白含量自2mg/次渐加0.5mg/次至4mg/次,维持此剂量,共6 周。到第5 周时共成模44 只,取30 只分为5 组:肝纤维化组T0、模型组T1、模型组T2、中药组T1、中药组T2。在第6 周时开始给予中药组T1、T2每天灌胃茵陈蒿汤液0.4ml/100g,模型组T1、T2大鼠灌胃等量生理盐水。第6 周末,除正常组、肝纤维化组T0外,其余4 组均予以腹腔注射D-Gal+LPS 液(合D-Gal 400mg/kg,LPS 100 μg/kg)急性攻击建立慢加急性肝衰竭模型。中药组T1、T2大鼠在急性攻击后立即灌胃茵陈蒿汤液0.4ml/100g,q4h,模型组T1、2大鼠则灌胃等量生理盐水。于急性攻击前(正常组、肝纤维化组T0)及攻击后1h(模型组T1、中药组T1)、12h(模型组T2、中药组T2)每组各取6 只大鼠处死取血,另取肝组织置4%多聚甲醛溶液内固定。
1.4 观察指标与方法
1.4.1 各组大鼠肝功能检测 采用自动生化分析仪检测肝功能,包括ALT、AST、TBil、DBil、IBil、TP、Alb、Glo、GGT、ALP。
1.4.2 各组大鼠肝脏病理学变化 肝脏大体标本经观察照相后,取肝组织标本石蜡包埋后切片,常规HE 染色,中性树胶,盖玻片封片。
1.4.3 各组大鼠细胞凋亡指数 TUNEL 凋亡染色按试剂盒说明书操作,具体为切片脱腊至水后,促渗,封闭,通透,TdT 酶反应液37℃避光反应60min,链霉素-HRP 液37℃避光反应30min,DAB 液显色。然后进行免疫组化染色,一抗液为CD123抗体或CD11c 抗体,加入二抗液孵育后GBI-久红液显色,苏木素复染,封片。同时制作阳性片与阴性片对照。每张切片分别取10 个视野,计数CD123 或CD11c 标记的细胞数及其中的凋亡细胞数,计算凋亡指数(AI)。
1.4.4 各组大鼠肝内树突状细胞Axl-mRNA 表达水平 大鼠Axl 具有两种略有差异的全序列NM_031794.1 和 NM_001013147.1,避开两条序列的差异部分,采用Primer Premier 5.0 软件设计探针序列:5'-CAG GGC TGA GAT TCT GAG CTG ACT GAC GAC TTT CCA-3',地高辛标记3'端,由生工生物工程(上海)股份有限公司合成。先进行原位杂交染色,具体为切片脱腊至水,促渗,封闭,通透,后固定,预杂交液40°3h,杂交液40°过夜,辣根酶标记抗地高辛抗体37°60min,Streptavidin-HRP液37℃30min,DAB 液显色。然后同上进行免疫组化染色。同时制作阳性片与阴性片对照。原位杂交切片分别取10 个视野拍照,用Adobe photoshop7.0 软件将照片中的CD123 或CD11c标记的细胞截取出来,然后采用Image Pro Plus 6.0 软件检测这类细胞DAB 染色的褐色的光密度(OD),取平均光密度值(MOD)统计。
1.5 统计学方法 所有数据采用SPSS 13.0 软件分析完成,计量资料用均数±标准差(±s)表示,多组间均数比较采用单因素方差分析(One-Way ANOVA)比较,选LSD 法比较组间差异,两组计量资料之间相关性分析采用线性相关分析,取P <0.05为差异有显著性意义。
2 结果
2.1 各组大鼠肝功能检测 结果见表1、表2、表3。
表1 各组大鼠血清ALT、AST、ALP、GGT 水平比较(±s)
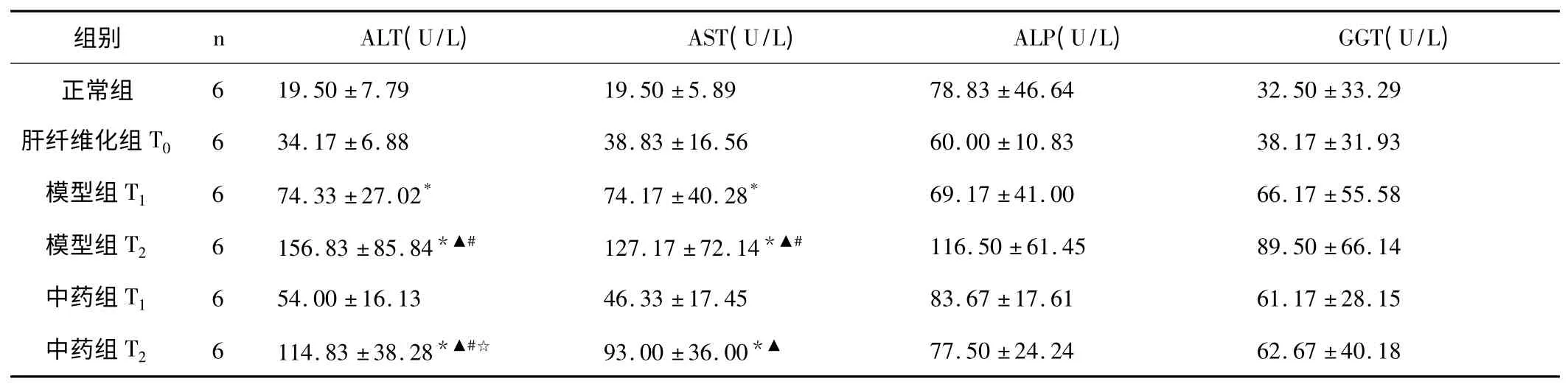
表1 各组大鼠血清ALT、AST、ALP、GGT 水平比较(±s)
与正常组比较,* P <0.05;与肝纤维化组T0比较,▲P <0.05;与对应时间点模型组比较,☆P <0.05;与相应T1 组比较,#P <0.05
表2 各组大鼠血清蛋白水平比较(±s)
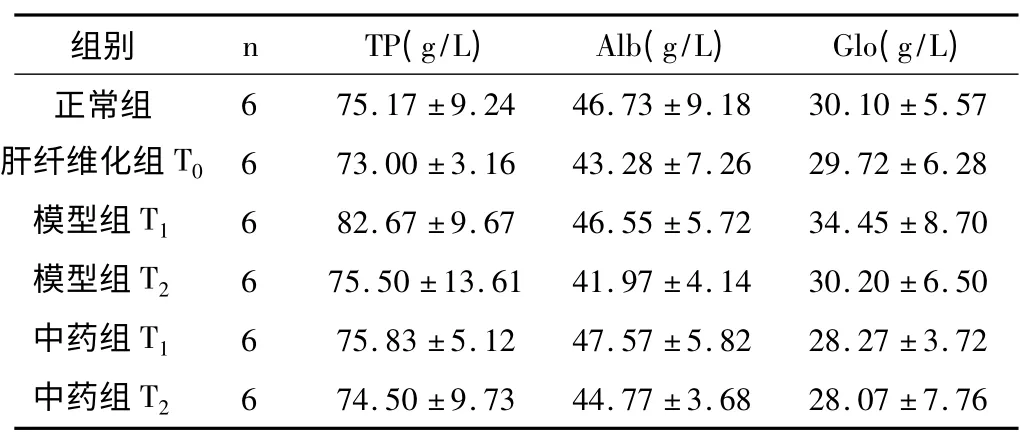
表2 各组大鼠血清蛋白水平比较(±s)
各组大鼠血清TP、Alb、Glo 进行比较,各组间差异无显著性意义(TP:F=0.82,P=0.54;Alb:F=0.74,P=0.60;Glo:F=0.73,P=0.61)。这可能与模型急性攻击后采血时间较短,而蛋白合成功能障碍尚未显示有关性。
表3 各组大鼠血清胆红素水平比较(±s)
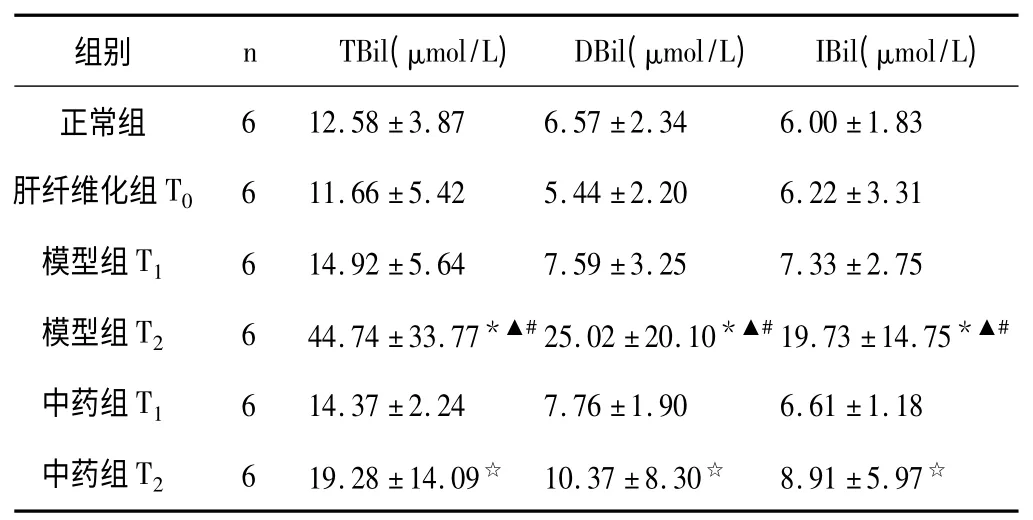
表3 各组大鼠血清胆红素水平比较(±s)
与正常组比较,* P <0.05;与肝纤维化组比较,▲P <0.05;与对应时间点模型组比较,☆P <0.05;与相应T1组比较,#P <0.05
2.2 各组大鼠病理学检测
2.2.1 各组大鼠肝脏大体情况及HE 染色 肝纤维化大鼠肝脏色暗红,表面有脂肪沉积,肝脏各叶黏连明显,肝脏边缘圆钝,与正常组大鼠肝脏区别明显,肝脏取材时有颗粒感,韧度高于正常组大鼠肝脏。经D-Gal +LPS 急性攻击后,肝脏肿胀增大,切开后可见充血明显。HE 染色显示:肝纤维化组大鼠肝脏有脂肪变,假小叶形成;模型组大鼠则可见肝窦内淤血,大片坏死,炎性细胞浸润,其中以12h 时间点的模型组T2明显;中药组炎性反应较模型组减轻。(见插页图1)
2.2.2 各组大鼠细胞凋亡指数 CD11c 和CD123 标记的细胞凋亡检测表明,两种树突状细胞在肝内表达均较少,每视野仅见1~31 个阳性细胞,呈分散分布,相对集中于血管周围,CD123阳性细胞在肝内数量多于CD11c 阳性细胞。各组间两种细胞凋亡指数的变化近似,并有显著性意义(CD11c:F=40.40,P <0.01;CD123:F=43.85,P <0.01)。在肝纤维化组,凋亡指数已有增高,而在急性攻击后,细胞凋亡明显增加,且随时间迁移凋亡细胞增加到近20%。中药茵陈蒿汤在急性攻击后1h、12h均显示有抑制凋亡的作用。见表4。
表4 各组大鼠肝内树突状细胞凋亡指数比较(±s)
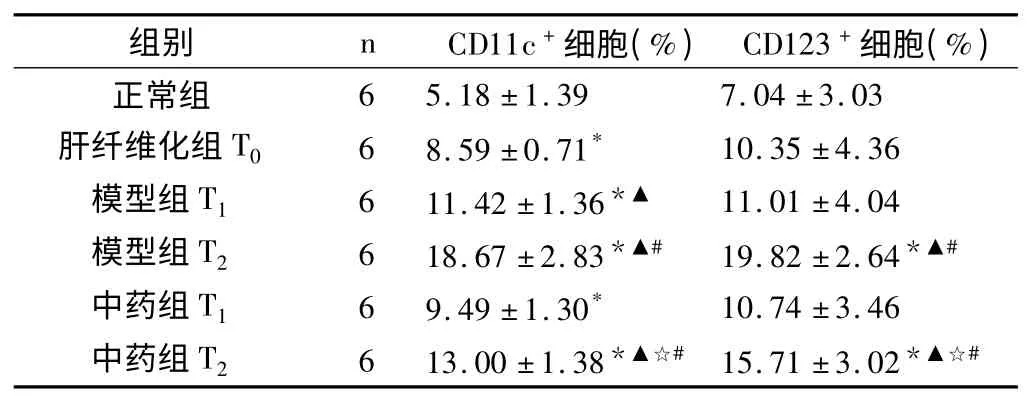
表4 各组大鼠肝内树突状细胞凋亡指数比较(±s)
与正常组比较,* P <0.05;与肝纤维化组T0比较,▲P <0.05;与对应时间点模型组比较,☆P <0.05;与相应T1组比较,#P <0.05
2.2.3 各组大鼠肝内DC Axl-mRNA 表达水平 CD123+标记细胞光密度的变化幅度高于CD11c+标记细胞,但各组间两种细胞的变化趋势近似,在正常组细胞的Axl 表达水平较高,而随着肝纤维化、肝衰竭的发展,Axl 表达水平下降明显(CD11c:F=45.53,P <0.01;CD123:F=43.43,P <0.01)。显示中药茵陈蒿汤具有上调Axl 表达的作用。见表5。
表5 各组大鼠肝内树突状细胞Axl-mRNA 表达水平比较(±s,光密度)
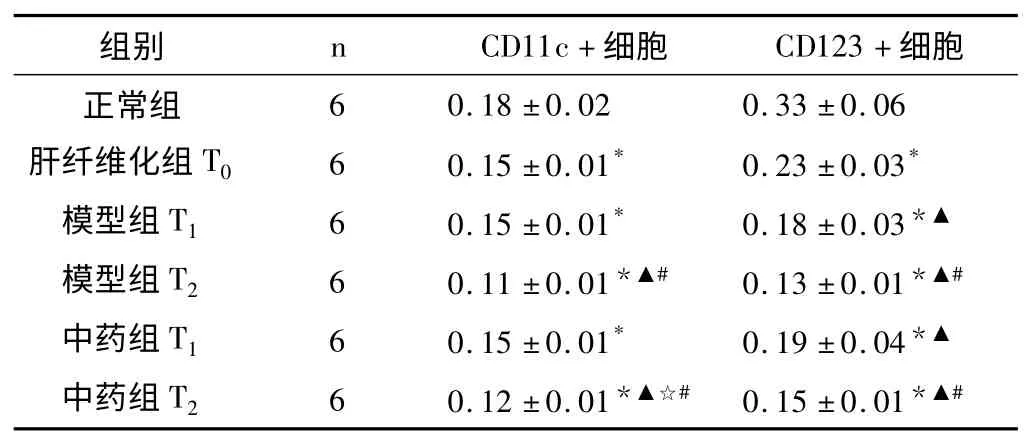
表5 各组大鼠肝内树突状细胞Axl-mRNA 表达水平比较(±s,光密度)
与正常组比较,* P <0.05;与肝纤维化组T0比较,▲P <0.05;与对应时间点模型组比较,☆P <0.05;与相应T1组比较,#P <0.05
将各组CD123+细胞/CD11c+细胞凋亡指数与相应切片上Axl-mRNA 原位杂交的平均光密度进行相关性分析,发现呈线性相关。CD11c+细胞各组比较,R=0.98,R2=0.95,F=76.78,P <0.01。CD123+细胞各组比较,R=0.86,R2=0.73,F=10.86,P=0.03。见图2、图3。
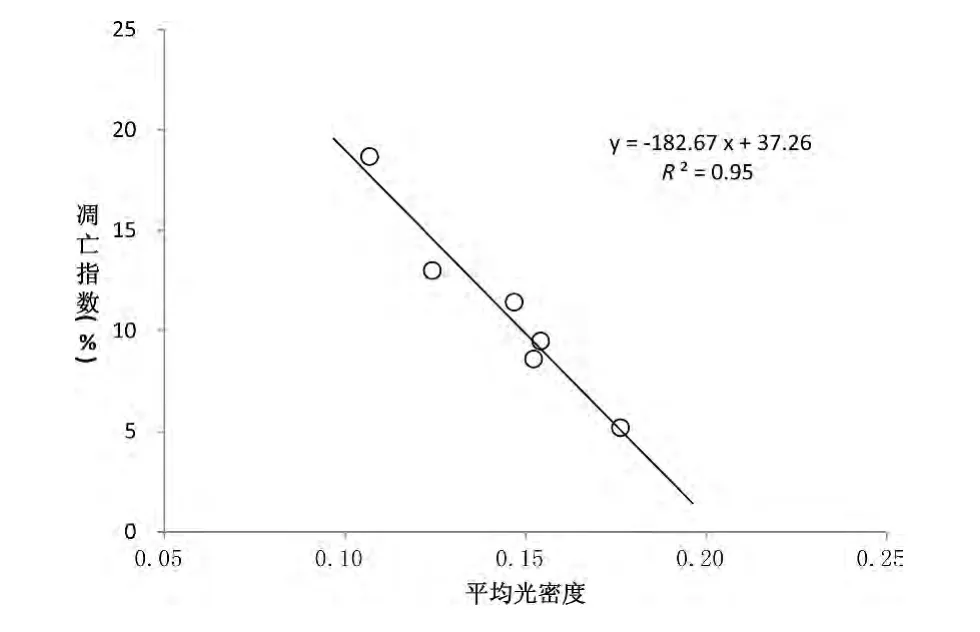
图2 CD11c +细胞凋亡指数与Axl-mRNA 表达相关性
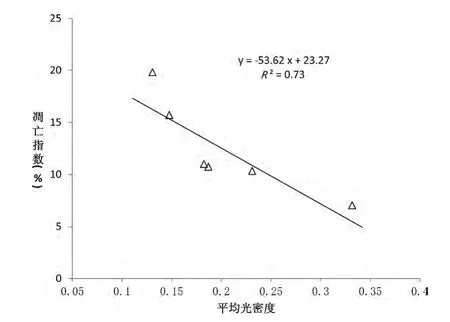
图3 CD123 +细胞凋亡指数与Axl-mRNA 表达相关性
3 讨论
中医认为慢加急性肝衰竭往往以黄疸为主要临床表现,因此列入黄疸病范畴。茵陈蒿汤作为治疗阳黄病的经典方剂,常作为基础方用于ACLF 的治疗。茵陈蒿汤,首载于《伤寒论》和《金匮要略》中治疗阳明病瘀热在里的发黄和谷疸。方中茵陈芳香醒脾、清热利湿、疏利肝胆,与黄疸病病位主要在肝胆脾胃契合,历代医家均将其作为退黄第一要药;栀子清泄三焦,祛除湿热,利湿从小便而出以退黄,茵陈与栀子相伍则正体现清利湿热从小便而出的大法;大黄推陈出新,清除瘀热,通利大便,导热下行为佐,大黄与栀子相伍还有凉血泻热的功用,对于ACLF病机中的瘀毒为患有化瘀凉血解毒之效。三药相配,使湿热之邪从二便排泄、湿清热除,则黄疸可退。现代研究发现其具有保肝、利胆、抑制肝纤维化、抑制肝细胞凋亡、抗炎、镇痛、消除氧自由基、抑制脂质过氧化等作用[1]。茵陈蒿汤治疗ACLF 大鼠可明显改善肝功能中的转氨酶和胆红素,在急性攻击后12h 作用显著,显示了较好地保护肝细胞膜和利胆的作用。
近年来,作为免疫应答启动器的DC 在ACLF 中的作用受到关注。肝内DC 的数量,在肝衰竭时明显高于未发生肝衰竭时[2]。因此在发生ACLF 时,血循环中的DC 富集到肝脏,并被激活。DC 被激活后,促使机体的免疫反应及免疫修复。同时因为免疫反馈机制的作用[3],DC 等通过凋亡等形式调控着免疫强度。在本研究中,DC 的凋亡染色显示在ACLF 大鼠肝内,DC 细胞凋亡随着病情的进展逐渐增加,显示作为免疫启动细胞的DC 在肝内的凋亡增加可能是肝内炎症反应持续存在并逐步加重的重要因素。
在DC 凋亡的调控中,一种新的信号通道——Gas6/Axl 信号通道受到关注。生长停滞特异性基因6(growth arrest specific gene 6,Gas6)是一类新的生长因子,它的受体属于受体酪氨酸激酶家族,包括Sky(Tyro3)、Axl、Mer,也统称TAMreceptor。Gas6 具有抗细胞凋亡的作用,主要是通过Gas6-Axl-PI3K-Akt 起抗凋亡作用[4]。本研究表明在肝脏免疫组化和原位杂交图像分析中,DC 的凋亡与Axl 的表达呈负相关,这表明了Axl 信号抑制DC 凋亡的作用是DC 凋亡的主要调控因素。中药治疗具有多靶点、多途径的作用,其中免疫调控是其作用的重要方面。目前已有关于一些草药成分调控DC 凋亡从而影响机体的免疫状态的报道[5],在本研究中茵陈蒿汤对DC 凋亡的下调作用与上调Axl 表达呈密切的相关性,提示该通道可能是茵陈蒿汤调控DC 凋亡,从而控制肝内免疫反应程度的主要机制,但其具体的作用靶点及上下游分子有待进一步明确。
[1]孟姝.茵陈蒿汤的药理作用研究[J].临床合理用药,2011,4(5B):152 -153.
[2]Zhang Z,Zou ZS,Fu JL,et al.Severe dendritic cell perturbation is actively involved in the pathogenesis of acute-on-chronic hepatitis B liver failure[J].J Hepatol,2008,49(3):396 -406.
[3]Mattei F,Bracci L,Tough DF,et al.Type ⅠIFN regulate DC turnover in vivo[J].Eur J Immunol,2009,39 (7):1807 -1818.
[4]符江琳,刘承云,徐晓,等.Gas6 经P13K/Akt 通路对缺氧复氧诱导H9c2 细胞凋亡的影响[J].中国病理生理杂志,2011,27(8):1508 -1512.
[5]Hu Z,Jiao Q,Ding J,et al.Berberine induces dendritic cell apoptosis and has therapeutic potential for rheumatoid arthritis[J].Arthritis Rheum,2011,63 (4):949 -959.
