不同部位子宫内膜息肉电切术后行辅助生殖技术助孕结局的比较
2015-03-22第四军医大学唐都医院生殖医学中心西安710038
第四军医大学唐都医院生殖医学中心(西安 710038)
肖西峰 张琬琳
不同部位子宫内膜息肉电切术后行辅助生殖技术助孕结局的比较
第四军医大学唐都医院生殖医学中心(西安 710038)
肖西峰 张琬琳
目的:分析不同部位子宫内膜息肉经宫腔镜子宫内膜息肉电切术(TCRP)后再行体外受精/显微授精(IVF/ICSI)助孕结局的差异。方法:选取本中心收治的子宫内膜息肉患者58例,按子宫内膜息肉分布于宫腔的位置分为4组,观察各组患者经TCRP治疗后妊娠率的差异。结果:位于宫腔前壁、宫腔后壁、宫腔前壁+后壁及宫角的子宫内膜息肉经TCRP术后行助孕治疗,其妊娠率分别为:60%、55.6%、21.4%及18.2%。各组之间妊娠率的差异具有统计学意义(P< 0.05)。前壁息肉电切术后助孕成功率高于前壁+后壁息肉电切术后助孕成功率;前壁息肉电切术后助孕成功率高于宫角息肉电切术后助孕成功率;后壁息肉电切术后助孕成功率高于宫角息肉电切术后助孕成功率。以上结果均具有统计学差异(P< 0.05)。结论:子宫内膜息肉位于宫腔前壁者其行经宫腔镜子宫内膜息肉电切术的治疗意义大于子宫内膜息肉位于宫腔其他部位者;子宫内膜息肉位于宫角者其治疗意义最小。
子宫内膜息肉是引起不孕的常见原因之一。李慧等[1]通过对比分析原发性不孕症患者检查结果发现,原发性不孕症患者宫腔异常以子宫内膜息肉最常见(40.81%)。李淑贤[2]通过比较刮宫术、子宫内膜去除术及经宫腔镜子宫内膜息肉电切术(Transcervical resection of polyps, TCRP),提示经宫腔镜子宫内膜息肉电切术是治理子宫内膜息肉的有效手段,具有创伤小、副作用小、恢复快、不易复发的优点,为临床治疗子宫内膜息肉的首选方法。本文章回顾性分析了不同部位子宫内膜息肉经宫腔镜子宫内膜息肉电切术后再行体外受精(IVF)或显微授精(ICSI)助孕治疗后妊娠结局的差异,报道如下。
资料与方法
1 一般资料 选取2014年9~11月期间本中心收治的子宫内膜息肉患者58例,平均年龄32.3岁,平均不孕年限4.6年,平均体重指数23.6。其中输卵管性不孕患者35例,男性因素不孕患者13例,输卵管性不孕+男性不孕因素共同存在的患者10例。
2 方 法
2.1 研究对象分组:按子宫内膜息肉分布于宫腔的位置,将研究对象分为4组;息肉位于前壁者15例;息肉位于后壁者18例;息肉位于前壁及后壁者14例;息肉位于宫角者11例。组间患者年龄、不孕年限及体重指数无统计学差异,组间具有可比性。
2.2 手术方法及手术器械:经宫腔镜子宫内膜息肉电切术:术前宫颈管预留海藻棒12h扩张宫颈。5%利多卡因宫颈局部阻滞麻醉,生理盐水为膨宫介质。采用Karl-Storze公司10mm宫腔电切镜配合等离子环形电切刀,等离子环形电切刀(功率80-100w)自子宫内膜息肉蒂部完整电切息肉、止血,术毕。
3 统计学方法 应用SPSS 22.0统计分析软件建立数据库,对组间妊娠率进行对比分析。对比结果采用检验,P<0.05为差异有统计学意义。
结 果
1 4组患者临床妊娠率的比较 位于宫腔前壁、宫腔后壁、宫腔前壁+后壁及宫角的子宫内膜息肉经TCRP术后行助孕治疗,妊娠率分别为:60%(9/15)、55.6%(10/18)、21.4%(3/14)及18.2%(2/11)。各组间妊娠率差异有统计学意义(P< 0.05),见附表。
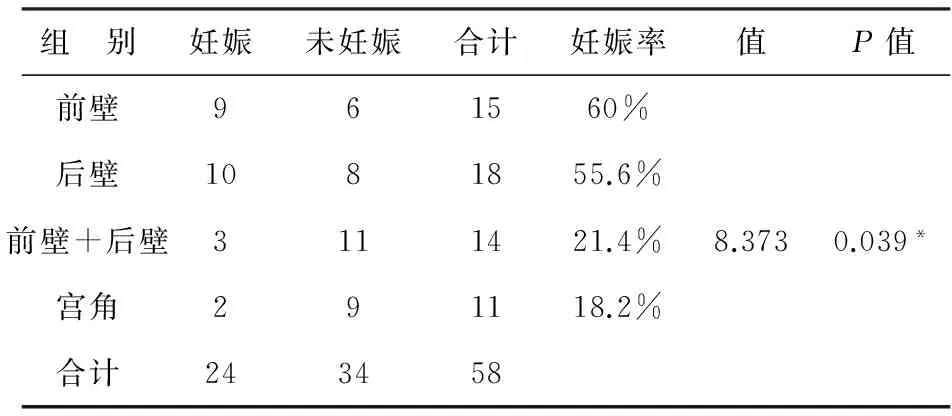
附表 四种息肉位置对助孕结局影响的两两比较
注:*P< 0.05
2 4组间临床妊娠率的两两比较 前壁息肉电切术后助孕成功率高于前壁+后壁息肉电切术后助孕成功率,结果具有统计学差异(60% vs 21.4%P< 0.05);前壁息肉电切术后助孕成功率高于宫角息肉电切术后助孕成功率,结果有统计学差异(60% vs 18.2%P< 0.05);后壁息肉电切术后助孕成功率高于宫角息肉电切术后助孕成功率,结果有统计学差异(55.6% vs 18.2%P< 0.05)。前壁息肉电切术后助孕成功率高于后壁息肉电切术后助孕成功率,结果无统计学差异(60% vs 55.6%P>0.05);后壁息肉电切术后助孕成功率高于前壁+后壁息肉电切术后助孕成功率,结果无统计学差异(55.6% vs 21.4%P> 0.05);前壁+后壁息肉电切术后助孕成功率高于宫角息肉电切术后助孕成功率,结果有统计学差异(21.4% vs 18.2%P> 0.05)。
讨 论
研究表明子宫内膜息肉在绝经前女性中发病率可高达5.8%[3]。子宫内膜息肉在不孕症患者的发病率更是高达15%~24%,并且随年龄增长发病率有升高趋势[4]。子宫内膜息肉的发病机制目前尚未明确,既往研究分析EP的发病机制为雌激素依赖性及非雌激素依赖性,或两种机制可同时发挥作用[5]。在行息肉切除术后患者的妊娠孕率可以提高到23%~65%[4]。切除子宫内膜息肉最常用的方法是双极等离子宫腔镜电切术。研究表明双极等离子宫腔镜电切术有助于保持手术前后电解质及血糖水平变化的相对稳定,减少手术时间、术中出血量、膨宫液用量、阴道流血及排液时间,降低术后并发症,同时可有效预防空气栓塞[6]。
研究表明子宫内膜息肉切除术可提高不孕症患者的临床妊娠率,然而,极少有资料研究宫腔内不同部位子宫内膜息肉去除后对临床妊娠率改善的差异。本研究通过回顾性分析,根据子宫内膜息肉在宫腔内的发生位置不同分为宫腔前壁、后壁、前壁+后壁及宫角,共四组。通过比较各组手术后行辅助生殖技术助孕的临床妊娠率得到规律。研究发现,位于宫腔前壁的子宫内膜息肉经手术治疗后其临床妊娠率最高(60%)。既往研究提示,胚胎在子宫腔内最易着床的部位为宫腔后壁,因而发生在前壁的息肉并不影响其后壁子宫内膜的容受性,因此并未明显降低助孕成功率,或许可以解释本研究的结果。本研究还提示位于宫角的子宫内膜息肉患者,其经助孕治疗后临床妊娠年率最低(18.2%),结论与我们的直观印象相反,因为发生于宫角的子宫内膜息肉并不影响大范围宫腔的子宫内膜形态,因此我们认为也并不降低其他部位的子宫内膜容受性,故发生于宫角的子宫内膜息肉其助孕成功率也因此而更高。然而,子宫内膜息肉的发生机制尚不清楚,子宫内膜息肉与子宫内膜容受性的关系也尚不清楚,子宫内膜容受性并不一定反映在肉眼可见的宫腔内病变,比如子宫内膜息肉等,可能与子宫内膜组织、细胞甚至分子水平的变化有关。因此,有必要更进一步研究发生于宫角的子宫内膜容受性的变化,以此来解释本研究的矛盾之处。
总之,经宫腔镜子宫内膜息肉电切术可显著提高输卵管性不孕、男性不孕或输卵管性不孕+男性不孕并同时伴有子宫内膜息肉的不孕症患者的临床妊娠率,并且,前壁息肉治疗后对妊娠结局的改善优于宫腔其他部位息肉。另外,本研究拟进一步设计更为严密的前瞻性临床试验,不但需要扩大样本量,而且需要更进一步在组织、细胞及分子水平揭示子宫内膜息肉对妊娠的影响,以期针对不同部位的子宫内膜息肉提出更个体化的治疗方案,得到更好的助孕结局。
[1] 李 慧, 陆 洋, 李晓红, 等. 复发性流产、原发不孕患者宫腔镜检查结果对比分析[J]. 山东医药, 2015, 55(12): 66-67.
[2] 李淑贤. 3种不同手术对子宫内膜息肉治疗的分析[J]. 中国卫生标准管理, 2014, 23(1): 122-124.
[3] Speroff L, 李继俊译. 临床妇科内分泌学与不孕[M]. 济南: 山东科学技术出版社, 2003: 230-231.
[4] 张 燕, 李光仪, 陈露诗. 宫腔镜下两种手术方式治疗子宫内膜息肉的临床分析[J].中国现代医生, 2008, 46(5): 28-29.
[5] Indraccolo U, Di Iorio R, Matteo M,etal. The pathogenesis of endometrial polyps: a systematic semi-quantitative review[J]. Eur J Gynaecol Oncol, 2013, 34(1): 5-22.
[6] 王雅迅. 等离子电切术在宫腔疾病中的应用效果探讨[J]. 当代医学, 2015, 21(8): 3-4.
(收稿:2015-04-15)
子宫内膜 息肉 @经宫腔镜子宫内膜息肉电切术
R711.6
A
10.3969/j.issn.1000-7377.2015.12.028
