卡托普利对自发性高血压大鼠胸主动脉缝隙连接蛋白43表达的影响*
2015-03-22陕西省人民医院心血管内二科西安710068
陕西省人民医院心血管内二科(西安710068)
程 功 陈春燕△ 寿锡凌 韩新源▲
·论著·基础研究·
卡托普利对自发性高血压大鼠胸主动脉缝隙连接蛋白43表达的影响*
陕西省人民医院心血管内二科(西安710068)
程 功 陈春燕△寿锡凌 韩新源▲
目的:通过比较Cx43在正常大鼠和自发性高血压大鼠胸主动脉表达的差异, 以及经卡托普利干预后的变化, 来阐明卡托普利抗高血压血管重构的分子机制。方法:12周龄自发性高血压大鼠(SHRs)16只随机分为对照组和卡托普利干预组,以年龄和体重匹配的Wistar-Kyoto大鼠(WKYs)为正常空白对照组。干预组,灌胃法给予卡托普利[12.5mg·d)],8周后,采用无创血压测定仪测量3组大鼠尾动脉收缩压;用酶联免疫吸附法测量血浆和胸主动脉组织血管紧张素Ⅱ(AngII)浓度。采用实时定量RT-PCR和Western blot分析,检测3组大鼠胸主动脉组织内Cx43的mRNA及蛋白表达。结果:SHR组的血浆、动脉组织AngII浓度较WKY大鼠组明显升高,而卡托普利干预组的血浆、组织AngII浓度则较SHR组明显降低。SHR组胸主动脉的Cx43的mRNA表达高于WKY组(P<0.01), 卡托普利降低Cx43mRNA的表达(P<0.01)。蛋白印迹法显示,SHR组大鼠胸主动脉中,Cx43蛋白表达高于WKY大鼠组(P<0.01)。卡托普利降低组织主动脉内Cx43的蛋白表达(P<0.01)。结论:自发性高血压大鼠主动脉Cx43表达增强, 卡托普利能够降低胸主动脉Cx43的表达。
缝隙连接(Gap junction,GJ)作为细胞间的直接通讯方式是由缝隙连接蛋白(Connexin,Cx)家族组成[1]。已有研究表明,GJ在调节血管舒缩以及血管平滑肌细胞增殖、表型转变中发挥重要作用,并与高血压的形成和发展密切相关[2]。肾素-血管紧张素-醛固酮系统(Renin angiotensin system, RAS)作为一类重要的生物活性物质,广泛存在于心脏、血管、肾脏等多种组织中,RAS系统的过度激活则是高血压发病机制之一[3]。血管紧张素Ⅱ(Angiotensin Ⅱ, AngⅡ)作为RAS系统循环和局部主要的效应分子,在高血压的发展和维持上起着重要作用。血管紧张素转换酶抑制剂(Angiotensin converting enzyme inhibitor, ACEI)是目前临床上最常用的降压药物之一。本研究以自发性高血压大鼠(Spontaneously hypertensive rats,SHRs)为模型,观察经卡托普利干预后SHR胸主动脉Cx43表达的变化, 旨在探讨卡托普利抗高血压的分子机制。
材料与方法
1 实验动物分组与处理 12周龄雄性SHR大鼠16只(购自西安交通大学医学院动物中心)随机分为2组:空白对照组(SHR组)和卡托普利组(SHR+Capt),每组8只。再选取周龄、体重匹配的雄性Wistar大鼠(均购于购自西安交通大学医学院动物中心)8只(WKY组)作为正常对照组。将卡托普利(商品名:开博通, 百时美施贵宝公司生产)研碎后溶于蒸馏水中制成悬液,按照12.5mg/(kg·d)的剂量灌胃给药,给药其间根据体重增长情况调整给药量剂量。空白对照组和正常对照组则给予生理盐水灌胃,均喂养8周。
2 血压测量 分别于给药前及给药后第8周采用用无创尾动脉血压测量分析系统测量大鼠安静清醒状态下尾动脉收缩压( Systolic blood pressure, SBP)。连续测量3次,取其平均值。
3 血管紧张素Ⅱ的测定 分别测取胸主动脉和血浆中的AngⅡ含量,方法如下:①血液血管紧张素Ⅱ(AngII)测定:血压测量结束后,穿刺右室,采血2.5 ml放入预先准备的EDTA抗凝管中,摇匀,4℃ 3000 rpm离心10 min,分离血浆,放入-80℃冰箱保存待测。②心房组织AngII测定:血液标本采集完毕后,颈椎脱臼法处死大鼠,迅速开胸游离胸主动脉,留取部分组织液氮冷冻,用于后续实验。剩余部分用分析天平称重,冰生理盐水洗净,加1 ml预冷的0.9%NaCl溶液中冰浴匀浆,加入蛋白酶抑制剂,95℃水浴中加热10 min,4℃ 10000r/min离心2次,取上清液﹣80℃保存待测。AngⅡ浓度采用酶联免疫吸附法(ELISA)检测,测定方法按照试剂盒说明的操作步骤进行。
4 Real-time PCR法检测各组大鼠胸主动脉Cx43的基因表达 按照Fast200试剂盒说明书,提取胸主动脉总RNA,核算定量仪测定所抽提RNA的浓度以及OD260/280值,OD260/280值在1.8~2.0则视为纯度很高,可以进行下一步操作。按照TaKaRa反转录试剂盒说明进行反转录反应,反应条件为37℃ 15 min( 反转录反应),85℃ 5 S(反转录酶的失活反应)合成cDNA。以 NCBI Gen Bank提供的GAPDH、Cx43的cDNA序列为模板,由北京奥科生物科技公司合成引物。引物序列如下: Cx43:上游:5’- TTGTTTCTGTCACCAGTAAC -3’;下游:5’- GATGAGGAAGGAAGAGAAGC -3’; GAPDH:上游:5’-GCGCCTGGTCACCAGGGCTGCTT-3’;下游:5’-TGCCGAAGTGGTCGTGGATGACCT-3’。按照TaKaRa Real-time PCR 试剂盒操作说明进行反应, 采用三步法PCR扩增程序,第一步95℃3min,第二步PCR反应95℃10s,59℃30s,72℃30s,40个循环,第三步55℃10s,81个循环。扩增曲线完成后自动生成融解曲线,反应完成后确认扩增曲线和融解曲线。根据Bio-Rad iQ5 Real-time PCR仪软件得出的各个样本的CT值,按照2-△△Ct法计算各个基因的相对表达量;用2%的琼脂糖凝胶电泳检验PCR产物,只有单一的扩增条带,未见引物二聚体等非特异性条带,说明扩增反应是特异的。
5 Western blot测定各组大鼠胸主动脉Cx43的蛋白表达 提取动脉组织总蛋白并用BCA法测定蛋白浓度,按每泳道加总蛋白20μg 用10%SDS-PAGE凝胶进行电泳分离,电泳后用半干转印法110V,2h转移至PVDF膜上,用5%TBST奶室温封闭1小时后加入1∶1000稀释的Cx43一抗(Abcam,英国)、GAPDH(1∶1000稀释),4℃孵育过夜。用TBST洗膜3次后加入辣根过氧化物酶标记二抗室温孵育1h,与增强化学发光试剂(ECL)(A:B=1∶1)于暗处反应5min,后利用Chemidoc化学发光仪显影成像,以BIO-RAD公司的Quantity One成像分析系统进行WB条带的灰度值分析。以目的蛋白与内参蛋白GAPDH比值作为目的蛋白的相对表达量。

结 果
1 各组大鼠血压比较 3组大鼠尾动脉血压显示,给药前, SHR对照组和卡托普利组收缩压均显著高于WKY组(均P<0.01) 。给药结束后, SHR组平均动脉压较Wistar组仍显著升高;而卡托普利干预组平均动脉压较高血压组显著降低(P<0.01),但和Wistar组无显著差异(P>0.05),见表1。
2 各组大鼠血浆及组织Ang II浓度比较 SHR组大鼠血浆、组织Ang II浓度较WKY组明显升高(P<0.01,P<0.001),卡托普利干预组血浆及组织匀浆Ang II浓度较SHR组明显降低(P<0.01,P<0.001),见表2。
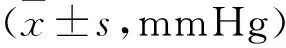
表1 各组大鼠干预前后血压的比较
注:与WKY组比较*P<0.01;与SHR比较#P<0.01
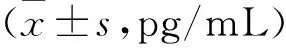
表2 各组大鼠血浆及组织Ang II浓度比较
注:与WKY组比较*P<0.01,**P<0.001;与SHR比较#P<0.01,##P<0.001
3 卡托普利对大鼠胸主动脉Cx43mRNA表达的影响 SHR对照组胸主动脉Cx43 mRNA的表达为WKY组的1.57倍(P<0.01),而卡托普利干预组Cx43 mRNA的表达则较SHR对照组明显降低(P<0.01),且卡托普利干预组与WKY组间的差异无统计学意义(P>0.01)。
4 卡托普利对大鼠胸主动脉Cx43蛋白表达的影响 SHR对照组胸主动脉Cx43蛋白表达高于WKY组79%(P<0.0.1),而卡托普利干预组的Cx43蛋白表达量则低于SHR对照组的74%(P<0.01)。
讨 论
缝隙连接通道的基本组成单位是连接蛋白,由6个Cx围成,小体中央形成直径1. 5 nm 的亲水管道,即为Cx 半通道。相邻细胞间的Cx 半通道对接而组成完整GJ 通道[4]。在心血管系统,缝隙连接通道是心肌细胞、血管的内皮细胞、平滑肌细胞间通讯的结构基础。在血管组织,缝隙连接通道间传导的信号能够协调血管的收缩和舒张。血管是一个三层的组织结构主要由内膜的内皮细胞、中膜的平滑肌细胞和外模的成纤维细胞构成,内皮细胞主要表达Cx37、Cx40和少量Cx43,而平滑肌细胞则主要表达Cx43、Cx45及少量的Cx37和Cx40[5]。血管壁重构导致内皮细胞和平滑肌细胞机械应力的变化能够影响Cx的表达。
国内外的研究已证实,无论是自发性高血压大鼠还是肾性高血压大鼠主动脉的Cx43表达均发生了改变,但这些研究结果并非完全一致。对于SHR大鼠,有研究认为主动脉Cx43的表达升高,但也有研究认为Cx43的表达则是下降的;而在肠系膜动脉,Cx43的mRNA水平则在自发性高血压大鼠与正常血压大鼠间无明显差异[6,7]。但是对于肾性高血压,大多数研究认为Cx43的表达升高。本研究选取自发性高血压大鼠,通过观察其胸主动脉Cx43的表达,发现自发性高血压大鼠胸主动脉Cx43的表达相对正常血压大鼠明显上升,这与既往的研究结果相符。
RAS的激活在高血压的发生发展中发挥着重要的作用,尤其是组织局部存在的RAS更是在神经-体液调节机制中发挥着重要的作用。本实验观察到自发性高血压大鼠血浆AngⅡ含量较WKY大鼠组明显升高,而在血管组织中AngⅡ的含量也较WKY组高。卡托普利为临床上常用的ACEI制剂,本研究中卡托普利的使用,同时降低了血浆和血管组织AngⅡ含量,但对血管组织的效应远远大于对血浆AngⅡ含量的影响。这一结果进一步说明了组织局部RAS系统的激活,在高血压发生、发展中发挥着重要的调控作用。
Alonso等研究发现AngⅡ能浓度依赖性增加动脉平滑肌细胞Cx43蛋白的表达, 而该效应与ERK和NF-kB通路的激活有关。本研究报道大鼠胸主动脉Cx43较正常高血压大鼠表达增高, 而卡托普利能降低大鼠动脉Cx43的表达。卡托普利的这一作用可能是通过降低血管组织AngⅡ的浓度,从而影响了动脉平滑肌细胞Cx43的表达。此研究为ACEI类药物在高血压的治疗提供了新的理论依据。
[1] Evans WH, Martin PE. Gap junctions: structure and function[J]. Mol Membr Biol, 2002, 19(2):121-136.
[2] Haefliger JA, Nicod P, Meda P. Contribution of connexins to the function of the vascular wall[J]. Cardiovasc Res 2004,62:345-56.
[3] Schmieder RE, Hilgers KF, Schlaich MP,etal. Renin-angiotensin system and cardiovascular risk. Lancet[J]. 2007,369:1208 -1219.
[4] Sohl G,Willecke K. Gap junctions and the connexin protein family[J].Cardiovasc Res,2004,62( 2):228-232.
[5] Figueroa XF, Duling BR. Gap junctions in the control of vascular function[J]. Antioxid Redox Signal,2009,11:251-266.
[6] Rummery NM, McKenzie KU, Whitworth JA,etal.Decreased endothelial size and connexin expression in rat caudal arteries during hypertension[J]. J Hypertens, 2002,20(2): 247-253.
[7] Rummery NM, Grayson TH, Hill CE. Angiotensin-converting enzyme inhibition restores endothelial but not medial connexin expression in hypertensive rats[J]. J Hypertens,2005, 23(2): 317-328.
(收稿:2015-07-15)
Effects of captopril on the expression of connexin 43 in thoracic aorta from spontaneous hypertensive rats Second Department of Cardiology, Shaanxi Provincial People’s Hospital
( Xi’an 710068)
Cheng Gong Chen Chunyan Shou XiLing et al
Objective:To investigate the differential expression of connexin 43 in thoracic aorta between spontaneously hypertensive rats(SHRs)and Wistar-Kyoto rats(WKYs),and effects of captopril on the expression of Cx43 in thoracic aorta of SHR and possible underlying mechanism.Methods:Sixteen 12-weeks old male SHRs were randomly divided into two groups:SHR control group receiving placebo and captopril group receiving captopril 12.5mg/(kg·d).Another eight WKY rats served as blank control group.Before and after eight weeks treatment, rats arterial pressure of tail were measured.When the treatment finished, plasma angiotensin II level and thoracic aortic tissue angiotensin II level were measured with enzyme linked immunosorbent assay (ELISA) method.Moreover,Cx43 mRNA and protein levels in thoracic aortic tissue were determined by RT-PCR and Western blot.Results: The plasma and thoracic aortic tissue angiotensin II levels were significantly increased in SHR as compared with the WKY group and captopril reduced the plasma and thoracic aortic tissue angiotensin II as compared with the SHR group(P<0.01).The expression of Cx43 mRNA in thoracic aorta of SHR group was obviously higher than that in the WKY rats(P<0.01)and was markedly decreased by captopril treatment(P<0.01).Cx43 protein level was higher as compared with that in WKY rats(P<0.01).Treatment with captopril significantly down-regulated Cx43 protein expression(P<0.01).Conclusion: The expression of Cx43 up-regulated in thoracic aorta of SHR and captopril treatment can ameliorate Cx43 increasing in thoracic aorta of SHR.
Angiotensin Ⅱ Captopril Connexins Animals,laboratory Rat
*陕西省自然科学基金(2013JC2-16)
血管紧张素II 卡托普利 连接蛋白类 动物,实验 大鼠
R544.1
A
10.3969/j.issn.1000-7377.2015.12.001
△西安交通大学医学院第一附属医院心内科
▲通讯作者
