DKK-1在浆液性卵巢癌患者血清的表达及其临床意义
2015-03-22陕西省肿瘤医院妇瘤科西安710061
陕西省肿瘤医院妇瘤科(西安710061)
袁 渊 常晓斌△ 姚安梅 韩志红 杨雪梅
DKK-1在浆液性卵巢癌患者血清的表达及其临床意义
陕西省肿瘤医院妇瘤科(西安710061)
袁 渊 常晓斌△姚安梅 韩志红 杨雪梅
目的:探讨血清DKK-1在浆液性卵巢癌患者中的表达情况及其临床意义。方法:通过ELISA检测57例浆液性卵巢癌患者及健康妇女的血清标本中DKK-1的表达水平,绘制ROC曲线分析其诊断价值,并以CA125作为对照;采用χ2检验分析DKK-1的表达水平与卵巢癌患者临床病理特征的关系;Kaplan-Meier法分析DKK-1的表达与病人的生存之间的关系。结果:卵巢癌患者血清中DKK-1表达高于健康对照组(P<0.001);ROC曲线下面积0.846 (95%CI:0.771-0.926),灵敏度85.9%,特异度87.7%; CA125曲线下面积为0.849 (95%CI:0.764-0.927),灵敏度92.9%,特异度84.2%;血清DKK-1与卵巢癌临床分期密切相关(P<0.05),且在卵巢癌细胞核中/低分化组的表达显著高于细胞核高分化组,差异有统计学意义,而与年龄、淋巴结转移等临床病理特征无显著相关性(P>0.05);血清DKK-1高表达的浆液性卵巢癌患者术后5年生存率显著低于血清DKK-1低表达的浆液性卵巢癌患者。结论:卵巢癌患者血清中DKK-1表达水平增高,为浆液性卵巢癌的临床诊断及预后判断提供了重要参考,具有重要的临床应用价值。
卵巢癌病理类型复杂,上皮癌占全部卵巢肿瘤40%,有浆液性和粘液性两种,均有向两侧卵巢发展和种植的倾向,恶性率高,其中浆液性最多,且恶变最常见, 具有早期症状隐匿、 易于转移和广泛播散的生物学行为,大部分患者就诊时已属晚期,5年生存率只有30%[1,2]。因此,寻找早期诊断浆液性卵巢癌的分子指标具有重要的临床实用意义。DKK-1是Dickkopf-1的简称,是Wnt-1信号转导通路的拮抗物。该分子在成人组织中很少表达,但可表达于胎盘和胚胎组织[3]。有研究发现DKK-1在肺癌、肝癌多种肿瘤患者血清中高表达,血清中DKK-1可以作为多种肿瘤的诊断标志物[4~6]。本研究探讨了血清中DKK-1在浆液性卵巢癌中的表达及其临床意义,为浆液性卵巢癌的诊断提供了新的理论基础。
资料和方法
1 一般资料 收集我院2007年6月至2010年6月期间收治的浆液性卵巢癌患者57例(实验组),以及同期健康体检者57例(对照组)。患者的临床资料完整,纳入标准:①患者均经影像学和病理组织学确诊为卵巢癌,均为初诊初治患者;②均未接受放、化疗及激素等药物治疗;③肝肾功能未见异常;④无其他肿瘤及内科疾病。术后每3个月进行一次随访,随访截止之间为2015年6月。实验组57例年龄28~70岁,平均年龄57.34±6.71岁,其中I-II期23例,III-IV期34例,高分化27例,中/低分化30例。对照组57例年龄27~75岁,平均年龄58.26±7.97岁。两组受试者在年龄、生理等一般资料方面比较差异无统计学意义(P>0.05),具有可比性。
2 试剂与主要仪器 DKK-1酶联免疫吸附试验(ELISA)由瑞典康乃格有限公司提供;CODA酶标仪由美国伯乐公司生产;-80℃冰箱由Thermo公司生产;台式低温高速离心机美国Beckman公司生产;全自动化学发光分析系统的AXSYM生化分析仪及配套CA125检测试剂由美国雅培公司生产。
3 实验方法 两组空腹采血5 ml,真空干燥管中保存,2000r/min 10 min 后,-80℃冰箱保存备用。
3.1 血清DKK-1含量检测:采用ELISA检测血清中DKK-1的含量,步骤根据试剂盒说明书进行。将96孔的包被有DKK-1抗体的酶标板置于室温过夜。酶标板洗涤3次,并加300μl稀释液封闭,室温静置3h,洗涤2次。每孔加入100μl 血清标本,室温孵育3h,洗涤酶标板2次。加入100μl 检测抗体,室温孵育3h,洗涤酶标板3次。每孔加入100μl链霉卵白素-过氧化物酶后,室温反应30 min,洗涤酶标板3次。每孔加入100μl四甲基联苯胺底物液,室温反应30min,最后再在每孔中加入50μl硫酸。迅速用酶标仪检测每孔的光吸收值。
3.2 血清CA125含量检测:使用全自动化学发光分析系统的AXSYM生化分析仪及配套CA125检测试剂对血清 CA125 进行检测,参考值为0~35 U/ml。

结 果
1 DKK-1在浆液性卵巢癌血清和健康对照血清中的表达水平差异 通过ELISA检测浆液性卵巢癌患者血清及健康对照血清中DKK-1 的表达差异,结果显示浆液性卵巢癌患者血清中DKK-1的表达水平高于健康对照组,两者比较差异有统计学意义(P<0.001)。
2 血清DKK-1表达水平与浆液性卵巢癌患者临床病理特征的关系 将57例浆液性卵巢癌患者按照病例特征因素(临床分期、细胞核分化程度、年龄、淋巴结转移)进行分类,进一步分析血清DKK-1相对表达量与浆液性卵巢癌患者临床特征的关系。χ2分析结果显示,血清DKK-1的表达水平与浆液性卵巢癌患者的临床分期密切相关,随着临床分期的进展,血清DKK-1的表达亦逐渐升高(P<0.05)。此外,血清DKK-1在卵巢癌细胞核中/低分化组的表达显著高于细胞核高分化组,差异有统计学意义(P<0.05)。血清DKK-1的表达与浆液性卵巢癌其他临床病理特征,包括年龄、淋巴结分期均无显著相关性,见附表。
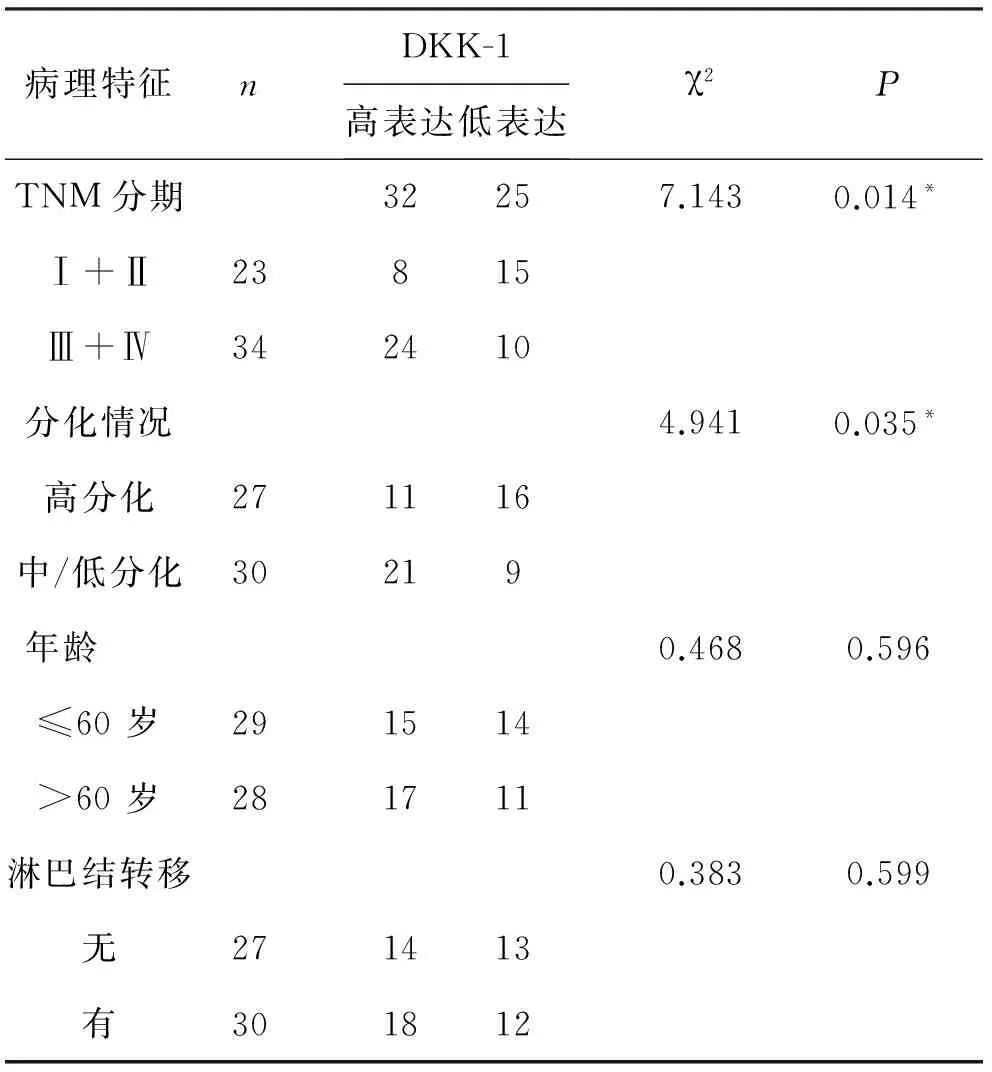
附表 血清DKK-1表达水平与浆液性卵巢癌患者临床病理特征的关系
注:组间比较差异有统计学意义, *P<0.05
3 血清DKK-1表达水平对浆液性卵巢癌的诊断效率 根据上述血清DKK-1的表达水平,建立DKK-1和CA125的ROC曲线,利用ROC曲线评价两者在卵巢癌中的诊断价值。结果显示,ROC曲线下面积0.846 (95%CI:0.771-0.926),灵敏度85.9%,特异度87.7%; CA125曲线下面积为0.849 (95%CI:0.764-0.927),灵敏度92.9%,特异度84.2%。血清DKK-1和CA125均具有较好的诊断价值。
4 血清DKK-1表达与浆液性卵巢癌患者生存之间的关系 生存分析结果显示,血清DKK-1表达与浆液性卵巢癌患者术后5年生存率密切相关,血清DKK-1高表达的浆液性卵巢癌患者术后5年生存率显著低于血清DKK-1低表达的浆液性卵巢癌患者(Log-rank test:P=0.0412),如附图。

附图 血清DKK-1表达与浆液性卵巢癌患者生存之间的关系
讨 论
近年来随着人们饮食结构,生育观念以及环境等因素的改变,卵巢癌发病率呈现出逐年上升的趋势,且高卵巢癌是女性生殖系统肿瘤中致死率最高的恶性肿瘤,如果能够早期(Ⅰ~Ⅱ)发现,约有90%的患者经过标准治疗可达完全缓解[7]。血清标志物具有易检测、 可重复、 非侵入性、 标本用量以及人为干扰少等优点, 且无需复杂的标本前处理,其在卵巢癌的诊断和预后预测中均占有重要的地位。因此, 寻找卵巢癌的早期诊断的血清学指标已成为近年来研究的热点问题。
DKK-1是人DKK(Dickkopf)蛋白家族成员之一,最早在非洲爪蟾中发现,其主要作用是诱导爪蟾头部形成。大量研究显示DKK-1表达异常与肿瘤的发生、 发展相关,并且DKK-1是一种分泌型糖蛋白,在多种肿瘤患者血清中呈高表达,为肿瘤的早期诊断、治疗监测及其预后判断提供新的途径。HCC组织DKK-1高表达患者远期预后较差,DKK-1单独或联合β-catenin可作为HCC预后预测标志物[8]。Lee等研究发现153例胃癌患者血清中DKK-1的浓度水平明显高于173例健康对照者,血清DKK-1诊断胃癌的敏感度为87.6%,特异度为87.9%,由此可见,检测血清DKK-1水平有可能帮助诊断胃癌并且预测患者预后[9]。DKK-1在骨转移乳腺癌患者血清中的表达水平显著高于未发生骨转移的乳腺癌患者和健康妇女,并可能对乳腺肿瘤细胞的骨转移能力发挥正向调节作用,提示检测血清DKK-1水平有助于乳腺癌骨转移患者的临床研究[10]。此外,血清DKK-1在多发性骨髓瘤患者的表达水平高于MGUS患者和健康对照[11]。 肺癌患者肿瘤组织中表达升高,血清中含量增加,且血清DKK-1在肺癌患者的阳性率为69.8%,而在肺部良性疾病患者和健康对照者分别为12.5%和5%[12]。由此可见,DKK-1不仅在不同肿瘤组织中表达,更重要的是在肿瘤患者血清中也存在高表达,血清DKK-1作为一种血液生物标志,极有可能在肿瘤早期诊断、疗效监测、预后预警等方面发挥重要的临床作用。
本研究主要探讨了血清DKK-1在浆液性卵巢癌中的表达及临床意义。研究发现血清DKK-1在浆液性卵巢癌患者血清中高表达;ROC曲线下面积0.846 (95%CI:0.771-0.926),灵敏度85.9%,特异度87.7%; CA125曲线下面积为0.849 (95%CI:0.764-0.927),灵敏度92.9%,特异度84.2%;血清DKK-1与卵巢癌临床分期密切相关,且在卵巢癌细胞核中/低分化组的表达显著高于细胞核高分化组,差异有统计学意义,而与年龄等无显著相关性;血清DKK-1高表达的浆液性卵巢癌患者术后5年生存率显著低于血清DKK-1低表达的浆液性卵巢癌患者。这些结果说明DKK-1是一种良好的诊断卵巢癌及判断卵巢癌预后的血清肿瘤标志物,血清DKK-1有望成为浆液性卵巢癌早期诊断和预后判断的新指标。
[1] Shan W, Mercado-Uribe I, Zhang J,etal. Mucinous adenocarcinoma developed from human fallopian tube epithelial cells through defined genetic modifications [J]. Cell Cycle, 2012, 11(11):2107-2113.
[2] Zaman MS, Maher DM, Khan S,etal. Current status and implications of microRNAs in ovarian cancer diagnosis and therapy [J]. J Ovarian Res, 2012, 5(1):44.
[3] Cao Z, Liu R, Zhang H,etal. Osterix controls cementoblast differentiation through downregulation of Wnt-signaling via enhancing DKK1 expression [J]. Int J Biol Sci,2015,11(3):335-344.
[4] Tung EK, Ng IO. Significance of serum DKK1 as a diagnostic biomarker in hepatocellular carcinoma [J]. Future Oncol,2012,8(12):1525-1528.
[5] Prieto PA, Cha CH. DKK1 as a serum biomarker for hepatocellular carcinoma [J].Hepatobiliary Surg Nutr, 2013, 2(3):127-128.
[6] Dong LL, Qu LY, Chu LY,etal. Serum level of DKK-1 and its prognostic potential in non-small cell lung cancer [J]. Diagn Pathol, 2014, 9:52.
[7] 陈 琳, 姚 丽, 张佳瑞,等. miR-542-5p在浆液性卵巢癌中的表达及意义[J].现代肿瘤医学,2014, (8):1936-1939.
[8] Yu B, Yang X, Xu Y,etal. Elevated expression of DKK1 is associated with cytoplasmic/nuclear beta-catenin accumulation and poor prognosis in hepatocellular carcinomas[J].J Hepatol,2009,50(5):948-957.
[9] Lee HS, Lee HE, Parkdo J,etal. Clinical significance of serum and tissue Dickkopf-1 levels in patients with gastric cancer [J]. Clin Chim Acta,2012,13(21-22):1753-1760.
[10] Voorzanger-Rousselot N, Goehrig D, Journe F,etal. Increased Dickkopf-1 expression in breast cancer bone metastases[J]. Br J Cancer,2007,97(7):964-970.
[11] Politou MC, Heath DJ, Rahemtulla A,etal. Serum concentrations of Dickkopf-1 protein are increased in patients with multiple myeloma and reduced after autologous stem cell transplantation [J] . Int J Cancer, 2006, 119(7):1728-1731.
[12] Sheng SL, Huang G, Yu B,etal. Clinical significance and prognostic value of serum Dickkopf-1 concentrations in patients with lung cancer [J]. Clin Chem, 2009, 55(9):1656-1664.
(收稿:2015-07-18)
Expression and clinical significance of serum DKK-1 in Serous ovarian cancer patients Department of Gynecological Oncology, Shaanxi Provincial Tumor Hospital
(Xi’an 710061)
Yuan Yuan Chang XiaoBin Yao AnMei et al
Objective: To investigate the expression of serum DKK-1 in serous ovarian cancer patients and its diagnosis and prognosis value.Methods: ELISA was used to detect the expression of serum DKK-1 in 57 serous ovarian cancer patients and 57 controls, and its diagnostic value was analyzed by the receiver operating characteristic (ROC) curve,and CA125 was aslo detected as control. Meanwhile,relationships between the expression levels of DKK-1 and ovarian cancer clinicopathological features were analyzed by χ2; the association of serum DKK-1 level with survival of serous ovarian cancer patients was further evaluated by Kaplan-Meier.Results: The expression of serum DKK-1 of serous ovarian cancer patients showed statistically higher than controls (P<0.001). The area under the ROC curve ( AUC) of DKK-1 was 0.846 (95%CI:0.771-0.926), DKK-1 screening serous ovarian cancer sensitivity rate was 85.9%,specificity rate was 87.7%, The area under the ROC curve ( AUC) of CA125 was 0.849 (95%CI: 0.764-0.927), sensitivity rate was 92.9%, specificity rate was 84.2%. The expression of serum DKK1 was significantly increased in serous ovarian cancer patients with advanced TNM stage (P<0.05), and the expression of serum DDK-1 in ovarian cancer cell medium / poorly differentiated-nuclear group was significantly higher than that in the well differentiated-nuclear group , but the expression of serum DKK-1 had no significant correlations with age and lymph node status (P> 0.05). The 5 years overall survival rate in the patients with high serum DKK1 expression was significantly lower than in the patients with low serum DKK1 expression. Conclusion: The relative expression level of DKK1 is significantly increased in serous ovarian cancer patients, which provides important references for the diagnosis and prognosis of serous ovarian cancer.
Ovarian neoplasms @Dkk-1 Diagnosis Prognosis
卵巢肿瘤 @DKK-1 诊断 预后
R737.31
A
10.3969/j.issn.1000-7377.2015.12.008
△陕西省肿瘤医院放疗科
