Wingspan支架治疗症状性颅内动脉狭窄36例临床研究
2015-03-22陕西省榆林市第一医院神经外科榆林718000
陕西省榆林市第一医院神经外科(榆林 718000)
宋彦彬 郝东宁▲ 刘 琦 李 乔
Wingspan支架治疗症状性颅内动脉狭窄36例临床研究
陕西省榆林市第一医院神经外科(榆林 718000)
宋彦彬 郝东宁▲刘 琦 李 乔
目的: 探讨Wingspan 支架对症状性颅内动脉狭窄的治疗情况,评价其安全性及可行性。方法:应用Wingspan支架治疗症状性颅内动脉狭窄患者36例,观察围手术期情况及术后随访情况,观察支架置入的手术成功率、狭窄率的改变、围手术期并发症、临床随访及影像学随访结果。结果:本组36例手术成功率为100%,围手术期(术后30d)并发症发生率为5.6%(2例)。28例患者接受了影像学(DSA或CTA)随访,在12个月随访期间,2例患者出现无症状性支架内再狭窄,1例患者出现症状性支架内再狭窄,再狭窄率为10.7%,1年不良事件发生率为8.3%。结论:对药物难治性症状性颅内动脉狭窄患者行Wingspan支架成形术是有效、可行的。
脑卒中是目前导致人类死亡的三大疾病之一,其中有85%患者属于缺血性脑卒中[1],在亚洲人口中,33%的脑梗死患者及51%的短暂性脑缺血发作(TIA)患者,是由于颅内动脉粥样硬化性狭窄引起[2]。
治疗颅内动脉粥样硬化性狭窄的目的是减少缺血性卒中的发生。然而即使在规范的抗血小板药物治疗下,许多患者仍然再次出现缺血性卒中[3]。WASID实验证明即使长期服用药物,症状性颅内动脉狭窄患者年卒中率为11%[4],狭窄大于70%患者面临脑卒中的风险可达19%[5]。因此人们开始采用其它方法治疗颅内动脉粥样硬化性狭窄,如:Wingspan支架[6,7]。国内有文献报道对于颅内动脉狭窄患者行支架成形术的疗效优于内科保守治疗[8]。但最新发表的《支架置人与强化药物治疗预防颅内动脉狭窄再发卒中对照试验SAMMPRIS》[9]提示:药物治疗组无论在早期还是在后期的长时间随访中,其安全性及有效性均优于Wingspan支架治疗组。这使得我们临床医师重新思考何种病人适合用药物治疗,何种病人适合用支架治疗。对颅内动脉狭窄患者,采用药物治疗还是采用支架治疗陷入左右为难的境地。本中心采用Gateway-Wingspan球囊支架治疗症状性颅内动脉狭窄36例,现将治疗结果报告如下。
资料与方法
1 临床资料 我中心于2012年1月至2013年7月收治动脉粥样硬化性颅内动脉狭窄患者36例,其中男21例,占58.3%;女15例,占41.7%。年龄41~83岁,平均56.4岁。基本病史:TIA发作13例,占36.1%;脑梗死23例,占63.9%;高脂血症5例,占13.9%;高血压26例,占72.2%;糖尿病20例,占55.6%;吸烟16例,占44.4%。狭窄长度大于10mm25例,占69.4%;术前狭窄率为(85.6±11.0)%。所有患者或其家属术前均签署手术知情同意书,均符合纳入标准:①反复的TIA或非致残性缺血性卒中,药物治疗效果欠佳;②全脑血管造影证实存在颅内动脉狭窄:症状性狭窄>70%。也符合排除标准:①无症状或轻微症状,药物控制有效;②脑梗死急性期;③颅内动脉狭窄为非动脉粥样硬化性狭窄或闭塞(如动脉炎早期、Moyamoya病等);④颅内动脉狭窄已进展到慢性完全性闭塞;⑤目标血管的管腔参考直径<2mm;⑥造影剂过敏、大面积脑梗塞等原因致严重的神经功能障碍、严重的全身性疾病(如心脏、肾脏功能障碍)等。
2 药物治疗 所有患者均于术前常规行头颅CT或MRI(含DWI)检查以除外新发梗死及脑出血。术前1周内行全脑血管造影检查,按照WASID方法(The Warfarin-Aspirin symptomatic intracranial disease)[10],测量并计算狭窄率,一致同意后记录结果。术前所有患者血压、血糖、血脂等高危因素均控制到正常。若患者处于脑梗死急性期,常规自发病4周后行支架置入术;术前3~5d,口服硫酸氢氯吡格雷片75mg和拜阿司匹林片300mg,1次/d;术中肝素化;术后必须严格控制血压,一般控制术后血压较术前基础血压低20~30mmHg,维持24h后,患者血压与术前基础血压基本保持一致。术后皮下注射低分子肝素钙注射液 0.4ml,2次/d, 3~5d,拜阿司匹林片300mg 1次/d,口服半年后改为100mg 1次/d口服终身;硫酸氢氯吡格雷片75mg 1次/d,口服3个月后停药;出院后患者继续积极控制血压、血糖、血脂等高危因素。
3 手术过程 均在全身麻醉及全身肝素化下进行。采用Seldinger技术穿刺股动脉后,将6F导引导管置入颈内动脉或椎动脉。在路径图指导下,先将微导丝通过狭窄血管,置入到病变血管远端,再沿微导丝将适合规格的球囊Gateway(美国史赛克公司)覆盖狭窄部位,精确定位后,透视下给予适当压力扩张,持续约20s,扩张满意后撤出球囊。再沿微导丝将适合规格的Wingspan支架置入狭窄部位,对位准确后释放。术后立刻造影,观察狭窄处支架置入术后残余狭窄率,若残余狭窄率大于50%,则给予球囊后扩张。本组病例所有患者支架置入术后残余狭窄率均较满意,无一例患者行球囊后扩张。扩张满意后撤出微导丝、微导管及导引导管。
4 效果评价 计算围手术期(术后30d)及术后12个月不良事件发生率(包括12个月内的任何死亡和卒中)。对患者行电话随访或临床随访,30d、6个月、12个月对患者进行mRs评分。所有患者计划于术后6个月行影像学(DSA或CTA)检查,对比其术前、术后及随访时的影像学结果。再狭窄是指血管造影证实的支架内或支架边缘(5mm内)的狭窄,其狭窄率>50%。
结 果
1 围手术期情况 全部病人36例(ICA:13例,MCA:14例,VA:7例,BA:2例),共37处狭窄(其中1例为同侧颈内动脉颅内段与大脑中动脉M1段同时置入支架)。 37处狭窄行支架置入术,手术成功率为100%。支架置入后即刻造影显示,血管狭窄率由(85.6±11.0)%降至(20.3±9.0)%。
2 围手术期并发症 共36例患者,围手术期(术后30d)并发症2例,均为大脑中动脉M1段穿支梗死,术后行头颅CT出现新的梗死灶,患者mRs评分均由1分变为3分,并发症发生率5.6%。患者围手术期情况见图1~2。
3 造影复查及随访 36例患者中有28例患者接受了影像学(DSA或CTA)随访,怀疑有支架内再狭窄患者均行DSA检查。其中1例患者出现症状性非支架置入处动脉重度狭窄(mRs评分由0分变为1分),2例患者出现无症状性支架内再狭窄,1例患者出现症状性支架内再狭窄(mRs评分由1分变为2分),再狭窄率为10.7%。在12个月随访期间共发生3例缺血性事件,包括2例TIA、1例症状性支架内再狭窄,其中2例与支架置入处动脉狭窄有关,1例与非支架置入处动脉狭窄有关。围手术期并发症患者在12个月随访期间,mRs评分由3分变为2分。年不良事件发生率为8.3%。
讨 论
缺血性脑卒中的致死致残率高,支架治疗主要是以预防脑卒中为目的。本中心围手术期出现2例穿支梗塞,这可能与大脑中动脉M1段解剖关系有关,该段动脉发出多支豆纹动脉,供应豆状核、内囊和尾状核。颅内动脉漂浮于蛛网膜下腔,且血管管壁缺乏平滑肌,同时血管外缺乏组织保护,特别薄弱,较外周血管更易破裂。大脑中动脉M1段分出的豆纹动脉也已硬化,动脉粥样硬化致血管的脆性增加,在此狭窄段进行球囊扩张及支架置入术时牵拉大脑中动脉可能会潜在的引起豆纹动脉血管破裂引起脑出血。术中Gateway球囊扩张以及Wingspan支架置入释放,可能会促使动脉粥样硬化性斑块发生移位,堵塞穿支豆纹动脉[11]。 Wingspan自膨式支架治疗症状性大脑中动脉狭窄时,需要Gateway球囊进行预扩张后再放置支架。在此过程中,球囊可能会将动脉粥样硬化斑块压碎。在使用球囊扩张后,行支架置入术时,支架网格可能会切割动脉粥样硬化性斑块[12]。在此情况下,动脉粥样硬化斑块碎屑可能会脱落甚至飘逸到远端,堵塞远端的血管及穿支动脉,引起脑梗死。
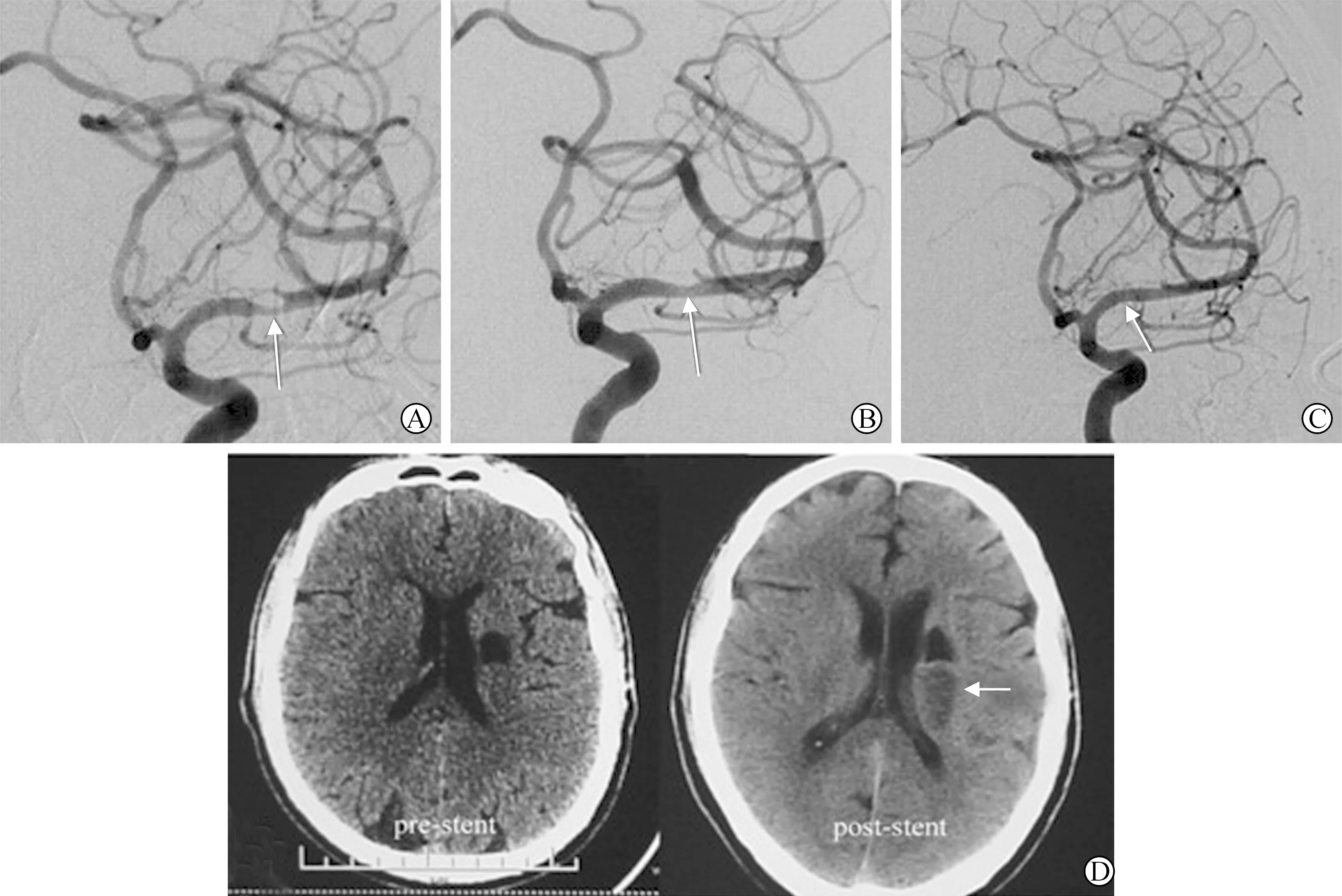
图1 MCA狭窄处置入Wingspan支架 A:DSA示大脑中动脉M1段重度狭窄;B:Gateway球囊扩张后;C:Wingspan支架置入后;D:支架置入前后CT图像对比,可见支架置入后出现新的梗死灶
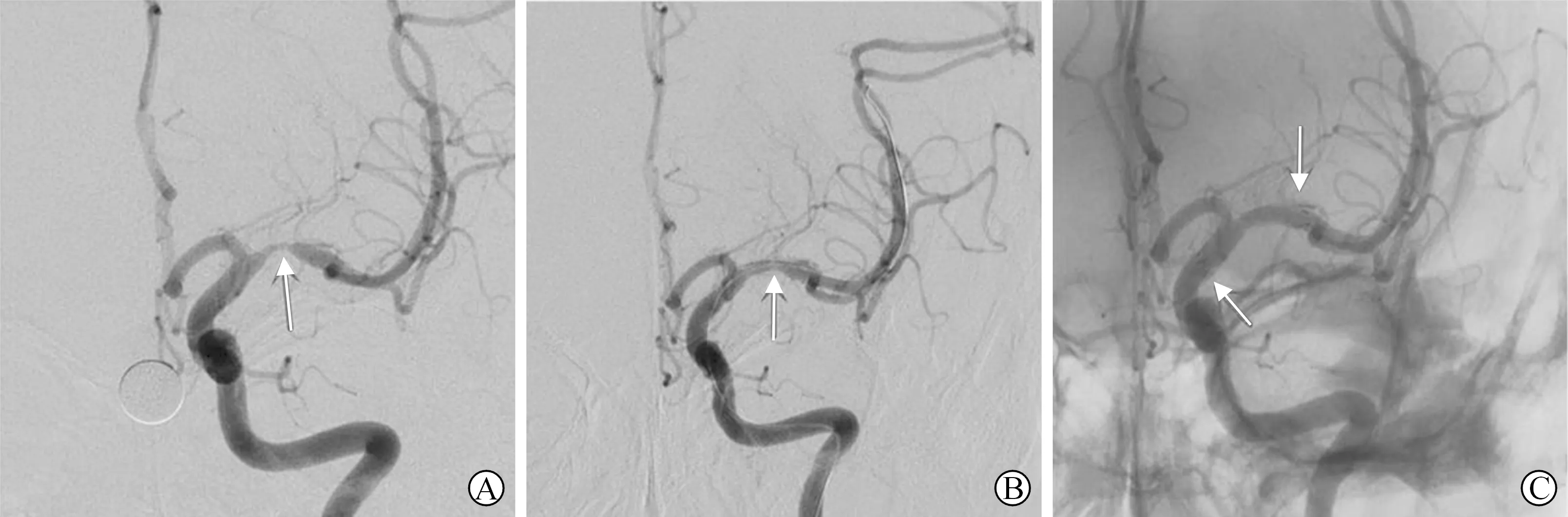
图2 MCA狭窄处置入Wingspan支架 A:DSA示大脑中动脉M1段重度狭窄;B:Gateway球囊扩张后;C:Wingspan支架置入后
许多研究机构报道颅内动脉狭窄行Wingspan支架置入术再狭窄率为25%~32.3%[13,14]。本中心在12个月随访期间,2例患者出现无症状性支架内再狭窄,1例患者出现症状性支架内再狭窄,再狭窄率为10.7%,再狭窄率相对较低,这可能与病例数相对较少有关。
对于我们临床医生而言,除了提高自身技术水平外,还应做到以下几点:①术前应严格掌握适应证,分清患者发病机制,对存在低灌注、容易血栓脱落或血管夹层实施合理的治疗;掌握合适治疗时机;②术中根据病变血管的狭窄部位、狭窄长度、分支状况及血管通路从而选择合适规格的支架治疗;③术后应严格管理,规范抗凝和抗血小板治疗(双抗血小板聚集治疗及抗凝),积极控制血压预防灌注压突破,积极控制血糖、血脂等危险因素,防止支架内血栓形成和再狭窄;④注重并加强患者临床随访,尤其是影像学随访。
本研究局限性:①病例数相对较少;②仪器设备、所用器材、技术方法的不断改善,及术者与技师经验的不断积累都会对手术过程及术后患者症状的改善产生一定的影响;③病人依从性较差,有部分失访;④无对照组支持。
总之,对于药物难治性症状性颅内动脉狭窄患者行Wingspan支架成形术是可行的、有效的。但长期疗效如何,仍需进一步随访观察。
[1] Lloyd-Jones D, Adams RJ, Brown TM,etal. Executive summary: heart disease and stroke statistics-2010 update: a report from the American heart association[J]. Circulation, 2010, 121 (7): 948-954.
[2] Wong KS, Huang YN, Gao S,etal. Intracranial stenosis in Chinese patients with acute stroke[J]. Neurology, 1998, 50 (3): 812-813.
[3] Wong KS, Li H. Long-term mortality and recurrent stroke risk among Chinese stroke patients with predominant intracranial atherosclerosis[J]. Stroke, 2003, 34 (10): 2361-2366.
[4] Chimowitz MI, Lynn MJ, Howlett-Smith H,etal. Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis[J]. The New England Journal of Medicine, 2005, 352 (13): 1305-1316.
[5] Kasner SE, Chimowitz MI, Lynn MJ,etal. Predictors of ischemic stroke in the territory of a symptomatic intracranial arterial stenosis[J]. Circulation, 2006, 113 (4): 555-563.
[6] Zaidat OO, Klucznik R, Alexander MJ,etal. The NIH registry on use of the Wingspan stent for symptomatic 70%~99% intracranial arterial stenosis[J]. Neurology, 2008, 70 (17): 1518-1524.
[7] Bose A, Hartmann M, Henkes H,etal. A novel, self-expanding, nitinol stent in medically refractory intracranial atherosclerotic stenoses: the Wingspan Study[J]. stroke, 2007, 38 (5): 1531-1537.
[8] 陶庆玲,孙 暄,赵 晖,等. 颅内动脉狭窄的支架成形术与内科治疗的疗效观察[J]. 中华神经外科杂志, 2006, 22(4): 233-235.
[9] Derdeyn CP, Chimowitz MI, Lynn MJ,etal. Aggressive medical treatment with or without stenting in high-risk patients with intracranial artery stenosis (SAMMPRIS): the final results of a randomised trial[J]. Lancet, 2014, 383 (9914): 333-341.
[10] Samuels OB, Joseph GJ, Lynn MJ,etal. A standardized method for measuring intracranial arterial stenosis[J]. AJNR, 2000, 21 (4): 643-646.
[11] 缪中荣. 症状性颅内动脉狭窄研究热点透视[J]. 中国脑血管病杂志, 2008, 5 (1): 2-4.
[12] Marks MP, Wojak JC, Al-Ali F,etal. Angioplasty for symptomatic intracranial stenosis: clinical outcome[J]. Stroke, 2006, 37 (4): 1016-1020.
[13] Turk AS, Levy EI, Albuquerque FC,etal. Influence of patient age and stenosis location on wingspan in-stent restenosis[J]. AJNR, 2008, 29 (1): 23-27.
[14] Albuquerque FC, Levy EI, Turk AS,etal. Angiographic patterns of Wingspan in-stent restenosis[J]. Neurosurgery, 2008, 63 (1): 23-28.
(收稿:2014-08-20)
Clinical study of Wingspan stents for symptomatic intracranial arterial stenosis
Department of Neurosurgery,Yulin First Hospital of Shaanxi Province(Yulin 718000)
Song Yanbin Hao Dongning Liu Qi et al
Objective: To retrospectively analyze the treatment of symptomatic intracranial arterial stenosis with Wingspan stent and to evaluate the feasibility and safety. Methods :36 patients with symptomatic intracranial arterial stenosis were treated by Wingspan stent. The operative successful rate,the degree of stenosis,perioperative complications and the results of clinical and imaging follow-up were observed.Results: The technical success rate was 100%. The rate of procedure-related complications during the perioperative period (30 days) was 5.6% (two of 36 patients).Twenty-eight patients were available for follow-up imaging with DSA or CTA. During 12 months, One patient was symptomatic in-stent restenosis (ISR), two patient was asymptomatic in-stent restenosis (ISR). The restenosis rate was 10.7%. The adverse event rate was 8.3% at 1 year.Conclusion:For refractory symptomatic intracranial arterial stenosis,Wingspan stents is an effective and feasible technique.But in the long term,we need further follow up.
Intracranial arterial diseases/therapy Stents/therapeutic use Intraoperative complications Follow-up studies @Wingspan stents
颅内动脉疾病/治疗 支架/治疗应用 手术中并发症 随访研究 @ Wingspan 支架
R743
A
10.3969/j.issn.1000-7377.2015.01.010
