不同因素对疯草内生真菌合成苦马豆素的影响
2015-03-22张蕾蕾余永涛何生虎赵清梅
张蕾蕾,余永涛*,何生虎,赵清梅,葛 松
(1.宁夏大学农学院,银川 750021;2.北方民族大学生物科学与工程学院,银川 750021;3.国家民委发酵酿造工程生物技术重点实验室,银川 750021)
不同因素对疯草内生真菌合成苦马豆素的影响
张蕾蕾1,余永涛1*,何生虎1,赵清梅2,3,葛 松1
(1.宁夏大学农学院,银川 750021;2.北方民族大学生物科学与工程学院,银川 750021;3.国家民委发酵酿造工程生物技术重点实验室,银川 750021)
研究不同因素对疯草内生真菌——Undifilumoxytropis合成苦马豆素的影响,筛选出显著影响U.oxytropis苦马豆素合成的因素。将U.oxytropis分别接种到不同pH或不同浓度聚乙二醇(PEG)、L-哌可酸、L-赖氨酸、α-酮戊二酸的培养基中培养,测定菌丝及其发酵液中苦马豆素,分析各条件下真菌苦马豆素产率的变化。结果表明:当pH在4.5~6.5时,随pH增加,真菌SW产率显著增加(P<0.05);当PEG质量浓度在0~32 g·L-1时,随PEG增加,真菌苦马豆素产率显著降低(P<0.01);当在培养基中添加相同量(10-3mol·L-1)的L-哌可酸、L-赖氨酸、ɑ-酮戊二酸时,L-哌可酸添加组的苦马豆素产率显著降低(P<0.05),L-赖氨酸添加组苦马豆素产率显著增加(P<0.05);当L-哌可酸的初始浓度为10-3和10-2mol·L-1时,真菌的苦马豆素产率显著下降(P<0.05),当其浓度为10-4mol·L-1时,苦马豆素产率显著增加(P<0.01);当L-赖氨酸的初始浓度为10-1、10-2或10-4mol·L-1时,真菌苦马豆素产率显著降低(P<0.05)。当ɑ-酮戊二酸的初始浓度分别为10-1、10-2、10-3mol·L-1时,真菌的苦马豆素产率显著降低(P<0.05)。由试验可知,低pH或添加PEG可抑制U.oxytropis中苦马豆素的合成,L-哌可酸、L-赖氨酸、α-酮戊二酸均对U.oxytropis的苦马豆素合成产生显著影响,但对苦马豆素合成的影响与各物质在培养基中的浓度密切相关。
疯草;内生真菌;棘豆波状芽管蠕孢菌;苦马豆素;生物合成
疯草是豆科棘豆属和黄芪属有毒植物的统称,广泛分布于中国西部省区和北美地区[1-2]。疯草的主要毒性成分是吲哚里西啶生物碱——苦马豆素(swainsonine,SW),它可抑制动物细胞溶酶体α-甘露糖苷酶和高尔基体甘露糖苷酶II的活性,导致低聚糖代谢和糖蛋白合成障碍[3]。动物长期采食疯草会发生以神经系统机能紊乱为特征的慢性中毒病,每年给草原畜牧业带来巨大的经济损失[2-10]。目前SW在动物机体内的代谢机制和毒理作用机制尚未被完全阐明,动物疯草中毒问题仍未能从根本上得到解决。近年研究表明,疯草内普遍存在能够产生SW的内生真菌——Undifilumoxytropis(棘豆波状芽管蠕孢菌),该类真菌是疯草中SW产生的主要因素[11-20]。因此,阐明疯草内生真菌合成SW的机制,抑制或阻断内生真菌合成SW,将有望降低或消除疯草的毒性,从根本上防除动物疯草中毒病,合理利用疯草[21]。
寄生于其他植物的病原真菌豆类丝核菌和昆虫病原真菌金龟子绿僵菌也能合成SW,其合成SW的部分途径已被阐明。这两种真菌均以L-赖氨酸为初始底物,在酵母氨酸氧化酶的催化下,赖氨酸与α-酮戊二酸缩合生成L-酵母氨酸,在该酶的作用下,酵母氨酸转化为L-2-氨基己二酸半醛,再经过一系列酶促反应依次生成△1,6-哌啶羧酸、哌可酸,并以哌可酸为前体合成SW[22-28]。在SW的合成中,酵母氨酸脱氢酶起负调控作用,它可促进L-2-氨基己二酸半醛逆向生成L-酵母氨酸和赖氨酸,而阻止SW的合成[29]。在此基础上,S.Mukherjee等研究了疯草内生真菌U.oxytropis中酵母氨酸脱氢酶对SW合成的影响,结果表明抑制酵母氨酸脱氢酶的表达可使赖氨酸和酵母氨酸的消耗量增加,而哌可酸及SW的产量显著提升[30-31],他们认为疯草内生真菌中SW的合成路径可能与豆类丝核菌等相似。杨国栋[32]研究表明,L-赖氨酸、哌可酸可增加U.oxytropis中SW的产量,同位素示踪试验也表明,L-赖氨酸中被同位素N15标记的部分氮原子在赖氨酸代谢过程中被掺入到了生成的SW分子中,认为L-赖氨酸和哌可酸是疯草内生真菌合成SW的前体物质。此外,W.E.Oldrup[33]评估了pH、聚乙二醇(polyethylene glycol,PEG)、温度等因素对疯草内生真菌SW合成的影响,结果表明低pH(pH 4.5)或高浓度PEG可使U.oxytropis的SW产量显著提高。
以上研究为进一步揭示疯草内生真菌中SW的合成机制奠定了重要基础,但在评估不同因素对U.oxytropis合成SW的影响时,以上研究仅是测定了真菌菌丝中SW产量的变化,并未对真菌培养基中的SW进行分析,而在K.Braun等[17]的研究中已经确定,疯草内生真菌可以将产生的SW从菌丝分泌到培养基中。此外,以上研究仅分析了固定量的PEG、L-赖氨酸、哌可酸对真菌SW合成的影响,这些物质量的变化是否会对SW的合成产生影响还不清楚。本研究拟对不同pH、不同PEG浓度、不同L-赖氨酸、哌可酸和α-酮戊二酸浓度的培养条件下培养U.oxytropis真菌菌丝及其培养液中的SW进行综合分析,从而确定以上因素对U.oxytropis合成SW的影响,筛选出可导致疯草内生真菌SW合成发生显著改变的因素,为进一步开展疯草内生真菌合成SW的机制研究提供依据。
1 材料与方法
1.1 材料
1.1.1 真菌菌株 疯草内生真菌菌株NX-FEL001,由张蕾蕾等[34]从宁夏黄花棘豆中分离,根据真菌的形态特征、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,gpd)、内部转录间隔区(internal transcribed space,ITS)等基因序列,进行同源性比较和遗传进化分析,确定为U.oxytropis。
1.1.2 试剂和仪器 SW标准品,由宁夏大学临床兽医学重点学科实验室从黄花棘豆中分离和纯化;L-赖氨酸、L-哌可酸、α-酮戊二酸、硝基苯基-ɑ-D-甘露糖苷(p-nitrophenyl-ɑ-D-mannopyranoside substrate)、ɑ-甘露糖苷酶(ɑ-mannosidase from jack bean)、氢氧化钠、柠檬酸、硼酸、改良基础盐(Murashige and skoog major salts)、水解酪蛋白均购自美国Sigma 公司;间苯三酚、谷氨酸、脯氨酸、盐酸硫胺、盐酸吡哆辛、肌醇等试剂均为国产分析纯。RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;KG-SX-500型高压锅,三洋电机株式会社日本生产;MIP-250型霉菌培养箱,上海精宏实验设备有限公司;QYC-2102C型摇床,上海福玛实验设备有限公司;MK3型酶标仪,Thermo Fisher公司;E438酸度计,Mettler Toledo有限公司;超纯水仪,Thermo Fisher公司。
1.1.3 培养基 培养基按以下方法配制。
蛋白胨无机盐固体培养基[32]:MgSO4·7H2O 0.6 g,KCl 0.6 g,FeSO40.02 g,蔗糖 15.58 g, K2HPO40.62 g,大豆蛋白胨 0.34 g,琼脂20 g,蒸馏水 1 L,氯霉素 500 mg·L-1,121 ℃高压灭菌30 min。
ULTO培养基:2.7 g Murashige and skoog major salts,4.4 g酸水解蛋白,12.6 mg间苯三酚,100 mg谷氨酸,0.575 g脯氨酸,100 mg VB1,25 mg VB6,肌醇,1 L去离子水,氯霉素 500 mg·L-1,121 ℃高压灭菌30 min。
蛋白胨无机盐液体培养基[32]:MgSO4·7H2O 0.6 g,KCl 0.6 g,FeSO40.02 g,蔗糖 15.58 g,K2HPO40.62 g,大豆蛋白胨 0.34 g,蒸馏水 1 L,氯霉素 500 mg·L-1,121 ℃高压灭菌30 min。
1.2 试验方法
1.2.1 真菌U.oxytropis的预培养
1.2.1.1 真菌U.oxytropis固体培养基的筛选:将保存的疯草内生真菌菌株U.oxytropisNX-FEL001接种于PDA平板上,22 ℃恒温培养30 d后,用灭菌的镊子收集菌丝于研磨器中,加入适量的灭菌水,研磨菌丝,制备菌丝悬浮液。定量取制备好的菌丝悬浮液分别均匀涂布于PDA固体培养基、马铃薯浸粉琼脂培养基、蛋白胨无机盐固体培养基平板上,22 ℃恒温15 d后,观察真菌的生长情况,筛选出适合真菌生长的固体培养基。
1.2.1.2 真菌U.oxytropis的制备:取疯草内生真菌菌株U.oxytropisNX-FEL001接种于PDA平板上,22 ℃恒温培养30 d后,用灭菌的镊子收集菌丝于研磨器中,加入适量的灭菌水,研磨菌丝,制备菌丝悬浮液。定量取制备好的菌丝悬浮液均匀涂布于1.2.1.1筛选出的固体平板上,22 ℃恒温30 d待用。
1.2.1.3 真菌U.oxytropis液体培养基的筛选:用灭菌的打孔器在1.2.1.2中制备的真菌平板上打孔,制成直径为 6 mm 的菌饼,分别接种到装有50 mL pH 6.5的蛋白胨无机盐液体培养基和ULTO液体培养基中,每瓶接种10 个菌饼,每个处理条件同时做10个重复,置恒温振荡培养箱中,22 ℃,150 r·min-1振荡培养30 d,筛选出适合真菌U.oxytropis快速生长的液体培养基。
1.2.1.4 真菌U.oxytropis培养方式的筛选:用灭菌的打孔器在1.2.1.2中制备的真菌平板上打孔,制成直径6 mm的菌饼,分别接种到装有50 mL pH 6.5的ULTO培养基中,每瓶接种10 个菌饼,每个处理条件同时做10个重复,一组置霉菌恒温培养箱,22 ℃,静置培养30 d;另一组置恒温振荡培养箱中,22 ℃,150 r·min-1振荡培养30 d,筛选出适合真菌U.oxytropis快速生长的培养方式。
1.2.2 不同因素下U.oxytropis的培养
1.2.2.1 不同pH下U.oxytropis的培养:用灭菌的打孔器在1.2.1.2中培养的真菌上打孔,制成直径为 6 mm 的菌饼,分别接种到装有50 mL pH分别为4.5、5.5、6.5 的ULTO液体培养基中,每瓶接种10 个菌饼,每个处理条件同时做10个重复,置恒温振荡培养箱中,22 ℃,150 r·min-1振荡培养30 d。
1.2.2.2 不同浓度PEG下U.oxytropis的培养:用灭菌的打孔器在1.2.1.2中培养的真菌上打孔,制成直径为 6 mm 的菌饼,分别接种到装有50 mL PEG 浓度分别为32、16、8、0 g·L-1的ULTO液体培养基(pH 6.5)中,每瓶接种10 个菌饼,每个处理条件同时做10 个重复,置恒温振荡培养箱中,22 ℃,150 r·min-1振荡培养30 d。
1.2.2.3 不同前体物质中U.oxytropis的培养:用灭菌的打孔器在1.2.1.2中培养的真菌上打孔,制成直径为 6 mm 的菌饼,分别接种到装有50 mL 1×10-3mol·L-1L-赖氨酸、1×10-3mol·L-1ɑ-酮戊二酸、1×10-3mol·L-1L-哌可酸的ULTO液体培养基(pH 6.5)中,每瓶接种10 个菌饼,每个处理条件同时做10 个重复,置恒温振荡培养箱中,22 ℃,150 r·min-1振荡培养30 d。
1.2.2.4 不同浓度L-哌可酸中U.oxytropis的培养:用灭菌的打孔器在1.2.1.2中培养的真菌上打孔,制成直径为 6 mm 的菌饼,分别接种到装有50 mL 1×10-2、1×10-3、1×10-4mol·L-1L-哌可酸的ULTO液体培养基(pH 6.5)中,每瓶接种10 个菌饼,每个处理条件同时做10个重复,置恒温振荡培养箱中,22 ℃,150 r·min-1振荡培养30 d。
1.2.2.5 不同浓度L-赖氨酸中U.oxytropis的培养:用灭菌的打孔器在1.2.1.2中培养的真菌上打孔,制成直径为 6 mm 的菌饼,分别接种到装有50 mL 1×10-1、1×10-2、1×10-3、1×10-4mol·L-1L-赖氨酸的ULTO液体培养基(pH 6.5)中,每瓶接种10 个菌饼,每个处理条件同时做10 个重复,置恒温振荡培养箱中,22 ℃,150 r·min-1振荡培养30 d。1.2.2.6 不同浓度α-酮戊二酸中U.oxytropis的培养:用灭菌的打孔器在1.2.1.2中培养的真菌上打孔,制成直径为 6 mm 的菌饼,分别接种到装有50 mL 1×10-1、1×10-2、1×10-3mol·L-1α-酮戊二酸的ULTO液体培养基(pH 6.5)中,每瓶接种10 个菌饼,每个处理条件同时做10个重复,置恒温振荡培养箱中,22 ℃,150 r·min-1振荡培养30 d。1.2.3 苦马豆素的测定
1.2.3.1 菌丝及其发酵液中SW的提取:振荡培养结束后,将培养物 5 000 r·min-1离心15 min,使菌丝与发酵液分离。将菌丝置于烘至恒重的称量瓶中,60 ℃烘至恒重,称重。将烘干的菌丝置于研钵中充分研磨成粉末,然后加入10 mL离心管中,加入7 mL 3%乙酸溶液,超声提取30 min,5 000 r·min-1离心15 min,收集上清液,重复提取4次,合并提取液于旋转蒸发仪上浓缩挥干,残渣用适量100 mmol·L-1pH 4.5的柠檬酸盐缓冲液溶解,0.45 μm微孔滤膜过滤后,用上述缓冲液定容至10 mL,置4 ℃冰箱中保存待检。将发酵液用旋转蒸发仪浓缩挥干,残渣用适量100 mmol·L-1pH 4.5的柠檬酸盐缓冲液溶解,0.45 μm微孔滤膜过滤后,用上述缓冲液定容至10 mL,置4 ℃冰箱中保存待检。
1.2.3.2 α-甘露糖苷酶法测定菌丝及其发酵液中SW的含量:精密称量苦马豆素标准品,将其分别配制成4、2、1、0.5、0.25、0.125、0.062 5、0.031 25、0.015 625 μg·mL-1等9个质量浓度梯度的标准溶液。取40 μL不同质量浓度的苦马豆素标准品溶液分别加入96孔板的各孔中,每个质量浓度的溶液同时做3个重复,另将60 μL 100 mmol·L-1pH 4.5的柠檬酸盐缓冲液加入空白孔中作为空白对照,将40 μL 100 mmol·L-1pH 4.5的柠檬酸盐缓冲液加入到阴性对照孔中作为阴性对照。然后分别在每孔中加入95 μL 1.0 mmol·L-14-Nitrophenyl α-D-mannopyranoside底物溶液,轻微振荡混匀,置37 ℃孵育1 h;孵育结束后在每孔加入20 μL 0.375 U·mL-1的α-甘露糖苷酶溶液的酶溶液,但空白对照中不加酶溶液,轻微振荡混匀,置37 ℃再孵育1 h。孵育结束后,每孔加入100 μL的pH 9.8的200 mmol·L-1硼酸盐缓冲溶液,轻微振荡混匀,置405 nm波长处测定各孔吸光度值。以SW质量浓度y对ɑ-甘露糖苷酶抑制率x进行回归分析,绘制标准曲线方程。将1.2.3.1中制备的待检液适当稀释后,按照上述方法测定样品孔的吸光度值,将ɑ-甘露糖苷酶的抑制率代入标准曲线方程计算出样品溶液中SW的含量。
1.2.4 数据分析 使用SAS8.1软件进行数据统计和作图,对每个处理组进行统计学分析,并用不同的字母表示不同因素差异显著(P<0.05)。其中SW产率依据菌丝和发酵液中SW的质量之和(mg)与菌丝干重(g)的比值进行统计分析,并结合Excel做t检验。
2 结 果
2.1 产SW内生真菌的预培养
2.1.1 固体培养基对菌丝生长繁殖的影响 将菌悬液分别接种到PDA固体培养基、马铃薯浸粉培养基、蛋白胨无机盐固体培养基上,15 d后,蛋白胨无机盐固体培养基的菌丝生长繁殖的能力最强,铺满整个平板,整个平板厚度均一,而其他培养基上的菌丝生长缓慢,其中菌丝在马铃薯浸粉培养基上生长最慢。
2.1.2 液体培养基对菌丝生长繁殖的影响 真菌U.oxytropis在ULTO培养基、蛋白胨无机盐液体培养基上培养10 d后,ULTO培养基中菌丝生长较快,培养基中出现大量的菌丝,而蛋白胨无机盐液体培养基中菌丝生长较慢。培养一个月后,ULTO培养基中菌丝生长旺盛,棕色,呈絮状,瓶壁上有大量的菌丝,呈粗条状,菌丝的平均干重为0.369 g,蛋白胨无机盐液体培养基上菌丝生长缓慢,呈白色棒状菌丝,平均干重为0.158 g。
2.1.3 不同培养方式对菌丝生长繁殖的影响 真菌U.oxytropis在ULTO培养基上,培养30 d后,静置培养的菌丝生长缓慢,仅有少量的菌丝,菌丝的平均干重为0.126 g;振荡培养的菌丝生长迅速,产生大量的菌丝,菌丝的干重明显增加,平均为0.369 g,是静置培养真菌菌丝干重的2.9倍。
2.2 α-甘露糖苷酶抑制法标准曲线绘制
以α-甘露糖苷酶抑制率y对SW质量浓度x进行回归分析,得回归方程:y=3.177 9x+1.246 6(R2=0.999 2),表明SW质量浓度在0.013 25~4 μg·mL-1范围内线性关系良好。
2.3 不同因素对疯草内生真菌菌丝产量和SW合成的影响
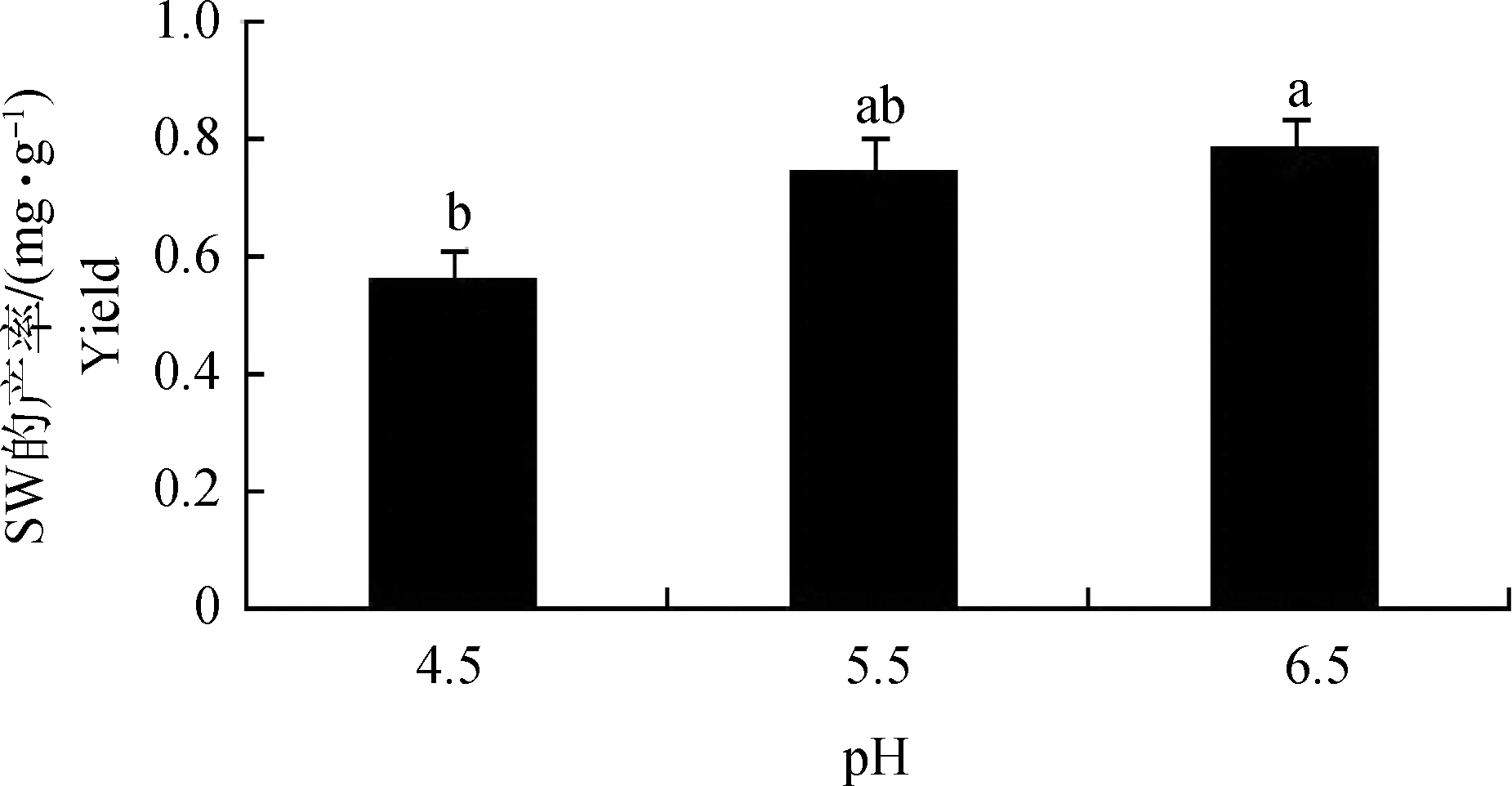
2.3.1 不同pH对真菌菌丝产量及SW合成的影响 随着培养基pH的不断增加,内生真菌菌丝的平均干重无显著变化(P>0.05,结果未展示),SW产率呈增加的趋势,各组之间差异显著(P<0.05),SW的产率分别为0.56、0.74、0.78 mg·g-1。pH 5.5与pH 6.5、pH 4.5与pH 6.5相比,随着菌丝平均干重的增加,SW的产率呈上升的趋势;pH 4.5与pH 5.5相比,随着菌丝平均干重的降低,SW的产率反而增加(图1)。
2.3.2 不同浓度聚乙二醇(PEG)对真菌菌丝产量及SW合成的影响 随着PEG质量浓度的增加,U.oxytropis的菌丝产量显著增加(P<0.01),而苦马豆素的产量显著降低(P<0.01),产率分别为1.16、0.95、0.77、0.18 mg·g-1。当PEG质量浓度达到32 g·L-1时,菌丝的平均干重为对照组的3倍,而苦马豆素的产量显著降低,为0.126 mg(图
相同字母表示不同pH下,在0.05水平上差异不显著The same letters show no significant difference of lines at 0.05 level图1 不同pH下SW产率Fig 1 The yield of swainsonine under different pH
2)。表明随着PEG质量浓度的增加,菌丝的生长速度加快,但会抑制SW合成。
2.3.3 不同前体物质对真菌菌丝产量及SW合成的影响 当3种前体物质在培养基中的浓度分别为10-3mol·L-1时,L-赖氨酸、α-酮戊二酸对U.oxytropis的菌丝的产量无显著影响(P>0.05),α-酮戊二酸对真菌SW产量没有显著影响,但有促进SW合成的趋势,L-赖氨酸可显著提高SW的产量,高达0.214 mg,为对照组的3.8倍,SW的产率为0.54 mg·g-1(P<0.05);L-哌可酸可显著增加U.oxytropis的菌丝的产量,但SW产量反而显著降低,其SW产率仅为0.33 mg·g-1(P<0.01)(图3)。2.3.4 不同浓度L-哌可酸对真菌菌丝产量及SW合成的影响 不同浓度L-哌可酸下,菌丝的平均干重存在明显的差异(P<0.05),随着L-哌可酸浓度的增加,SW的产量反而显著降低,SW产率分别为0.5、0.34、0.23 mg·g-1(P<0.05)。与对照组相比,当L-哌可酸的浓度为1×10-4mol·L-1时,SW产量显著增加,为对照组的1.25倍(P<0.01);当L-哌可酸的浓度为1×10-2、1×10-3mol·L-1时,SW的产量显著降低,分别为对照组的57.5%、85%。当L-哌可酸的浓度为1×10-2、1×10-3mol·L-1时,随着菌丝干重的增加,SW产量增加;当L-哌可酸的浓度为1×10-3、1×10-4mol·L-1时,随着菌丝干重的降低,SW产量反而上升(图4)。推测L-哌可酸浓度在一定的范围可促进菌丝的生长,从而加速SW的合成;在某一浓度范围内可抑制菌丝的生长,促进SW的合成速度,总体来说L-哌可酸有促进SW合成的趋势。
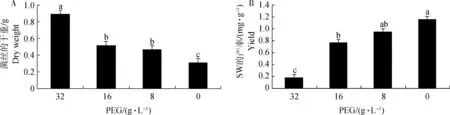
A.菌丝平均干重;B.SW产率。不同字母表示,不同质量浓度PEG下在0.01水平上差异显著A.Mean mycelial dry weight under different PEG;B.The yield of swainsonine under different PEG.The different letters show significant difference of lines at 0.01 level图2 不同质量浓度PEG下菌丝的平均干重及苦马豆素产率Fig.2 The mean production of mycelium and yield of swainsonine under different PEG
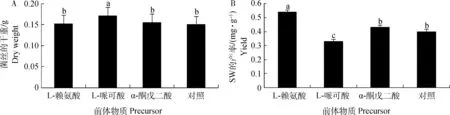
A.菌丝平均干重;B.苦马豆素产率。相同字母表示,不同前体物质在0.05水平上差异不显著;不同字母表示,不同前体物质在0.05水平上差异显著A.Mean mycelial dry weight under different precursor;B.The yield of swainsonine under different precursor.The same letters show no significant difference of lines at 0.05 level;The different letters show significant difference of lines at 0.05 level图3 不同前体物质下,菌丝平均干重及苦马豆素产率Fig.3 The mean production of mycelium and yield of swainsonine under different precursor

A.菌丝平均干重;B.苦马豆素产率。相同字母表示,不同浓度L-哌可酸在0.05水平上差异不显著;不同字母表示,不同浓度L-哌可酸在0.05水平上差异显著A.Mean mycelial dry weight under different L-pipecolic acids;B.The yield of swainsonine under different L-pipecolic acids.The same letters show no significant difference of lines at 0.05 level;The different letters show significant difference of lines at 0.05 level图4 不同浓度L-哌可酸下菌丝平均干重及苦马豆素产率Fig.4 The mean production of mycelium and yield of swainsonine under different L-pipecolic acids
2.3.5 不同浓度L-赖氨酸对真菌菌丝产量及SW合成的影响 L-赖氨酸浓度为1×10-1、1×10-2、1×10-3mol·L-1时,菌丝的平均干重无显著的变化(P>0.05),仅当L-赖氨酸浓度为1×10-4mol·L-1时,菌丝的平均干重显著增加(P<0.01);L-赖氨酸浓度为1×10-1、1×10-2、1×10-4mol·L-1时,SW产量显著降低,SW产率分别为0.028、0.29、0.18 mg·g-1(P<0.01);L-赖氨酸浓度为1×10-3mol·L-1时,SW产量显著增加,SW产率为0.54 mg·g-1(P<0.01)(图5)。推测L-赖氨酸浓度与产SW内生真菌生长及SW合成密切相关,浓度为1×10-1、1×10-2、1×10-4mol·L-1时,L-赖氨酸可抑制菌丝合成SW,L-赖氨酸浓度为1×10-3mol·L-1时,可促进菌丝合成SW。
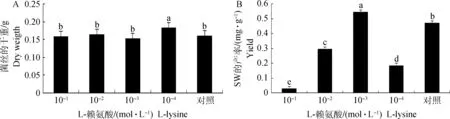
A.菌丝平均干重;B.苦马豆素产率。相同字母表示,不同浓度L-赖氨酸在0.05水平上差异不显著;不同字母表示,不同浓度L-赖氨酸在0.05水平上差异显著A.Mean mycelial dry weight under different L-lysine;B.The yield of swainsonine under different L-lysine.The same letters show no significant difference of lines at 0.05 level;The different letters show significant difference of lines at 0.05 level图5 不同浓度L-赖氨酸下菌丝平均干重及苦马豆素产率Fig.5 The mean production of mycelium and yield of swainsonine under different L-lysine
2.3.6 不同浓度ɑ-酮戊二酸对真菌菌丝产量及SW合成的影响 随着ɑ-酮戊二酸浓度的递增,SW的产量显著降低(P<0.05)。当ɑ-酮戊二酸浓度为1×10-1mol·L-1时菌丝的干重显著降低,而SW产量显著降低,SW产率为对照组的44%,为0.20 mg·g-1;1×10-2mol·L-1时,菌丝的平均干重无显著的变化,而SW产量显著降低,SW产率为对照组的84%,达0.38 mg·g-1(图6)。推测ɑ-酮戊二酸浓度在1×10-1~1×10-2mol·L-1,可抑制SW的合成,小于1×10-1mol·L-1时,可抑制真菌的生长及SW的合成。
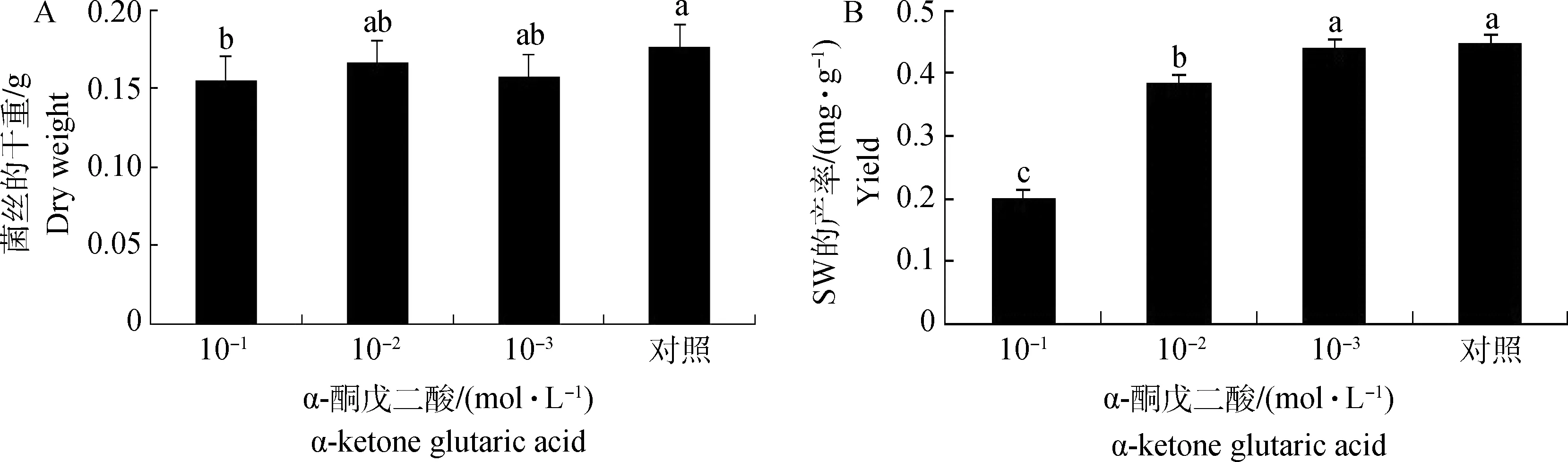
A.菌丝平均干重;B.苦马豆素产率。相同字母表示,不同浓度ɑ-酮戊二酸下,在0.05水平上差异不显著;不同字母表示,不同浓度ɑ-酮戊二酸条件下,在0.05水平上差异显著A.Mean mycelial dry weight under different ɑ-ketone glutaric acid;B.The yield of swainsonine under different ɑ-ketone glutaric acid.The same letters show no significant difference of lines at 0.05 level;The different letters show significant difference of lines at 0.05 level图6 不同浓度ɑ-酮戊二酸下菌丝平均干重及苦马豆素产率Fig.6 The mean production of mycelium and yield of swainsonine under different ɑ-ketone glutaric acid
3 讨 论
目前,国内外一致认为U.oxytropis是疯草中唯一能够产生SW的内生真菌,该类真菌与疯草的毒性紧密相关。近几年来,对于该类菌株的研究主要集中在分离与鉴定[11-20]、疯草毒性与疯草内生真菌的关系[37-39]、传播机制[40]、环境因素对SW合成影响[33,37]、疯草与内生真菌的共生关系[41]、基因及蛋白组学[29]上SW合成的机制等方面。
本研究对真菌U.oxytropis的固体培养基、液体培养基及培养方式进行筛选,并对不同pH、不同质量浓度PEG、不同浓度L-赖氨酸、L-哌可酸和α-酮戊二酸的培养条件下真菌U.oxytropis的菌丝及其培养液中的SW进行综合分析,结果显示蛋白胨无机盐固体培养基及ULTO液体培养基有利于真菌U.oxytropis的生长繁殖。研究表明,碳源、氮源、金属离子的浓度及无机盐种类,都会对丝状真菌生长繁殖产生影响[11,42],蛋白胨无机盐固体培养基含有真菌U.oxytropis生长所必需的碳源、氮源、金属离子,促进菌丝生长;微量元素及氨基酸是生命体必需的物质,ULTO培养基营养丰富,含有菌丝生长所需的微量元素及氨基酸,从而促进菌丝的生长;蛋白胨无机盐液体培养的主要成分为盐类,与ULTO液体培养基相比,相对缺少促进菌丝生长的维生素和氨基酸,U.oxytropis生长相对缓慢。
静置培养与振荡培养相比,振荡培养更适合菌丝的生长。据报道,振荡培养可改善菌丝与培养基成分的接触和氧的供应[43],菌丝的生长繁殖比较均一,繁殖能力强,特别是在霉菌的培养中,菌饼不易形成附有菌膜的小球。pH对U.oxytropis的生长无显著的影响,可能是真菌自身通过某种方式调节其生长环境pH,使环境pH更利于其生长繁殖,这一研究与C.Tamerler等[42]报道一致;随着pH的递增,SW的产率逐渐的增加,这与W.E.Oldrup[33]的结果相反。本研究不仅检测了菌丝提取物中的苦马豆素,还检测了发酵液中的苦马豆素,发现发酵液中的SW高于菌丝提取物中的SW。在植物研究中,PEG溶液经常被用作渗透胁迫剂,研究显示任何PEG质量浓度对植物种子的萌发抗旱指数、活力指数、发芽率、发芽势、胚根和胚芽长都有极显著的影响;另一方面PEG具有亲水性,可以改变细胞的膜结构,在细胞融合中起决定性的作用;然而高质量浓度、高相对分子质量的PEG会对细胞产生毒性[35-36]。研究发现高质量浓度的PEG胁迫下,随着PEG质量浓度的增高,菌丝的生长能力增强,SW合成受到阻碍,与W.E.Oldrup[33]、M.H.Ralphs等[37]的研究结果不一致,但在W.E.Oldrup的研究中仅对真菌菌丝中的SW做了检测。另据K.Braun等[17]报道,真菌在生长的过程中不仅进行SW胞内分泌,还可将SW分泌到细胞的外部,并且在菌丝发酵液中检测到SW的存在。余永涛[11]在发酵培养试验中,检测到发酵液中的苦马豆素产量为2~85 mg·L-1。可能在真菌生长的过程中,高质量浓度的PEG会对细胞产生毒性,破坏细胞膜结构的完整性,从而抑制真菌吸收丰富的营养物质,导致SW产量下降;低质量浓度的PEG条件下,细胞的膜结构改变,细胞易于融合,促进真菌吸收丰富的营养物质,菌丝生长加快,促进SW合成。
目前,国内外学者推测疯草中U.oxytropis内生真菌合成SW的机制类似于豆类丝核菌及金龟子绿僵菌,并认为赖氨酸、ɑ-酮戊二酸、酵母氨酸、哌可酸、酵母氨酸氧化酶等为U.oxytropis内生真菌合成SW关键物质[24,29-32]。
本试验研究了L-赖氨酸、ɑ-酮戊二酸、L-哌可酸三种前体底物及不同浓度前体物质对U.oxytropis真菌生长及SW合成的影响,研究发现当L-哌可酸浓度为1×10-3mol·L-1时可显著促进U.oxytropis的生长,但会抑制SW的合成,L-赖氨酸可显著促进SW的合成,ɑ-酮戊二酸具有促进U.oxytropis的生长及SW合成的趋势;与杨国栋[32]的试验结果存在差异,其试验中添加的化合物按质量计算,而本试验改进方法,用化合物物质的量浓度来确定添加量,每个化合物相对分子质量存在差异,该法更合理化。此外,在杨国栋[32]的研究中,也未对发酵液中的SW量进行测定。不同浓度前体物质在一定的范围可促进U.oxytropis的生长,从而加速SW的合成;在某一浓度范围内可抑制U.oxytropis的生长,从而阻碍SW的合成速度。L-哌可酸、L-赖氨酸、ɑ-酮戊二酸为内生真菌U.oxytropis合成SW的前体底物,猜测U.oxytropis的生长与SW合成之间存在复杂的关系,SW合成不仅与真菌U.oxytropis菌丝的干重有关,而且与其自身合成SW的能力相关。
4 结 论
U.oxytropis内生真菌与疯草中SW含量密切关联,不同pH、不同PEG质量浓度、不同L-赖氨酸、L-哌可酸和α-酮戊二酸浓度的培养条件下对疯草内生真菌的生长及SW的合成具有一定的影响。U.oxytropis自身具有调节其生长环境pH的能力,适应其生长;低pH抑制SW的合成,高pH下促进SW的合成;高质量浓度的PEG可促进真菌U.oxytropis的生长,但抑制U.oxytropis合成SW,L-赖氨酸、L-哌可酸和α-酮戊二酸是真菌U.oxytropis合成SW的前体底物,均对U.oxytropis的苦马豆素合成产生显著影响,但对苦马豆素合成的影响与各物质在培养基中的浓度密切相关。
[1] 史志诚.中国草地重要有毒植物[M].北京 :中国农业出版社,1997:12-66. SHI Z C.Importent poisonous plants of china grassland[M].Beijing:China Agriculture Press,1997:12-66.(in Chinese)
[2] 赵宝玉,樊月圆,樊泽峰,等.我国西部草原疯草危害及其动物中毒病的控制[J].草食家畜,2006(1):12-15. ZHAO B Y,FAN Y Y,FAN Z F,et al.The damage and control of locoweed and locosim in western grassland of China [J].GrassFeedingLivestock,2006(1):12-15.(in Chinese)
[3] MOLYNEUX R J,JAMES L F.Loco intoxication:indolizidine alkaloids of spotted locoweed(Astragaluslentiginosus)[J].Science,1982,216(4542):190-191.
[4] 王 凯,曹光荣,段得贤,等.黄花棘豆对山羊的毒性研究[J].畜牧兽医学报,1990,21(1) :80-86. WANG K,CAO G R,DUAN D X,et al.A study on toxicity ofOxytropisochrochphalain goats[J].ActaVeterinariaetZootechnicaSinica,1990,21(1):80-86.(in Chinese)
[5] 李建科,杨具田,潘和平,等.家畜黄花棘豆、甘肃棘豆中毒的调查[J].中国兽医科技,1987(5):22-23. LI J K,YANG J T,PAN H P,et al.A investigation on poisoning ofOxytropisochrochphalaandOxytropiskansuensisin livestock [J].VeterinaryScienceinChina,1987(5):22-23.(in Chinese)
[6] 赵宝玉,曹光荣,段得贤,等.西藏茎直黄芪对山羊的毒性研究[J].畜牧兽医学报,1992,23(3):276-280. ZHAO B Y,CAO G R,DUAN D X,et al.A study on toxicity ofAstragalusstrictusin goats in Tibet[J].ActaVeterinariaetZootechnicaSinica,1992,23(3):276-280.(in Chinese)
[7] 余永涛,耿果霞,刘志滨,等.家畜毛瓣棘豆中毒研究[J].草业科学,2006,23(5) :75-77. YU Y T,GENG G X,LIU Z B,et al.Progress in the study of Oxytropisserioopetalapoisoning in domestic animals[J].PrataculturalScience,2006,23(5):75-77.(in Chinese)
[8] 余永涛.毛瓣棘豆的毒性及其主要化学成分研究[D].杨凌 :西北农林科技大学,2006. YU Y T.Studies on the toxicity and major chemical constitutients ofOxytropisserioopetalaC.R.C.Fisch[D].Yangling:Northwest A&F University,2006.(in Chinese)
[9] 高新磊,韩 冰,赵萌莉,等.疯草及毒性成分研究进展[J].草业科学,2011,20(3):279-286. GAO X L,HAN B,ZHAO M L,et al.Locoweed and advances in research on toxic components[J].PrataculturalScience,2011,20(3):279-286.(in Chinese)
[10] 曹光荣,李绍君,段得贤,等.黄花棘豆有毒成分的分离与鉴定[J].西北农业大学学报,1989,17(3):1-8. CAO G R,LI S J,DUAN D X,et al.The isolation and identification of toxic components fromOxytropisochrochphala[J].JournalofNorthwestA&FUniversity,1989,17(3):1-8.(in Chinese)
[11] 余永涛.产苦马豆素疯草内生真菌的分离鉴定及其遗传多态性研究[D].杨凌:西北农林科技大学,2009. YU Y T.Isolation,identification and genetic polymorphism of swainsonine-producing fungal endophytes from locoweeds in China[D].Yangling:Northwest A&F University,2009.(in Chinese)
[12] 余永涛,王建华,王 妍,等.西藏3种疯草中合成苦马豆素内生真菌的鉴定[J].中国农业科学,2009,42(10):3662-3671. YU Y T,WANG J H,WANG Y,et al.Identification of swainsonine-producing fungal endophytes from three species of locoweeds in Tibet[J].ScientiaAgriculturaSinica, 2009,42(10):3662-3671.(in Chinese)
[13] 余永涛,王建华,赵清梅,等.甘肃棘豆中产苦马豆素内生真菌的分离与鉴定[J].西北农林科技大学学报(自然科学版),2009,37(2):40-46,51. YU Y T,WANG J H,ZHAO Q M,et al.Isolation and identification of swainsonine-producing fungal endophyte fromOxytropiskansuensis[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2009,37(2):40-46,51.(in Chinese)
[14] YU Y T,ZHAO Q M,WANG J N,et al.Swainsonine-producing fungal endophytes from major locoweed species in China[J].Toxicon,2010,56(3):330-338.
[15] BRAUN K,COOK T,LIDDELLC M.Locoism of cattle caused by a species ofAlternaria[J].Phytopathology,1997,87:S11-S12.
[16] BRAUN K.Fungal endophyte infection and swainsonine toxi city in locoweed[D].Las Cruces,N.M :New Mexico State University,1999.
[17] BRAUN K,ROMERO J,LIDDELL C,et al.Production of swainsonine by fungal endophytes of locoweed[J].MycolRes,2003,107(8):980-988.
[18] WANG Q,NAGAO H,LI Y,et al.Embellisiaoxytropis,a new species isolated fromOxytropiskansuensis in China[J].Mycotaxon,2006,95:255-260.
[19] 卢 萍.内蒙古三种棘豆属植物中苦马豆素相关因子的研究[D].呼和浩特 :内蒙古农业大学,2007. LU P.Factors related to swainsonine in threeOxytropisspecies in Inner Mongolia[D].Huhehaote:Inner Mongolia Agricultural University,2007.(in Chinese)
[20] PRYOR B,CREAMER R,SHOEMAKER R,et al.Undifilum,a new genus for endophyticEmbellisiaoxytropisand parasiticHelminthosporiumbornmuellerion legumes[J].Botany,2009,87(2):178-194.
[21] OLDRUP E,MCLAINROMERO J,PADILLA A,et al.Localization of endophyticUndifilumfungi in locoweed seed and influence of environmental parameters on a locoweed in vitro culture system[J].Botany,2010,88(5):512-521.
[22] HARRIS T M,HARRIS C M,HILL J E,et al.(1S,2R,8aS)-1,2-Dihydroxyindolizidine formation byRhizoctonialeguminicola,the fungus that produces slaframine and swainsonine[J].JOrgChem,1987,52(14):3094-3098.
[23] HARRIS C M,SCHNEIDER M J,UNGERMACH F S,et al.Biosynthesis of the toxic indolizidine alkaloids slaframine and swainsonine inRhizoctonialeguminicola:metabolism of 1-hydroxyindolizidines[J].JAmChemSoc,1988,110(3):940-949.
[24] HARRIS C,CAMPBELL B,MOLYNEUX R,et al.Biosynthesis of swainsonine in the Diablo locoweed(Astragalusoxyphysus)[J].TetrahedronLett,1988a,29(38):4815-4818.
[25] WICKWIRE B M,HARRIS C M,HARRIS T M,et al.Pipecolic acid biosynthesis in Rhizoctonia leguminicola.I.The lysine saccharopine,delta 1-piperideine-6-carboxylic acid pathway[J].JBiolChem,1990,265(25):14742-14747.
[26] WICKWIRE B M,WAGNER C,BROQUIST H P.Pipecolic acid biosynthesis inRhizoctonialeguminicola.II.Saccharopine oxidase:a unique flavin enzyme involved in pipecolic acid biosynthesis[J].JBiolChem,1990,265(25):14748-14753.
[27] 路宏朝,杨鸣琦,朱晓飞,等.金龟子绿僵菌发酵代谢物中苦马豆素的初步研究[J].西北农业学报,2006,15(4):70-72. LU H Z,YANG M Q,ZHU X F,et al.Preliminary study of swainsoine from metabolism products of theMetarhiziumanisopliae[J].ActaAgriculturaeBoreali-occidentalisSinica,2006,15(4):70-72.(in Chinese)
[28] SIM K,PERRY D.Analysis of swainsonine and its early metabolic precursors in cultures ofMetarhiziumanisopliae[J].GlycoconjJ,1997,14:661-668.
[29] 李海利.产苦马豆素疯草内生真菌蛋白质双向电泳及蛋白质组学研究[D].杨凌:西北农林科技大学,2012. LI H L.Studies on the two-dimensional gel electrophoresis and proteomic of locoweed endophytic fungi synthesizing swainsonine[D].Yangling:Northwest A&F University,2012.(in Chinese)
[30] MUKHERJEE S,DAWE A L,CREAMER R.Potential role for saccharopine reductase in swainsonine metabolism in endophytic fungus,Undifilumoxytropis[J].FungalBiol,2012,116(8):902-909.
[31] MUKHERJEE S,DAWE A L,CREAMER R.Development of a transformation system in the swainsonine producing,slow growing endophytic fungus,Undifilumoxytropis[J].JMicrobiolMeth,2010,81(2):160-165.
[32] 杨国栋.疯草内生真菌合成苦马豆素的研究[D].杨凌:西北农林科技大学,2012. YANG G D.Study on biosynthesis of swainsonine by the locoweed’s endophytic fungi[D].Yangling:Northwest A&F University,2012.(in Chinese)
[33] OLDRUP W E.Determining the influence of environmental parameters on swainsonine production inOxytropissericeaand its fungal endophyte[D].Las Cruces:New Mexico State University,2005.
[34] 张蕾蕾,何生虎,余永涛,等.宁夏黄花棘豆中产苦马豆素内生真菌的分离及鉴定[J].中国畜牧兽医,2013,40(12):77-84. ZHANG L L,HE S H,YU Y T,et al.Isolation and identification of swainsonine-producing fungal endophyte from Oxytropis ochrocephala Bunge in Ningxia[J].ChinaAmimalHusbandry&VeterinaryMedicine,2013,40(12):77-84.(in Chinese)
[35] 张 静,崔 颖,孙 尧,等.不同程度干旱胁迫对油菜种子萌发及幼苗生长特性的影响[J].干旱地区农业研究,2011,29(2):164-167. ZHANG J,CUI Y,SUN X,et al.Effect of different degree of drought stress on germination and seedling growth of rapeseed (BrassicanapusL.)[J].AgriculturalResearchintheAridAreas,2011,29(2):164-167.(in Chinese)
[36] 丁 振,贾士儒,王文哲,等.聚乙二醇(PEG) 模拟干旱胁迫对液体悬浮培养发状念珠蓝细菌生长及生理生化的影响[J].中国酿造,2012,31(8):82-84. DING Z,JIA S R,WANG W Z,et al.Response ofNostocflagelliformein liquid suspension culture to polyethylene glycol (PEG) simulated drought stress[J].ChinaBrewing,2012,31(8):82-84.(in Chinese)
[37] RALPHS M H,CREAMER R,BAUCOM D,et al.Relationship between the endophyteEmbellisiaspp.and the toxic alkaloid swainsonine in major locoweed species(AstragalusandOxytropis)[J].JChemEcol,2008,34(1):32-38.
[38] COOK D,GARDNER D R,RALPHS M H,et al.Swainsonine concentrations and endophyte amounts ofUndifilumoxytropisin different plant parts ofOxytropissericea[J].JChemEcol,2009,35(10):1272-1278.
[39] COOK D,GARDNER D R,GRUM D,et al.Swainsonine and endophyte relationships inAstragalusmollissimusandAstragaluslentiginosus[J].JAgricFoodChem,2011,59(4):1281-1287.
[40] RALPHS M H,COOK D,GARDNER D R,et al.Transmission of the locoweed endophyte to the next generation of plants[J].FungalEcol,2011,4(4):251-255.
[41] 袁志林,章初龙,林福呈.植物与内生真菌互作的生理与分子机制研究进展[J].生态学报,2008,28(9):4431-4438. YUAN Z L,ZHANG C L,LIN F C.Recent advances on physiological and molecular basis of fungal endophyte-plant interactions [J].ActaEcologicaSinica,2008,28(9):4431-4438.(in Chinese)
[42] TAMERLER C,ULLAH M,ADLARD M W,et al.Effect of pH on physiology ofMetarhiziumanisopliaefor production of swaisonine[J].FEMSMicrobiolLett,1998,168(1):17-23.
[43] 熊 强,徐 晴,顾 帅,等.丝状真菌形态控制及其在发酵过程优化中的应用[J].生物工程学报,2012,28(2):178-190. XIONG Q,XU J,GU S,et al.Controlling the morphology of filamentous fungi for optimization of fermentation process [J].ChineseJournalofBiotechnology,2012,28(2):178-190.(in Chinese)
(编辑 白永平)
Influence of Different Factors on Swainsonine Production in Fungal Endophyte from Locoweed
ZHANG Lei-lei1,YU Yong-tao1*,HE Sheng-hu1,ZHAO Qing-mei2,3,GE Song1
(1.CollegeofAgronomyNingxiaUniversity,Yinchuan750021,China; 2.CollegeofBiologicalScienceandEngineering,BeifangUniversityofNationalities,Yinchuan750021,China; 3.KeyLaboratoryofFermentationBrewingEngineeringandBiotechnologyofStateNationalitiesAffairsCommission,Yinchuan750021,China)
The research was conducted to screen the influence factors on swainsonine production in fungal endophyte,Undifilumoxytropis,from locoweed.U.oxytropiswere inoculated in liquid medium of different pH or containing different concentration of PEG,L-pipecolic acid,L-lysine and ɑ-ketoglutaric acid,respectively.To estimate the influence of different factors on swainsonine production inU.oxytropis,the swainsonine of cultured fungal mycelia and zymotic fluid were extracted and detected after shaking culture.The results showed that low pH (pH4.5) inhibit significantly (P<0.05) the synthesis of swainsonine in fungi.With the increase of PEG in culture medium,the production of swainsonine in fungi was also inhibited significantly (P<0.01).When the fungi were inoculated respectively in liquid medium that contained equivalent concentration (10-3mol·L-1) of L-pipecolic acid,L-lysine or ɑ-ketoglutaric acid,the production of swainsonine was inhibited significantly (P<0.05) in the group added L-pipecolic acid.However,the yield of swainsonine were increased significantly(P<0.05) in the group added L-lysine.When the initial concentration of L-pipecolic acid was 10-3and 10-2mol·L-1,the production of swainsonine inU.oxytropiswas inhibited significantly (P<0.05).However,when the initial concentration of L-pipecolic acid was 10-4mol·L-1,the yield of swainsonine inU.oxytropiswas increased significantly (P<0.01).When the initial concentration of L-lysine was 10-1,10-2and 10-4mol·L-1,the production of swainsonine inU.oxytropiswas inhibited significantly (P<0.05).When the initial concentration of ɑ-ketoglutaric acid was 10-1,10-2and 10-3mol·L-1,the production of swainsonine inU.oxytropiswas inhibited significantly(P<0.05).Low pH or PEG added to medium could significantly inhibit the production of swainsonine inU.oxytropis.It was significant that the influence of L-pipecolic acid,L-lysine and ɑ-ketoglutaric acid on the swainsonine producing of fungal endophyte.However,the extent of influence on fungal swainsonine producing was highly correlated with the concentration of L-pipecolic acid,L-lysine and ɑ-ketoglutaric in liquid media.
locoweed;fungal endophyte;Undifilumoxytropis;swainsonine;biosynthesis
10.11843/j.issn.0366-6964.2015.01.021
2014-05-05
国家自然科学基金(31201962);宁夏自然科学基金(NZ1118)
张蕾蕾(1989- ),女,陕西渭南人,硕士生,主要从事兽医临床诊断技术研究,E-mail:andybeilei@163.com
*通信作者:余永涛(1980- ),男,宁夏平罗人,副教授,博士,硕导,主要从事动物中毒病与营养代谢病研究,E-mail:yyt1211@163.com
S852.66
A
0366-6964(2015)01-0163-11
