牦牛Ihh基因组织表达分析、SNP检测及其基因型组合与生产性状的关联分析
2015-03-22李天科赵娟花梁春年
李天科,赵娟花,裴 杰,梁春年,郭 宪,秦 文,阎 萍*
(1.中国农业科学院兰州畜牧与兽药研究所,兰州 730050;2.甘肃省牦牛繁育工程重点实验室,兰州 730050; 3.甘肃农业大学动物科学技术学院,兰州 730070)
牦牛Ihh基因组织表达分析、SNP检测及其基因型组合与生产性状的关联分析
李天科1,2,3,赵娟花1,2,裴 杰1,2,梁春年1,2,郭 宪1,2,秦 文1,2,3,阎 萍1,2,3*
(1.中国农业科学院兰州畜牧与兽药研究所,兰州 730050;2.甘肃省牦牛繁育工程重点实验室,兰州 730050; 3.甘肃农业大学动物科学技术学院,兰州 730070)
为了研究牦牛Ihh基因多态位点基因型组合与生产性状间的相关性,发现与牦牛生产性状相关的分子标记,同时进一步研究Ihh基因在牦牛和黄牛各个组织的分布和表达,试验采用高分辨率熔解曲线分析技术(High resolution melting curve,HRM)进行基因型分型和统计等位基因频率,同时,运用荧光定量PCR 分析Ihh基因在牦牛和黄牛不同器官的表达差异。试验结果表明,Ihh基因在牦牛和黄牛的所有组织中均表达。然后采用SHEsis和PHASE软件对Ihh基因多态位点进行配对连锁不平衡和单倍型分析,采用SPSS17.0进行多态位点单倍型组合与生产性状关联性分析。结果检测到牦牛Ihh基因外显子3的 2个多态位点5855(C/T)和6383(G/A)。群体遗传学分析显示,2个多态位点均表现为高度多态(PIC>0.25);χ2检验表明,甘南牦牛和大通牦牛群体在两个突变位点处于Hardy-Weinberg平衡状态(P>0.05),而天祝牦牛在2个突变位点处未达到Hardy-Weinberg平衡(P<0.05);多态位点配对连锁不平衡分析发现,2个突变位点之间存在强连锁平衡,有4种单倍型组合;基因型组合主要发现了3种。关联分析表明,Ihh基因2个突变位点的3种基因型组合对牦牛体斜长、体高、胸围、管围和体重有显著差异(P<0.05),具有CTGA基因型组合的牦牛个体在体斜长、体高、胸围、管围和体重方面显著高于CCGG和TTAA型(P<0.05)。因此,综上推断Ihh基因基因型组合与牦牛体斜长、体高、胸围、管围和体重存在相关性。
牦牛;Ihh基因;多态性;高分辨率熔解曲线;生产性状;荧光定量;基因表达
骨骼是脊椎动物整个身体的支架,它们不仅保护邻近器官,而且保证了机体的自由运动,它们的位置、形状和尺寸基本决定了动物体格的大小。Indian hedgehog(印度豪猪因子,Ihh)是一个主要的骨发育调节因子,它对于协调软骨细胞的增殖,软骨细胞的分化和造骨细胞的分化等软骨内骨发育过程是必须的[1-6]。研究发现,Ihh属于一个非常保守的Hedgehog(Hh)分泌信号家族,在脊椎动物中存在其2种同源基因:Sonic Hedgehog(音速豪猪因子,Shh)和Desert Hedgehog(沙漠豪猪因子,Dhh)[7]。Hedgehog 信号最早是在 1980年从果蝇体内分离得到[8], Hedgehog 的突变可使果蝇胚胎发育成毛团状,酷似刺猬,故又被称为刺猬基因[9]。
Ihh是细胞分泌的一种重要的多肽,由 2 个结构域组成:氨基端结构域(Hh-N)和羧基端结构域(Hh-C),而且高度保守,具有独特的生物活性[10-11]。回顾与Ihh基因相关的一些研究,可以了解到,Ihh在软骨细胞和成骨细胞的增殖和分化中起调节作用[12],进一步研究发现,Ihh在成骨细胞中也有表达[13];K.K.Mak等[14-15]研究发现,Ihh 既可以单独作用于软骨分化,又可以协同PTHrP(甲状旁腺素相关肽) 形成负反馈轴机制,从而维持骨的稳定生长。另也有研究表明,Ihh也在妊娠过程中介导胚胎的植入,敲除Ihh基因后小鼠不能受孕[16]。表达试验表明,Ihh在小鼠妊娠第3.5~5.5天的子宫内膜腔上皮和腺上皮呈高水平表达[17],且分泌期子宫内膜Ihh基因表达明显高于增殖期[18]。Ihh基因突变方面的研究主要集中在人和小鼠上,Ihh基因突变的小鼠表现出个体矮小和典型的A1型短指/趾症表型[19];在人上Ihh的突变主要造成并趾和短指[20],这都说明Ihh基因与指骨关节发育密切相关;另外,G.Lettre等研究发现Ihh基因的单核苷酸多态性也是人身高差异的主要因素[21]。
目前,对Ihh基因的相关研究主要集中在人和小鼠上,而在家畜方面,关于Ihh基因的研究尚未见报道,鉴于Ihh基因在人和小鼠中具有重要的功能,在牦牛中开展对该基因的相关研究就显得尤为重要。鉴于此,笔者从分子水平入手,初步筛查出Ihh基因多态位点,并进行多态位点基因型组合与生产性状的相关性分析,找到与生产性状相关的DNA标记,为牦牛新品种的选育提供科学依据;同时,以荧光定量PCR法分析了Ihh基因在牦牛和黄牛不同器官的表达差异,为进一步研究Ihh基因在牦牛体内的分布、表达奠定基础。
1 材料与方法
1.1 试验材料
用于表达谱分析的组织样品采自于6头成年甘南牦牛和6头成年黄牛的心、肝、脾、肺、肾、肌肉、小肠和胰,取样后立即投入液氮中,回实验室后-80 ℃保存。用GIBCO公司的TRIZOL Reagent 提取组织总RNA,用分光光度计测定其浓度,将RNA稀释至1 μg·μL-1备用,cDNA第一链的合成参考TaKaRa反转录试剂盒说明书进行。
用于遗传多样性分析的全血样品采自3个中国地方牦牛品种(包括6月龄的甘南牦牛200头、6~9月龄的大通牦牛203头和2~3岁的天祝牦牛208头),颈静脉采血10 mL,ACD抗凝(V(血液)∶V(ACD)=6∶1),轻微震荡混匀后,-20 ℃保存备用。利用Relax Gene血液基因组DNA提取系统(天根,北京)提取基因组DNA,采用1%的琼脂糖凝胶电泳检测DNA的质量,使用NANO DROP 2000(Thermo,美国)检测提取的DNA浓度并抽取20 μL稀释到18~22 ng·μL-1作为PCR扩增模板,其余母液保存于-80 ℃。实地测量4项体尺指标(体斜长、体高、胸围、管围)和体重。
1.2 组织表达分析
1.2.1 组织表达谱引物 根据NCBI网站中黄牛Ihh基因的 mRNA(登录号:NM_001076870),利用Pimer5设计定量PCR引物(表1),内参引物选用文献中牦牛GAPDH引物[22],引物由TaKaRa公司合成。
表1Ihh基因定量分析引物信息
Table 1 Information of primer sequences for relative analysis within yakIhhgene
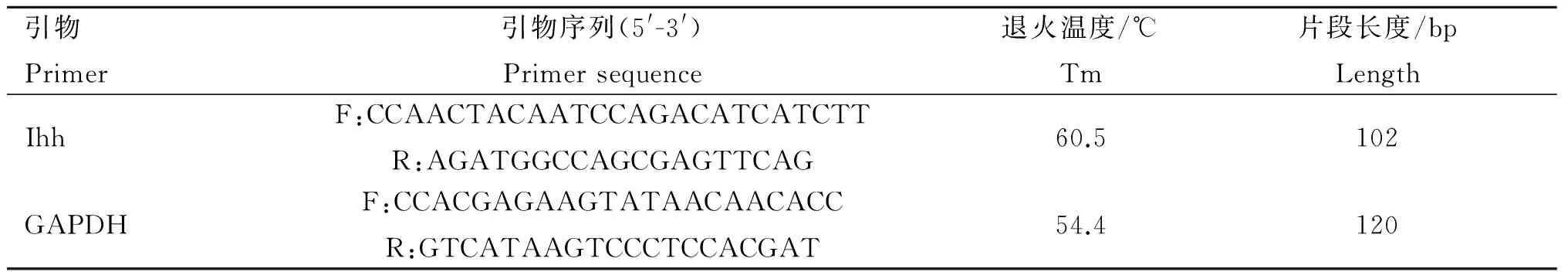
引物Primer引物序列(5'-3')Primersequence退火温度/℃Tm片段长度/bpLengthIhhF:CCAACTACAATCCAGACATCATCTTR:AGATGGCCAGCGAGTTCAG60.5102GAPDHF:CCACGAGAAGTATAACAACACCR:GTCATAAGTCCCTCCACGAT54.4120
1.2.2 荧光定量PCR 反应体系(10 μL):2 μL RT产物,5 μL SYBR Green荧光染料,上下游引物各1 μL,1 μL ddH2O。反应程序:95 ℃预变性30 s;95 ℃ 5 s,退火温度退火30 s,62 ℃ 30 s,40个循环;于60 ℃采集荧光,采用默认设置自动生成Ct值。采用2-△△Ct法[22-23],用GAPDH作为内参基因对各样本用实时定量PCR结果进行校正处理,并以胰腺表达量作为校正者,计算各样本Ihh基因的相对表达水平。每个样本3个重复,取平均值。
1.3 PCR扩增
1.3.1 SNP检测 参考NCBI数据库牛的Ihh基因(登录号:NP_001070338),并结合牦牛全基因组测序的序列,采用交叉重叠原理[24]设计4对引物对Ihh基因外显子序列进行扩增(表2),引物由上海生物工程股份有限公司合成。
PCR扩增体系(25 μL):包括约20 ng·μL-1的基因组DNA 1 μL,10 pmol的上下游引物各1 μL,2×Taq PCR MasterMix(内含TaqDNA聚合酶、Mg2+、dNTPs等)(北京,天根)12.5 μL,灭菌超纯水9.5 μL。PCR反应程序:95 ℃预变性3 min;94 ℃变性30 s,复性30 s(退火温度见表2),72 ℃延伸(时间见表2),35个循环;72 ℃延伸10 min;4 ℃保存。
表2 鉴定牦牛Ihh基因突变位点所用引物信息表
Table 2 Information of primer sequences for scanning SNPs within yakIhhgene
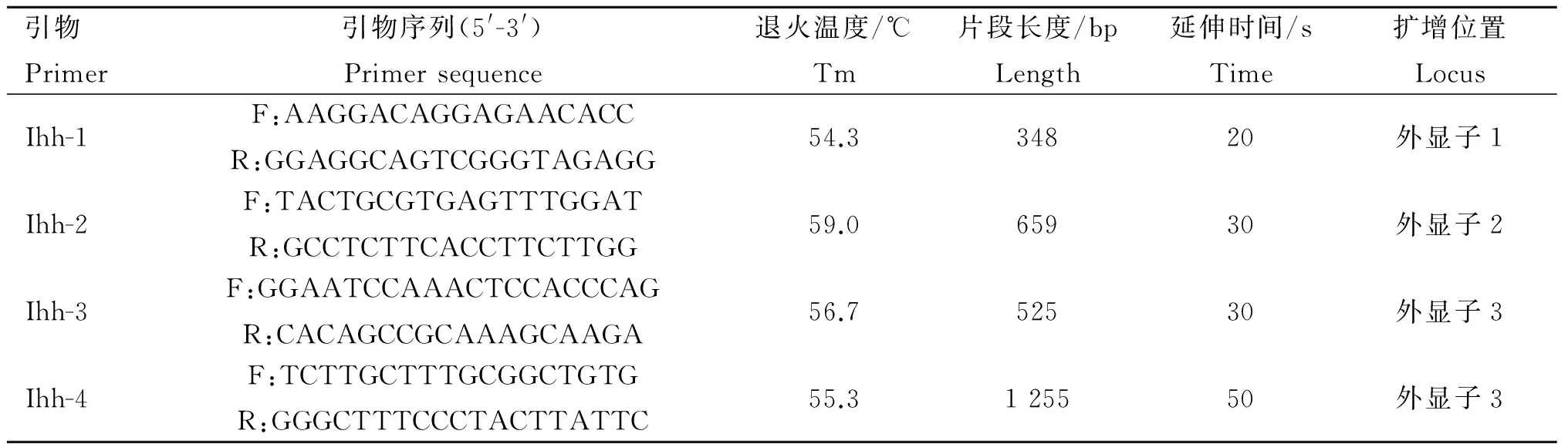
引物Primer引物序列(5'-3')Primersequence退火温度/℃Tm片段长度/bpLength延伸时间/sTime扩增位置LocusIhh-1F:AAGGACAGGAGAACACCR:GGAGGCAGTCGGGTAGAGG54.334820外显子1Ihh-2F:TACTGCGTGAGTTTGGATR:GCCTCTTCACCTTCTTGG59.065930外显子2Ihh-3F:GGAATCCAAACTCCACCCAGR:CACAGCCGCAAAGCAAGA56.752530外显子3Ihh-4F:TCTTGCTTTGCGGCTGTGR:GGGCTTTCCCTACTTATTC55.3125550外显子3
1.3.2 DNA测序分析和HRM小片段法基因分型[24-25]PCR扩增产物通过琼脂糖凝胶回收试剂盒(天根,北京)回收纯化送往大连宝生工生物工程有限公司进行测序,测序结果通过DNASTAR软件比对分析。针对所发现的多态位点,利用Light Scanner Primer Design Software(Idaho公司,美国)设计出用于HRM(High Resolution Melting,高分辨率熔解曲线)分析多态位点的引物(表3),对试验群体样本进行基因型分析。合成1对高低温内标[26](表4)对熔解曲线进行校正,提高分型的精确度。
HRM-PCR扩增体系(11 μL):包括20 ng·μL-1的基因组DNA 1 μL,10 pmol的上下游引物各0.2 μL,2×Taq PCR MasterMix(内含TaqDNA聚合酶、Mg2+、dNTPs等)(北京,天根)5 μL,灭菌超纯水3.6 μL,10×LC Green饱和染料(美国,Idaho)1 μL。HRM-PCR反应程序:95 ℃预变性5 min;94 ℃变性20 s,Tm(℃)(表3)退火20 s,72 ℃延伸20 s,35个循环;72 ℃延伸10 min。
高低温内标稀释方法:1 OD内标单链加400 μL水,退火体系:饱和氯化钠1 μL,内标互补双链各1 μL,补水至10 μL,95 ℃水浴3 min,然后缓慢降至室温。
HRM荧光信号采集:将稀释好的高低温内标各1 μL加入HRM-PCR产物单孔中,95 ℃变性30 s,放入Light Scanner 96(美国,Idaho)中收集荧光信号。
表3 HRM分析多态位点的引物信息表
Table 3 Information of primer sequences for genotyping mutations by HRM

检测位点Loci引物序列(5'-3')Primersequence退火温度/℃Tm片段长度/bpLength5855(C/T)F:GCAGCTGTCTCCACGCACF:ACCACATCCTCCACCACC64.41126383(G/A)F:GTCCCAACCCAGCCAGCCF:GCAAGCCCACCCAAGAGG65.596
表4 高低温内标序列信息表
Table 4 Information of low and high calibrator sequence

高低温内标LowandhighcalibratorTm/℃内标序列(5'-3')CalibratorLow269.85GCGGTCAGTCGGCCTAGCGGTAGCCAGCTGCGGCACTGCGTGACGCTCAG-C3High287.92ATCGTGATTTCTATAGTTATCTAAGTAGTTGGCATTAATAATTTCATTTT-C3
1.4 数据统计
各组织中表达量的差异用独立样本t检验进行分析。多态性根据群体遗传学理论直接计算得到基因型和等位基因频率,统计牦牛群体Ihh基因多态位点的纯和度Ho、杂合度He、有效等位基因数Ne、多态信息含量PIC[27-29],并进行Hardy-Weinberg 平衡检验。采用SPSS17.0软件对Ihh基因多态性位点在不同牦牛群体中的基因型分布进行卡方检测,考虑到品种、性别、环境和年龄因素的影响,采用固定模型分析基因型效应对生产性状的影响。
固定模型:Yijklm=u+Gi+Sj+Ak+Bl+Em+εijklm。
式中,Yijklm为个体表型记录,u为群体均值,Gi为标记基因型效应,Sj为性别因素,Ak为年龄因素,Bl为品种效应,Em为环境因素,εijklm为随机误差。
2 结 果
2.1 牦牛Ihh基因的组织表达谱分析
利用实时定量PCR对牦牛和黄牛Ihh基因在心、肌肉、小肠、肺、肾、肝、卵巢和胰各个组织的表达情况进行检测,结果见图1。Ihh基因在牦牛和黄牛所研究的组织中均表达,其中在牦牛肝中的表达量显著高于黄牛(P<0.05);在牦牛和黄牛的卵巢、肺、肾和胰组织中中度表达,在心、脾和肌肉组织中牦牛和黄牛表达量都相对低。
2.2 牦牛Ihh基因HRM方法的分型
通过DNA混合池对牦牛Ihh基因测序后,应用MEGA.5软件对拼接得到的Ihh基因序列与黄牛序列进行比对,并结合测序峰图可知,牦牛Ihh基因外显子3上存在5855(C/T)和6383(G/A)的多态位点(图2),应用高分辨率熔解曲线对多态位点进行基因型分析,结果如图3所示。
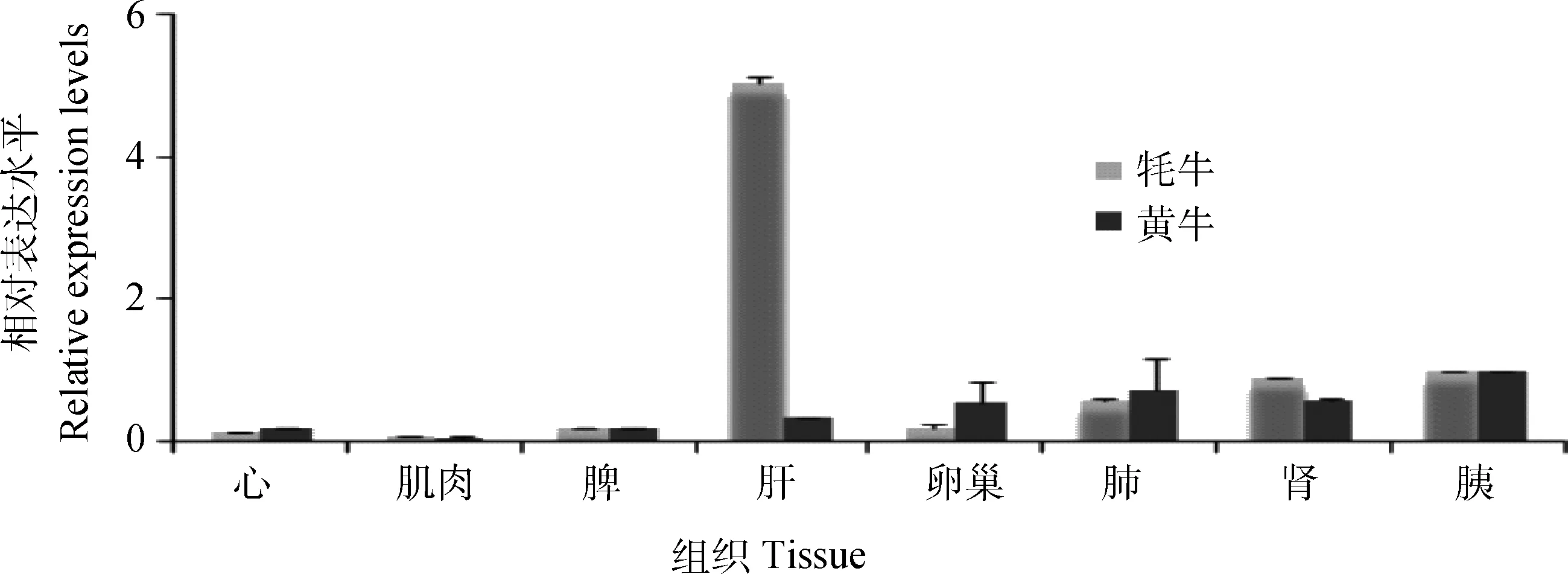
图1 Ihh 基因在牦牛和黄牛不同组织器官的表达模式Fig.1 Transcript levels of Ihh gene by quantitative real-time PCR in cattle and yak
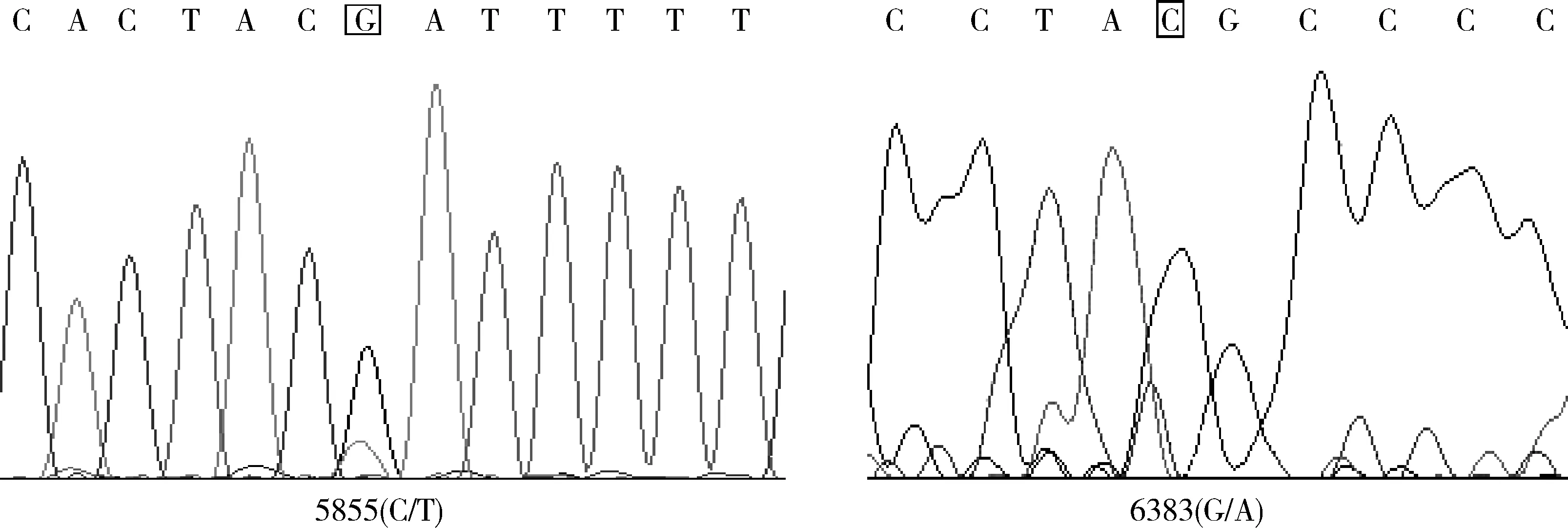
图2 2个多态位点的测序峰图Fig.2 The sequencing peak graph of 2 loci
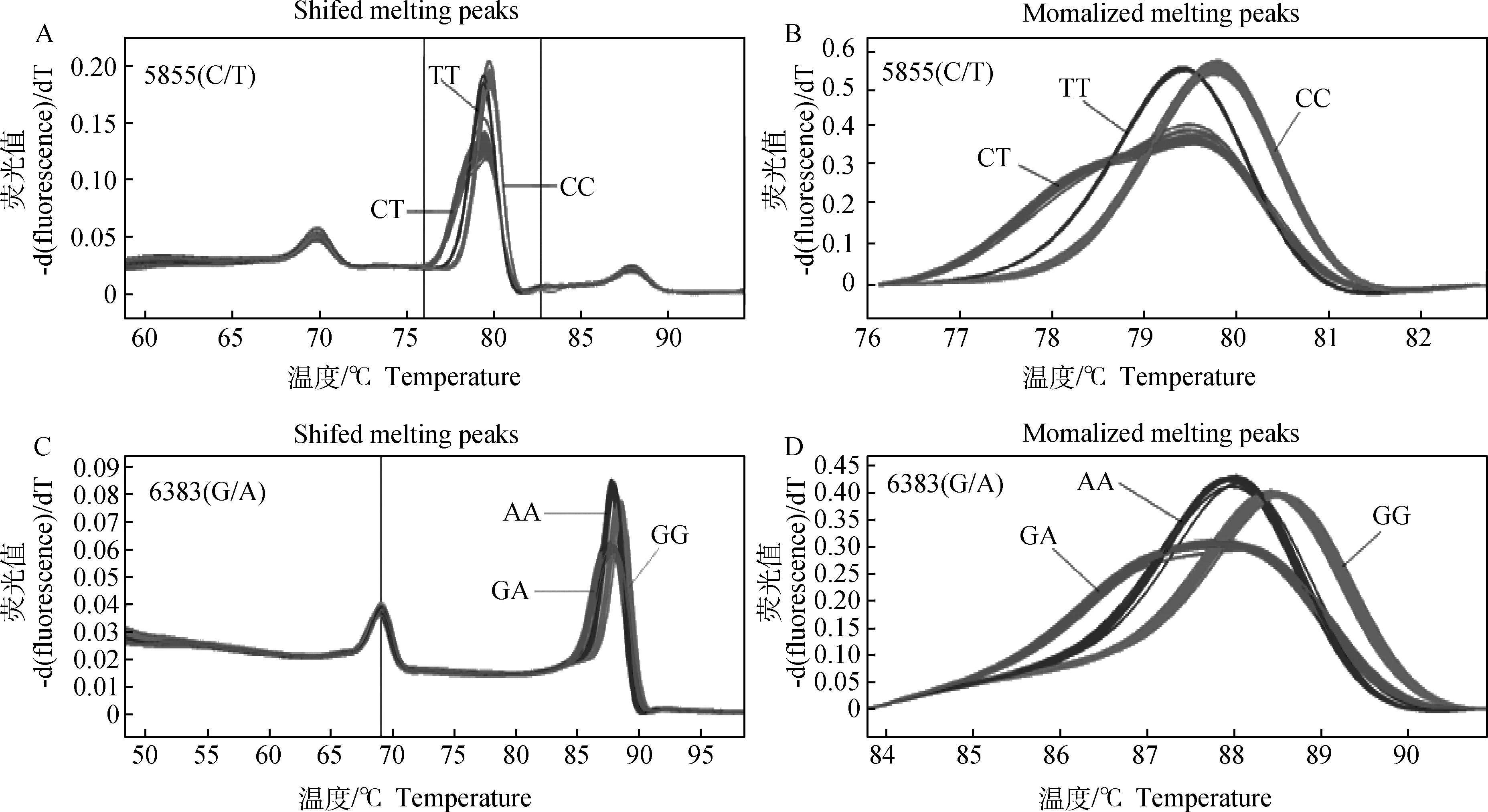
图3 2个多态性位点HRM分型曲线Fig.3 The HRM analysis at 2 loci
5855(C/T)基因型判定:扩增包含多态性位点在内的112 bp的DNA片段,然后将扩增通过Light Scanner(美国,Idaho)扫描分型,其基本原理是通过LC Green饱和染料和DNA进行结合,然后通过Light Scanner高分辨率分析系统升温,并收集荧光信号得到熔解曲线,在熔解曲线形成过程中,由于核酸分子物理性质的不同,从而导致熔解曲线的不同,达到区分不同样品的目的。结果表明,熔解曲线分析有3种基因型:CC、CT和TT(图3A)。统计分析发现,CC基因型属于优势基因型,个体数明显多于其他基因型。
6383(G/A) 基因型判定:扩增包含多态性位点在内的98 bp的DNA片段,然后将扩增通过Light Scanner(美国,Idaho)扫描,通过熔解曲线分析出有3种基因型,GG、GA和AA(图3B)。 统计分析发现,GG基因型属于优势基因型,个体数明显多于其他基因型。
2.3 不同牦牛群体Ihh基因多态位点遗传多态性的分析
2.3.1 不同牦牛群体Ihh基因突变位点的基因型频率和等位基因频率 在Ihh基因5855(C/T)突变位点处,3个牦牛品种的优势等位基因为C(表5);在Ihh基因6383(G/A)突变位点处,3个牦牛品种的优势等位基因为G(表5),它们的等位基因频率基本均在0.7以上。
表5Ihh基因突变位点5855(C/T)和6383(G/A)的基因型及等位基因频率
Table 5 Genotypes and allele frequence of 5855(C/T) and 6383(G/A) in theIhhgene
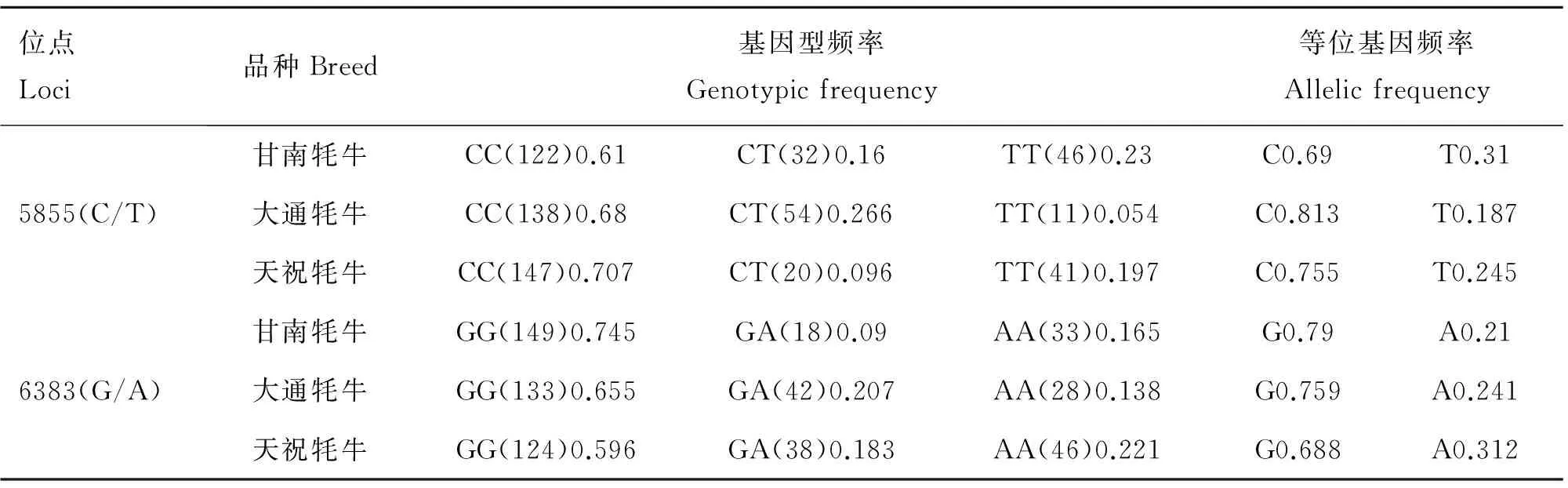
位点Loci品种Breed基因型频率Genotypicfrequency等位基因频率Allelicfrequency5855(C/T)甘南牦牛CC(122)0.61CT(32)0.16TT(46)0.23C0.69T0.31大通牦牛CC(138)0.68CT(54)0.266TT(11)0.054C0.813T0.187天祝牦牛CC(147)0.707CT(20)0.096TT(41)0.197C0.755T0.2456383(G/A)甘南牦牛GG(149)0.745GA(18)0.09AA(33)0.165G0.79A0.21大通牦牛GG(133)0.655GA(42)0.207AA(28)0.138G0.759A0.241天祝牦牛GG(124)0.596GA(38)0.183AA(46)0.221G0.688A0.312
2.3.2 不同牦牛群体Ihh基因群体遗传特性 多态位点5855(C/T)在甘南牦牛和大通牦牛群体中,表现为高度多态(PIC>0.5),天祝牦牛表现为中度多态(0.5
表6Ihh基因突变位点5855(C/T)和6383(G/A)的遗传多态性
Table 6 Genetic diversity of 5855(C/T) and 6383(G/A) of theIhhgene

位点Loci品种Breed纯合度Homozygosity杂合度Heterozygosity有效等位基因数Effectiveallelenumbers多态信息含量PolymorphicinformationcontentHWE卡方χ2P值Pvalue5855(C/T)甘南牦牛0.4250.5752.3530.5360.073P<0.01大通牦牛0.4650.5352.1510.5320.436P<0.05天祝牦牛0.5390.4611.8550.4222.404P>0.056383(G/A)甘南牦牛0.5820.4181.7180.3881.679P<0.05大通牦牛0.4480.5522.2320.5360.657P<0.05天祝牦牛0.4040.5962.4750.5612.674P>0.05
2.4 不同牦牛群体Ihh基因不同基因型组合与体尺性状的关联性分析
对各牦牛群体Ihh基因各多态位点进行HRM分型统计后,运用SHEsis软件进行位点间的连锁不平衡分析,2个位点间可能存在强连锁不平衡(D’>0.75,r2>0.33);同时,在3个牦牛群体中发现了4种单倍型组合(表7)。参照鲍斌等[30]研究方法从基因型组合角度出发,选取3个牦牛群体中共同的基因型组合CCGG、TTAA和CTGA(表8)运用SPSS17.0软件分析这3种基因型组合与生长性状的相关性。由表9可知,甘南牦牛基因型组合对体重有显著影响(P<0.05),对体长、体高、胸围和管围差异不显著(P>0.05);由表9可知,大通牦牛基因型组合对体长、体高、胸围、管围和体重都有显著影响(P<0.05);由表9可知,天祝牦牛基因型组合对胸围和体重有显著影响(P<0.05),而在体长、体高和管围方面差异不显著(P>0.05)。总体比较发现CTGA基因型组合在各个牦牛群体中都具有较高的生产性状。
表7 牦牛Ihh基因多态位点的分布及频率
Table 7 The haplotype frequencies and distribution of SNPs inIhhgene

品种Breed单倍型组合HaplotypecombinationCGTACATG甘南牦牛286(0.688)71(0.177)26(0.064)0大通牦牛303(0.748)102(0.245)28(0.067)4(0.010)天祝牦牛274(0.685)82(0.205)2(0.005)42(0.105)
表8 牦牛Ihh基因突变位点5855(C/T)和6383(G/A)基因型组合
Table 8 Genotype at theIhhgene for the 5855(C/T) and 6383(G/A) SNPs in yak populations
表9 甘南牦牛、大通牦牛和天祝牦牛Ihh基因不同基因型组合与生产性状关联分析
Table 9 Association of differentIhhgenotypes combinations with production traits in Gannan,Datong and Tianzhu yaks

品种Breed基因型Genotype体长/cmBodylenghth体高/cmBodyheight胸围/cmChestgirth管围/cmTubegirth体重/kgWeight甘南牦牛CCGG(122)83.91±0.81985.54±0.998106.79±1.09911.66±0.13786.74±3.133aCTGA(5)83.60±0.66885.57±0.727107.49±1.74111.59±0.11285.66±1.622aTTAA(32)82.77±1.13884.46±0.090104.18±1.79111.78±0.13978.05±1.715b大通牦牛CCGG(119)85.86±0.971a85.32±0.725a113.97±1.186a11.88±0.047a72.71±1.238abCTGA(15)86.96±0.621a86.61±0.604b109.87±1.006b11.91±0.066ab76.60±2.023aTTAA(41)84.10±0.758b85.77±0.691a109.56±1.145b12.06±0.057b70.92±1.531b天猪牦牛CCGG(139)113.50±0.391110.4±0.654145.42±0.558A13.64±0.393210.48±1.455abCTGA(36)117.57±1.426114.08±0.753156.86±0.791C14.07±0.701223.42±1.126aTTAA(7)115.87±0.419109.43±1.485150.75±0.8865B13.55±0.202196.37±0.871b
同列相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下同
The same letters within the same column show no significant difference(P>0.05),the different letters show significant difference(P<0.05).The same as below
3 讨 论
在长骨发育过程中,Ihh主要表达在肥大软骨细胞区域。Ihh基因敲除的小鼠显示出软骨细胞增殖减少,肥大软骨细胞增加和造骨细胞缺失等多方面的骨发育异常[31-32]。本试验研究的牦牛和黄牛的8个组织中,均检测到Ihh基因mRNA的表达,说明Ihh基因是黄牛和牦牛很多组织细胞功能所必需。
牛的生长性状属微效多基因控制的数量性状,常规的表型选择,精确性较差,遗传进展缓慢。而且关于调控牛生长的机理目前还不清楚,主效基因还没有确定,目前可能与生产性状有关的候选基因主要有GH[33]、GHR[34-35]和IGF[36-37]等,而牛的Ihh基因位于2号染色体107722665~107728939位置,通过与牛2号染色体上的 QTL数据(http://www.animalgenome.org/QTLdb/pubs.php)库进行比对发现,在包括Ihh基因在内的106.5~115.4 cm的QTL区域主要与体尺性状、产犊、结核病和乳房炎等性状有关,而且研究发现Ihh基因突变的小鼠(E95K突变)表现出个体矮小和典型的A1型短指/趾症表型—第2~第4 指中指节严重缩短,第5指中指节缺失[19],在人上Ihh基因的突变主要造成并趾和短指[20],这都证明Ihh基因与指骨关节发育密切相关。因此把Ihh基因作为影响牛生产性状的候选基因进行研究。
本试验通过DNA混合池测序得到甘南牦牛Ihh基因2个多态位点,均位于外显子3上,在群体中均存在3种基因型和2种等位基因, TT和AA分别为其优势基因型,其优势等位基因频率都达到了0.7以上,这可能与样本的品种、家系和自然环境有关系。按照D.Botstein等[29]提出衡量基因变异程度高低的多态信息含量指标(PIC)的标准,本试验中所检测到的2个多态位点杂合度及PIC值都在高等水平,故这2个多态位点均为高度多态,遗传变异高,选择余地大。 Hardy-Weinberg平衡检测表明,在2个突变位点处,甘南牦牛和大通牦牛均未达到哈代-温伯格平衡(P<0.05),这可能是因为甘南牦牛和大通牦牛较长期的人工选育,人为的因素为其不处于Hardy-Weinberg平衡的主要因素;而2个突变位点在天祝牦牛中均达到Hardy-Weinberg平衡(P>0.05),可能因牦牛种群是一个较为原始的封闭种群,长期处于闭锁繁育状态,从而处于动态平衡。
试验中对不同牦牛品种2个突变位点进行连锁不平衡分析后,发现2个突变位点有强连锁不平衡,统计发现了4种单倍型组合,发现了主要的3种基因型组合,对3种基因型组合与生产性状间的相关性分析表明,CCGG、CTGA和TTAA的3种基因型组合可能与牦牛的生产性状相关,而在这3种组合中,CTGA具有较高的生产性能,但在群体中数目少,需要加大人工选育。同时,这种相关性分析降低了单个突变位点受环境、其他位点和其他相关微效基因的影响[38],得到较可靠的基因型效应估计值,在评估品种和种群的遗传改良时更准确。
4 结 论
Ihh基因2个突变位点的3种基因型组合对牦牛体斜长、体高、胸围、管围和体重均有不同程度的影响,具有CTGA基因型组合的牦牛个体可能体型更大,因此,Ihh基因可以作为主效候选基因或与主基因紧密连锁的分子标记,将来可以尝试通过人工干预,扩大有利基因型组合个体的数目。
[1] 齐晓龙,王玉炯,吴 更.Hedgehog信号通路研究进展[J].中国细胞生物学学报,2013,35(8):1211-1220. QI X L,WANG Y J,WU G.Progress of study on hedgehog signaling pathway[J].ChineseJournalofCellBiology,2013,35(8):1211-1220.(in Chinese)
[2] VORTKAMP A,LEE K,LANSKE B,et al.Regulation of rate of cartilage differentiation by Indian hedgehog and PTH-related protein[J].Science,1996,273:613-622.
[3] ST JACQUES B,HAMMERSCHMIDT M,MCMAHON A P.Indian hedgehog signaling regulates proliferation and differentiation of chondrocytes and is essential for bone formation[J].GenesDev,1999,13:2072-2086.
[4] KARP S J,SCHIPANI E,ST JACQUES B,et al.Indian hedgehog coordinates endochondral bone growth and morphogenesis via parathyroid hormone related-protein-dependent and independent pathways[J].Development,2000,127:543-548.
[5] LONG F,ZHANG X M,KARP S,et al.Genetic manipulation of hedgehog signaling in the endochondral skeleton reveals a direct role in the regulation of chondrocyte proliferation[J].Development,2001,128:5099-5108.
[6] CHUNG U I,SCHIPANI E,MCMAHON A P,et al.Indian hedgehog couples chondrogenesis to osteogenesis in endochondral bone development[J].JClinInvest, 2001,107:295-304.
[7] 高耀祖,魏 垒,李鹏翠,等.Indian hedgehog 在软骨内成骨和骨关节炎中作用的研究进展[J].中国矫形外科杂志,2013,(17):1472-1475. GAO Y Z,WEI L,LI P C,et al.Progress of study on the role of Indian hedgehog in endochondral ossification and osteoarthritis[J].OrthopedicJournalofChina,2013,(17):1472-1475.(in Chinese)
[8] NUSSLEIN VOLHARD C,WIESCHAUS E.Mutations affecting segment number and polarity in Drosophila[J].Nature,1980,287(30):795-801.
[9] CHANG D T,LOPEZ A,VON KESSLER D P,et al.Products,genetic linkage and limb patterning activity of a murine Hedgehog gene[J].Development,1994,120(11):3339-3353.
[10] EHLEN E C,BUELENS L A,VORTKAM P.Hedgehog signaling in skeletal development[J].BirthDefectsResPartC,EmbryoTodayRev,2006,78(3):267-279.
[11] WEIR E D,PHILBRIEK W M,AMLING M,et al.Targeted overex pression of parathyroid hormone-related peptide in chondrocytes causes chondrodysplasia and delayed endochondral bone formation[J].ProcNatlAcadSciUSA,1996,93(19):10240-10245.
[12] JEMTLAND R,DIVIETI P,LEE K,et al.Hedgehog promotes primary osteoblast differentiation and increases PTHrP mRNA expression and iPTHrP secretion[J].Bone,2003,32(6):611-620.
[13] 韩 磊,张晓玲,李 晅,等.Hedgehog通路对成骨细胞增殖和分化的作用研究[J].上海口腔医学,2009,18(3):287-290. HAN L,ZHANG X L,LI X,et al.Hedgehog pathway is associated with the proliferation and differentiation of osteoblasts [J].ShanghaiJournalofStomatology,2009,18(3):287-290.(in Chinese)
[14] MAK K K,KRONENBERG H M,CHUANG P T,et al.Indian Hedgehog signals independently of PTHrP to promote chondrocyte hypertrophy[J].Development,2008,135(11):1947-1956.
[15] KOBAYASHI T,SOEGIARTO D W,YANG Y,et al.Indian hedgehog stimulates periarticular chondrocyte differentiation to regulate growth plate length independently of PTHrP[J].JClinInvest,2005,115(7):1734-1742.
[16] LEE K,JEONG J,KWAK I,et al.Indian Hedgehog is a major mediator of progesterone signaling in the mouse uterus[J].NatGenet,2006,38(10):1024-1029.
[17] KUBOTA K,YAMAUCHI N,YAMAGAMI K,et al.Steroidal regulation of Ihh and Gli-1 expression in the rat uterus[J].CellTissueRes,2010,340(2):389-395.
[18] WEI Q,LEVENS E D,STEFANSSON L,et al.Indian Hedgehog and its targets in human endometrium:menstrual cycle expression and response to CDB-2914[J].JClinInvest, 2010,95(12):5330-5337.
[19] GAO B,HU J,STRICKER S,et al.A mutation in Ihh that causes digit abnormalities alters its signalling capacity and range[J].Nature,2009,458(7242):1196-1200.
[20] McCREADY M E,SWEENEY E,FRYER A E,et al.A novel mutation in the IHH gene causes brachydactyly type A1:a 95-year-old mystery resolved[J].HumGenet,2002,(111):368-375.
[21] LETTRE G,JACKSON A U,GIEGER C,et al.Identification of ten loci associated with height highlights new biological pathways in human growth[J].NatGenet,2008,40(4):584-591.
[22] PEI J,LANG X,GUO X,et al.Expression profiles of growth hormone receptor and insulinlike growth factor I in cattle and yak tissues revealed by quantitative real-time PCR[J].ArchAnimBreed,2013,70:7482-7491.
[23] 李爱民,马 云,杨东英,等.鲁西牛ANGPTL6基因的3个多态位点与其生长性状的关联性分析[J].中国农业科学,2012,45(11):2306-2314. LI A M,MA Y,YANG D Y,et al.Association analysis of three SNPs within ANGPTL6 gene with growth traits in Luxi cattle[J].ScientiaAgriculturaSinica,2012,45(11):2306-2314.(in Chinese)
[24] MICHAEL L,ROBERT P,ROBERT P.Genotyping of single-nucleotide polymorphisms by high- resolution melting of small amplicons[J].MolDiagnostGenet,2004,50(7):1156-1164.
[25] YE M H,CHEN J L,ZHAO G P.Associations of A-FABP and H-FABP markers with the content of intramuscu -lar fat in Beijing-you chicken[J].AnimBiotechnol,2010,21:14-24.
[26] CAMERON N,STEVEN F.Base-pair neutral homozygotes can be discriminated by calibrated high resolution melting of small amplicons[J].NucleicAcidsRes,2008,1093(10):1-8.
[27] NEI M,ROYCHOUDHURY A K.Sampling variances of heterozygosity and genetic distance[J].Genetics,1974,76(2):379-390.
[28] NEI M,LI W H.Mathematical model for studying genetic variation in terms of restriction endonucleases[J].ProcNatlAcadSciUSA, 1979,76(10):5269-5273.
[29] BOTSTEIN D,WHITE R L,SKOLNICK M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].AmJHumGenet,1980,32(3):314-331.
[30] 鲍 斌,房兴堂,陈 宏,等.中国荷斯坦牛STAT5A基因遗传多态性与泌乳性状的相关分析[J].中国农业科学,2008,41(6):1872-1878. BAO B,FANG X T,CHEN H,et al.Polymorphisms of STAT5A gene and its association with milk performance traits in Chinese Holstein cattle[J].ScientiaAgriculturaSinica,2008,41(6):1872-1878.(in Chinese)
[31] ST JACQUES B,HAMMERSCHMIDT M,MCMAHON A P.Indian hedgehog signaling regulates proliferation and differentiation of chondrocytes and is essential for bone formation[J].GenesDev,1999; 13:2072-2086.
[32] 赵恒伍,张锦程,李长有.血管内皮生长因子调节成骨细胞中Ihh和p38 MAPK的表达[J].中国医科大学学报,2011,40(2):113-116. ZHAO H W,ZHANG J C,LI C Y.Effect of vascular endothelial growth factor on the expressions ofIhhandp38MARKin osteoblasts[J].JournalofChinaMedicalUniversity,2011,40(2):113-116.(in Chinese)
[33] WU Y,PAN A L,PI J S,et al.One novel SNP of growth hormone gene and its associations with growth and carcass traits in ducks[J].MolBiolRep,2012(39):8027-8033.
[34] OUYANG J H,XIE L,NIE Q,et al.Single nucleotide polymorphism(SNP) at the GHR gene and its associations with chicken growth and fat deposition traits[J].BrPoultSci,2008,(49):87-95.
[35] 赵高锋,陈 宏,雷初朝,等.秦川牛GHR基因SNPs 及其与生长性状关系的研究[J].遗传,2007,29(3):319-323. ZHAO G F,CHEN H,LEI C Z,et al.Study on SNPs of GHR gene and its associations with growth traits in Qinchuan cattle[J].Hereditas(Beijing),2007,29(3):319-323.(in Chinese)
[36] MULLEN M P,BERRY D P,DAWN J,et al.Single nucleotide polymorphisms in the insulin-like growth factor 1(IGF-1) gene are associated with performance in Holstein-Friesian dairy cattle[J].OriglResArticle,2011,(2):1-9.
[37] TRUJILLO A I,CASAL A,PEAGARICANO F,et al.Association of SNP of neuropeptide Y,leptin,and IGF-1 genes with residual feed intake in confinement and under grazing condition in Angus cattle[J].JAnimSci,2013,91:4235-4244.
[38] 鞠志花,王洪梅,李秋玲,等.荷斯坦牛 κ-酪蛋白基因两 SNPs位点基因型组合对产奶性状的影响[J].农业生物技术学报,2009,17(4):587-592. JU Z H,WANG H M,LI Q L,et al.Effect of genotype combination of κ-casein gene on milk production traits in Holsteins[J].JournalofAgriculturalBiotechnology, 2009,17(4):587-592.(in Chinese)
(编辑 郭云雁)
Tissue Expression,SNP Detection and Association of Genotype Combination ofIhhGene with Production Traits in Yak
LI Tian-ke1,2,3,ZHAO Juan-hua1,2,PEI Jie1,2,LIANG Chun-nian1,2, GUO Xian1,2,QIN Wen1,2,3,YAN Ping1,2,3*
(1.LanzhouInstituteofHusbandryandPharmaceuticalSciences,ChineseAcademyofAgriculturalSciences,Lanzhou730050,China;2.KeyLaboratoryofYakBreedingEngineering,Lanzhou730050,China;3.CollegeofAnimalScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China)
The objective of this study was to identify the polymorphisms ofIhhgene and their correlation with production traits,then to detect the molecular markers related to production traits,and investigate distribution and expression in tissues detected in yak and cattle.At the same time,RT-PCR method was used to detect the expression ofIhhgene in different tissues in yak and cattle.BLAST and Chromas were used to screen the SNPs inIhhgene by the wave height of sequencing map.The genotypes were determined by high-resolution melting curve(HRM) and the alleles frequency was estimated.The PHASE and SHEsis softwares were used to analyze matching chain disequilibrium and haplotype,respectively.The SPSS17.0 software was used for association analysis.Two SNPs(5855(C/T) and 6383(G/A)) ofIhhgene were indentified in the population,which were on exon 3.Through population genetics analysis,the results showed that 2 loci were at high polymorphic status(PIC>0.25).The χ2tests showed that the 2 loci were in the status of Hardy-Weinberg equilibrium(P<0.05) in Gannan and Datong yaks; the 2 loci were not all in the status of Hardy-Weinberg equilibrium(P>0.05) in Tianzhu yak.Analysis of matching chain disequilibrium and haplotype showed that there was a strengh linkage equilibrium between the 2 loci with 4 haplotype combinations and 3 genotype combinations.Analysis of association of polymorphism with body measurement traits at all mutation loci showed that 3 genotype combinations had significant effects on body height,body length,weight,tube girth and herrt girth(P<0.05).Yak with CTGA genotype combination had higher body height,body length,weight,tube girth and herrt girth than individuals with CCGG and TTAA.The result of expression showed thatIhhgene was expressed in 8 different tissues.The results suggest thatIhhgene may have potential effects on production traits in the above mentioned yak populations and could be used for marker-assisted selection.
yak;Ihhgene;polymorphism;HRM;production traits;RT-PCR;gene expression
10.11843/j.issn.0366-6964.2015.01.007
2014-01-25
甘肃牧区生产生态生活优化保障技术集成与示范(2012-2016)(2012BAD13B05);甘肃省科技重大专项计划(1102NKDA027)
李天科(1987-),男,硕士生,主要从事动物遗传育种与繁殖研究,E-mail:litianke1987@163.com
*通信作者:阎 萍,研究员,博士生导师,主要从事动物遗传育种与繁殖研究,E-mail:pingyan@sohu.com
S832.85;S813.3
A
0366-6964(2015)01-0050-10
