内蒙古地区猪腹泻相关病毒的检测与分析
2015-03-22刘艳成杜雅楠吴卫杰王雪飞刘丹丹
刘艳成,杜雅楠*,吴卫杰,王雪飞,芦 婷,刘丹丹
(1.内蒙古农业大学兽医学院,农业部动物疾病临床诊疗技术重点实验室,呼和浩特 010018; 2.兴安盟动物疫病预防控制中心,乌兰浩特 137400)
内蒙古地区猪腹泻相关病毒的检测与分析
刘艳成1,杜雅楠1*,吴卫杰2,王雪飞1,芦 婷1,刘丹丹1
(1.内蒙古农业大学兽医学院,农业部动物疾病临床诊疗技术重点实验室,呼和浩特 010018; 2.兴安盟动物疫病预防控制中心,乌兰浩特 137400)
旨在明确引起内蒙古地区猪腹泻的主要相关病毒及其流行特点,为该病的防控提供依据。采用多重RT-PCR方法对从内蒙古8个盟市采集的394份腹泻粪样进行猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪轮状病毒(PoRV)三种病毒的检测;对部分 PCR检测呈阳性的病料进行PEDVM基因的克隆、测序,并与国内外已报道的48条M基因序列进行比对和遗传进化分析。检测结果表明:PEDV、PoRV阳性率分别为63.96%、2.03%,未检测到TGEV;PEDV和PoRV混合感染率为2.03%;各日龄猪群均可发病,但以未断乳仔猪和哺乳母猪感染率较高;遗传进化分析结果表明:CH/NMG/XLGL分离株与CV777等经典毒株亲缘关系较近,位于G2分支上;其余7条分离毒株与2012年以来国内多个省市的流行毒株及泰国、韩国、俄罗斯、越南等邻国的流行毒株位于G1-1分支上,特别是与美国2013—2014年流行的毒株亲缘关系更为密切,核苷酸序列相似性为99.5%~100%。从2013年至今导致内蒙古地区猪腹泻的病毒主要是PEDV,其次是PoRV;不同日龄的猪群均可感染,以未断乳的仔猪感染最为严重;获得的大部分流行毒株与我国2012年至今的大部分省市的流行毒株亲缘性较高,但与我国2007年以前分离的内蒙毒株、疫苗株、经典毒株相距较远,并存在碱基突变的情况。
猪流行性腹泻病毒;猪传染性胃肠炎病毒;猪轮状病毒;RT-PCR;M基因;内蒙古
猪腹泻是猪场常见的一类猪肠道病症候群,其既可由饲料、环境和管理等非传染性因素导致,也可由细菌、病毒、寄生虫等传染性因素引起,其中又以病毒性腹泻的危害最为严重。病毒性腹泻的病因十分复杂,目前研究表明主要是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(porcine transmissible gastroenteritis virus,TGEV)、猪轮状病毒(porcine rotavirus,PoRV)三种病毒单一或混合感染所致[1]。
近几年,国内猪病毒性腹泻的发病率明显上升,呈现由南向北扩散的趋势。流行规律发生很大的变化,有报道称该病不再呈现明显的季节性,部分猪场夏季也能发生本病的流行[2]。从2010年10月至今,我国十几个省份均有流行性腹泻的发生,数百万头仔猪死于该病,病死率高达80%~100%,造成严重的经济损失[3]。美国自2013年5月猪流行性腹泻首次暴发以来,已迅速蔓延至30多个州,波及4 000多个养殖场,累计死亡仔猪超过800万头。近日,猪流行性腹泻又洗劫日本,截至到2015年1月中旬已造成40多万头猪死亡,疫情还在进一步蔓延。此外加拿大、墨西哥、哥伦比亚、多米尼加等国也相继暴发此病,欧洲多国也开始研究防止PEDV传入的策略[4]。
目前,内蒙古地区猪病毒性腹泻时有发生,但尚未发现相关的文献报道,特别是近几年引起猪腹泻的主要病原,流行状况以及是否存在混合感染等问题都有待进一步的调查研究。本研究旨在通过对内蒙古地区猪腹泻相关病毒的检测,明确引起内蒙古地区猪病毒性腹泻的主要病原,为该病的防控提供依据。
1 材料与方法
1.1 病毒
PEDV、TGEV购自中国普通病毒保藏中心;PoRV由西北农林科技大学动物医学院张彦明老师馈赠。
1.2 病料
腹泻粪样采自内蒙古自治区赤峰市(CF)、通辽市(TL)、包头市(BT)、呼伦贝尔市(HLBE)、巴彦淖尔市(BYNE)、鄂尔多斯市(EEDS)、锡林郭勒盟(XLGL)、呼和浩特市(HHHT)等地的腹泻猪群,共计394份。
1.3 主要试剂
RNAiso plus、DL2000 DNA Marker、PremixTaq购自宝生物工程(大连)有限公司;TIANScript RT Kit、TIANgel Midi Purification Kit、pGM-T Ligation Kit、TIANprep Mini Plasmid Kit购于TIAN GEN有限公司;Agarose 购自Invitrogen公司;其他试剂均为分析纯。
1.4 引物设计及合成
根据GenBank上收录的PEDV的M基因序列(JX435317)、TGEV的N基因序列(GQ374559)、PoRV的VP6基因序列(JN605419),利用Primer Premier 5.0、Oligo6.0设计3对特异性引物(表1),引物由上海生物工程技术有限公司合成。
1.5 病料处理及RNA的提取
取腹泻病猪的粪便用PBS做10倍稀释,涡旋器上充分振荡混匀,反复冻融3次,4 ℃ 3 000 r·min-1离心10 min,取上清液,4 ℃ 12 000 r·min-1离心5 min,收集上清液,直接提取RNA或-70 ℃长期保存。
采用Trizol法提取粪便中的总RNA,具体步骤如下:吸取上清液300 μL,加入RNAiso Plus 1 500 μL,充分混匀。冰上静置7 min。4 ℃ 12 000 r·min-1离心5 min。吸取上清液,转移至新的离心管中,加入氯仿300 μL,剧烈振荡20 s,冰上静置13 min。4 ℃ 13 000 r·min-1离心15 min。吸取上清液至新的离心管中,加入等体积的异丙醇,上下颠倒混匀,冰上静置10 min。4 ℃ 12 000 r·min-1离心10 min。小心弃去上清,沿管壁加入75%的乙醇(DEPC水配制)1 000 μL,上下颠倒洗涤离心管,4 ℃ 7 500 r·min-1离心5 min后小心弃去乙醇。低温干燥沉淀2~5 min,加入30 μL无酶水溶解沉淀,待RNA 沉淀完全溶解后直接进行反转录或于-70 ℃保存。
表1 引物序列及扩增长度
Table 1 Primer sequences and length of specific fragment
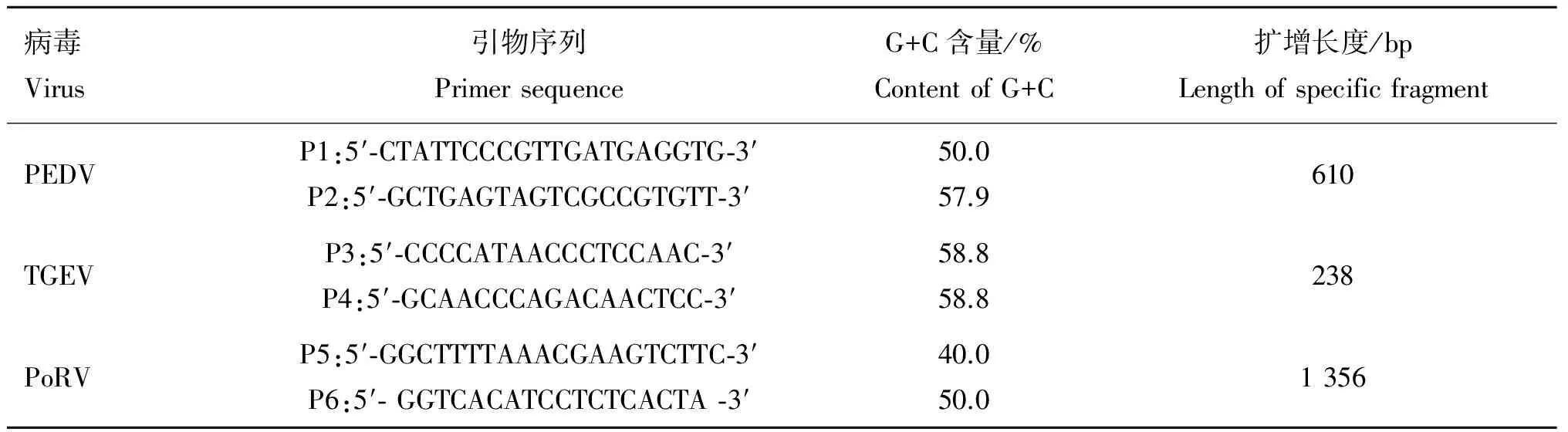
病毒Virus引物序列PrimersequenceG+C含量/%ContentofG+C扩增长度/bpLengthofspecificfragmentPEDVP1:5′⁃CTATTCCCGTTGATGAGGTG⁃3′P2:5′⁃GCTGAGTAGTCGCCGTGTT⁃3′50.057.9610TGEVP3:5′⁃CCCCATAACCCTCCAAC⁃3′P4:5′⁃GCAACCCAGACAACTCC⁃3′58.858.8238PoRVP5:5′⁃GGCTTTTAAACGAAGTCTTC⁃3′P6:5′⁃GGTCACATCCTCTCACTA⁃3′40.050.01356
1.6 反转录及多重RT-PCR体系的构建
参照TIANScript RT Kit的使用说明,将1.5中提取的总RNA进行反转录;利用设计的三对特异性引物进行多重RT-PCR的扩增,阳性对照以PEDV、TGEV、PoRV的混合cDNA为模板,PCR反应总体系为25 μL:PremixTaq12.50 μL、cDNA模板6.50 μL、PEDV上下游引物各0.50 μL、TGEV上下游引物各0.80 μL、PoRV上下游引物各1.0 μL、补充ddH2O 1.40 μL。扩增反应条件:94 ℃预变性5 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸50 s,35个循环;72 ℃延伸10 min;4 ℃保存。反应结束后,取PCR产物8 μL,于10 g·L-1的琼脂糖凝胶电泳上检测扩增结果。
1.7 临床粪样的检测
应用1.6所建立的多重RT-PCR方法,检测来自内蒙古8个盟市的394份腹泻粪样中的PEDV、TGEV、PoRV,了解三种病毒在内蒙古地区的流行状况。
1.8 目的基因克隆及测序
根据PCR检测结果,对部分PCR检测为阳性的产物进行纯化回收,具体操作参见TIANgel Midi Purification Kit。将已纯化的目的基因与pGM-T载体16 ℃连接过夜,连接产物转移至100 μL的TOP10感受态细胞中,冰浴30 min后,迅速置于42 ℃水浴90 s,立即冰浴3 min。缓慢加入890 μL LB液体培养基,37 ℃ 150 r·min-1振荡培养45 min。3 000 r·min-1离心5 min,弃去部分上清,吸取剩余的150 μL菌液滴加到LB固体培养基上(含有20 μL 50 ng·mL-1的Amp+、16 μL 50 ng·mL-1的IPTG、40 μL 20 mg·mL-1的X-Gal),玻璃棒涂布均匀,充分吸收后,37 ℃培养过夜。经扩大培养后,挑取白色菌落接种于5 mL的LB液体培养基(含5 μL的Amp+),37 ℃ 180 r·min-1振荡培养过夜。应用TIANprep Mini Plasmid Kit提取质粒。对所提取的质粒进行PCR及酶切鉴定,将检测为阳性的质粒送至上海生物工程有限公司进行测序。
1.9 序列同源性及遗传进化分析
根据样品采集地点将所获得8条PEDVM基因序列分别命名CH/NMG/CF(赤峰)、CH/NMG/TL(通辽)、CH/NMG/BT(包头)、CH/NMG/HHHT(呼和浩特)、CH/NMG/HLBE(呼伦贝尔)、CH/NMG/WY(巴彦淖尔)、CH/NMG/EEDS(鄂尔多斯)、CH/NMG/XLGL (锡林郭勒)。应用DNAMAN、DNAStar对本试验所获得的8条PEDVM基因进行核苷酸及氨基酸同源性比对,并与GenBank上已登录的48条PEDVM基因(表2)进行核苷酸序列及其推导氨基酸序列的比对分析,利用MEGA 6.06的邻接法(neighbor-joining method,NJ),建立系统发育树,其中,自举检验次数设为1 000。分析内蒙古地区PEDV流行毒株与参考毒株的系统发育关系。
表2 国内外PEDVM基因的参考序列
Table 2 Reference sequence of PEDVMgene at home and abroad
毒株Strain地点Area登录号Accessionnumber毒株Strain地点Area登录号AccessionnumberCH/IMB内蒙古EU033962CH/S江苏JN547228CH/IMT内蒙古EU033965CH/TJ⁃2012⁃01天津KC176073CH/HLJH黑龙江EU033964CH/HuBWHYQ武汉KF840551HLJ⁃2012黑龙江JX512906LZW⁃CPGEN北京KJ777678HB⁃2012⁃3河北JX43531LZC甘肃EF1859927HBMC河北JX163295CH/YNKM⁃8昆明KF761675CH/TY/12河南JX501327KUIDL⁃PED⁃2014⁃002越南KJ588063CH/ZMDZY河南KC196276VN/VAP1113越南KJ960179CH/SDZD⁃1山东KF84054908RB01泰国FJ196182SD⁃M山东JX56076108CB02泰国FJ196167AHFD/2012安徽KJ001721K14JB01韩国KJ623926AHLA/2013安徽KJ001738MF3809/2008韩国KF779470LZW_FGE北京KJ777677Chinju99韩国DQ845249JS⁃HZ2012江苏KC21014783P⁃5日本AB618618JS1江苏JQ390543JMe2日本D89752XG1广西JN089745Br1/87法国Z24733XG2广西JN089746CV777瑞士AF353511CH/GDGZ广东KF384500USA/Colorado美国KF272920CHYJ130330广东KJ020932MEX/104/2013美国KJ645708FUJ2⁃2011福建JQ390542MN美国KF468752FJ⁃ZP福建KJ646592OH15962美国KJ584361CH/SHH/06上海EU033966NPL⁃PEDv美国KJ778615SHQP/YM上海KJ196348Mx_EdoMexC1EM_2014莫斯科KM044328ZJ⁃2011⁃1浙江JX435319Mx_EdoMexC1GM_2014莫斯科KM044329
2 结 果
2.1 多重RT-PCR体系构建
电泳检测显示泳道1分别于1 356、610、238 bp处出现明显条带,与目的条带大小一致;泳道2于1 356、610 bp 处出现目的条带;泳道3、4、5分别为610、1 356、238 bp处出现目的条带;泳道6为阴性对照;泳道7、8、9为临床PEDV感染的粪样,于610 bp处出现条带。电泳检测结果表明,所构建的多重RT-PCR方法,均于正确位置出现目的条带,且各条带清晰,无其他非特异性条带,可用于临床粪样的鉴别诊断。
2.2 临床病料检测
各地的腹泻粪样检测结果见表3。394份病料中,PEDV阳性病料252份,阳性率为63.96%;PoRV阳性病料8份,阳性率为2.03%;TGEV均为阴性;存在PEDV和PoRV的混合感染,混合感染病料8份,混合感染率为2.03%。
2.3 流行病学调查
由图2可知,内蒙古8个盟市的腹泻病料均可检出PEDV,其中又以赤峰市腹泻病料中PEDV阳性检出率最高,为75.81%;其次是包头市和呼和浩特市,均为66.67%;最低的为呼伦贝尔市,但其阳性检出率也达到了45.00%,在造成猪腹泻的各因素中,仍占有重要比重。从图3中可以看出,来自不同猪群的病料,其阳性检出率存在明显差异;仔猪、母猪、保育-育肥猪三种不同生长阶段猪群的阳性率分别为72.58%、53.97%和44.94%;8个盟市中又以赤峰市仔猪、母猪的PEDV阳性率最高,分别为84.10%和75.00%,保育-育肥阶段则以包头市的PEDV阳性检出率最高,为72.22%。
表3 采集地及临床病料的检测结果
Table 3 Collecting areas and results of the tested samples
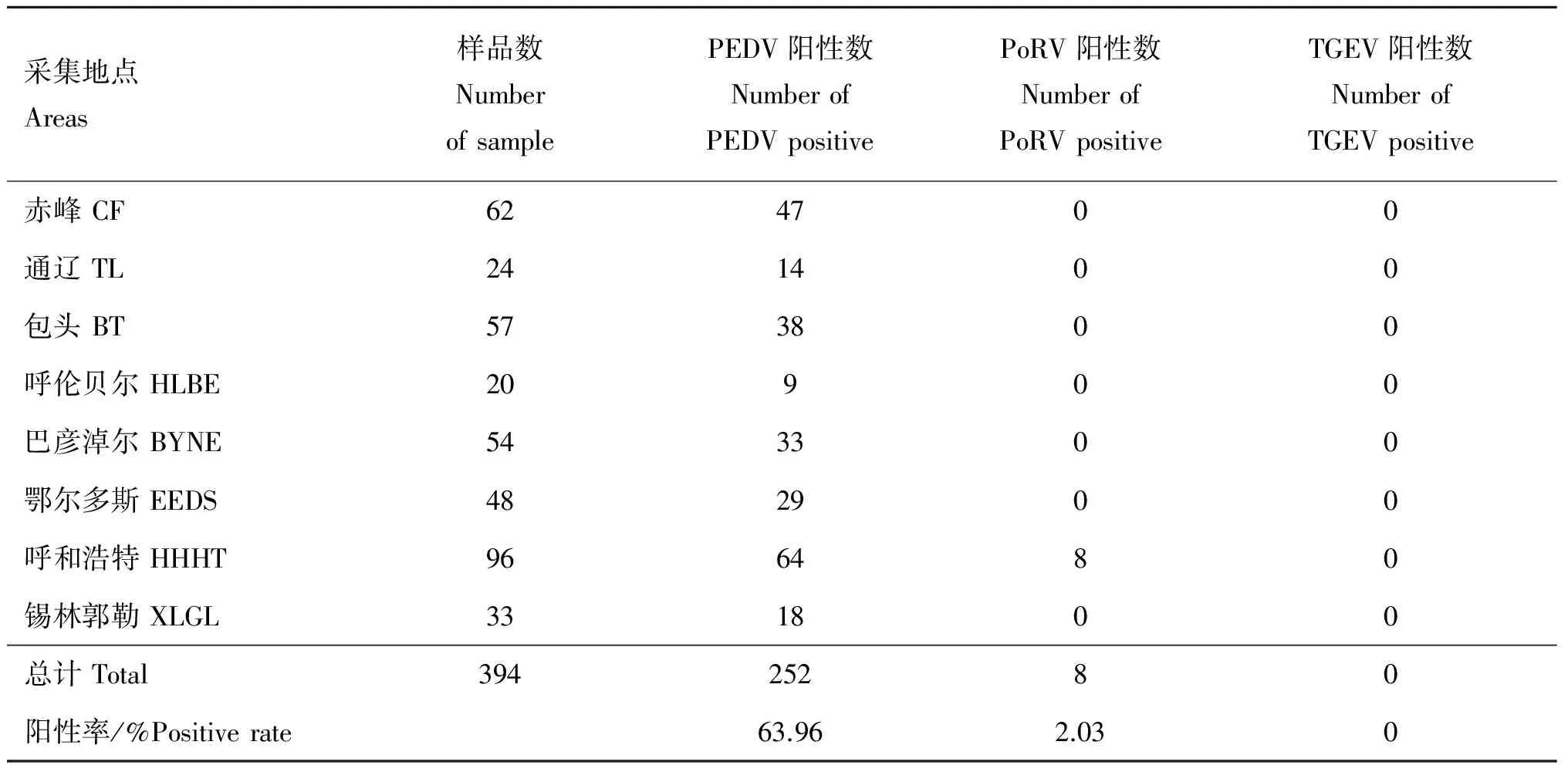
采集地点Areas样品数NumberofsamplePEDV阳性数NumberofPEDVpositivePoRV阳性数NumberofPoRVpositiveTGEV阳性数NumberofTGEVpositive赤峰CF624700通辽TL241400包头BT573800呼伦贝尔HLBE20900巴彦淖尔BYNE543300鄂尔多斯EEDS482900呼和浩特HHHT966480锡林郭勒XLGL331800总计Total39425280阳性率/%Positiverate63.962.030
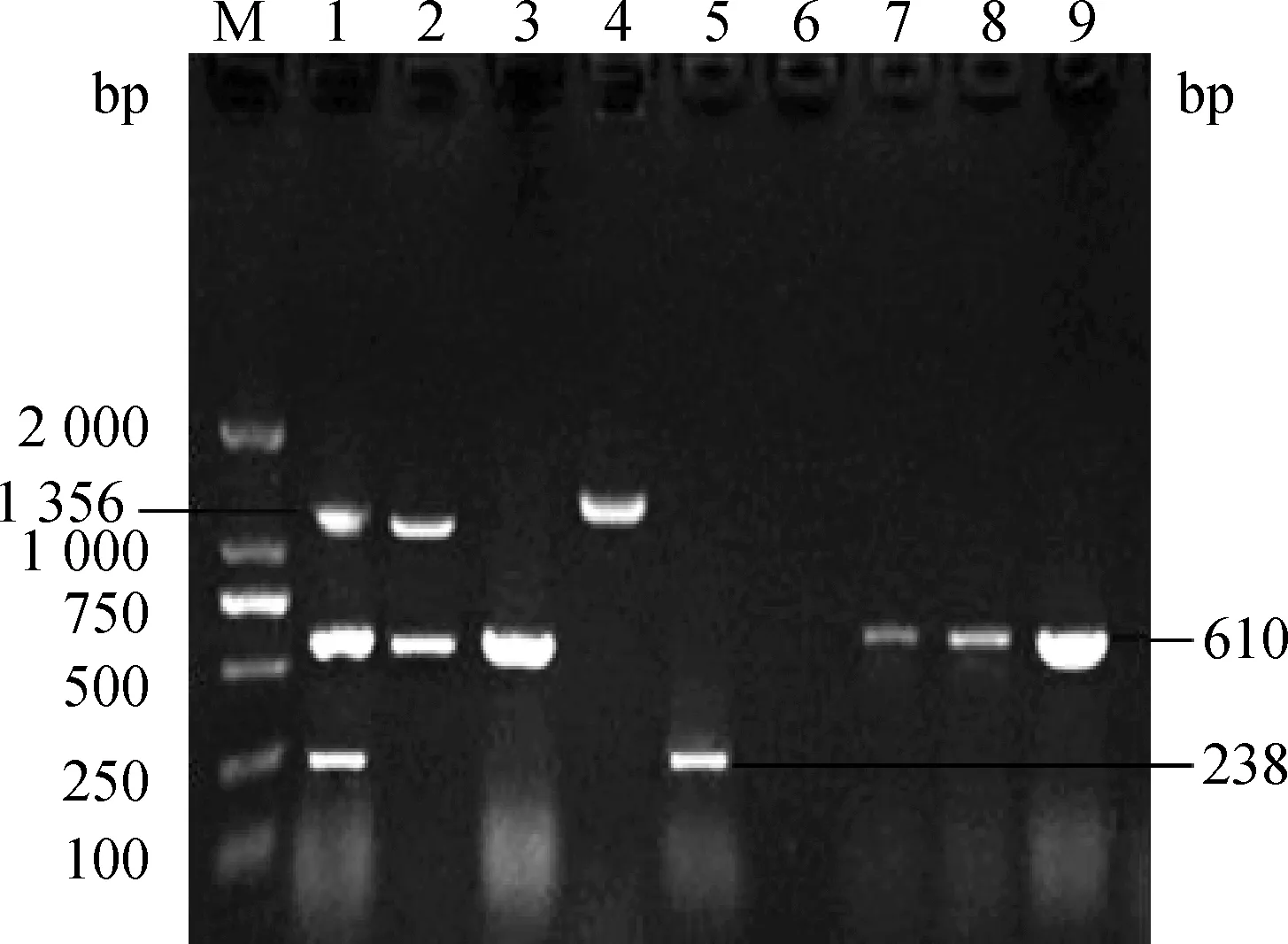
M.DL2000 DNA相对分子质量标准;1.PEDV+TGEV+PoRV阳性对照;2.PEDV、PoRV混合感染的粪样;3.PEDV阳性对照;4.PoRV阳性对照;5.TGEV阳性对照;6.阴性对照;7~9.临床粪样M.DL2000 DNA marker;1.The positive control of PoRV,PEDV and TGEV;2.Mix infection of PEDV and PoRV;3.The positive control of PEDV;4.The positive control of PoRV;5.The positive control of TGEV;6.Negative control;7-9.Clinical fecal samples图1 多重RT-PCR方法构建及临床样品的检测Fig.1 The building of multiple RT-PCR and the application in clinical samples
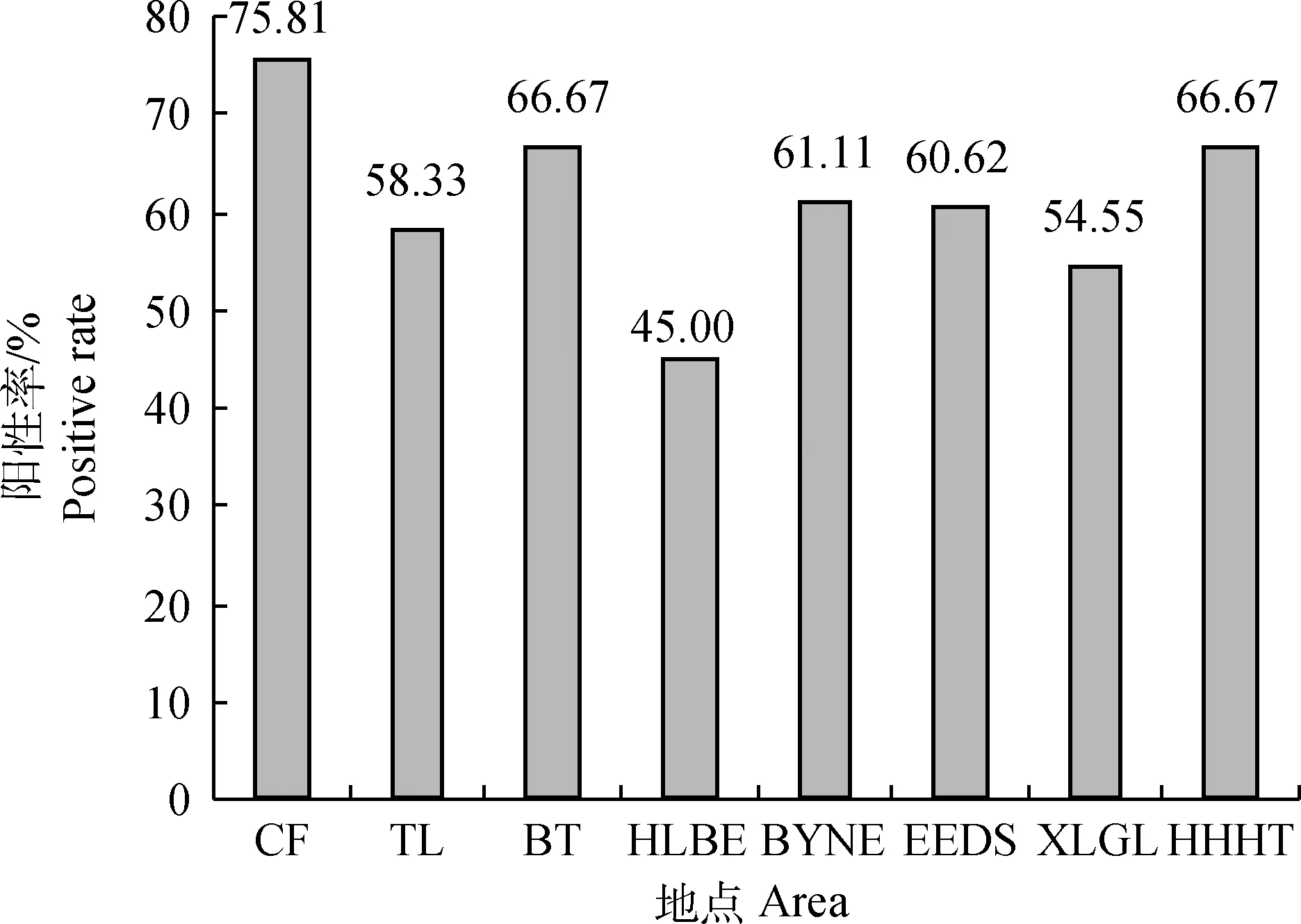
图2 内蒙古8个盟市PEDV检测结果Fig.2 The testing result of PEDV collected from eight cities of Inner Mongolia
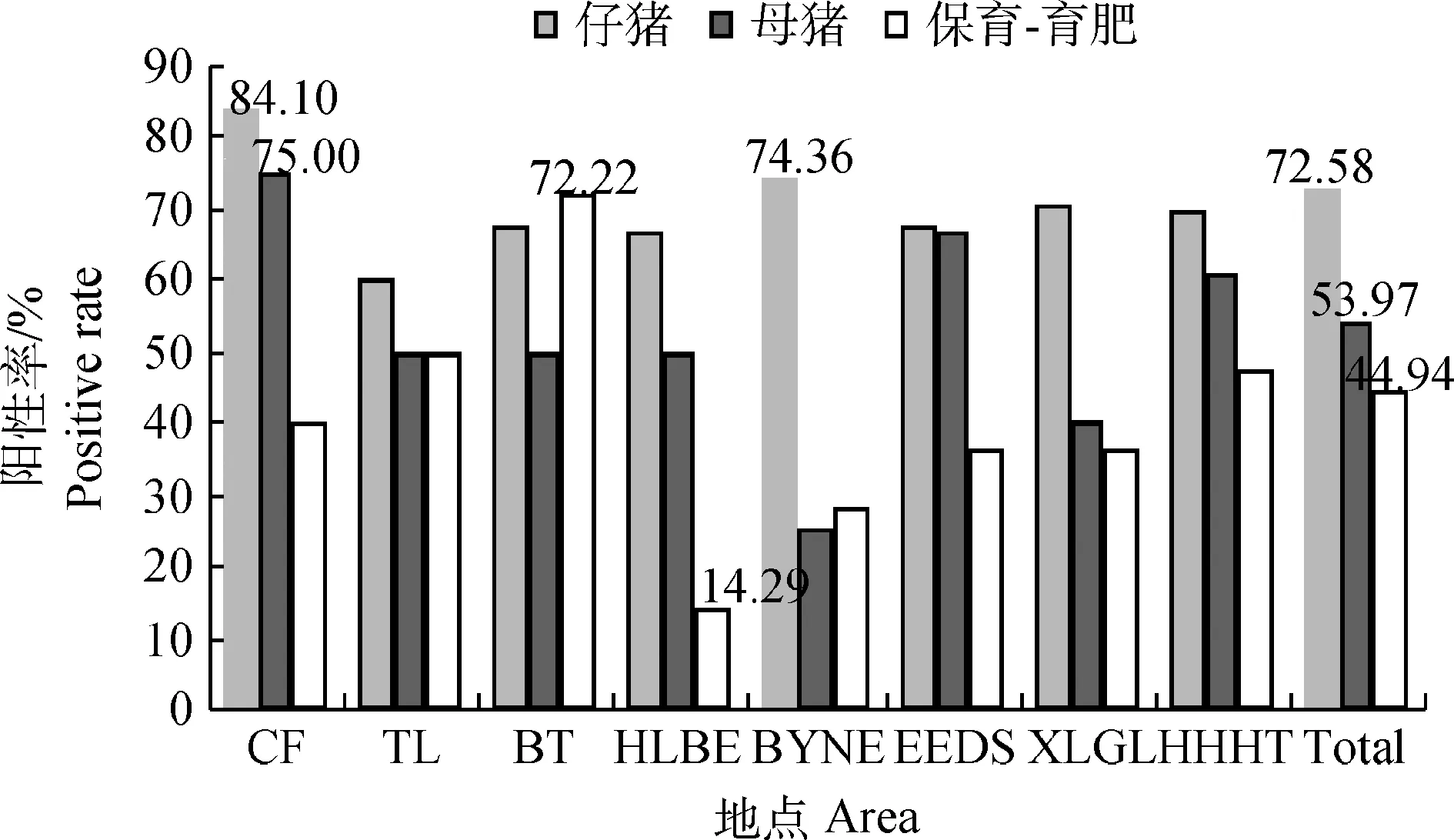
图3 内蒙古8个盟市不同猪群PEDV阳性率Fig.3 The positive rate of PEDV in different populations of eight cities in Inner Mongolia
2.4 质粒PCR及酶切鉴定
将重组质粒进行PCR扩增及酶切鉴定,结果如图4所示:质粒PCR产物电泳检测于610 bp处出现明显条带;质粒酶切后,电泳检测于610和3 015 bp处获得两条亮带,与预期结果一致,表明重组质粒含有所需目的片段。
2.5 PEDVM基因同源性及遗传进化分析
序列同源性比对结果表明:所获得的8条PEDVM基因核苷酸相似性为97.2%~100.0%,氨基酸相似性为98%~100%。与GenBank上已登录的48条国内外PEDVM基因构建遗传进化树(图5)。进化树可分为G1、G2两大分支,其中G1又可分为G1-1、G1-2两小分支。本试验所获得的8条M基因中有7条与国内近三年分离的黑龙江、河北、河南、山东、北京、安徽、江苏、广东、福建、上海、天津、武汉、昆明等地的分离株(HLJ-2012、HB/2012-3、HBMC2012、CH/TY/12、CH/ZMDZY/11、CH/SDZD-1/12、LZW-FGE/2014、AHFD/2012、AHLA/2013、LZW-CPGEN/2014、JS-HZ2012、JS1、FJ-ZP、SHQP/YM、CH/HuBWHYQ、CH/TJ-2012-1、CH/YNKM-8),2008年泰国分离的参考毒株(08RB01、08RB02)、韩国分离毒株(K14JB01、MF3809/2008)、美国2013—2014年分离毒株(USA/Colorado、MN、MEX/104/2013、OH15962、NPL-PEDv)、俄罗斯2014年分离的两株参考株(Mx_EdoMexC1EM、Mx_EdoMexC1GM)同位于G1-1上。而CH/NMG/XLGL 分离株则与国内2007年以前内蒙古分离株(CH/IMB/06、CH/IMT/06)、山东SD-M株、黑龙江CH/HLJH株、上海CH/SHH /06株、CH/S沪毒株、LZC西部毒株,韩国的Chinju99株、日本83P-5、JMe2株、法国的Br1/87株、瑞士的CV777等经典毒株同位于G2上。
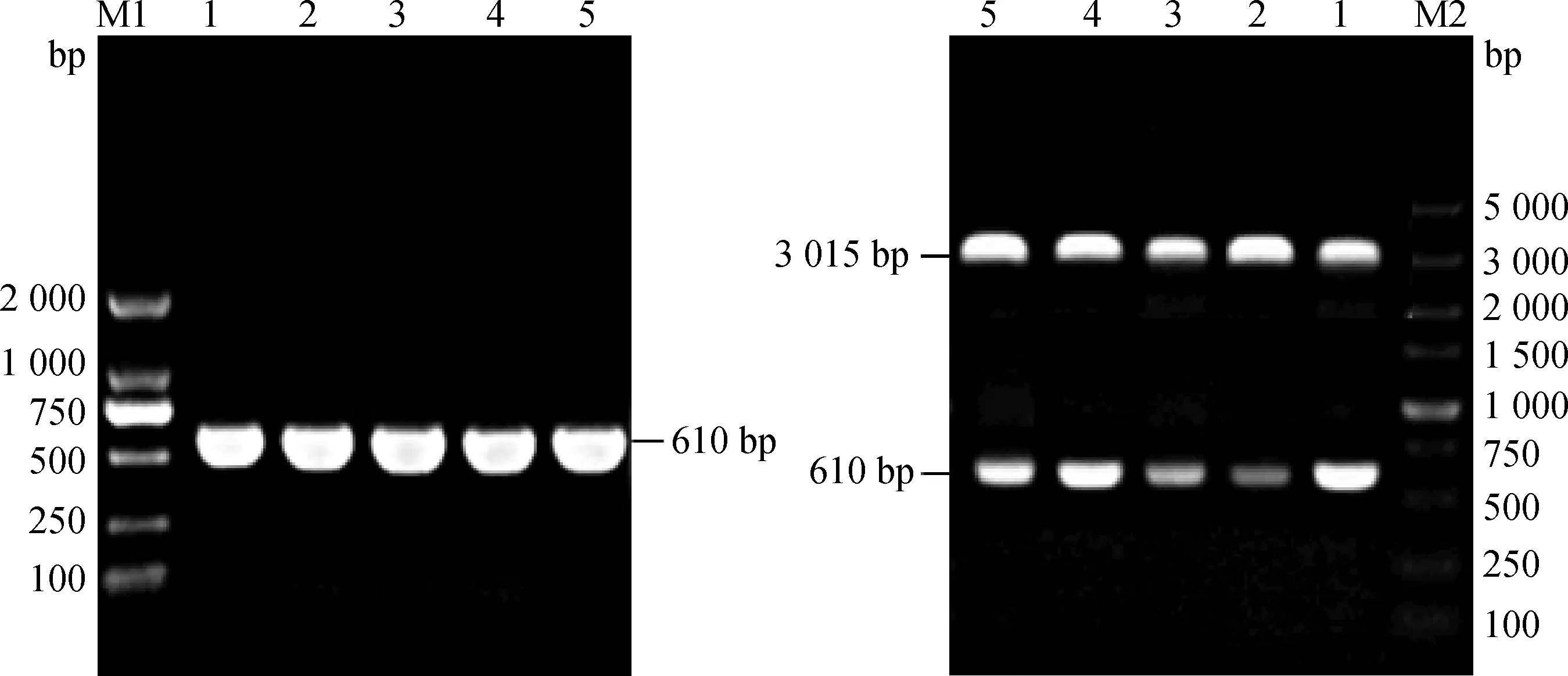
M1.DL2000 DNA相对分子质量标准;M2.DL5000 DNA相对分子质量标准;1~5(左).质粒PCR结果;1~5(右).质粒酶切结果M1.DL2000 DNA marker;M2.DL5000 DNA marker;1-5 (left).The result of recombinant plasmid PCR;1-5 (right).The result of recombinant plasmid identification of enzyme digestion图4 重组质粒PCR(左)及酶切鉴定(右)结果Fig.4 The results of recombinant plasmid PCR(left) and identification of enzyme digestion (right)
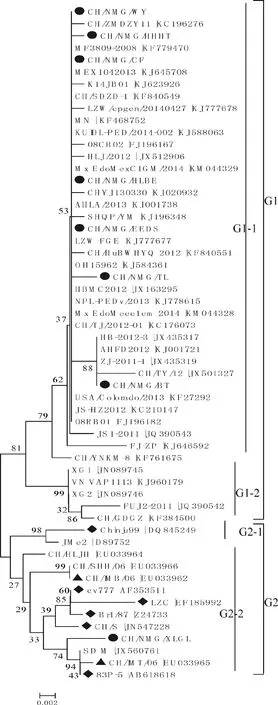
●.Inner Mongolia strains;▲.Inner Mongolia strains of 2006;◆.Classic strains图5 PEDV M基因的系统发育树Fig.5 Phylogenetic tree of M genes from different PEDV strains
2.6 PEDVM基因突变情况
运用DNAStar与经典毒株CV777 核苷酸序列比对可知,内蒙古地区流行毒株的M基因核苷酸序列发生了11处碱基突变,其中CH/NMG/HHHT株于第594位缺失碱基T;氨基酸比对结果表明:有2个氨基酸位点发生了变化,分别是13位(E→Q),42位(V→A);CH/NMG/HHHT分离株于198位到202位缺失了5个氨基酸(YVRSK)。与2006年于内蒙古分离的CH/IMB/06地方株相比,流行毒株存在6处突变位点,氨基酸比对仅于42位发生改变,由V变成了A;与CH/IMT/06地方株比对表明:流行毒株存在11处核苷酸突变,4处氨基酸位点变化,分别是5位(F→G)、13位(E→Q)、42位(V→A)、167位(D→N)。
3 讨 论
PEDV、TGEV、PoRV是目前造成猪病毒性腹泻的主要病原,且三者在临床症状、病理变化以及流行病学上均无明显差异[5]。传统的病毒检测方法虽然能对三者进行鉴别诊断,但因其对实验设备、人员技术等条件要求较高,而且检测周期长、灵敏度低等缺点在临床实践中并不常用[6]。随着分子生物学的快速发展,PCR技术以其高特异、高灵敏、快速、简单等特点成为目前鉴别诊断上述三种病毒的最敏感、最特异的方法。多重 PCR 方法不仅保持了常规 PCR 快速、灵敏、特异的特点,更具有一步可检测多个病原靶标基因的优势,适于大规模样品的检测,在动物疫病流行病学调查与预防中,具有不可替代的作用[7]。多重PCR并非单项PCR的简单混合[8]。其中引物设计是此方法能否成功的前提,除考虑每对引物的特异性及扩增效率之外,还必须尽量减少不同引物对之间形成二聚体的可能性。另外应在确定三种病毒单项PCR最佳反应条件基础上,优化多重PCR中的引物浓度、退火温度及其他PCR反应条件,同时还要保证该方法的特异性和灵敏度[9-10]。本试验针对PEDV、TGEV及PoRV的保守序列,扩增出3条片段,长度分别为610、238和1 356 bp,目的片段之间长度差异明显,便于临床上的鉴别诊断。同时只需取活体动物的粪样即可达到很好的检测效果,从而更有利于病毒性腹泻的早期鉴别诊断,有较好的应用前景。
应用上述试验所建立的检测方法,对2013年10月至今于内蒙古部分盟市采集的394份腹泻粪便进行PEDV、TGEV、PoRV 3种病毒的检测,发现各盟市的腹泻猪群均存在PEDV感染的情况,部分地区还存在PEDV和PoRV混合感染的现象。其中PEDV和 PoRV的阳性率分别为63.96%和2.03%,TGEV均为阴性,表明PEDV为引起内蒙古地区猪腹泻的主要致病因子,其次是PoRV。这一检测结果与国内大部分省市的调查结果一致[10-15],由此共同验证了PEDV是目前导致猪病毒性腹泻的主要病原。
临床调查中发现,各日龄猪群均有PEDV感染的情况发生,但主要集中在未断奶仔猪及哺乳期母猪,其中以7日龄以内的仔猪发病最为严重,死亡率高达100%。有报道称在母猪的乳汁中也能检测出该病毒[3],这可能是造成哺乳期仔猪发病率和死亡率较高的一方面诱因。但有资料显示在欧洲一些猪场,断奶猪和成年猪经常发生严重的腹泻,而哺乳仔猪尤其是无母源抗体的哺乳仔猪不发生或仅发生轻微腹泻,发病率很低,对于这种现象至今仍没有很好的解释。
本研究所获得的8条PEDV M基因中,除CH/NMG/XLGL外,全部位于G1-1分支上,其核苷酸、氨基酸相似性分别为99.7%~100%和99%~100%,保持高度一致,说明导致这几个地区猪流行性腹泻的毒株基本一致。系统进化树表明,CH/NMG/XLGL分离株与内蒙古其他地区分离株差异较大,不在同一分支上;而与CV777等经典毒株亲缘关系较近,在同一个分支上。后期调查发现发病猪场长期进行PEDV灭活苗和弱毒苗(CV777株)的免疫预防工作,推测该分离株多为使用弱毒疫苗后的正常排毒,亦或是疫苗株发生毒力返强,进而引起猪发生腹泻。其余7条PEDV的流行毒株则与2012年至今国内多个省市的分离株、2008年泰国的两条参考毒株、韩国的K14JB01、MF3809/2008参考株、美国的5条参考毒株、俄罗斯2014年分离的参考株亲缘关系较近,同位于G1-1上,特别是与美国2013年暴发的流行毒株亲缘关系最为密切,两者的核苷酸及其氨基酸序列相似性均为99.5%~100%,基于二者的发病时间、基因同源性高度相似,笔者猜测两者之间或许存在某些关联。S.Lee等[16]报道称已于韩国分离出类似美国此次流行的病原。C.N.Lin 等[17]在台湾也发现了类似美国毒株的病例。L.Y.Wang等[4]通过S基因序列分析发现美国新型毒株OH851可能来自中国CH/HBQX/10株的变异。都在一定程度上佐证了笔者的猜测,但如需进一步验证,还需测出内蒙古流行毒株的全基因序列,进而进行全基因序列的同源性比较。与2006年于内蒙古分离的两株流行毒株同源性分析表明,其核苷酸相似性为97.2%~98.7%,差异性较大,不在同一分支上;与2007年以前国内部分省市的流行毒株(SD-M、CH/HLJH、CH/SHH/06、CH/S、LZC)、韩国Chinju99、日本83P-5和JMe2、法国Br1/87、瑞士的CV777等经典毒株相距较远,表明内蒙古大部分地区近三年的流行毒株与2006年流行株以及疫苗株相比,已经发生一定程度的变异,这一发现与J.F.Chen等[18]的结论一致。PEDV的M基因虽然高度保守,但随其所处环境条件的改变,病毒可能会发生变异。S.J.Park等[19]通过ORF3基因与M基因对韩国流行毒株进行比对分析,发现自2003年以来韩国PEDV流行毒株与我国的流行毒株越来越相近。Y.Gao等对2011—2012年来自北京、河北、浙江等地的腹泻样品进行M基因及S基因遗传进化分析,发现所分离毒株与韩国流行毒株亲缘关系较近,推测为一种新型毒株的流行[20]。以上结果在一定程度上反映出,我国PEDV已经发生很大程度的变异,这可能是造成我国现用疫苗免疫效果较差的又一因素。
4 结 论
此次调查明确了当前导致内蒙古猪腹泻病的主要病原是PEDV,各地均有不同程度的感染;各日龄猪群均可感染,但以未断乳仔猪和哺乳母猪更为严重;此次调查发现的流行毒株与2012年以来国内、外大部分流行毒株亲缘关系较近,但与2007年以前分离的内蒙古流行毒株、疫苗株、经典毒株亲缘关系较远,存在基因突变的现象。
[1] SONG D,PARK B.Porcine epidemic diarrhoea virus:a comprehensive review of molecular epidemiology,diagnosis,and vaccines[J].VirusGenes,2012,44(2):167-175.
[2] LI Z L,ZHU L,MA J Y,et al.Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field strains in south China[J].VirusGenes,2012,45(1):181-185.
[3] SUN R Q,CAI R J,CHEN Y Q,et al.Outbreak of porcine epidemic diarrhea in suckling piglets,China[J].EmergInfectDis,2012,18(1):161-163.
[4] WANG L Y,BYRUM B,ZHANG Y.New variant of porcine epidemic diarrhea virus,United States,2014[J].EmergInfectDis,2014,20(5):917-919.
[5] 秦谷雨,杨 勇,李 郁,等.安徽省仔猪腹泻5种病毒感染情况的调查研究[J].动物医学进展,2012,33(12):59-63. QIN G Y,YANG Y,LI Y,et al.Investigation on infection status of five kinds of viruses causing pig diarrhea in Anhui Province[J].ProgressinVeterinaryMedicine,2012,33(12):59-63.(in Chinese)
[6] SONG D S,KANG B K,OH J S,et al.Multiplex reverse transcription-PCR for rapid differential detection of porcine epidemic diarrhea virus,transmissible gastroenteritis virus,and porcine group A rotavirus[J].JVetDiagnInvest,2006,18(3):278-281.
[7] BEN S A N,CHUPIN S A,BJADOVSKAYA O P,et al.Multiplex nested RT-PCR for the detection of porcine enteric viruses[J].JVirolMethod,2010,165 (2):283-293.
[8] KIM S Y,SONG D S,PARK B K.Differential detection of transmissible gastroenteritis virus and porcine epidemic diarrhea virus by duplex RT-PCR[J].JVetDiagnInvest,2001,13(6):516-520.
[9] KIM S H,KIM I J,PYO H M,et al.Multiplex real-time RT-PCR for the simultaneous detection and quantification of transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J].JVirolMethod,2007,146(1-2):172-177.
[10] 霍金耀,郑逢梅,陈 陆,等.猪流行性腹泻病毒、传染性胃肠炎病毒、A群轮状病毒和嵴病毒多重RT-PCR检测方法的建立及临床应用[J].中国兽医学报,2013,33(12):1792-1797. HUO J Y,ZHENG F M,CHEN L,et al.Establishment and clinical application of a multiplex reverse transcription-PCR for rapid detection of porcine epidemic diarrhea virus,transmissible gastroenteritis virus,group A rotavirus,and porcine kobuvirus[J].ChineseJournalofVeterinaryScience,2013,33(12):1792-1797.(in Chinese)
[11] 张 坤,何启盖.猪流行性腹泻病毒、猪传染性胃肠炎病毒和猪A群轮状病毒多重RT-PCR检测方法的建立及临床应用[J].畜牧兽医学报,2010,41(8):1001-1005. ZHANG K,HE Q G.Establishment and clinical application of a multiplex reverse transcription-PCR for detection of porcine epidemic diarrhea virus,porcine transmissible gastroenteritis virus and porcine group A rotavirus[J].ActaVeterinariaetZootechnicaSinica,2010,41(8):1001-1005.(in Chinese)
[12] 焦 洋,姜 焱,王凯民,等.猪传染性胃肠炎病毒、猪流行性腹泻病毒和猪博卡病毒多重PCR检测方法的建立[J].动物医学进展,2013,34(8):71-75. JIAO Y,JIANG Y,WANG K M,et al.Establishment of multiplex PCR for detextion of TGEV,PEDV and PBoV[J].ProgressinVeterinaryMedicine,2013,34(8):71-75.(in Chinese)
[13] 师保浚,赵 津,张小敏,等.2011—2012年江苏和安徽两省部分猪场主要疫病流行病学调查[J].畜牧与兽医,2013,45(5):69-71. SHI B J,ZHAO J,ZHANG X M,et al.Investigation on epidemiology of part farms mainly disease in Jang Su and An Hui from 2011 to 2012[J].AnimalHusbandryandVeterinaryMedicine,2013,45(5):69-71.(in Chinese)
[14] 郭 旋,陈 静,刘 欢,等.广西仔猪腹泻病毒病原流行病学调查[J].南方农业学报,2013,44(1):155-160. GUO X,CHEN J,LIU H,et al.Investigation on epidemiology of piglets diarrhea virus disease in Guangxi[J].JournalofSouthernAgriculture,2013,44(1):155-160.(in Chinese)
[15] 刘孝珍,陈建飞,时洪艳,等.2011年猪流行性腹泻病毒的遗传变异分析[J].中国预防兽医学报,2012,34(3):180-183. LIU X Z,CHEN J F,SHI H Y,et al.Genetic variation analysis of porcine epidemic diarrhea virus isolated in 2011[J].ChineseJournalofPreventiveVeterinaryMedicine,2012,34(3):180-183.(in Chinese)
[16] LEE S,LEE C.Outbreak-related porcine epidemic diarrhea virus strains similar to US strains,South Korea,2013[J].EmergInfectDis,2014,20(7):1223-1226.
[17] LIN C N,CHUNG W B,CHANG S W,et al.US-Like strain of porcine epidemic diarrhea virus outbreaks in Taiwan,2013-2014[J].JVetMedSci,2014,76(9):1297-1299.
[18] CHEN J F,SUN D B,WANG C B,et al.Molecular characterization and phylogenetic analysis of membrane protein genes of porcine epidemic diarrhea virus isolates in China[J].VirusGenes,2008,36(2):355-364.
[19] PARK S J,KIM H K,SONG D S,et al.Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field isolates in Korea[J].ArchVirol,2011,156(4):577-585.
[20] GAO Y,KOU Q,GE X,et al.Phylogenetic analysis of porcine epidemic diarrhea virus field strains prevailing recently in China[J].ArchVirol,2013,158 (3):711-715.
(编辑 白永平)
Detection and Analysis of Porcine Diarrhea Associated Virus in Inner Mongolia
LIU Yan-cheng1,DU Ya-nan1*,WU Wei-jie2,WANG Xue-fei1,LU Ting1,LIU Dan-dan1
(1.KeyLaboratoryofClinicalDiagnosisandTreatmentTechnologyinAnimalDiseaseofMinistryofAgriculture,CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Hohhot010018,China; 2.XinganLeagueAnimalDiseaseControlCenter,Ulanhot137400,China)
The research aimed to understand the main pathogens of pigs diarrhea virus found in Inner Mongolia in order to provide theoretical basis for pig diarrhea control and prevention.Through the Multiple RT-PCR method,the porcine epidemic diarrhea virus (PEDV),transmissible gastroenteritis virus (TGEV),and porcine rotavirus (PoRV) from 394 tissue samples collected from the pig farms in 8 cities of Inner Mongolia were tested.Mgene of the PEDV positive materials were cloned and analyzed along with the sequence alignment and phylogenetic trees of 48Mgene sequences from other domestic and international.The tested results indicated that the positive rates of PEDV and PoRV were 63.96% and 2.03%,respectively,yet the TGEV tested negative,The Mixed infection rate of PEDV and PoRV was 2.03%.Phylogenetic analysis indicated that CH/NMG/ XLGL strain stayed close relative with classic strains such as CV777,located at G2.The rest of the strains stayed close relatives with the domestic many provinces before 2012,and Thailand,South Korea,Russia,Vietnam and other neighboring countries were same branch,G1-1.United States,in particular,the nucleotide sequence homology was 99.5%-100%.From 2013 until now,the main pathogeny for pig diarrhea in Inner Mongolia was PEDV,followed by PoRV.The infection degree was different in varying cities,and pigs of all ages can be infected,especially the suckle pigs and the sow.Most of the prevalent strains exhibited higher affinity with the strains isolated from the most provinces and cities domestic since 2012,but the stains were far apart from Inner Mongolia strains isolated before 2007,vaccine strains and classic strains,and some sites appeared base mutations.
porcine epidemic diarrhea virus;transmissible gastroenteritis virus;porcine rotavirus;RT-PCR;Mgene;Inner Mongolia
10.11843/j.issn.0366-6964.2015.09.018
2014-11-27
内蒙古自治区自然科学基金(980202);内蒙古自治区2014年博士研究生科研创新重点项目(B20141012908Z)
刘艳成(1988-),男,蒙古族,内蒙古赤峰人,硕士生,主要从事畜禽传染病的研究,E-mail:liuyancheng513@163.com
*通信作者:杜雅楠,副教授,E-mail:yanandu@126.com
S858.285.3
A
0366-6964(2015)09-1620-09
