T-2毒素对BALB/c小鼠营养物质表观消化率及小肠形态结构的影响
2015-03-22杨俊花陈慧英赵志辉孙真真郭文博
杨俊花,陈慧英,韩 薇,赵志辉,孙真真,郭文博
(上海市农业科学院农产品质量标准与检测技术研究所,上海 201403)
T-2毒素对BALB/c小鼠营养物质表观消化率及小肠形态结构的影响
杨俊花,陈慧英,韩 薇,赵志辉*,孙真真,郭文博
(上海市农业科学院农产品质量标准与检测技术研究所,上海 201403)
本试验旨在研究T-2毒素对BALB/c小鼠粪便pH、水分以及肠道营养物质、矿物元素、氨基酸表观消化率和小肠形态结构的影响。选用平均体重为(20±2) g的BALB/c小鼠80只,随机分成4组,每组20只。4组分别为0(对照组)、0.4、1.0和2.5 mg·kg-1·BW T-2 毒素剂量组,连续灌胃28 d。结果表明,1.0 mg·kg-1·BW组小鼠粪便pH显著高于对照组和0.4 mg·kg-1·BW组(P<0.05),2.5 mg·kg-1·BW组则显著高于前3组(P<0.05或P<0.01)。粗蛋白、灰分、粗纤维和粗脂肪的表观消化率随T-2毒素添加量的增加而降低,不同处理组之间统计学差异均显著(P<0.05或P<0.01)。其次,与对照组相比,0.4 mg·kg-1·BW组矿物元素Ca、Fe、Mg、Na和P的消化率显著降低(P<0.01);1.0 和2.5 mg·kg-1·BW组Ca、Zn、Mg、K、Mn和P的消化率低于对照组和0.4 mg·kg-1·BW组(P<0.05或P<0.01),2.5 mg·kg-1·BW组显著低于1.0 mg·kg-1·BW组(P<0.01)。此外,1.0 mg·kg-1·BW组氨基酸Asp、Thr、Ser、Glu、Gly、Val、Ile、His、Ala、Leu、Phe、Lys、Arg和Pro的消化率显著低于对照组或0.4 mg·kg-1·BW组(P<0.05或P<0.01);2.5 mg·kg-1·BW组所有氨基酸指标均显著低于其他组(P<0.01)。同时,T-2的剂量超过1.0 mg·kg-1·BW时,小鼠肠道形态结构发生严重损伤,黏膜脱落、绒毛数量减少,与对照组和0.4 mg·kg-1·BW组相比,十二指肠、空肠和回肠均出现绒毛数量减少、长度降低、隐窝深度增加、绒毛长度/隐窝深度(V/C)比值降低,统计学差异显著(P<0.05或P<0.01)。由此可知,T-2毒素处理使肠道黏膜损伤,肠道pH升高,营养物质、矿物元素和氨基酸的表观消化率降低,且这种损伤和降低呈剂量效应关系。
T-2毒素;表观消化率;营养物质;矿物元素;氨基酸;肠道;形态结构;BALB/c小鼠
真菌毒素是一类由真菌在适宜的温度和湿度条件下产生的次级代谢产物,已报道存在有400多种。其中,T-2毒素由梨孢镰刀菌(F.Poae)、三线镰刀菌(F.tricinctum)、拟枝孢镰刀菌(F.sPorotricoides)等真菌在特定条件下产生,属A类单端孢霉烯族,是毒性最强的一种[1]。人畜误食不仅严重损害肝、肾、胰腺等组织,对上皮细胞也有刺激作用[2]。研究发现,畜禽摄入被单端孢霉烯族毒素污染的食物或饲料,极易引起肠道功能紊乱、营养物质吸收障碍、生长缓慢以及中毒死亡等[3-4]。而肠道作为机体的第一道防线,不仅可以防止外源性物质如饲料蛋白、天然毒素、微生物以及真菌毒素等入侵,同时也极易成为外源性物质的攻击靶标。K.Obremski等[5]指出,给猪短期饲喂含T-2毒素、脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)和玉米赤霉烯酮(Zearalenone,ZEA)混合污染的配合饲料,肠道上皮黏膜杯状细胞减少,内皮细胞和黏膜细胞增多。D.Sklan等[6]给火鸡饲喂浓度为1 ppm的T-2毒素污染饲料,空肠绒毛缩短、变薄,对形态结构产生显著影响。这些研究表明,T-2毒素能对肠道黏膜产生刺激作用,但是肠道作为营养物质消化吸收的主要场所,T-2毒素是否能对营养物质消化代谢产生影响,目前国内外研究报道较少。这可能是源于真菌毒素标准品价格昂贵,动物试验代价高而限制了研究的发展。
本试验采用T-2毒素标准品,观察不同剂量T-2毒素对BALB/c小鼠肠道基础营养物质、矿物元素、氨基酸以及肠道形态结构的影响,旨在填补国内外T-2毒素对肠道营养毒理学研究的空白,为T-2毒素其他毒性作用机制的深入研究和畜禽生产中真菌毒素污染防控提供参考和理论依据。
1 材料与方法
1.1 材料与仪器
T-2毒素标准品:粉末状,纯度≥99% (Pribolab,Singapore),购于北京普华仁生物技术开发有限公司。氨基酸标准品(Sigma,美国)购于西格玛奥德里奇(上海)贸易有限公司,其他常规试剂均为分析纯。
试验所用分析仪器包括日立L-8800全自动氨基酸分析仪(HITACHI,日本)、JY系列多功能电子天平(上海衡平仪器仪表厂)、便携式pH计(Thermo,梅特勒-托利多仪器上海有限公司)、酶标仪(Biorad,美国)、UDK 159全自动凯氏定氮仪(VELP,意大利)、马福炉、粗纤维测定仪、索氏抽提器、ICP-AES分析仪(Leeman,美国)及Parr 6300氧弹式热量仪(Parr,美国)等。
1.2 动物饲养管理
BALB/c小鼠80只,6周龄,体重18~22 g,清洁级,高压灭菌的小鼠颗粒饲料,均购自复旦大学实验动物科学部。室温维持23±2 ℃,相对湿度为40%~70%,光照周期12 h,自由饮水、采食,预饲1周。
1.3 试验方法
1.3.1 试验设计 将80只BALB/c小鼠随机分成4组,每组20个重复,每个重复1只,雌雄各半,分笼饲养。试验剂量设计参考T-2毒素的LD50(5~10 mg·kg-1·BW)和文献[6-7]的报道,在预试验基础上分别为对照组(灌胃灭菌生理盐水)、0.4、1和2.5 mg·kg-1·BW T-2毒素组,每只小鼠每次灌胃0.2 mL,试验持续28 d。基础日粮中营养物质成分含量见表1,所有成分含量测定均由本实验室完成。
表1 基础饲粮组成及营养水平(风干基础)

Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1).矿物质预混料为每千克饲料提供:FeSO4·7H2O 251.41 mg,CuSO4·5H2O 23.81 mg,MnSO4·H2O 155.37 mg,ZnSO4·7H2O 132.59 mg,Na2SeO30.22 mg,KI 0.4 mg。2).维生素预混料为每千克饲料提供:VA 4 000 IU,VD31 000 IU,VE 50 IU,VB16 mg,VB330 mg,VB516 mg,VB67 mg,VB112 mg,VB120.01 mg,VH 0.2 mg,VK32 mg。3).代谢能为计算值,其余为实测值
1).Mineral premix provides the following per kg of diet:FeSO4·7H2O 251.41 mg,CuSO4·5H2O 23.81 mg,MnSO4·H2O 155.37 mg,ZnSO4·7H2O 132.59 mg,Na2SeO30.22 mg,KI 0.4 mg.2).Vitamin premix provides the following per kg of diet:VA 4 000 IU,VD31 000 IU,VE 50 IU,VB16 mg,VB330 mg,VB516 mg,VB67 mg,VB112 mg,VB120.01 mg,VH 0.2 mg,VK32 mg.3).ME was a calculated value,while the others were measured values
1.3.2 样品采集 试验结束前4 d,每日进行粪便采集,方法:固定小鼠,将其尾部提起,用手指轻轻按压小鼠下腹部,每日重复5次。收集各组新鲜粪便于EP管中,将每只老鼠连续4 d收集的所有粪便样本混合,一部分用于pH和水分测定,一部分置于-20 ℃低温冰箱中保存用于测定营养物质等表观消化率。
试验结束后,将小鼠脱颈处死。剖开腹腔,手术剪取十二指肠、空肠、回肠各段中间部位约5 cm,剪除周围肠系膜及脂肪组织,沿肠线剪开,放入预冷PBS冲洗3次,除尽肠内容物。吸水纸除去多余水分,将组织块平放于包埋盒内,加入适量OCT包埋剂浸没组织,放入液氮速冻,后转入-80 ℃低温保存,用于HE染色。
1.3.3 粪便pH测定 准确称取新鲜粪便1 g,按1∶10(m/v)加入双蒸水中,均质混匀,静置半小时,取其上清液用便携式pH计测定pH[7]。
1.3.4 粪便水分含量的测定 采用烘干法[8]。准确称取1 g新鲜粪便,先置鼓风烘干箱内60 ℃干燥48 h,后转入105 ℃烘干3 h,直至恒重,称量,两次结果的差值为水分含量。
1.3.5 粪便中营养物质的消化试验 称取室温解冻后的粪便,先置鼓风烘干箱内60 ℃干燥48 h,后转入105 ℃烘干3 h,粉碎,过40目筛,干燥储存。按照不同国家标准和张丽英[9]公布的方法测定常规成分(粗蛋白、粗脂肪、粗纤维)和纯养分(氨基酸、能量、钙、磷、微量元素),并计算各营养物质消化率。
其中,凯氏定氮法测定粗蛋白质含量,参考GB/T 6432-1994;索氏浸提法测定粗脂肪含量,参考GB/T 6433-2006;参考GB/T 6434-2006采用酸碱消煮法测定粗纤维含量;氧弹式热量仪测定饲料和粪便中的能量[9];参考GB/T 18246-2000采用日立L-8800全自动氨基酸分析仪测定氨基酸含量;微波消解电感耦合等离子发射光谱法(ICP-AES)测定钙(Ca)、总磷(P)和矿物元素铁(Fe)、铜(Cu)、锌(Zn)、锰(Mn)、镁(Mg)、钠(Na)、钾(K)等无机矿物元素含量[10]。参考GB/T 23742-2009测定饲料、粪便中酸性不溶性灰分(Acid insoluble ash,AIA)含量。所有营养物质的表观消化率计算参考公式:
营养物质表观消化率(%)=100%-

1.4 数据统计
所有数据采用SPSS 17.0软件进行统计分析。差异显著性检验采用单因子方差分析(one-way ANOVA),LSD进行多重比较,P<0.05为差异显著,P<0.01为差异极显著,所有结果均以“平均值±标准误”表示。
2 结 果
2.1 T-2毒素处理对BALB/c小鼠肠道营养物质表观消化率的影响
表2结果显示,T-2毒素处理BALB/c小鼠粪便中pH呈逐渐升高趋势,1 mg·kg-1·BW组显著高于对照组和0.4 mg·kg-1·BW组(P<0.05),2.5 mg·kg-1·BW组则显著高于前3组,统计学差异显著(P<0.05或P<0.01)。粗蛋白、灰分、粗纤维、粗脂肪以及能量的表观消化率随T-2毒素灌胃剂量的提高呈下降趋势,0.4 mg·kg-1·BW组粗蛋白、灰分、粗纤维和粗脂肪消化率分别显著低于对照组(P<0.05或P<0.01),1 mg·kg-1·BW组则分别显著低于对照组和0.4 mg·kg-1·BW组(P<0.05或P<0.01)。2.5 mg·kg-1·BW组粗蛋白、灰分、粗纤维、粗脂肪消化率以及能量水平均低于前3组,且统计学差异极显著(P<0.01)。
2.2 T-2毒素处理对BALB/c小鼠矿物元素表观消化率的影响
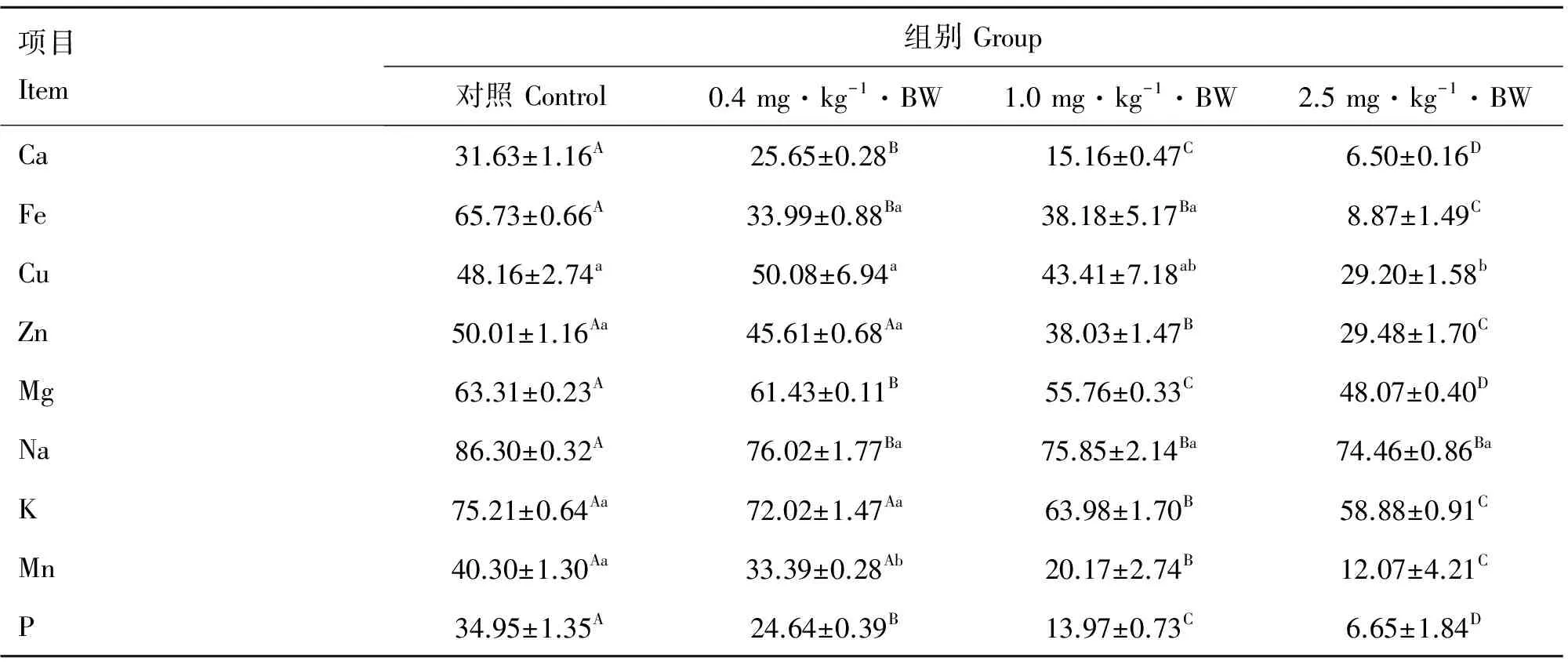
表3结果显示了T-2毒素处理BALB/c小鼠粪便中矿物元素表观消化率的变化。与对照组相比,0.4 mg·kg-1·BW组的Ca、Fe、Mg、Na、Mn和P的消化率显著降低(P<0.05或P<0.01)。1 mg·kg-1·BW组除Cu外,其他矿物元素的消化率均极显著低于对照组(P<0.01),其中Ca、Zn、Mg、K、Mn和P的消化率还显著低于0.4 mg·kg-1·BW组(P<0.01)。2.5 mg·kg-1·BW组除Cu、Na以外,其他矿物元素消化率均极显著低于前3组(P<0.01),Cu的消化率显著低于对照组和0.4 mg·kg-1·BW组(P<0.05),Na的消化率则极显著低于对照组(P<0.01)。
表2 不同浓度T-2毒素处理对BALB/c小鼠肠道营养物质表观消化率的影响

Table 2 Effect of T-2 toxin with different concentrations on nutrient apparent digestibility of BALB/c mice %
同行数据肩标无字母或有相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),下同
In the same row,values with no letter or the same small letter superscripts mean no significant difference(P>0.05),values with different small letter superscripts mean significant difference(P<0.05),and values with different capital letter superscripts mean extremely significant difference(P<0.01).The same as below
表3 不同浓度T-2毒素处理对BALB/c小鼠肠道矿物元素表观消化率的影响
Table 3 Effect of T-2 toxin with different concentrations on mineral apparent digestibility of BALB/c mice %
2.3 T-2毒素处理对BALB/c小鼠肠道氨基酸消化率的影响
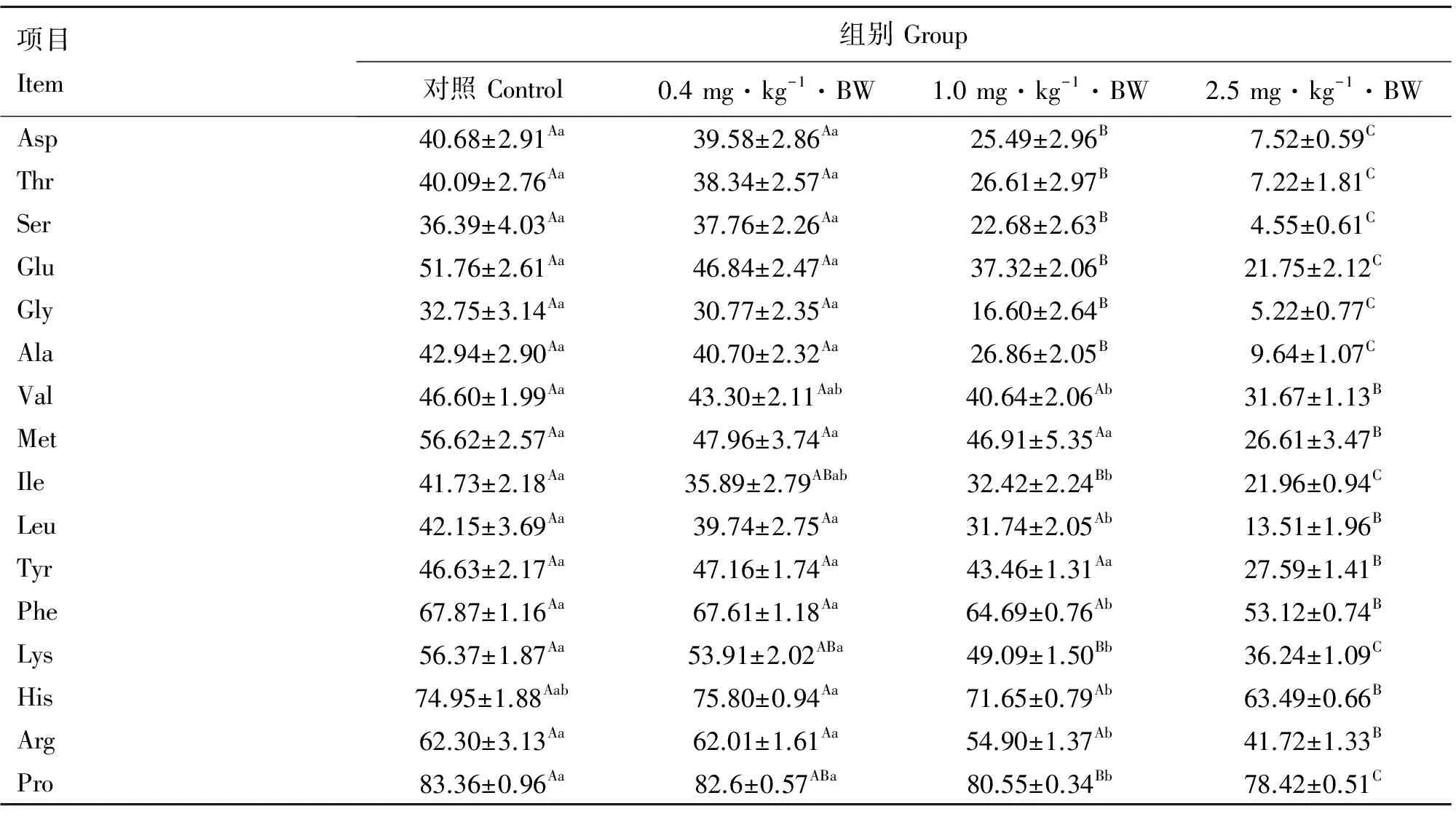
表4结果显示了T-2毒素处理BALB/c小鼠粪便中氨基酸表观消化率的变化。与对照组相比,0.4 mg·kg-1·BW组不同种类氨基酸消化率没有显著变化(P>0.05)。1 mg·kg-1·BW组Asp、Thr、Ser、Glu、Gly、Ala、Leu、Phe、Lys、Arg和Pro的消化率显著低于对照组和0.4 mg·kg-1·BW组(P<0.05或P<0.01),Val和Ile的消化率只显著低于对照组(P<0.05),His的消化率则显著低于0.4 mg·kg-1·BW组。2.5 mg·kg-1·BW组所有氨基酸的消化率均显著低于前3组,统计学差异极显著(P<0.01)。
2.4 T-2毒素处理对BALB/c小鼠肠道组织形态的影响
图1和表5结果显示,随着T-2毒素添加剂量的增加,小鼠十二指肠、空肠和回肠形态结构出现不同程度的损伤。0.4 mg·kg-1·BW组损伤程度较小,只有回肠绒毛长度降低(图1 B3),与对照组相比差异极显著(P<0.01)。1 mg·kg-1·BW剂量组,不同肠段均表现出绒毛数量减少、长度降低、隐窝深度增加(图1 C1,C2,C3),其中绒毛长度极显著低于对照组和0.4 mg·kg-1·BW组(P<0.01),隐窝深度则显著高于前两组(P<0.05或P<0.01),十二指肠和空肠绒毛长度/隐窝深度(V/C)比值显著低于前两组(P<0.05或P<0.01),回肠V/C比值显著低于对照组(P<0.05)。2.5 mg·kg-1·BW剂量组损伤更为严重,肠道黏膜脱落、绒毛数量减少、隐窝深度增加(图1 D1,D2,D3),绒毛长度显著低于前3组(P<0.05或P<0.01),十二指肠和回肠隐窝深度显著高于前3组,空肠隐窝深度显著高于对照组和0.4 mg·kg-1·BW组(P<0.05),十二指肠和空肠V/C比值显著低于前3组(P<0.05或P<0.01),回肠V/C比值显著低于对照组和0.4 mg·kg-1·BW组(P<0.05)。
表4 不同浓度T-2毒素处理对BALB/c小鼠肠道氨基酸表观消化率的影响
Table 4 Effect of T-2 toxin with different concentrations on amino acid apparent digestibility of BALB/c mice %
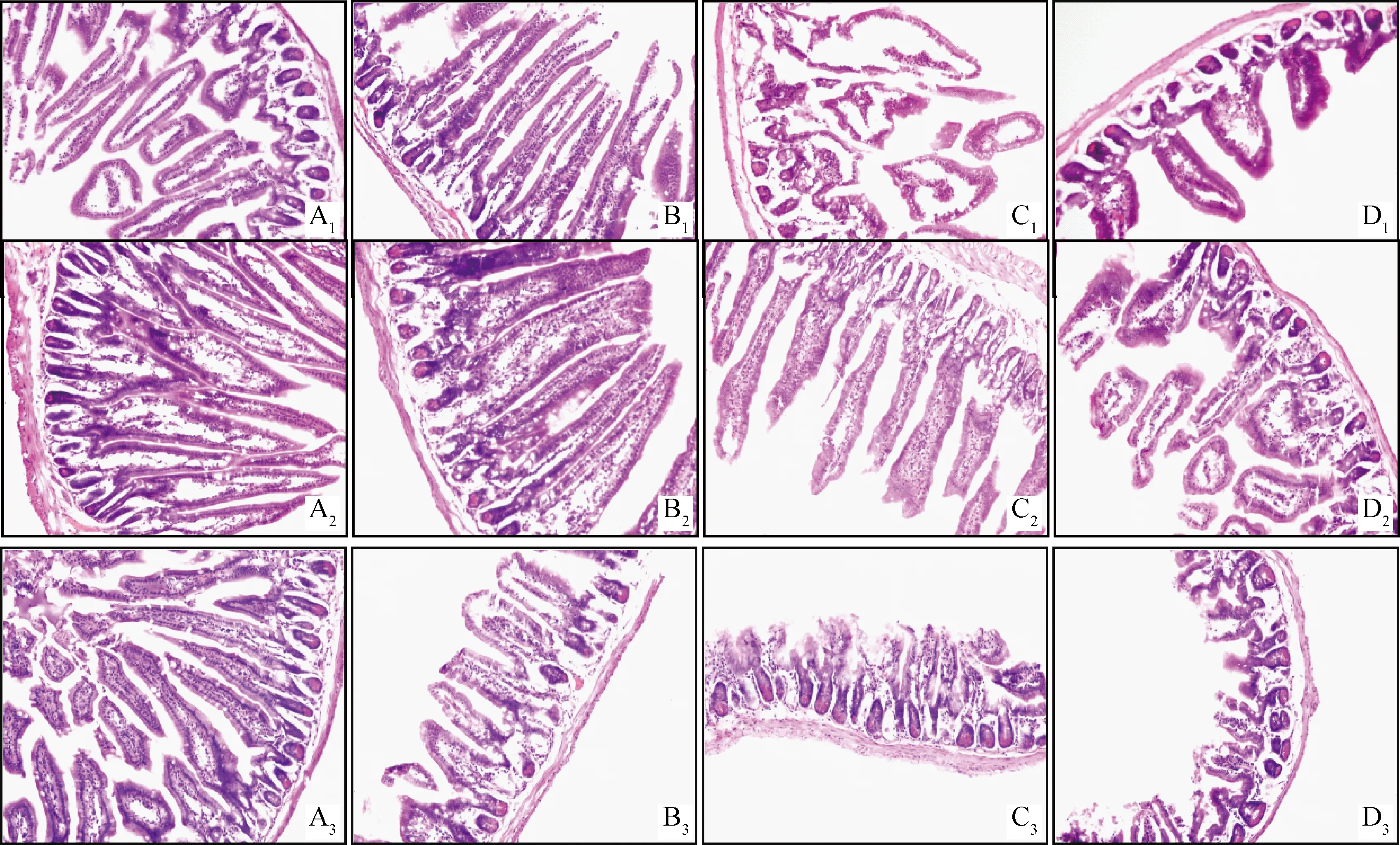
A1、A2、A3.对照组;B1、B2、B3.0.4 mg·kg-1·BW组;C1、C2、C3.1.0 mg·kg-1·BW组;D1、D2、D3.2.5 mg·kg-1·BW组A1,A2,A3.Control group;B1,B2,B3.0.4 mg·kg-1·BW group;C1,C2,C3.1.0 mg·kg-1·BW group;D1,D2,D3.2.5 mg·kg-1·BW group图1 不同浓度T-2毒素处理BALB/c小鼠十二指肠、空肠、回肠形态结构变化 200×Fig.1 Morphology change of duodenum,jejunum,ileum exposed to different levels of T-2 toxin in BALB/c mice 200×
表5 不同浓度T-2毒素处理BALB/c小鼠不同肠段黏膜结构的变化
Table 5 Change of mucosal structure in different intestinal segments exposed to different levels of T-2 toxin in BALB/c mice

项目Item组别Group对照Control0.4mg·kg-1·BW1.0mg·kg-1·BW2.5mg·kg-1·BW十二指肠duodenum绒毛长度/μmVillouslength263.67±22.16Aa259.39±27.54Aa176.72±18.94Bb134.39±14.54Bc隐窝深度/μmCryptdepth85.19±12.84Bc89.83±24.01Bc109.58±16.72ABb116.83±29.55Aa绒毛长度/隐窝深度V/C3.09±0.34Aa2.88±0.52Aa1.61±0.25Bb1.15±0.26Cc空肠jejunum绒毛长度/μmVillouslength324.76±32.45Aa329.64±43.21Aa285.65±28.73Bb234.39±43.52Bc隐窝深度/μmCryptdepth65.14±12.84a64.29±8.72a82.95±16.72b86.25±11.38b绒毛长度/隐窝深度V/C4.98±0.89Aa5.12±1.02Aa3.44±0.13ABb2.71±0.49Bc回肠ileum绒毛长度/μmVillouslength221.83±41.74A198.54±23.43B163.67±13.73C135.55±16.25D隐窝深度/μmCryptdepth92.31±21.33Bc107.91±14.35Bbc114.84±10.22ABb133.25±11.3Aa绒毛长度/隐窝深度V/C2.40±0.13a1.83±0.34ab1.42±0.08bc1.01±0.11c
3 讨 论
3.1 T-2毒素处理对BALB/c小鼠肠道营养物质消化率的影响
肠道是机体营养物质吸收和转运的主要部位,外界有毒有害物质的进入极易对营养物质的消化吸收产生影响。本试验小鼠灌胃T-2毒素后,粗蛋白、灰分、粗纤维、粗脂肪及能量等营养物质的表观消化率显著降低。笔者推测可能与pH的升高有关,pH是反映动物体内消化环境的重要因素之一,酸性条件下可促进饲料中营养物质的消化吸收、抑制病原微生物的生长、有利于有益酸性菌的生存,提高动物生长性能和饲料利用率、增强机体抗病能力[12]。本试验中1.0和2.5 mg·kg-1·BW T-2毒素处理使肠道内容物pH升高,可能是引起营养物质消化率降低的原因之一。此外,早期的研究报道指出T-2毒素作用使空肠葡萄糖吸收率降低,动物生产性能下降[13],本研究在前期试验中也发现了BALB/c小鼠的体重明显降低,而单端孢霉烯族的另一种真菌毒素脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)研究指出其作用主要源于真菌毒素对肠道黏膜的损伤作用[14],本试验也得到了相同的结果。可见,T-2毒素对肠道营养物质消化率的影响主要是由于对肠道黏膜的损伤进而导致肠道pH升高进而干扰了营养物质的消化吸收。
3.2 T-2毒素处理对BALB/c小鼠肠道矿物元素消化率的影响
矿物元素是动物体所必须的重要营养要素之一,直接或间接地参与了机体几乎所有的生理和生化过程,对各种生命活动有着极其重要的意义。试验中BALB/c在经T-2毒素处理后,肠道Ca、P、Fe、Cu、Zn、Mg、Na、K、Mn等矿物元素的表观消化率随T-2毒素灌胃剂量的增加逐渐降低,所有矿物元素表观消化率水平的降低主要与肠道黏膜损伤有关。目前真菌毒素对肠道矿物元素消化吸收的研究非常少,只有G.Hunder等[14]指出,给小鼠饲喂低剂量的DON,对肠道Fe元素的消化率无显著影响,与本试验结果不一致。这可能是由于T-2毒素毒性远大于DON,因此对肠道黏膜造成严重损伤,从而影响了矿物元素的吸收。
3.3 T-2毒素处理对BALB/c小鼠肠道氨基酸消化率的影响
氨基酸不仅是机体蛋白质合成的基本单位,亦是多种生物活性分子的前体及能量代谢底物。肠道是氨基酸代谢吸收的主要场所,由肠道黏膜担负非必须氨基酸和必须氨基酸的代谢。本研究T-2毒素处理后,日粮中氨基酸的表观消化率均显著降低,并具有剂量依赖性。一方面与T-2毒素对肠道的黏膜损伤有关[6],抑制了氨基酸转运载体的表达。尽管目前还未有T-2毒素对氨基酸消化率影响的报道,但有研究指出DON可降低蛋鸡肠道Na依赖性氨基酸普氨酸的消化吸收,并对Na依赖性氨基酸转运载体的表达具有抑制作用[15-16];另一方面,可能与T-2毒素干扰肠道微生物菌群结构平衡有关,有研究指出部分动物肠上皮细胞中因为缺乏关键酶不能代谢生理浓度的赖氨酸、色氨酸、苏氨酸等[17],需要某些特定的微生物组合协同作用代谢这些氨基酸[18],但T-2毒素是否能通过影响肠道微生物菌群结构的组成进而改变氨基酸的消化吸收代谢,将有待进一步试验证明。
3.4 T-2毒素处理对BALB/c小鼠肠道组织形态的影响
肠道是机体消化、吸收营养物质的重要场所。肠绒毛作为肠道的重要组成部分,主要负责营养物质的吸收,增加肠壁的表面积。绒毛长度越高说明成熟细胞越多,对营养物质的吸收功能越强;隐窝深度则反映细胞的成熟率,当细胞成熟率增加时,隐窝深度变浅,分泌功能增强,绒毛长度/隐窝深度综合反映了小肠的吸收功能,比值越大说明小肠的吸收功能越强[19]。T-2毒素作为一种天然污染物,其吸收和各组织脏器内的分布都是通过肠道的吸收调控完成,同时肠道也成为T-2毒素毒性作用的首要攻击对象。本试验在灌胃不同浓度剂量的T-2毒素之后,小鼠十二指肠、空肠、回肠都随灌胃剂量的增加呈现肠绒毛减少、脱落、绒毛长度降低、肠隐窝深度增加、绒毛长度/隐窝深度的比值减小。表明T-2毒素可使肠道黏膜严重损伤,与D.Sklan等[6]研究T-2毒素对空肠黏膜损伤的结果一致。同时,其他研究也证实即使是低剂量的T-2毒素也可对口腔、胃及肠道黏膜造成坏死性损伤[20-22]。
4 结 论
不同剂量T-2毒素可使BALB/c小鼠肠道pH升高,粗蛋白、灰分、粗纤维、粗脂肪、能量、矿物元素及氨基酸的表观消化率降低,十二指肠、空肠和回肠绒毛脱落、长度降低、肠隐窝深度变深、V/C比率降低,并且T-2毒素剂量越大,营养物质的表观消化率越低、绒毛损伤程度越大。综合分析,T-2毒素毒性较大,可使肠道黏膜发生损伤进而影响各营养物质的消化吸收。
[1] UENO Y.Toxicological features of T-2 toxin and related trichothecenes[J].FundApplToxicol,1984,2(2):S124-S132.
[2] PARENT M D.Haematotoxicity of trichothecenes[J].ToxicolLett,2004,153(1):75-81.
[3] ROTTER B A,PRELUSKY D B,THOMPSON B K.The role of tryptophan in DON induced feed rejection[J].JEnvironSciHealthB,1996,31(6):1279-1288.[4] PESTKA J J,SMOLINSKI A T.Deoxynivalenol:toxicology and potential effects on humans[J].JToxicolEnvironHealthBCritRev,2005,8(1):39-69.
[5] OBREMSKI K,ZIELONKA L,GAJECKA M,et al.Histological estimation of the small intestine wall after administration of feed containing deoxynivalenol,T-2 toxin and zearalenone in the pig[J].PolJVetSci,2008,11(4):339-345.
[6] SKLAN D,SHELLY M,MAKOVSKY B,et al.The effect of chronic feeding of diacetoxyscirpenol and T-2 toxin on performance,health,small intestinal physiology and antibody production in turkey poults[J].BrPoultSci,2003,44(1):46-52.
[7] 陈国营,詹 凯,朱由彩,等.枯草芽孢杆菌及其发酵豆粕对蛋鸡肠道菌群和粪便中N、S含量的影响[J].中国家禽,2012,34(6):10-15. CHEN G Y,ZHAN K,ZHU Y C,et al.Effects of bacillus subtilis and fermented soybean meal on intestinal microflora,fecal nitrogen and sulfur content in layers[J].ChinaPoultry,2012,34(6):10-15.(in Chinese)
[8] 侯振平,印遇龙,王文杰,等.乳铁蛋白素B和天蚕素P1对投喂大肠杆菌断奶仔猪生长及肠道微生物区系的影响[J].动物营养学报,2011,23(9):1536-1544. HOU Z P,YIN Y L,WANG W J,et al.Effects of lactoferricin b and cecropin p1 on growth and gut microflora in weaned piglets challenged with enterotoxigenicEscherichiacoli[J].ChineseJournalofAnimalNutrition,2011,23(9):1536-1544.(in Chinese)
[9] 张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2003. ZHANG L Y.Feed analysis and determining technique[M].Beijing:Chinese Agricultural University Press,2003.(in Chinese)
[10] 辛国省,李爱华,巫 亮,等.微波消解ICP-AES法测定配合饲料中无机元素[J].草业科学,2011,28(7):1384-1386. XIN G S,LI A H,WU L,et al.Determination of inorganic elements in formula feed by microwave digestion ICP-AES[J].PrataculturalScience,2011,28(7):1384-1386.(in Chinese)
[11] 田玉旺,李 琳,朱红艳,等.提高冷冻切片制片质量的方法探讨[J].中国组织化学与细胞化学杂志,2010,19(4):408-410. TIAN Y W,LI L,ZHU H Y,et al.Discussion on a method for improvement of preparation for frozen sections[J].ChineseJournalofHistochemistryandCytochemistry,2010,19(4):408-410.(in Chinese)
[12] 赵国先,宋海彬,马可为,等.葡萄糖氧化酶制剂对肉鸡肠道pH及盲肠微生物的影响[J].河北农业大学学报,2009,32(4):83-87. ZHAO G X,SONG H B,MA K W,et al.Effects of glucose oxidase on intestinal tract pH and cecum microorganism in broiler chickens[J].JournalofAgriculturalUniversityofHebei,2009,32(4):83-87.(in Chinese)
[13] KUMAGAI S,SHIMIZU T.Effects of fusarenon-X and T-2 toxin on intestinal absorption of monosaccharide in rats[J].ArchToxicoly,1988,61(6):489-495.
[14] HUNDER G,SCHUMANN K,STRUGALA G,et al.Influence of subchronic exposure to low dietary deoxynivalenol,a trichothecene mycotoxin,on intestinal absorption of nutrients in mice[J].FoodChemToxicol,1991,29(12):809-814.
[15] AWAD W A,BÖHM J,RAZZAZI-FAZELI E,et al.In vitro effects of deoxynivalenol on electrical properties of intestinal mucosa of laying hens[J].PoultSci,2005,84(6):921-927.
[16] AWAD W A,REHMAN H,BÖHM J,et al.Effects of luminal deoxynivalenol and L-proline on electrophysiological parameters in the jejunums of laying hens[J].PoultSci, 2005,84(6):928-932.
[17] CHEN L,LI P,WANG J,et al.Catabolism of nutritionally essential amino acids in developing porcine enterocytes[J].AminoAcids,2009,37(1):143-152.
[18] DAI Z L,ZHANG J,WU G,et al.Utilization of amino acids by bacteria from the pig small intestine[J].AminoAcids,2010,39(5):1201-1215.
[19] 邓 波,万 晶,徐子伟,等.脱氧雪腐镰刀菌烯醇吸附剂对断奶仔猪生长性能、血清生化指标及肠道形态的影响[J].动物营养学报,2014,26(5):1294-1301. DENG B,WAN J,XU Z W,et al.Effects of deoxynivalenol adsorbent on growth performance,serum biochemical indexes and intestinal morphology of weaner piglets[J].ChineseJournalofAnimalNutrition,2014,26(5):1294-1301.(in Chinese)
[20] ADEMOYERO A A,HAMILTON P B.Mouth lesions in broiler chickens caused by scirpenol mycotoxins[J].PoultSci,1991,70(10):2082-2091.
(编辑 郭云雁)
Influence of T-2 Toxin on Nutrient Apparent Digestibility and Small Intestinal Morphology in BALB/c Mice
YANG Jun-hua,CHEN Hui-ying,HAN Wei,ZHAO Zhi-hui*,SUN Zhen-zhen,GUO Wen-bo
(InstituteforAgri-FoodStandardsandTestingTechnology,ShanghaiAcademyofAgriculturalSciences,Shanghai201403,China)
This study was conducted to investigate the effect of T-2 toxin exposed to BALB/c mice on pH and moisture content in feces,apparent digestibility of nutrients,mineral elements and amino acids,as well as morphological structure in small intestine.A total of 80 BALB/c mice weighted about(20±2) g were randomly allotted to 4 groups(20 mice per group).The mice were fed one of four kinds of diets(0,0.4,1.0 and 2.5 mg·kg-1·BW T-2 toxin exposed daily via intragastric administration for 28 d).The results showed as follows:the pH in feces in 1.0 mg·kg-1·BW group was higher than that in control and 0.4 mg·kg-1·BW groups(P<0.05),pH in feces in 2.5 mg·kg-1·BW group was the highest among all 4 groups(P<0.05 orP<0.01).The apparent digestibility of crude protein,ash,crude fiber and ether extract were greatly decreased with the increasing of T-2 toxin addition,and there were significant difference among different treatment groups(P<0.05 orP<0.01).The apparent digestibility of mineral elements(including Ca,Fe,Mg,Na and P) of 0.4 mg·kg-1·BW group was largely reduced compared with control group(P<0.01).The mineral elements(including Ca,Zn,Mg,K,Mn and P) in 1.0 and 2.5 mg·kg-1·BW groups were lower than those of control and 0.4 mg·kg-1·BW groups(P>0.05 andP<0.01),and 2.5 mg·kg-1·BW group was significantly lower than 1.0 mg·kg-1·BW group(P<0.01).The apparent digestibility of amino acid(including Asp,Thr,Ser,Glu,Gly,Ala,Val,Ile,Leu,Phe,Lys,His,Arg and Pro) in 1.0 mg·kg-1·BW group were also observably declined compared with control or 0.4 mg·kg-1·BW groups(P<0.05 andP<0.01),and the digestibility of all kinds of amino acid in 2.5 mg·kg-1·BW group were the lowest among all the 4 groups(P<0.01).Moreover,the duodenum,jejunum and ileum presented mucosal damage and microvilli exfoliated when the dose of T-2 toxin was more than 1.0 mg·kg-1·BW.In addition,reduction of villous number and villous length,increase of crypt depth,decrease of the ratio of villus length to crypt depth were also observed in 1.0 and 2.5 mg·kg-1·BW groups,and there were significant differences between 1.0,2.5 mg·kg-1·BW groups,and control,0.4 mg·kg-1·BW groups(P<0.05 andP<0.01),respectively.It was concluded that the supplementation of T-2 toxin could damage intestinal mucosal,induce the increase of pH,decrease the apparent digestibility of nutrient,mineral elements and amino acid,and all these damage and decreasing were associated with dose-effect relationship of T-2 toxin.
T-2 toxin;apparent digestibility;nutrient;mineral elements;amino acid;intestine;morphology;BALB/c mouse
10.11843/j.issn.0366-6964.2015.09.013
2015-01-16
上海市农委科技兴农重点攻关项目[沪农科攻字(2013)第3-8号];上海市农委青年人才成长计划[沪农青字(2015)第1-34号]
杨俊花(1980-),女,山西清徐人,助理研究员,博士,主要从事饲料及饲料添加剂毒理学研究, E-mail:yangjunhua303@126.com
*通信作者:赵志辉,研究员,主要从事农产品质量安全风险评估研究,E-mail:zhao9912@hotmail.com
S815
A
0366-6964(2015)09-1584-09
