胍基乙酸和甜菜碱对育肥猪肌肉能量代谢和肉品质的影响
2015-03-22李蛟龙周光宏
刘 洋,李蛟龙,张 林,高 峰,周光宏
(南京农业大学动物科技学院/江苏省动物源食品生产与安全保障重点实验室,南京 210095)
胍基乙酸和甜菜碱对育肥猪肌肉能量代谢和肉品质的影响
刘 洋,李蛟龙,张 林,高 峰*,周光宏
(南京农业大学动物科技学院/江苏省动物源食品生产与安全保障重点实验室,南京 210095)
旨在研究日粮中添加胍基乙酸及联合添加胍基乙酸和甜菜碱对育肥猪肌肉能量代谢和肉品质的影响。试验选用杜长大三元杂交阉割公猪180头,随机分为3组:对照组,饲喂基础日粮;胍基乙酸组,饲喂基础日粮+1 g·kg-1胍基乙酸;胍基乙酸+甜菜碱组,饲喂基础日粮+1 g·kg-1胍基乙酸+0.5 g·kg-1甜菜碱,每组3个重复(圈),每个重复20头猪。试验期为15 d。结果表明:日粮中添加胍基乙酸及胍基乙酸+甜菜碱能显著降低猪肉的滴水损失(P<0.01)、硬度、蒸煮损失和剪切力值(P<0.05),并提高pH45 min(P<0.05)、pH24 h(P<0.01),肌酸含量(P<0.05)、磷酸肌酸含量(P<0.01)和ATP含量(P<0.001)。结果表明:饲料中添加胍基乙酸及联合添加胍基乙酸和甜菜碱能通过调节育肥猪能量代谢改善肉品质。
胍基乙酸;甜菜碱;猪;能量代谢;肉品质
胍基乙酸又称胍乙酸(Guanidine acetic acid,GAA) 和N-咪基甘氨酸,是动物体内合成肌酸(Creatine,Cr) 的主要内源性物质,是合成Cr的前体物质,而Cr是能量代谢中的重要物质,是能量的贮存场所[1-2]。前期研究表明[3-5],宰前日粮中添加Cr可增加肌肉组织中Cr和磷酸肌酸(Phosphocreatine,PCr) 的含量,在动物宰后ATP(Adenosine triphosphate) 供能不足时,提供磷酸基团供ADP(Adenosine diphosphate) 重新合成ATP,延缓糖酵解生成的乳酸积累,从而提高系水力,改善肌肉嫩度,进而提高肉品质。
由于GAA在体内形成Cr时需要甲基,本试验假设添加GAA后育肥猪体内甲基供体不足,需要额外添加甲基供体。因为甜菜碱是稳定性好的三甲基供体[6],所以本试验选择添加 0.5 g·kg-1的甜菜碱来满足GAA的需要,促使GAA在体内合成Cr。本试验拟通过研究GAA单独添加及GAA和甜菜碱联合添加对育肥猪肌肉能量代谢和肉品质的影响,为其在畜牧生产中的应用提供科学依据。
1 材料与方法
1.1 试验材料
杜长大三元杂交阉割公猪;试验场地均由常州美农农牧科技有限公司提供;食品级胍基乙酸(纯度≥99%)、甜菜碱(纯度≥99%)均购自天津天成制药有限公司。
1.2 试验设计
选择生长发育良好、体重相近((102.35±3.68) kg) 的杜长大阉公猪180头,随机分为3组,分别为对照组(CON组):饲喂基础日粮;胍基乙酸组(GAA组):在基础日粮中添加1 g·kg-1GAA;胍基乙酸+甜菜碱组(Combination of GAA and betaine,CGB组):在基础日粮中添加1 g·kg-1GAA和0.5 g·kg-1甜菜碱。每组3个重复(圈),每个重复20头猪。
基础日粮参照美国NRC(2012) 肥育猪的营养需要配合而成,基础日粮配方及营养水平见表1。预试期为7 d,在此期间对试验猪打耳号、驱虫和防疫注射。正式试验期为15 d。
1.3 样品采集与处理
饲养试验结束后,宰前禁食12 h(自由饮水)。每个处理组随机挑选9头猪运送到屠宰场,经过电击晕、放血、褪毛、标记、去内脏、劈半后,胴体被均分为两半,迅速采集大腿后侧半腱肌的组织样品3份,1份装于塑料袋中密封置于4 ℃冰箱用于测定肌肉的滴水损失,1份用于肉色、pH和质构分析,另外1份用于测定其蒸煮损失及剪切力。另取10 g肌肉于冻存管中,立即置于液氮中冻存,以备后续试验。
表1 试验育肥猪日粮组成与营养水平
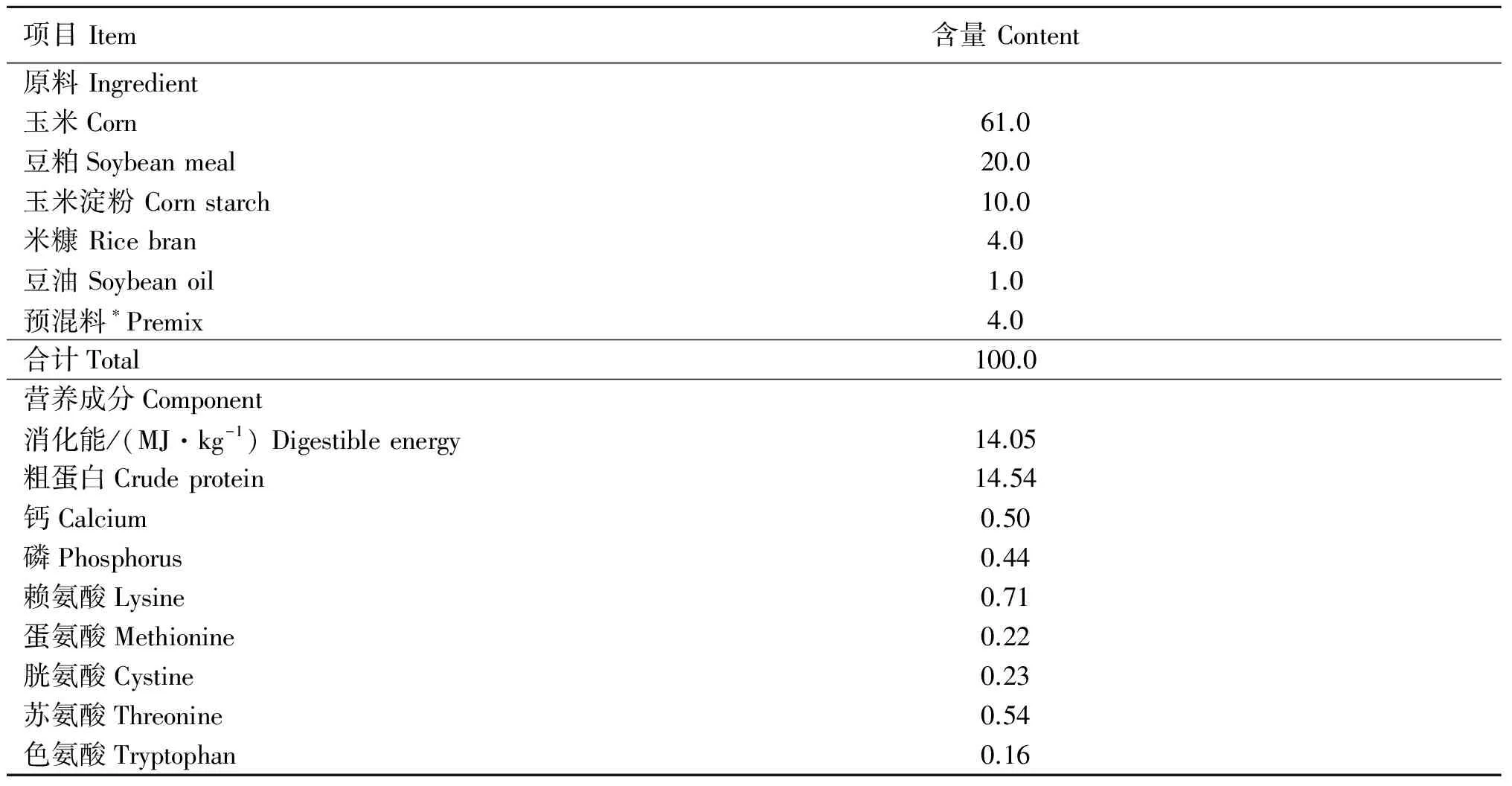
Table 1 Ingredient composition and calculated nutrient levels of the basal diets %
*.预混料为每千克日粮提供:钙 4 200 mg;磷 900 mg;铁 100 mg;锌 100 mg;锰 30 mg;铜 10 mg;硒0.3 mg;碘 0.5 mg,维生素A 5 000 IU;维生素D31 000 IU;维生素E 20 IU;维生素K 3.0 mg;维生素B12.0 mg;维生素B26.0 mg;维生素B63.0 mg;维生素B1230 μg;烟酸 20 mg;泛酸 8 mg;叶酸 0.5 mg;胆碱 300 mg
*.The premix provided the diet per kg as the following:4 200 mg calcium,900 mg phosphorus,100 mg iron,100 mg zinc,30 mg manganese,10 mg copper,0.3 mg selenium,0.5 mg iodine,5 000 IU vitamin A,1 000 IU vitamin D3,20 IU vitamin E,3.0 mg vitamin K,2.0 mg vitamin B1,6.0 mg vitamin B2,3.0 mg vitamin B6,30 μg cyanocobalamin,20 mg nicotinic acid,8 mg calcium pantothenate,0.5 mg folic acid,300 mg choline
1.4 肌肉常规养分测定
肌肉中水分、粗蛋白、粗脂肪和粗灰分含量的测定全部采用AOAC(1995) 方法[7]。水分含量测定用105 ℃烘箱干燥法[8],粗蛋白含量测定用半微量凯氏定氮法[9],粗脂肪含量测定用索氏抽提法[9],粗灰分含量测定在马福炉中550 ℃累计灼烧12 h至恒重,每样品测3个平行样,计算均值,作为测定结果。
1.5 质构测定
取2 cm半腱肌并去除外周的脂肪和结缔组织,用直径1 cm的圆形取样器顺肌纤维方向钻切肉样块,用质构仪(TMS-Pro,FTC,Virginia,USA) 测定。测定条件:样品下压变形量15%,测试前探头下降速度为 2.0 mm·s-1,测试速度为1.0 mm·s-1,测试后探头回程速度为 5.0 mm·s-1,触发力为 0.15 N,时间间隔为5 s,探头类型为 P-50,获取 200 pps,6个重复。TPA 参考 M.C.Bourne[10]的方法,硬度: TPA曲线第一压缩周期中第一个峰处力值;内聚性:两次压缩周期的曲线面积比;弹性:两次压缩周期中下压时间比;胶着性:硬度与内聚性的乘积;咀嚼性:硬度、内聚性和弹性三者乘积。
1.6 肉品质测定
1.6.1 pH测定 屠宰后肌肉45 min 和 24 h 的pH参照I.K.Straadt等[11]的方法,使用便携式pH计(HANNA Instruments,Cluj1Napoca,Romania) 测定,每块肌肉测定3个不同位置,计算平均值。
1.6.2 肉色测定 在4 ℃条件下放置24 h后进行肉色测定。参照J.E.Hayes等[12]的方法,将肉样切开,在空气中暴露20 min,用色差仪(Minolta Co.Ltd.,Osaka,Japan) 进行肉色测定,每块肉样测定3点,分别记录肉样的亮度值(L*)、红度值(a*)、黄度值(b*),计算均值,作为测定结果。
1.6.3 滴水损失测定 在4 ℃条件下放置24 h后进行滴水损失测定。参照K.O.Honikel[13]的方法,称取30 g左右的肉样,悬挂在泡沫箱中,放入4 ℃冷库自然滴水24 h,再次称重,计算前后差值。
1.6.4 蒸煮损失和剪切力测定 在4 ℃条件下放置72 h后进行蒸煮损失和剪切力值的测定。蒸煮损失参照V.E.Beattie等[14]方法,取20 g左右的肉样,密封于塑料中,于恒温水浴锅中用80 ℃水温加热至肉的中心温度达70 ℃,取出擦干、冷却至室温后称重,计算重量损失的百分率。剪切力参照Y.L.Yuan等[15]的方法,按与肌纤维呈垂直方向切取肉样(1 cm × 1 cm × 2 cm),用嫩度仪(东北农业大学,哈尔滨,中国) 以垂直于肌纤维方向测定剪切力,同源样本的重复度量次数为3次,记录3个肉样的剪切力值,计算平均数。单位用牛顿(N)表示。
1.7 腺苷酸、Cr、PCr测定
试剂:Cr、PCr、ATP、ADP、AMP(Adenosine monophosphate) 标准品;四丁基硫酸氢铵(TBAHS);乙腈、甲醇均为色谱纯;高氯酸、碳酸二氢钾、磷酸二氢钾、氢氧化钾均为分析纯。
腺苷酸测定:称取约300 mg组织样品于10 mL离心管中,加入1.5 mL预冷的7%HClO4溶液,浸提15 min,在高速分散器上制成匀浆液后,于4℃下以15 000 r·min-1离心10 min,移取850 μL上清液,用KOH调节pH至6.5。浸提10 min后,再于4 ℃下以15 000 r·min-1离心10 min,随后,吸取的上清液用45 μm滤膜过滤,而后取10 μL过滤后的上清液进行色谱分析。
色谱条件:色谱柱:Waters SunFire C18(5 μm,250 mm×4.6 mm) 色谱柱;流动相:V(甲醇)∶V(50 mmol·L-1磷酸缓冲液) =13.5︰86.5,内含2.5 mmol·L-1TBAHS,pH=7.00;流速:1.0 mL·min-1;柱温:25 ℃;进样量:10 μL;紫外检测波长:254 nm;运行时间:20 min。
Cr和PCr测定:称取约300 mg组织样品于10 mL离心管中,加入2 mL预冷的5%HClO4溶液,浸提15 min,在高速分散器上制成匀浆液后,于4 ℃下以10 000 r·min-1离心10 min,移取900 μL上清液,加入K2CO3调节pH至6.5。浸提10 min后,再于4 ℃下以10 000 r·min-1离心10 min,随后,吸取的上清液经45 μm滤膜过滤,取10 μL用于色谱分析。
色谱条件:色谱柱:Agilent Zorbax ODS-C18(5 μm,250 mm×4.6 mm);流动相:V(乙腈)∶V(29.4 mmol·L-1KH2PO4缓冲液) =2∶98,内含2.30 mmol·L-1TBAHS,pH=5.30,流速1.0 mL·min-1;柱温30 ℃;进样量20 μL;紫外检测波长210 nm;运行时间15 min。
1.8 数据处理与统计分析
采用SPSS20.0软件的One-way ANOVA先进行方差齐次性检验,再进行LSD多重比较, 结果利用平均数和平均标准误(SEM) 表示,P<0.05为差异显著。
2 结 果
2.1 胍基乙酸和胍基乙酸+甜菜碱对半腱肌常规养分的影响
GAA和甜菜碱对育肥猪半腱肌常规养分的影响见表2。与CON组相比,GAA组和CGB组的水分、粗蛋白、粗脂肪和粗灰分含量均无显著变化(P>0.05)。GAA组与CGB组之间也无显著差异(P>0.05)。
表2 胍基乙酸和胍基乙酸+甜菜碱对半腱肌常规养分的影响(n=9)
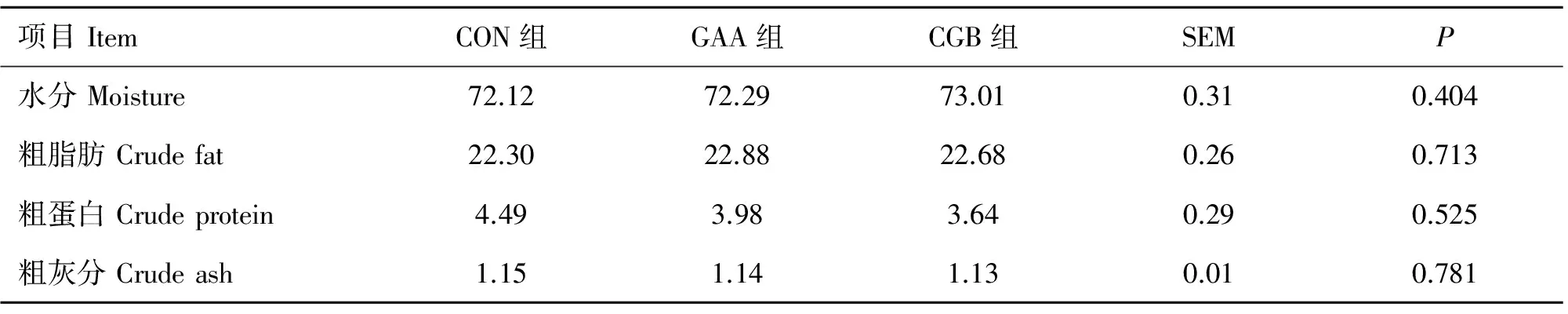
Table 2 Effects of guanidinoacetic acid supplementation and combination of guanidinoacetic acid and betaine on chemical composition in semitendinosus of finishing pigs(n=9) %
2.2 胍基乙酸和胍基乙酸+甜菜碱对半腱肌质构的影响
半腱肌质构测定结果见表3。与CON组相比,GAA组和CGB组的硬度显著下降(P<0.05),而内聚性、弹性、胶粘性和咀嚼性无显著变化(P>0.05)。GAA组与CGB组之间也无显著差异(P>0.05)。
表3 胍基乙酸和胍基乙酸+甜菜碱对半腱肌质构的影响(n=9)
Table 3 Effects of guanidinoacetic acid supplementation and combination of guanidinoacetic acid and betaine on textural characteristics in semitendinosus of finishing pigs(n=9)
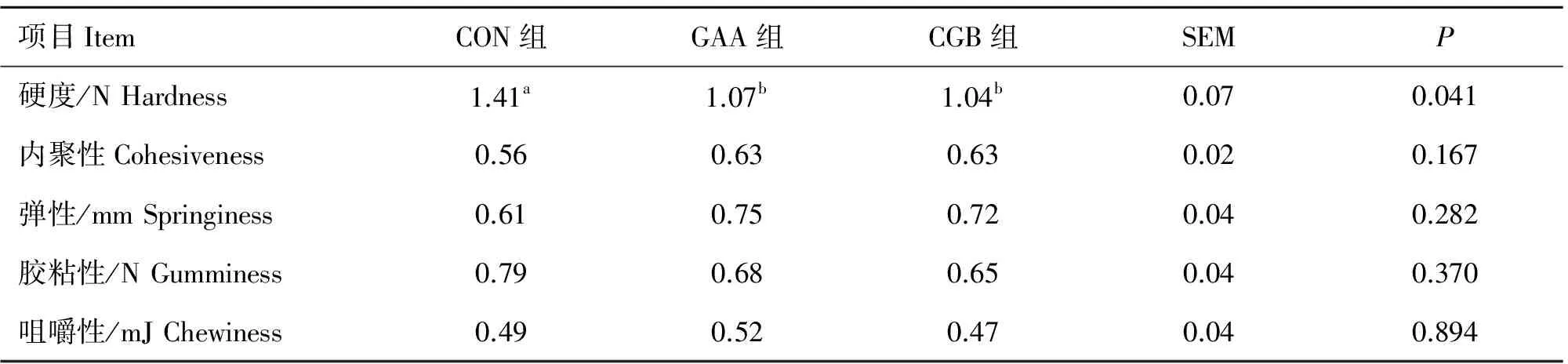
项目ItemCON组GAA组CGB组SEMP硬度/NHardness1.41a1.07b1.04b0.070.041内聚性Cohesiveness0.560.630.630.020.167弹性/mmSpringiness0.610.750.720.040.282胶粘性/NGumminess0.790.680.650.040.370咀嚼性/mJChewiness0.490.520.470.040.894
同行数据肩注小写字母不同者表示差异显著(P<0.05)
In the same row,values with different low-case letter superscripts mean significant difference(P<0.05)
2.3 胍基乙酸和胍基乙酸+甜菜碱对半腱肌肉品质的影响
肉质性状测定结果见表4。与CON组相比,饲喂GAA和CGB均可以显著提高半腱肌pH45 min(P<0.05),极显著提高pH24 h(P<0.01)。而饲喂GAA及CGB对L*值、a*值、b*值均无显著影响(P>0.05)。饲粮中添加GAA及CGB能够显著降低肌肉的蒸煮损失和剪切力(P<0.05),极显著降低滴水损失(P<0.01)。而GAA组与CGB组之间在肉品质方面无显著差异(P>0.05)。
2.4 胍基乙酸和胍基乙酸+甜菜碱对半腱肌腺苷酸和肌酸含量的影响
半腱肌腺苷酸和Cr含量见表5。与对照组相比,GAA组和CGB组显著升高了肌肉中Cr含量(P<0.05)、PCr含量(P<0.01)及ATP含量(P<0.001),而对ADP和AMP的含量无显著影响(P>0.05)。对于肌肉中腺苷酸和Cr含量,GAA组与CGB组之间无显著差异(P>0.05)。
3 讨 论
GAA是人和动物体内合成Cr的内源性物质,而Cr是细胞内能量代谢的重要分子,是暂时储存能量的场所。Cr被磷酸化后形成PCr,PCr是动物所有活细胞能量转移的关键物质。PCr和Cr一起组成磷酸原系统,参与ATP代谢。在机体ATP供能不足时,磷酸原系统提供P,供ADP重新合成ATP,以维持机体能量代谢的稳定。而GAA是Cr的天然前体物,饲粮中添加GAA可以提高Cr、PCr等高能量物质的储备,促进肌肉的能量代谢,减少碳水化合物、脂肪和蛋白质的分解供能。肌肉中大量的磷酸肌酸储备对宰后延缓糖酵解发生和pH下降速度,进而改善肉品质具有重要的作用。
表4 胍基乙酸和胍基乙酸+甜菜碱对半腱肌肉品质的影响(n=9)
Table 4 Effects of guanidinoacetic acid supplementation and combination of guanidinoacetic acid and betaine on meat quality in semitendinosus of finishing pigs(n=9)
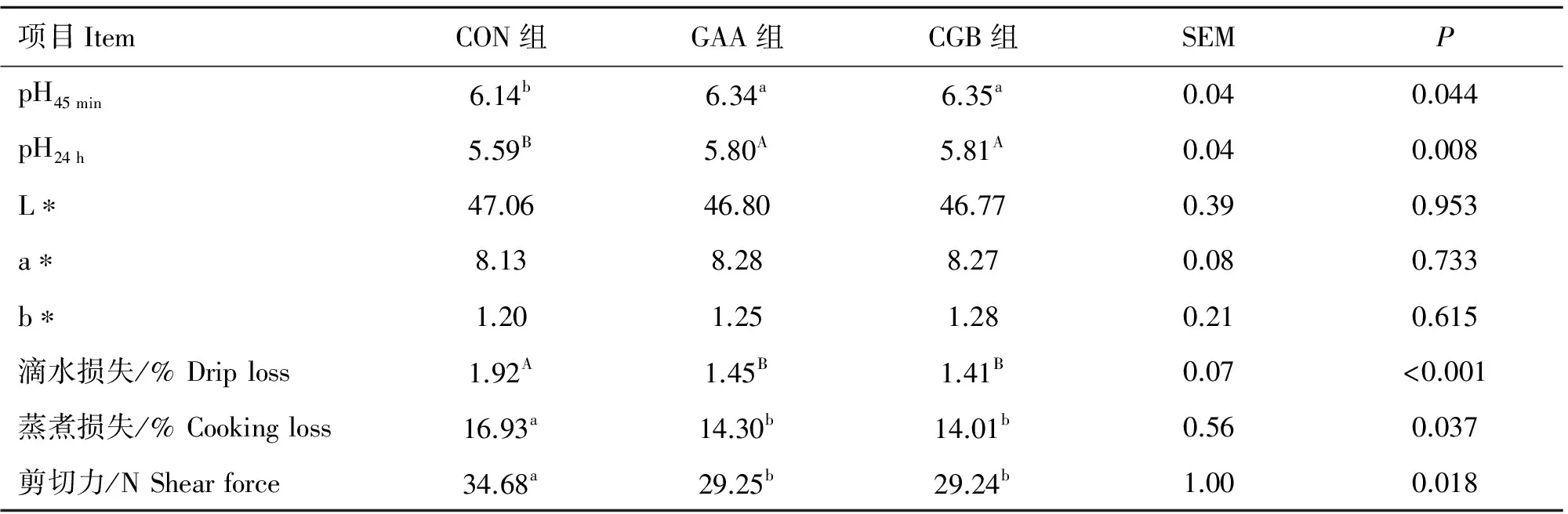
项目ItemCON组GAA组CGB组SEMPpH45min6.14b6.34a6.35a0.040.044pH24h5.59B5.80A5.81A0.040.008L∗47.0646.8046.770.390.953a∗8.138.288.270.080.733b∗1.201.251.280.210.615滴水损失/%Driploss1.92A1.45B1.41B0.07<0.001蒸煮损失/%Cookingloss16.93a14.30b14.01b0.560.037剪切力/NShearforce34.68a29.25b29.24b1.000.018
同行数据肩注小写字母不同者表示差异显著(P<0.05),标有不同大写字母者表示差异极显著(P<0.01)。下同
In the same row,values with different low-case letter superscripts mean significant difference(P<0.05),and with different capital letter superscripts mean very significant difference(P<0.01).The same as below
表5 胍基乙酸和胍基乙酸+甜菜碱对半腱肌腺苷酸和肌酸含量的影响(n=9)
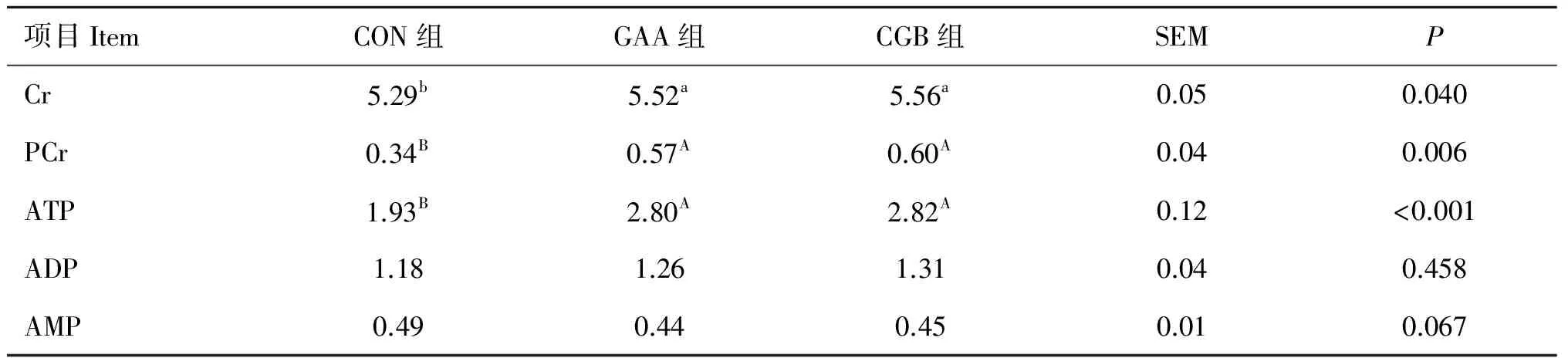
Table 5 Effects of guanidinoacetic acid supplementation and combination of guanidinoacetic acid and betaine on creatine,phosphocreatine and adenosine nucleotides concentrations in semitendinosus of finishing pigs(n=9) mg·g-1
猪后腿肉占身体比重较大,且肉质紧实、肉色红润,检测猪肉品质时常用半腱肌作为样品[16-17]。因此,本试验选择半腱肌作为肉品质的研究对象。试验结果表明,饲粮中添加GAA能够显著提高猪肉宰后pH,降低滴水损失、蒸煮损失、硬度和剪切力,这说明GAA可以改善猪肉品质,这与A.Lemme等[18]和L.S.Wang等[19]的试验结果一致。在宰后肌肉熟化过程中,血液循环停止,氧气供给中断,无氧酵解开始,ATP供应不足,导致糖原无氧氧化生成乳酸,大量乳酸积累,使肌肉pH下降[20-21]。而本试验饲料中添加GAA增加了半腱肌中Cr含量,提高了高能磷酸化合物PCr的储备,同时也增加了维持动物生命活动直接的能量来源——ATP的含量。可利用能量物质含量的增加延缓糖原形成乳酸,最终升高终点pH。而较高的pH可以减少蛋白质变性,使肌原纤维蛋白质偏离其等点电,蛋白质的净电负荷增多,加强了蛋白质与水的相互作用,而减弱了蛋白质与蛋白质之间的相互作用,进而降低了滴水损失和蒸煮损失,提高了肌肉系水力。
硬度是描述与食品变形或穿透产品所需的力有关的机械质地特性,M.S.Rahman等研究发现,硬度与含水率呈现一定的相关性[22],M.J.Benito等报道硬度变化可能与蛋白质的变性有关[23]。而本试验中,饲粮中添加GAA显著提高了pH和半腱肌系水力,减少了蛋白质变性,从而降低了硬度。剪切力也是衡量肉品嫩度的一个重要因素。在肌肉的pH降到最低点之前,肌细胞中肌浆内质网释放钙离子[24],如果此时肌肉中含有足够的能量则发生收缩,肌动蛋白的细丝过度插入而引起Z线断裂,则嫩度下降[1,25]。本试验中,饲粮中添加GAA显著提高了ATP、Cr和PCr的含量,使肌肉有足够的能量过度收缩,最终剪切力下降,提高了嫩度。
GAA是由甘氨酸和L-精氨酸在L-精氨酸甘氨酸咪基转移酶(AGAT) 的催化下形成的,形成的GAA再由S-腺苷蛋氨酸—胍基乙酸N-甲基转移酶(GAMT)催化生成Cr[26-27]。已有报道表明[1,25,28],饲料中添加GAA能够增加肌肉中Cr含量,Cr是能量代谢中的关键性物质,而能量代谢与改善猪肉品质紧密相关。本试验中,饲粮中添加GAA显著提高了Cr和PCr的含量,这说明GAA是一种潜在的Cr来源。而生成的Cr在体内以PCr的形式储存,PCr作为供能物质迅速提供ATP,而ATP是所有生物组织内生物能量转换的高能磷酸化合物,是维持动物生命活动直接的能量来源。肌肉中大量的能源储备节约了糖原的利用,延迟了糖酵解的能量释放以及乳酸的形成,提高了pH,最终减少了蛋白质变性,提高了系水力和肉的嫩度,进而改善了肉品质。
汪以真等[29]报道,饲粮中添加甜菜碱对猪肉的pH和失水率并无显著影响;J.O.Matthews等[30-31]提出,饲喂甜菜碱对猪肉的pH、系水力和剪切力均无显著影响。本试验假设添加GAA后育肥猪体内甲基供体不足,需要额外添加甲基供体。由于甜菜碱是稳定性较好的三甲基供体,因此本试验选择在添加了GAA的饲粮中额外添加 0.5 g·kg-1的甜菜碱来满足GAA合成Cr时的需要。本试验发现,相比于GAA组,CGB组对半腱肌营养成分、质构、能量代谢及肉品质方面均无显著影响。我们推测,在本次试验条件下基础日粮已能够为育肥猪提供足够甲基辅助GAA形成Cr,并不需要额外添加甲基,因此甜菜碱对GAA调节肌肉能量代谢并无显著促进作用。
4 结 论
本试验结果表明,在基础日粮中添加1 g·kg-1的GAA能够提高育肥猪肌肉中Cr、PCr和ATP的含量,改善肌肉能量代谢,进而改善猪肉品质。而添加0.5 g·kg-1的甜菜碱对GAA提高能量利用和改善肉质并无显著促进作用。
[1] MICHIELS J,MAERTENS L,BUYSE J,et al.Supplementation of guanidinoacetic acid to broiler diets:effects on performance,carcass characteristics,meat quality,and energy metabolism[J].PoultSci,2012,91(2):402-412.
[2] OSTOJIC S M,NIESS B,STOJANOVIC M,et al.Creatine metabolism and safetyprofiles after six-week oral guanidinoacetic acid administration in healthy humans[J].IntJMedSci,2013,10(2):141-147.
[3] WYSS M,KADDURAH-DAOUK R.Creatine and creatinine metabolism[J].PhysiolRev,2000,80(3):1107-1213.
[4] SCHOCH R D,WILLOUGHBY D,GREENWOOD M.The regulation and expression of the creatine transporter:a brief review of creatine supplementation in humans and animals[J].JIntSocSportsNutr,2006,3(1):60-66.
[5] LINDAHL G,YOUNG J F,OKSBJERG N,et al.Influence of dietary creatine monohydrate and carcass cooling rate on colour characteristics of pork loin from different pure breeds[J].MeatSci,2006,72(4):624-634.
[6] SALES J.A meta-analysis of the effects of dietary betaine supplementation on finishing performance and carcass characteristics of pigs[J].AnimFeedSciTech,2011,165(1-2):68-78.
[7] AOAC.Official methods of analysis[S].Arlington,V A:Association of Official Analytical Chemists,1995:684.
[8] 国家质检总局,GB/T5009—2003食品中水分的测定方法[S].北京:中国标准出版社,2003. General administration of quality supervision,inspection and quarantine of the People’s Republic of China,GB/T5009—2003 Determination of moisture in food[S].Beijing:China Standards Press,2003.(in Chinese)
[9] 吴谋成.食品分析与感官评定[M].北京:中国农业出版社,2002. WU M C.Food analysis and sensory evaluation[M].Beijing:China Agriculture Press,2002.(in Chinese)
[10] BOURNE M C.Texture profile analysis[J].FoodTechnol,1978,32(7):62-66,72.
[11] STRAADT I K,RASMUSSEN M,ANDERSEN H J,et al.Aging-induced changes in microstructure and water distribution in fresh and cooked pork in relation to water-holding capacity and cooking loss-A combined confocal laser scanning microscopy(CLSM) and low-field nuclear magnetic resonance relaxation study[J].MeatSci,2007,75(4):687-695.
[12] HAYES J E,KENNY T A,WARD P,et al.Development of a modified dry curing process for beef[J].MeatSci,2007,77(3):314-323.
[13] HONIKEL K O.Reference methods for the assessment of physical characteristics of meat[J].MeatSci,1998,49(4):447-457.
[14] BEATTIE V E,O’CONNELL N E,MOSS B W.Influence of environmental enrichment on the behaviour,performance and meat quality of domestic pigs[J].LivestProdSci,2000,65(1-2):71-79.
[15] YUAN Y L,LI J L,ZHANG W H,et al.A comparison of slaughter performance and meat quality of pigs immunised with a gonadotrophin-releasing factor vaccine against boar taint with physically castrated pigs[J].AnimProdSci,2012,52(10):911-916.
[16] REHFELDT C,STABENOW B,PFUHL R,et al.Effects of limited and excess protein intakes of pregnant gilts on carcass quality and cellular properties of skeletal muscle and subcutaneous adipose tissue in fattening pigs[J].JAnimSci,2012,90(1):184-196.
[17] PARDO C E,KREUZER M,BEE G.Effect of average litter weight in pigs on growth performance,carcass characteristics and meat quality of the offspring as depending on birth weight[J].Animal,2013,7(11):1884-1892.
[18] LEMME A,RINGEL J,ROSTAGNO H S,et al.Supplemental guanidino-acetic acid improved feed conversion,weight gain,and breast meat yield in male and female broilers[C].In:Proceedings of the 16thEuropean Symposium on Poultry Nutrition.Strasbourg,France:World’s Poultry Science Association,2007:335-338.
[19] WANG L S,SHI B M,SHAN A S,et al.Effects of guanidinoacetic acid on growth performance,meat quality and antioxidation in growing-finishing pigs[J].JAnimVetAdv,2012,11(5):63-68.
[20] BERTOL T M,ELLIS M,RITTER M J,et al.Effect of feed withdrawal and handling on longissimus muscle glycolytic potential and blood measurements in slaughter weight pigs[J].JAnimSci,2005,83(7):1536-1542.
[21] RYU Y C,KIM B C.The relationship between muscle fiber characteristics,postmortem metabolic rate,and meat quality of pig longissimus dorsi muscle[J].MeatSci,2005,71(2):351-357.
[22] RAHMAN M S,AL-FARSI S A.Instrumental texture profile analysis(TPA) of date flesh as a function of moisture content[J].JFoodEng,2005,66(4):505-511.
[23] BENITO M J,RODRIGUEZ M,ACOSTA R,et al.Effect of the fungal extracellular protease EPg222 on texture of whole pieces of pork loin[J].MeatSci,2003,65(2):877-884.
[24] SCHEFFLER T L,GERRARD D E.Mechanisms controlling pork quality development:The biochemistry controlling postmortem energy metabolism[J].MeatSci,2007,77(1):7-16.
[25] LEMME A,RINGEL J,STERK A,et al.Supplemental guanidino acetic acid affects energy metabolism of broilers[C].In:Proceedings of the 16thEuropean Symposium on Poultry Nutrition.Strasbourg,France:World’s Poultry Science Association,2007:26-30.
[26] GUTHMILLER P,VANPILSUM J F,BOEN J R,et al.Cloning and sequencing of rat-kidney L-arginine-glycine amidinotransferase.Studies on the mechanisms of regulation by growth-hormone and creatine[J].JBiolChem,1994,269(26):17556-17560.
[27] DILGER R N,BRYANT-ANGEONI K,PAYNE R L,et al.Dietary guanidino acetic acid is an efficacious replacement for arginine for young chicks[J].PoultSci,2013,92(1):171-177.
[28] European Food Safety Authority.Scientific opinion of the Panel on Additives and Products or Substances used in Animal Feed(FEEDAP) on a request from the European Commission on the safety and efficacy of CreAmino(guanidinoacetic acid) as feed additive for chickens for fattening[J].EFSAJ,2009,998:1-30.[29] 汪以真,许梓荣,冯 杰.甜菜碱对杜长大肥育猪生长性能、胴体组成和肉质的影响[J].动物营养学报,1998,10(3):21-28. WANG Y Z,XU Z R,FENG J.Effect of betaine on growing performance,carcass composition and meat quality of fattening pig[J].ActaZoonutrimentaSinica,1998,10(3):21-28.(in Chinese)
[30] MATTHEWS J O,SOUTHERN L L,HIGBIE A D,et al.Effects of betaine on growth,carcass characteristics,pork quality,and plasma metabolites of finishing pigs[J].JAnimSci,2001,79(3):722-728.
[31] MATTHEWS J O,SOUTHERN L L,BIDNER T D,et al.Effects of betaine,pen space,and slaughter handling method on growth performance,carcass traits,and pork quality of finishing barrows[J].JAnimSci,2001,79(4):967-974.
(编辑 郭云雁)
Effects of Dietary Supplementation of Guanidinoacetic Acid and Combination of Guanidinoacetic Acid and Betaine on Muscle Energy Metabolism,Meat Quality in Finishing Pigs
LIU Yang,LI Jiao-long,ZHANG Lin,GAO Feng*,ZHOU Guang-hong
(KeyLaboratoryofAnimalOriginFoodProductionandSafetyGuaranteeofJiangsuProvince/CollegeofAnimalScienceandTechnology,NanjingAgriculturalUniversity,Nanjing210095,China)
This study aimed to evaluate the effects of guanidinoacetic acid(GAA) and combination of GAA and betaine on muscle energy metabolism and meat quality in finishing pigs.A total of 180 cross castrated male pigs(Duroc×Landrace×White) were randomly assigned to 3 experimental diet groups:control(CON,basal diet),GAA group(GAA;basal diet supplemented with 1 g of GAA per kg of feed),combination group(CGB;basal diet supplemented with 1 g of GAA and 0.5 g of betaine per kg of feed).Each treatment was replicated in 3 pens with 20 pigs each.The experimental period lasted 15 d.Compared with the control group,GAA and CGB supplementation significantly reduced drip loss(P<0.01),hardness,cooking loss and shear force(P<0.05),increased pH45 min(P<0.05),pH24 h(P<0.01).In addition,dietary GAA and CGB increased the contents of creatine(P<0.05),phosphocreatine(P<0.01) and adenosine triphosphate(ATP)(P<0.001) in muscle.The results indicated that the dietary supplementation with GAA and CGB could improve meat quality via regulating muscle energy metabolism of finishing pigs.
guanidinoacetic acid;betaine;pigs;energy metabolism;meat quality
10.11843/j.issn.0366-6964.2015.09.010
2014-11-24
“十二五”国家科技支撑计划课题(2012BAD28B03);中央高校科研基本业务费自主创新项目(KYZ201222);江苏省农业三新工程项目(SX(2011)146)
刘 洋(1988-),女,河北乐亭人,硕士生,主要从事动物营养与畜产品品质研究,E-mail:2012105043@njau.edu.cn
*通信作者:高 峰,教授,博士,主要从事动物营养与畜产品品质研究,E-mail:gaofeng0629@sina.com
S828;S815.4
A
0366-6964(2015)09-1557-07
