贵州矮马(Equuscaballus)生长激素受体基因5个单核苷酸位点的多态性研究
2015-03-22冉雪琴赵星艳王嘉福田松军魏小红
冉雪琴,赵星艳,王嘉福,田松军,魏小红
(1.贵州大学动物科学学院,贵阳 550025; 2.贵州大学农业生物工程研究院,贵阳 550025;3.贵州紫云县畜牧兽医局,紫云 550800)
贵州矮马(Equuscaballus)生长激素受体基因5个单核苷酸位点的多态性研究
冉雪琴1*,赵星艳1,王嘉福2,田松军3,魏小红3
(1.贵州大学动物科学学院,贵阳 550025; 2.贵州大学农业生物工程研究院,贵阳 550025;3.贵州紫云县畜牧兽医局,紫云 550800)
旨在探究贵州矮马生长慢的根本原因,本研究采用PCR和基因克隆技术测定贵州矮马生长激素受体基因(GHR)外显子10的核苷酸序列;以伊犁马为对照,通过AS-PCR和SSCP方法研究贵州矮马群体中SNP位点的分布频率,应用群体遗传学和生物信息学方法分析基因型与体尺指标间的相关性。结果,从贵州矮马GHR外显子10中得到10个单倍型,包括10个SNPs位点,其中的5个引起氨基酸改变。与伊犁马相比,贵州矮马GHR基因1028位点的A等位基因占优势,对应较低的尻高和较粗的管围;1471位点的E等位基因在贵州矮马群体中分布较多,与胸围率较高相关;1697和1732两个位点的杂合型存在于最矮的雄性矮马(6岁)GHR基因中。1028位点引起的V343A位于UbE结构域中,1471、1697和1732位点引起的S491G、Y566C和R578G改变与GHR蛋白的磷酸化有关。这4个位点可能影响GHR的内化作用或通过磷酸化途径影响细胞内的信号传导效率。研究结果提示,贵州矮马GHR基因外显子10中的多态性变化可能影响贵州矮马的生长发育。
贵州矮马;生长激素受体基因;外显子10;SNP
动物个体的生长和糖、脂、蛋白等代谢主要受生长激素(Growth hormone,GH)的控制。GH由腺垂体合成,与生长激素受体(Growth hormone receptor,GHR)结合发挥促生长作用。GHR为穿膜一次的糖蛋白,由638个氨基酸组成,包含3个结构域,即位于胞外的配体结合结构域、穿膜结构域及胞内的胞质结构域。1个GH刺激2个GHR分子形成二聚体[1],通过GHR的胞质结构域启动细胞内的JAK/Stat、PI3K、MSAP等信号途径,刺激胰岛素样生长因子(Insulin-like growth factors,IGFs)、转录因子、代谢相关酶类的合成,实现GH的促生长作用[2]。GHR属于1型细胞因子受体家族(Cytokine receptor family type 1),几乎在各个组织中表达,肝和脂肪细胞中的表达量较高[3-4]。已知纯血马(Thoroughbred)的GHR基因长244 757 bp(NCBI No.:NW_001867391),位于21号染色体长臂23 836 204~ 24 080 960 bp区域,经可变剪接产生两个转录本X1和X2,转录本X1长4 048 bp(XM_001498656),编码638 aa;转录本X2(XM_005604292)长3 970 bp,编码646 aa,两种转录本的外显子2~10完全一样。外显子2编码信号肽;外显子3~7编码胞外区,外显子8编码穿膜结构域,外显子9和10编码胞内区,外显子10最长为2 992 bp,编码323 aa,约占GHR胞内结构域的90%[5]。人GHR基因中存在丰富的SNP位点,是出生前后生长和代谢出现明显个体差异的原因之一,人类基因突变数据库(http://www.hgmd.cf.ac.uk/ac/gene.php?gene=GHR)记录了GHR基因中90个突变与人特发性身材矮小、Laron综合征、严重的生长障碍等有关。GHR基因的多态性与鸡的性连锁矮小[6]、肉牛的生长[7]和奶牛的产奶量等性状有关[8]。目前,对马GHR基因中的SNP知之甚少。贵州矮马长期生活在贵州山区环境中,是中国矮马中5个分支之一[9]。与普通马相比[10],贵州矮马明显较矮,但身体各部分的比例协调。贵州矮马的体型特点与人类的特发性矮小有一定的相似性。
本试验主要研究贵州矮马GHR基因外显子10的单核苷酸多态性,及其与贵州矮马的矮小特性之间的联系。
1 材料与方法
1.1 样品
74匹贵州矮马血液样品采自“贵州省紫云县贵州矮马原种场”,均为成年健康役用母马,年龄5~8岁;61匹雌性伊犁马的血液样品采自新疆伊犁州“昭苏伊犁种马场”,年龄6~8岁,所有马匹处于成年期,体格健壮,以放牧为主。参照Qiagen公司QIAamp DNA Blood Mini Kit说明书,提取血液基因组DNA,-20 ℃保存。贵州矮马的体高、体长、胸围、管围、头长、颈长、胸深、背高、尻高、前肢长、前膊长、前系长等12项体尺指标参照文献[11]测定,胸围率=(胸围/体高)×100%。
1.2 基因克隆及测序
据已知马GHR基因序列设计特异引物(表1),以血液基因组DNA为模板,扩增GHR基因外显子10区。PCR反应体系20 μL:2×PCR Mixture(天根生化科技(北京)有限公司)10 μL,10 μmol·L-1引物各0.3 μL,基因组DNA 100 ng,ddH2O补足20 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,58~60 ℃退火30 s,72 ℃延伸50 s,35个循环;72 ℃延伸5 min;4 ℃保存。扩增产物以1%琼脂糖凝胶电泳纯化,连接pMD18-T载体(宝生物工程(大连)有限公司),转化大肠杆菌DH5α。由生工生物工程(上海)股份有限公司进行引物合成和DNA序列测定,每个样品重复测定5个阳性克隆子的碱基序列。
依据得到的GHR外显子10基因序列,设计7对特异引物(表1),采用AS-PCR方法检测GHR外显子10中的3个SNPs位点,包括1028、1267和1471位点;采用SSCP方法检测2个相邻的SNPs位点1697和1732。
表1 基因扩增和SNP检测引物
Table 1 Primers used to detect the polymorphism ofGHRgene in 2 horse populations
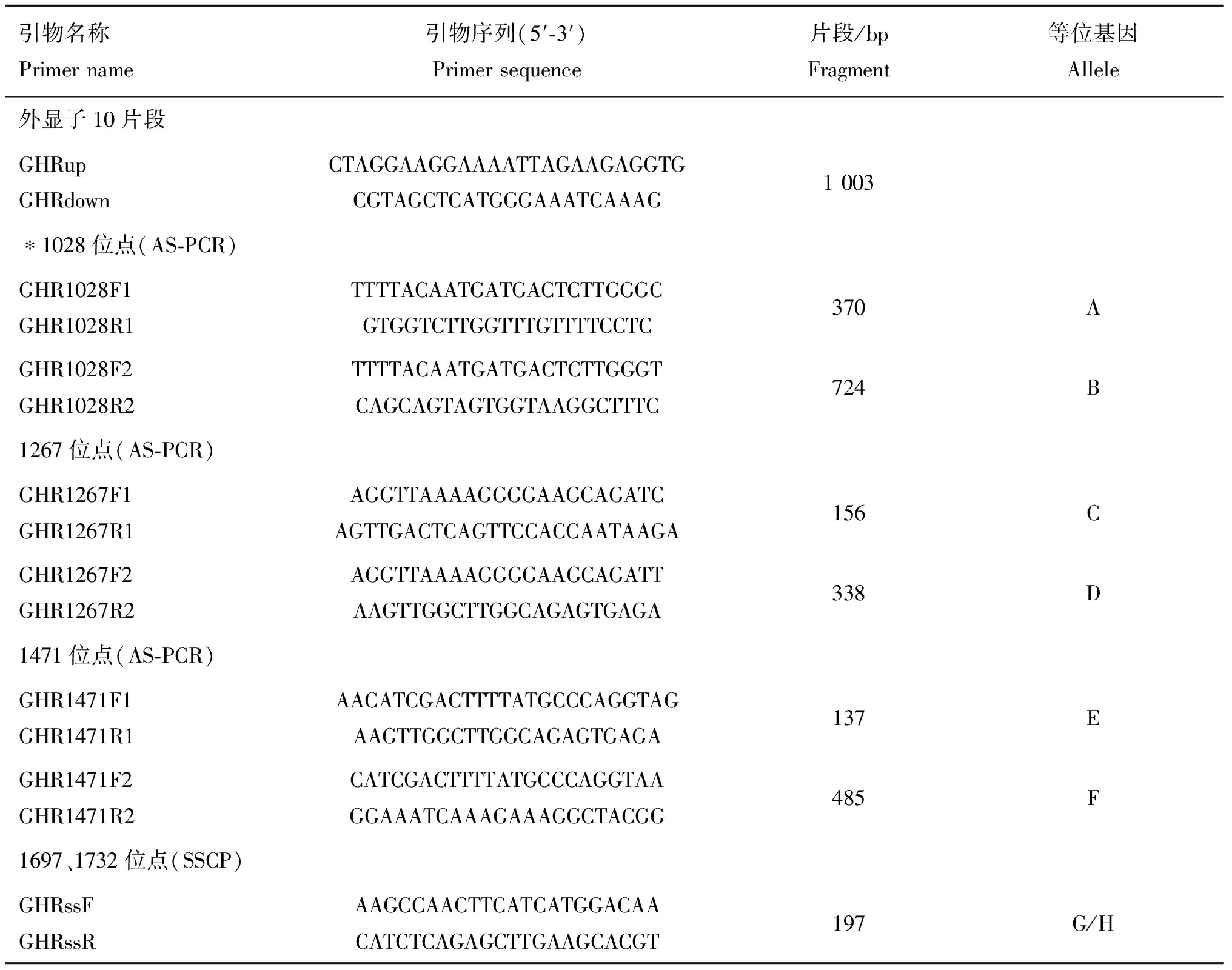
引物名称Primername引物序列(5′⁃3′)Primersequence片段/bpFragment等位基因Allele外显子10片段GHRupGHRdownCTAGGAAGGAAAATTAGAAGAGGTGCGTAGCTCATGGGAAATCAAAG1003∗1028位点(AS⁃PCR)GHR1028F1GHR1028R1TTTTACAATGATGACTCTTGGGCGTGGTCTTGGTTTGTTTTCCTC370AGHR1028F2GHR1028R2TTTTACAATGATGACTCTTGGGTCAGCAGTAGTGGTAAGGCTTTC724B1267位点(AS⁃PCR)GHR1267F1GHR1267R1AGGTTAAAAGGGGAAGCAGATCAGTTGACTCAGTTCCACCAATAAGA156CGHR1267F2GHR1267R2AGGTTAAAAGGGGAAGCAGATTAAGTTGGCTTGGCAGAGTGAGA338D1471位点(AS⁃PCR)GHR1471F1GHR1471R1AACATCGACTTTTATGCCCAGGTAGAAGTTGGCTTGGCAGAGTGAGA137EGHR1471F2GHR1471R2CATCGACTTTTATGCCCAGGTAAGGAAATCAAAGAAAGGCTACGG485F1697、1732位点(SSCP)GHRssFGHRssRAAGCCAACTTCATCATGGACAACATCTCAGAGCTTGAAGCACGT197G/H
*.以GHR基因起始码第一个碱基A记为1,计算SNP位点在GHR编码区中的位置。阴影字母代表变异的碱基
*.The location of SNP was counted from the first A of first start codon ATG in the coding region ofGHR.The changed nucleotides in the primers were shaded in grey color
1.4 数据处理
核苷酸序列采用NCBI的Blastn软件比对,以MEGA v6.0分析变异位点,用SPSS v21.0软件以Duncan氏新复极差测验法(New multiple range test)经多重比较进行差异显著性检验。经Popgene v1.32软件计算基因型频率、等位基因频率、Hardy-Weinberg平衡检验、群体遗传学指标,以PICv0.6软件计算多态信息含量(Polymorphism information content,PIC)。
2 结 果
2.1GHR基因片段的克隆测序
随机选取15匹贵州矮马血液样本,提取基因组DNA,在特异引物GHRup / GHRdown引导下,扩增出约1 000 bp片段(图1),测序得到15条DNA序列,长1 003 bp,有10个单倍型H1~H10(表2)。经在线比对,与已知普氏野马(XM_008524570)、纯血马(NW_001867391)GHR基因序列的相似性最高,为99%,之间有1~2个碱基差异,由此确定扩增片段为矮马GHR基因外显子10序列。经同源比对,1 003 bp序列中第5~1 003 bp为马的外显子10区段,第974~976 bp为终止码TAG,共编码323个氨基酸,对应完整GHR蛋白C端的316~638 aa。单倍型1编码的323 aa与普氏野马(XP_008522792)和纯血马参考基因组注释的GHR X1(XP_001498706)和X2(XP_005604349)相应序列完全一样。10个单倍型之间相比(表2),共有10个位点发生了核苷酸变异,其中5个位点为同义突变,不影响编码的氨基酸;另外5个位点引起了氨基酸改变,包括1028、1267、1471、1697、1732位点(以GHR基因编码区起始码的A记为1),引起的氨基酸替换为V343A、L423F、S491G、Y566C、R578G(数字前的氨基酸为普氏野马和参考马的氨基酸,数字后为变异的氨基酸)。采用AS-PCR方法,检测1028、1267、1471位点在贵州矮马及伊犁马群体中的基因频率。另外2个突变位点1697和1732位置相近,采用PCR-SSCP方法检测。
表2 贵州矮马GHR基因外显子10的核苷酸变异位点
Table 2 Nucleotide changes in exon 10 ofGHRgene in Guizhou pony
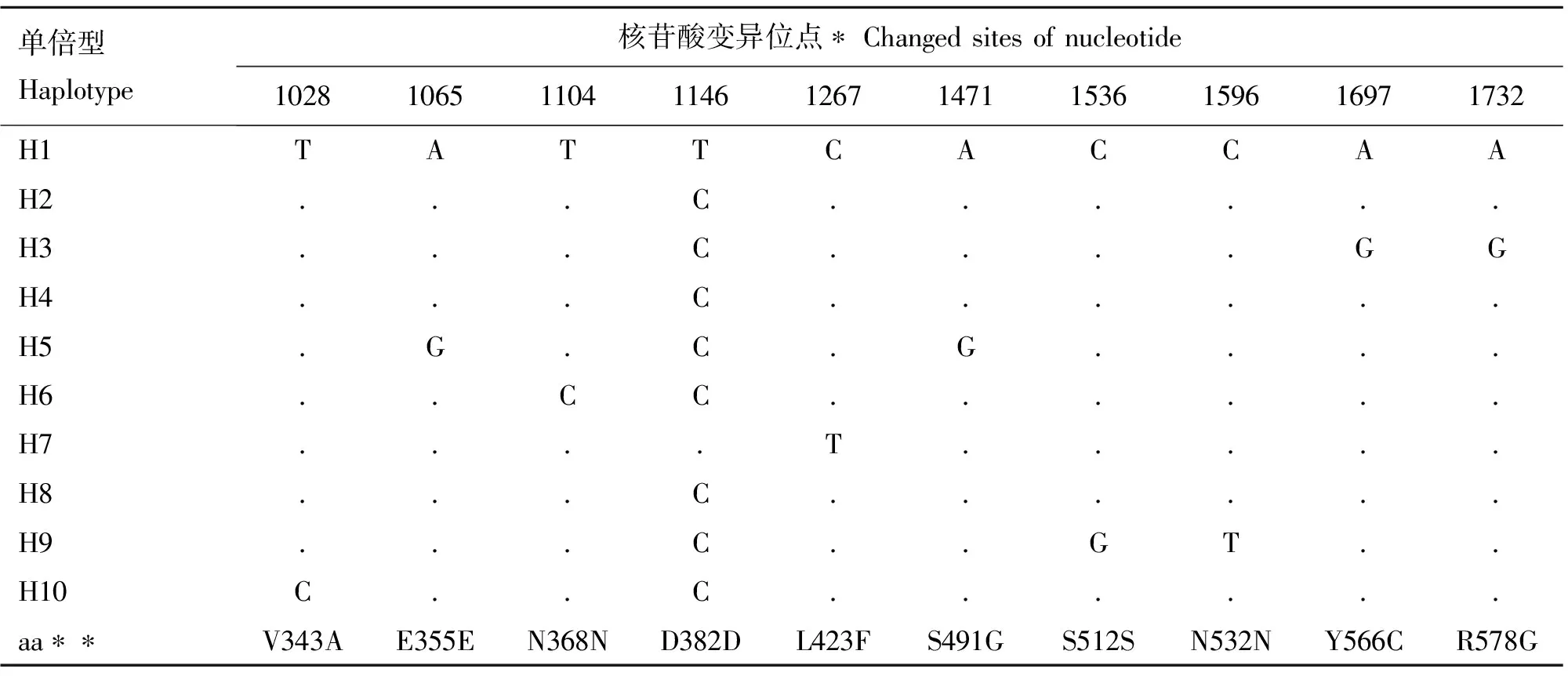
单倍型Haplotype核苷酸变异位点∗Changedsitesofnucleotide1028106511041146126714711536159616971732H1TATTCACCAAH2...C......H3...C....GGH4...C......H5.G.C.G....H6..CC......H7....T.....H8...C......H9...C..GT..H10C..C......aa∗∗V343AE355EN368ND382DL423FS491GS512SN532NY566CR578G
*.核苷酸变异位置以GHR基因CDS起始码第一个碱基A记为第1位核苷酸;**.以起始码编码的Met开始标识变异氨基酸的位置
*.Denoted the first nucleotide starting from the first A in the coding region ofGHRgene;**.Showed the first amino acid was Met coded by the start codon
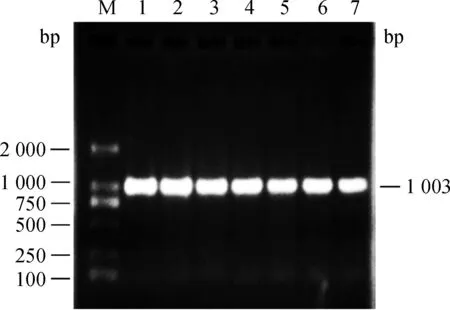
M.DNA 相对分子质量标准DL2000; 1~7.贵州矮马GHR基因外显子10M.DL2000 DNA marker;1-7.PCR products of GHR gene图1 贵州矮马GHR基因外显子10区域扩增Fig.1 Amplification of GHR exon 10 of Guizhou pony by PCR
2.2GHR基因1028位点的多态性检测
不要怂!我对自己说。高度的紧张令我的感官敏锐又麻木。我保持着高速而均匀的行驶。到了!我快速伸出手去,紧握住黑暗中另一只手。冰冷而光滑,像乳胶制的假手。但我知道这是一只真手,来自一具男尸。我强迫自己紧握住它,拖着尸体飞快骑行。不知骑了多久,我的直觉告诉我,该是出手的时候了。于是我用尽全身的力气,将这只手甩了出去。我似乎将尸体甩过墙,甩到了巷子的另一边。体育课上扔铅球,我的成绩一向很差。不知道为何,这时迸发出这么大的力气。我好像还握着这只手抡了几个圈才脱手。但由于紧张,我已经忘了我到底有没有握着它抡几圈。
以135匹贵州矮马和伊犁马的血液基因组DNA为模板,分别以GHR1028F1/R1和GHR1028F2/R2两对引物进行PCR扩增,得到370和724 bp两种条带,将只有一条370 bp条带定义为AA基因型,只有一条724 bp带定义为BB基因型,出现370和724 bp两条带定义为AB基因型(图2)。
随机选择部分纯合的AA和BB基因型扩增产物克隆测序(图2),证实A等位基因(370 bp)1028位为碱基C,编码GHR蛋白第343位丙氨酸(Ala 343);B等位基因(724 bp)相应位置为T碱基,编码缬氨酸(Val 343)。
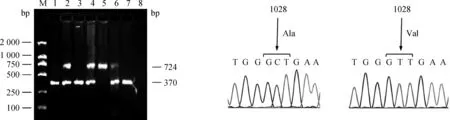
M.DNA 相对分子质量标准DL2000; 1、3、7.AA基因型; 2、4、6.AB基因型; 5.BB基因型; 8.阴性对照。A等位基因为C1028,B等位基因为T1028M.DL2000 DNA marker;1,3,7.AA genotype;2,4,6.AB genotype;5.BB genotype;8.Negative control.The nucleotide of allele A was C1028 and allele B was T1028 at site 1028 of GHR gene图2 GHR编码区1028位点的多态性检测(左)及序列比较(右)Fig.2 Detection and sequencing of GHR polymorphism at site 1028
按贵州矮马和伊犁马GHR基因编码区1028位点的基因型和等位基因频率进行分析(表3),AB基因型在贵州矮马和伊犁马中为优势基因型,分别占0.757、0.672,两个马群的Fis值均为负值,群体的杂合子较为丰富。贵州矮马A等位基因占优势,为0.568,伊犁马以B等位基因为主,为0.598,经卡方双侧检验,χ2=5.785,P=0.016,差异显著(P<0.05)。两个马群GHR基因1028位点的PIC值均为0.25~0.5,属于中度多态信息位点;与伊犁马相比,贵州矮马的观察杂合度(Observed heterozygosity,Ho)、期望杂合度(Expected heterozygosity,He)、有效等位基因数(Effective number of alleles,Ne)、Shannon信息指数(Shannon's information index,I)、多态信息含量(Polymorphism information content,PIC)均较高,表明贵州矮马GHR基因1028位点的遗传多样性更为丰富。经Hardy-Weinberg平衡检验,两个马群GHR基因1028位点不符合Hardy-Weinberg平衡。
表3GHR基因1028位点等位基因频率及HWE检验
Table 3 Frequencies of allele inGHRgene at site 1028 and Hardy-Weinberg equilibrium(HWE) detection
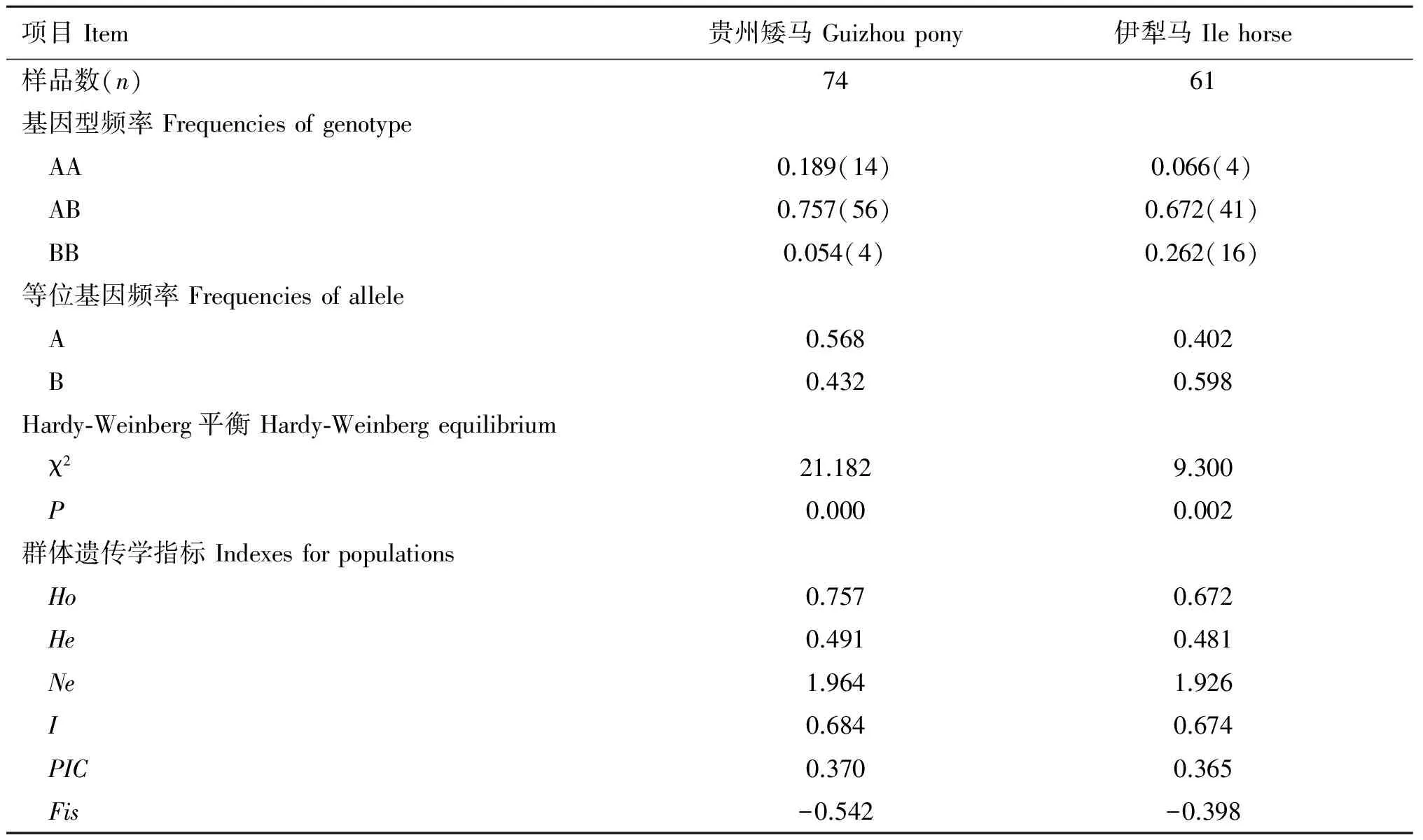
项目Item贵州矮马Guizhoupony伊犁马Ilehorse样品数(n)7461基因型频率Frequenciesofgenotype AA0.189(14)0.066(4) AB0.757(56)0.672(41) BB0.054(4)0.262(16)等位基因频率Frequenciesofallele A0.5680.402 B0.4320.598Hardy⁃Weinberg平衡Hardy⁃Weinbergequilibrium χ221.1829.300 P0.0000.002群体遗传学指标Indexesforpopulations Ho0.7570.672 He0.4910.481 Ne1.9641.926 I0.6840.674 PIC0.3700.365 Fis-0.542-0.398
按贵州矮马和伊犁马的GHR基因1028位点3种基因型AA、BB和AB,分析不同基因型个体的体尺指标差异(表4),贵州矮马的管围、尻高两项指标有显著差异,AB基因型的管围明显高于BB基因型(P<0.05),AB基因型的尻高明显高于AA型(P<0.05),其他指标之间差异不明显(P>0.05)。AB型伊犁马的尻高明显高于AA型(P<0.05)。
表4 据GHR基因1028位点基因型对马体尺指标的影响
Table 4 Influence of genotypes ofGHRat site 1028 on body sizes in horse
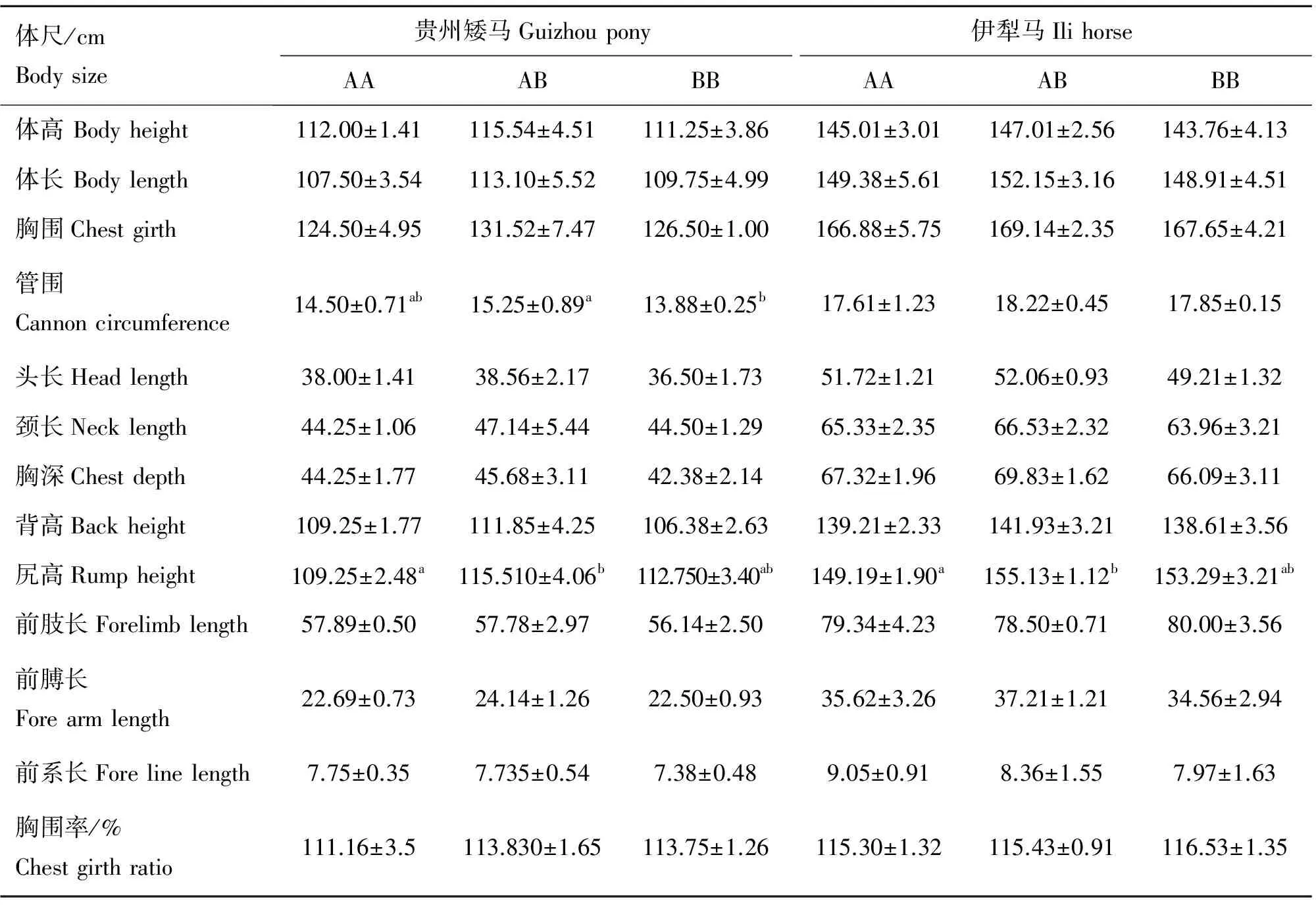
体尺/cmBodysize贵州矮马Guizhoupony伊犁马IlihorseAAABBBAAABBB体高Bodyheight112.00±1.41115.54±4.51111.25±3.86145.01±3.01147.01±2.56143.76±4.13体长Bodylength107.50±3.54113.10±5.52109.75±4.99149.38±5.61152.15±3.16148.91±4.51胸围Chestgirth124.50±4.95131.52±7.47126.50±1.00166.88±5.75169.14±2.35167.65±4.21管围Cannoncircumference14.50±0.71ab15.25±0.89a13.88±0.25b17.61±1.2318.22±0.4517.85±0.15头长Headlength38.00±1.4138.56±2.1736.50±1.7351.72±1.2152.06±0.9349.21±1.32颈长Necklength44.25±1.0647.14±5.4444.50±1.2965.33±2.3566.53±2.3263.96±3.21胸深Chestdepth44.25±1.7745.68±3.1142.38±2.1467.32±1.9669.83±1.6266.09±3.11背高Backheight109.25±1.77111.85±4.25106.38±2.63139.21±2.33141.93±3.21138.61±3.56尻高Rumpheight109.25±2.48a115.510±4.06b112.750±3.40ab149.19±1.90a155.13±1.12b153.29±3.21ab前肢长Forelimblength57.89±0.5057.78±2.9756.14±2.5079.34±4.2378.50±0.7180.00±3.56前膊长Forearmlength22.69±0.7324.14±1.2622.50±0.9335.62±3.2637.21±1.2134.56±2.94前系长Forelinelength7.75±0.357.735±0.547.38±0.489.05±0.918.36±1.557.97±1.63胸围率/%Chestgirthratio111.16±3.5113.830±1.65113.75±1.26115.30±1.32115.43±0.91116.53±1.35
同行不同小写字母表示在0.05水平差异显著。表6和表8同
The differences were significant in the same row with different lowercases at 0.05 level.It was the same as Table 6 and Table 8
2.3GHR基因1267位点的多态性检测
采用引物GHR1267F1/R1和GHR1267F2/R2,检测贵州矮马和伊犁马血液基因组中GHR基因1267位点的多态性变化,经AS-PCR得到156和338 bp两种条带。将156 bp条带定义为CC基因型,338 bp定义为DD基因型,156和338 bp条带同时出现为CD基因型(图3)。随机回收CC和DD基因型扩增片段克隆测序,证实C等位基因(156 bp)中1267位点为碱基C,编码亮氨酸(Leu423),D等位基因(338 bp)1267位点为碱基T,编码苯丙氨酸(Phe423)。
据贵州矮马、伊犁马GHR基因编码区1267位点基因型和等位基因频率进行分析(表5),杂合的CD基因型在贵州矮马和伊犁马中为优势基因型,分别为0.851、0.705,两个马群的Fis值均为负值,杂合子较丰富。贵州矮马D等位基因略占优势(0.534),伊犁马以C等位基因为主,为0.549,经卡方检验(χ2=1.281,P=0.258),二者之间的差异不显著(P>0.05)。贵州矮马的Ho较高,He、Ne、I和PIC值接近;两个马群体均不符合Hardy-Weinberg平衡,表明贵州矮马GHR基因1267位点的遗传多样性与伊犁马相近。
据贵州矮马和伊犁马的GHR基因1267位点的基因型,分析不同基因型个体的体尺指标差异(表6),未发现GHR基因的1027位点基因型对马的体尺指标有显著的影响(P>0.05)。
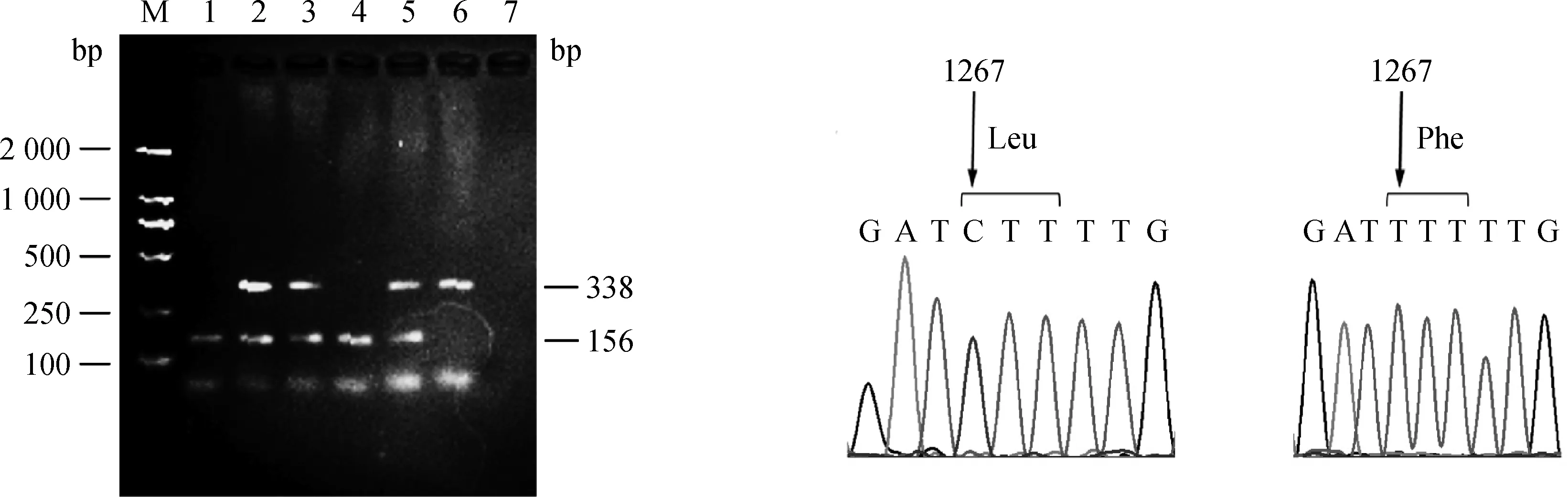
M.DNA 相对分子质量标准DL2000;1、4.CC基因型; 2、3、5.CD基因型;6.DD基因型;7.阴性对照。C等位基因为C1267,D等位基因为T1267M.DL2000 DNA marker;1,4.CC genotype;2,3,5.CD genotype;6.DD genotype;7.Negative control.The nucleotide of allele C was C1267 and allele D was T1267 at site 1267 in GHR gene图3 GHR编码区1267位点的多态性检测和序列比较Fig.3 Detection and sequencing of GHR polymorphism at site 1267
表5GHR基因1267位点等位基因频率和HWE检验
Table 5 Frequencies of allele inGHRgene at site 1267 and Hardy-Weinberg equilibrium detection
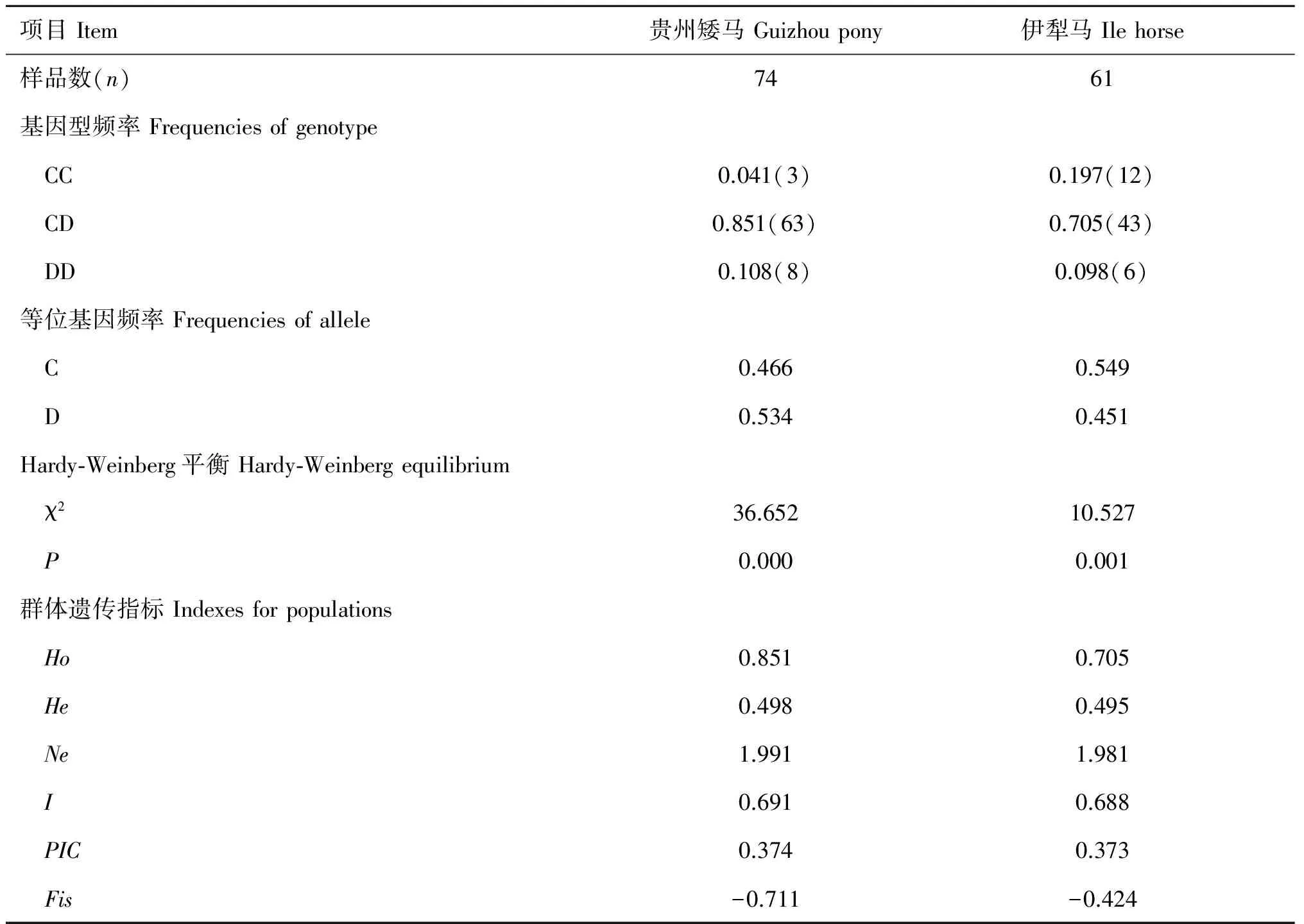
项目Item贵州矮马Guizhoupony伊犁马Ilehorse样品数(n)7461基因型频率Frequenciesofgenotype CC0.041(3)0.197(12) CD0.851(63)0.705(43) DD0.108(8)0.098(6)等位基因频率Frequenciesofallele C0.4660.549 D0.5340.451Hardy⁃Weinberg平衡Hardy⁃Weinbergequilibrium χ236.65210.527 P0.0000.001群体遗传指标Indexesforpopulations Ho0.8510.705 He0.4980.495 Ne1.9911.981 I0.6910.688 PIC0.3740.373 Fis-0.711-0.424
2.4GHR基因1471位点的多态性分析
以贵州矮马、伊犁马的血液基因组DNA为模板,分别以引物GHR1471F1/R1和GHR1471 F2/R2进行PCR扩增,得到137和485 bp两种条带。对所有样品进行AS-PCR分析,得到3种带型,只有一条137 bp条带定义为EE基因型,只有485 bp一条带定义为FF基因型,出现137和485 bp两个条带为EF基因型(图4)。经克隆测序证实,E等位基因(137 bp)1471位为碱基G,编码GHR第491位甘氨酸(Gly 491);F等位基因(485 bp)为碱基A,编码丝氨酸(Ser 491)。
表6GHR基因1267位点基因型对马体尺指标的影响
Table 6 Influence of genotypes ofGHRat site 1267 on body sizes in horse

体尺/cmBodysize贵州矮马Guizhoupony伊犁马IlihorseCCCDDDCCCDDD体高Bodyheight114.87±6.30115.19±4.53115.08±5.10145.71±3.72146.16±1.21147.81±5.12体长Bodylength113.57±5.66112.71±5.74113.17±3.55151.20±3.92150.68±2.30153.57±4.31胸围Chestgirth130.65±6.96131.18±7.65129.50±4.37168.65±2.51169.53±2.96171.81±3.81管围Cannoncircumference15.20±1.0815.21±0.9114.83±0.7517.16±0.7618.35±0.8718.76±0.95头长Headlength38.35±3.2238.51±2.1938.17±1.1751.51±0.8750.76±0.7751.13±0.98颈长Necklength45.97±3.8746.94±5.5446.67±1.6365.88±1.5766.71±15466.32±2.77胸深Chestdepth45.11±2.9645.57±3.2144.67±1.8468.75±2.7669.31±2.1570.56±2.11背高Backheight112.10±3.96111.55±4.32110.42±4.67141.87±3.05140.25±2.76142.43±3.22尻高Rumpheight115.95±6.12115.13±4.00115.08±5.87151.67±3.88150.73±2.76152.32±4.77前肢长Forelimblength57.31±3.5857.81±2.9156.72±2.9979.66±5.1080.83±4.26278.39±4.15前膊长Forearmlength24.17±1.6324.06±1.2723.85±1.3236.81±3.1535.97±2.3434.37±3.91前系长Forelinelength6.98±0.977.73±0.517.750±0.768.50±0.368.90±0.758.10±1.11胸围率/%Chestgirthratio113.08±1.97113.88±5.30112.53±1.88115.63±1.78116.30±2.15116.70±1.21

M.DNA相对分子质量标准DL2000; 1、2、4.EF基因型; 3、6.FF基因型;5.EE基因型。E等位基因为C1471,F等位基因为A1471M.DL2000 DNA marker;1,2,4.EF genotype;3,6.FF genotype;5.EE genotype.The nucleotide of allele E was G1471 and allele F was A1471 at site 1471 of GHR gene图4 GHR编码区1471位点的多态性检测和序列比较Fig.4 Detection and sequencing of GHR polymorphism at site 1471
对贵州矮马和伊犁马GHR基因编码区1471位点的基因型和基因频率进行统计(表7),EF基因型在贵州矮马及伊犁马中为优势基因型,分别为0.784、0.918,贵州矮马中未发现FF型,伊犁马中未检测到EE基因型。两个马群的Fis值均为负值,杂合子丰富,而且伊犁马群表现为高度杂合。
贵州矮马中E等位基因占优势(0.608),伊犁马以F等位基因较多(0.541)。经卡方双侧检验,χ2=4.522,P=0.033,贵州矮马与伊犁马等位基因频率间的差异显著(P<0.05)。与伊犁马相比,贵州矮马的Ho、He、Ne、I、PIC值较小,表明贵州矮马GHR基因1471位点的遗传多样性较低。经Hardy-Weinberg平衡检验,两个马群GHR基因的1471位点变化不符合Hardy-Weinberg平衡。
以贵州矮马和伊犁马的GHR基因1471位点的基因型为依据,对各基因型的体尺指标进行多重比较(表8),EE基因型的胸围率显著高于EF型(P<0.05),其他指标差异不显著(P>0.05)。
表7GHR基因1471位点等位基因频率及HWE检验
Table 7 Frequencies of allele inGHRgene at site 1471 and Hardy-Weinberg equilibrium detection
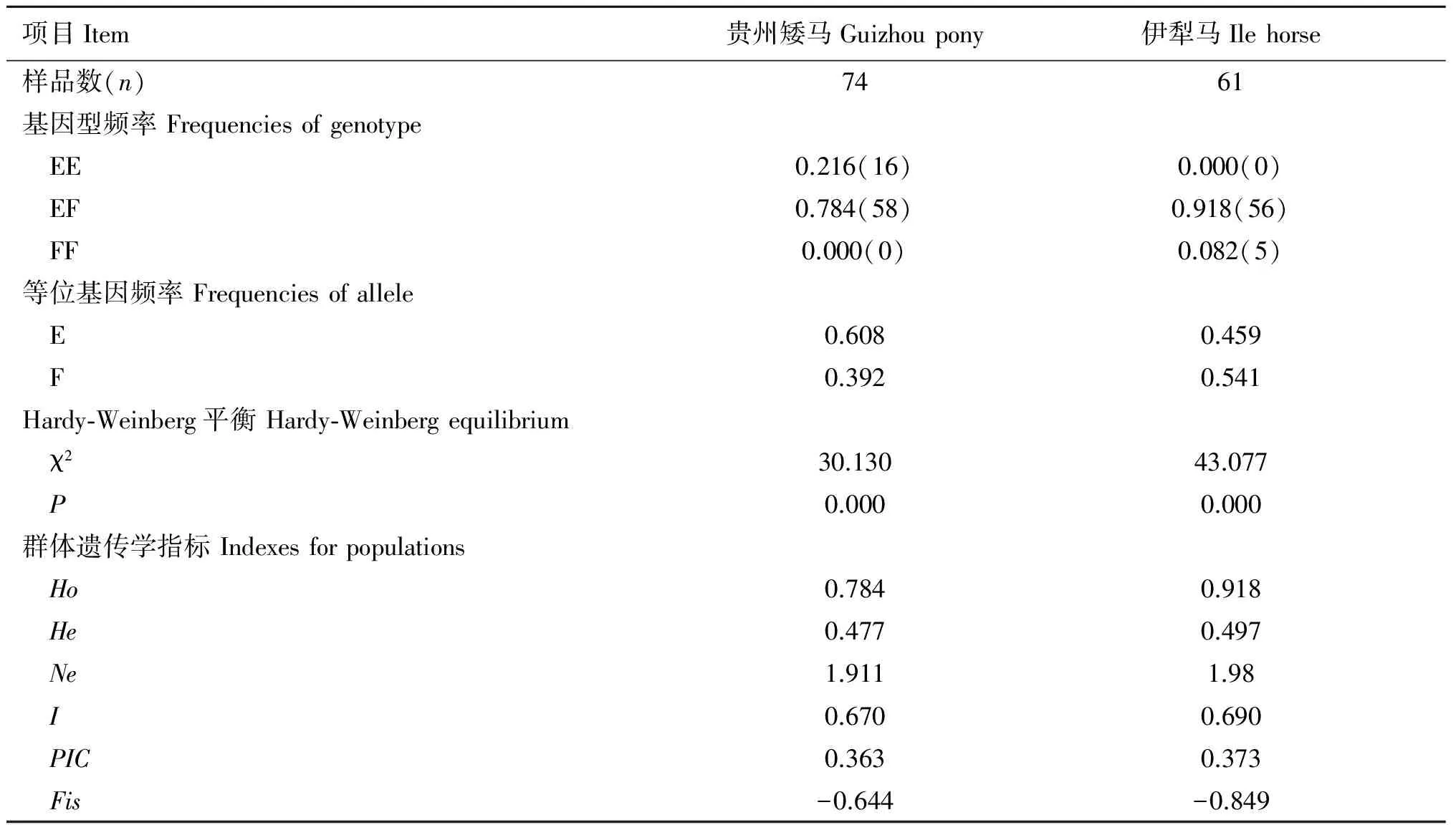
项目Item贵州矮马Guizhoupony伊犁马Ilehorse样品数(n)7461基因型频率Frequenciesofgenotype EE0.216(16)0.000(0) EF0.784(58)0.918(56) FF0.000(0)0.082(5)等位基因频率Frequenciesofallele E0.6080.459 F0.3920.541Hardy⁃Weinberg平衡Hardy⁃Weinbergequilibrium χ230.13043.077 P0.0000.000群体遗传学指标Indexesforpopulations Ho0.7840.918 He0.4770.497 Ne1.9111.98 I0.6700.690 PIC0.3630.373 Fis-0.644-0.849
表8GHR基因1471位点基因型对马体尺指标的影响
Table 8 Influence of genotypes ofGHRat site 1471 on body sizes in horse

体尺/cmBodysize贵州矮马Guizhoupony伊犁马IlihorseEEEFEFFF体高Bodyheight114.50±5.66115.20±4.56146.69±4.32147.13±3.55体长Bodylength113.50±12.02112.73±5.36151.31±5.65152.39±3.56胸围Chestgirth137.00±8.49130.76±7.30170.77±4.76167.94±4.86管围Cannoncircumference15.00±2.8315.17±0.8218.31±1.6317.91±1.55头长Headlength37.25±1.0638.52±2.1251.66±2.0352.38±1.96颈长Necklength47.25±3.8946.89±5.3266.82±1.9667.13±2.03胸深Chestdepth46.50±0.7145.43±3.1469.53±1.6768.54±1.09背高Backheight112.00±5.66111.40±4.34140.65±3.78142.53±3.77尻高Rumpheight114.25±6.01115.15±4.17152.87±3.51150.66±4.86前肢长Forelimblength55.61±4.7157.77±2.8679.250±6.71881.327±4.082前膊长Forearmlength23.74±2.7324.04±1.2336.78±1.9735.45±1.11前系长Forelinelength7.71±0.357.72±0.548.54±0.679.23±0.46胸围率/%Chestgirthratio115.65±1.50a113.51±1.60b116.73±0.97a114.86±0.63b
2.5 群体遗传学分析
对贵州矮马和伊犁马两个群体3个SNPs位点的变异进行中性检验(Ewens-Watterson test for neutrality)[12],结果显示,3个位点的F值均在L95和U95之间(表9),说明这3个位点的核苷酸变异为中性突变。
计算两个群体间的Nei遗传距离为0.034,相似性(Nei's genetic identity)为0.967。据Fst值进行基因流分析(表10),位点1267的Fst值最小,为0.007,表明99.3%的差异存在于群体内部,群体之间的差异最小,Nm值最大,为36.063,表明两个群体在1267位点交流的频率最高。位点1028的Fst值最大,Nm值最小,表明两个马群在1028位点有基因交流。
表9 两个马群的中性检验
Table 9 Neutral detection between 2 horse populations
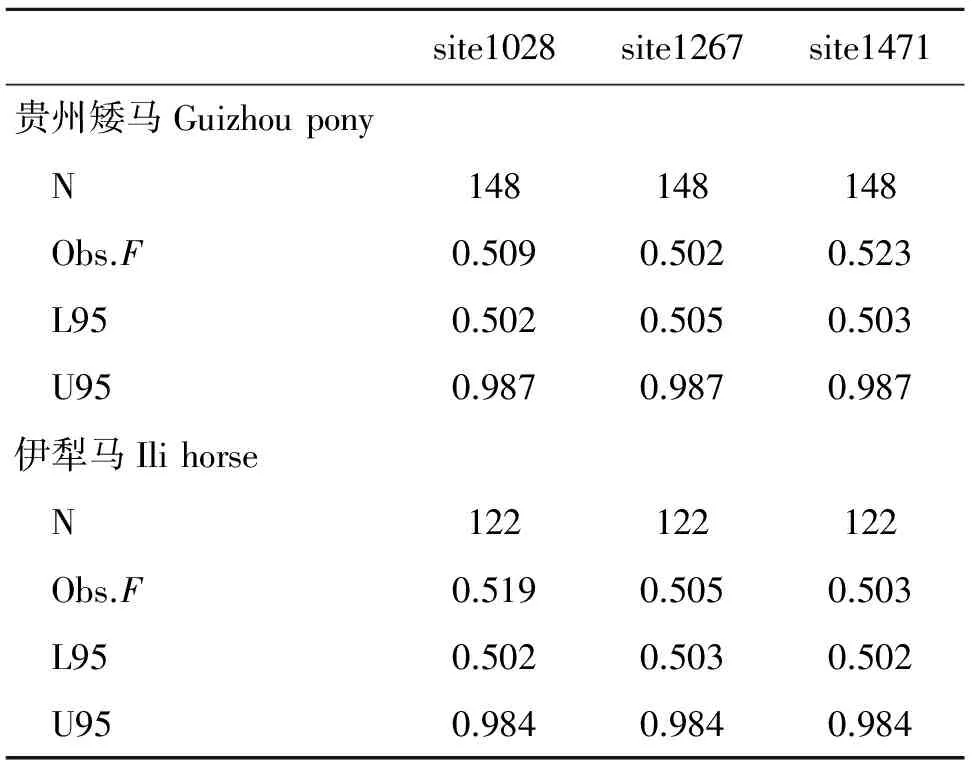
site1028site1267site1471贵州矮马Guizhoupony N148148148 Obs.F0.5090.5020.523 L950.5020.5050.503 U950.9870.9870.987伊犁马Ilihorse N122122122 Obs.F0.5190.5050.503 L950.5020.5030.502 U950.9840.9840.984
表10 两个马群的基因流分析
Table 10 Gene flow analysis in 2 horse populations
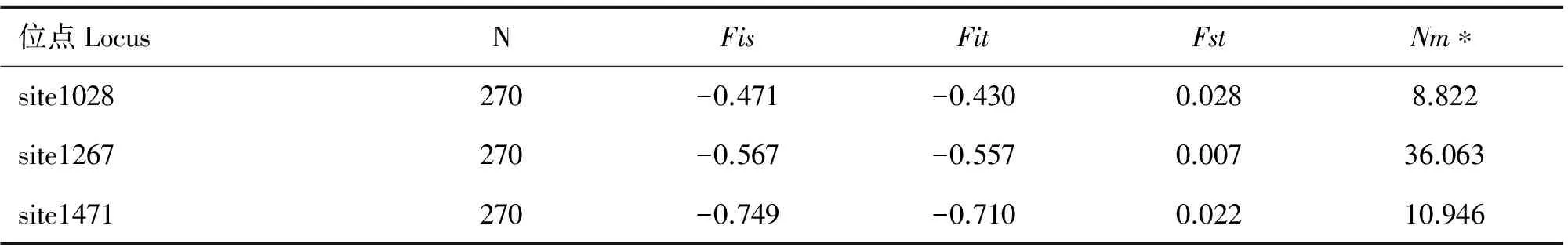
位点LocusNFisFitFstNm∗site1028270-0.471-0.4300.0288.822site1267270-0.567-0.5570.00736.063site1471270-0.749-0.7100.02210.946
*Nm= Gene flow estimated fromFst= 0.25 (1-Fst)/Fst
2.6 SSCP-PCR检测GHR基因外显子10中1697和1732位点的多态性
分别以贵州矮马和伊犁马的血液基因组DNA为模板,用引物GHRssF/GHRssR进行PCR扩增,只得到1条带(图5),经克隆测序,确为预期的197 bp条带,位于GHR基因编码区1 574~1 770 bp区段。
以12%聚丙烯酰胺凝胶对197 bp的PCR扩增产物进行SSCP检测,共得到两种带型,一种为2条带,另一种有3条带,分别定义为GG和GH基因型(图5)。135份血液样品中,仅有一匹贵州矮马(124号)为GH型,其他样品均为GG型。
将124号贵州矮马扩增得到的3条SSCP条带分别回收,作为模板进行二次扩增,克隆测序得到两种序列,在GHR基因编码区1697位和1732位点各有一个A/G变异(图6),并导致566位酪氨酸变成半胱氨酸,第578位精氨酸变成甘氨酸。

M.DNA 相对分子质量标准DL2000; 1~6.PCR产物;7~11.GG基因型;12.GH基因型M.DL2000 DNA marker;1-6.PCR products;7-11.GG genotype;12.GH genotype图5 GHR基因外显子10片段的PCR扩增及SSCP检测Fig.5 Amplification and detection of partial exon 10 in GHR gene by PCR and SSCP methods
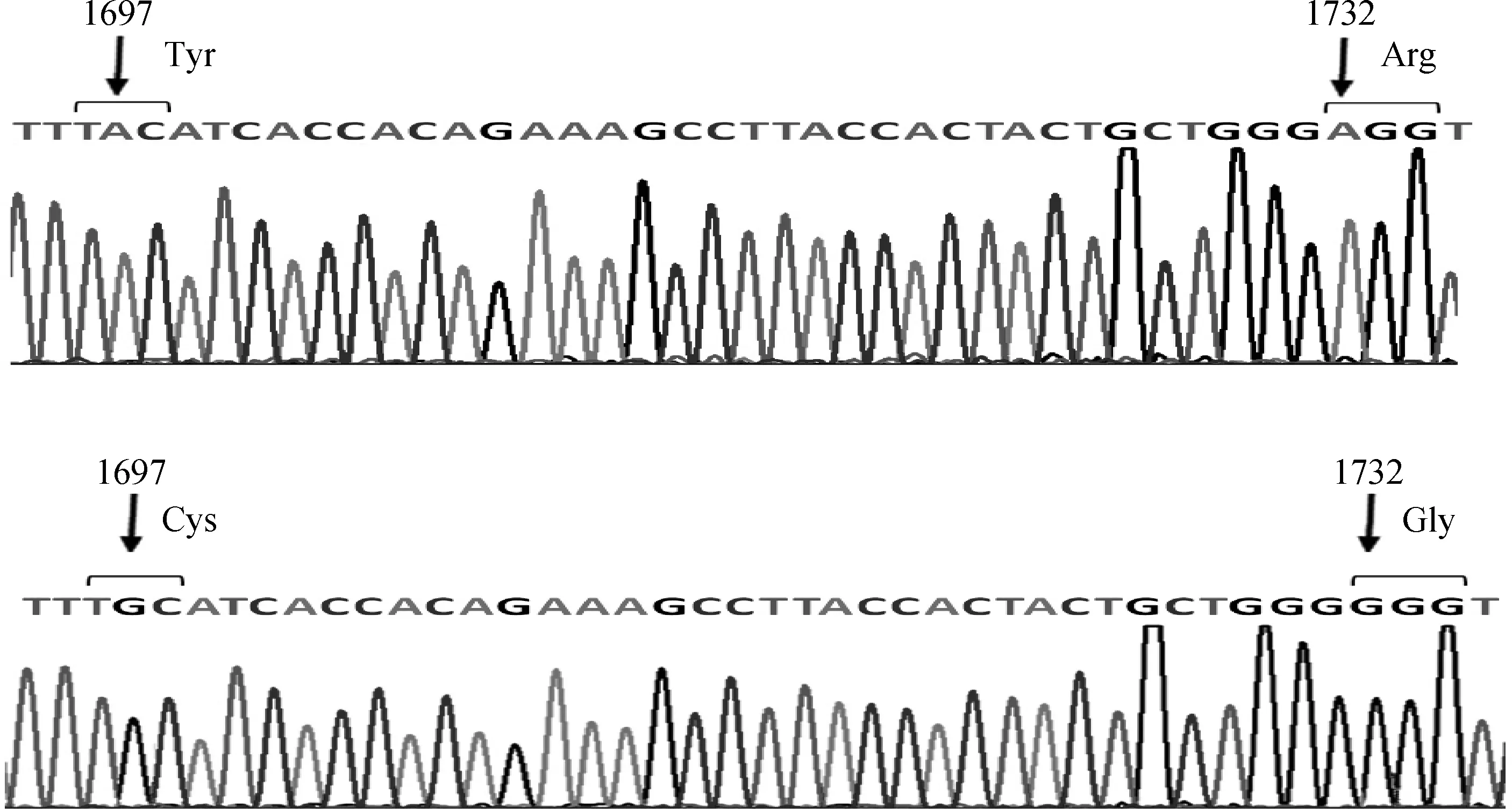
图6 GHR基因1697和1732位点的序列比较Fig.6 Nucleotide changes in GHR gene at sites 1697 and 1732
3 讨 论
对15匹贵州矮马GHR基因外显子10区域进行测序,共检测到10个核苷酸变异,其中5个SNPs位点引起了氨基酸改变,为编码区第1028、1267、1471、1697、1732位点,导致氨基酸改变:V343A、L423F、S491G、Y566C、R578G。
对1267位点的C/T变异进行群体检测,贵州矮马中C、D等位基因的频率与伊犁马间的差异不显著,多重比较未找到有明显差异的体尺指标;1267位点的Nm值是3个位点中最大的(表10),即矮马与伊犁马在该位点可能有较为频繁的基因交流,使得1267位点在两个群体间的差异最小。在人群和其他动物中未发现相同的点突变。
1471位点为A/G变异,贵州矮马中未发现FF型,伊犁马未检测到EE基因型。贵州矮马E等位基因占优势,伊犁马以F等位基因为主,之间差异显著。E等位基因编码G491,F等位基因编码S491。经比较,EE基因型个体的胸围率明显高于EF基因型个体(P< 0.05)(表8),提示E等位基因可能有促进马胸围率的作用。从人类SNP数据库中发现,同源位点存在C/T变异(dbSNP,rs6176),C/T变异处于密码子的第3位(AGC/AGT),均编码Ser491,为同义突变。该位点与亚洲人群的下颌高度没有直接的联系[17]。与人的S491S变异不同,本研究从两个马群中检测到的A/G变异导致了氨基酸改变,由Ser变为Gly。突变后的甘氨酸较丝氨酸少了羟基的影响。从一名特发性矮小患者GHR基因中检测到496位点发生Ala/Thr突变[18-19],在496位点的N端即为保守的Y487,是JAK2磷酸化GHR的作用位点[5],矮马GHR的S491G位点距Y487和496位点分别相隔3和5个氨基酸,非常近。S491G改变是否会影响到贵州矮马GHR蛋白Y487位点的磷酸化,还有待积累更多的试验数据。
采用SSCP方法检测1697、1732两个变异位点在贵州矮马和伊犁马群体中的频率。只有一匹贵州矮马(124号)为GH基因型,其余样品均为GG型;经测序证实124号矮马GHR基因编码区1697位和1732位点均为杂合型,导致Y566C、R578G替换。124号贵州矮马的体高为106 cm,雄性,6岁,已繁殖了十余个后代,是供试样本中最矮的个体。Y566C是GHR蛋白中5个保守的磷酸化位点之一[5]。人成熟GHR胞内区有5个酪氨酸是JAK2磷酸化作用位点,包括469、516、548、577和609[5],这5个酪氨酸从哺乳类到鱼类都很保守[20],其中548位点对应于贵州矮马GHR的Y566C位点。GH诱导GHR形成二聚体,JAK2结合于GHR上使GHR的酪氨酸残基发生磷酸化,做为胞内下游信号分子的结合位点。已知人GHR的454~620区域是GHR与SHC-MAPK(Src-homology and collagen homology-mitogen-activated protein kinase)信号结合的区域,MAPK通道被激活,可促进细胞的增殖,促进代谢相关酶类的合成,影响机体的代谢和生长[2,21-23]。124号贵州矮马(单倍型H3,表2)GHR基因1697位点突变为G,编码Cys566,且为杂合子,可能引起GHR的磷酸化不足,减弱下游的信号传导,但对124号矮马的繁殖功能似乎影响不大;此外,1732位点导致578位点从精氨酸变成甘氨酸,从带正电荷的碱性氨基酸转变为疏水的非极性氨基酸,有可能会对GHR蛋白的空间结构及功能产生影响。已有研究证明,人GHR成熟蛋白中的P561T多态性影响亚洲人的下颌骨生长,而且与体高相关[21],人P561T位点对应于GHR蛋白前体的P579位,与本研究检测到的矮马R578G紧邻。此外,安格斯牛GHR基因启动子区的SNP位点直接影响血清中的IGF-1含量,通过腺垂体-生长激素-胰岛素样生长因子1轴削弱了骨的生长,导致矮小[22]。贵州矮马1697和1732两个位点的多态性变化是否影响矮马长骨的生长有待进一步研究。
4 结 论
从贵州矮马基因组GHR外显子10区域发现5个SNPs位点引起了氨基酸变化,其中贵州矮马1028位点以A等位基因占优势,与较粗的管围、较低的尻高相关,1471位点以E等位基因为主,对应较高的胸围率;1697和1732位点以杂合型存在于矮马中,是否影响体高有待进一步研究。本试验的研究结果提示,GHR基因外显子10的多态性变化可能影响贵州矮马个体的生长。
[1] FRANK S J.Growth hormone signalling and its regulation:preventing too much of a good thing[J].GrowthHormIGFRes, 2001,11(4):201-212.
[2] PILECKA I,WHATMORE A,HUIJSDUIJNEN R,et al.Growth hormone signalling:sprouting links between pathways,human genetics and therapeutic options[J].TrendsEndocrinolMetab,2007,18(1):12-18.[3] SØRENSEN M T,CHAUDHURI S,LOUVEAU I,et al.Growth hormone binding proteins in pig adipose tissue:Number,size and effects of pGH treatment on pGH and bGH binding[J].DomestAnimEndocrinol,1992,9(1):13-24.
[4] RENAVILLE R,HAMMADI M,PORTETELLE D.Role of the somatotropic axis in the mammalian metabolism[J].DomestAnimEndocrinol,2002,23(1-2):351-360.
[5] VARVIO S L,TOURU T I,KANTANEN J,et al.Molecular anatomy of the cytoplasmic domain of bovine growth hormone receptor,a quantitative trait locus[J].ProcRSocB,2008,275(4):1525-1534.
[6] HULL K L,MARSH J A,HARVEY S.A missense mutation in the GHR gene of Cornell sex-linked dwarf chickens does not abolish serum GH binding[J].JEndocrinol,1999,161(3):495-501.
[7] CARDOSO D F,de SOUZA F R,de CAMARGO G M,et al.Polymorphism analysis in genes of the somatotropic axis in Nellore cattle selected for growth[J].Gene,2014,545(2):215-219.
[8] VIITALA S,SZYDA J,BLOTT S,et al.The role of the bovine growth hormone receptor and prolactin receptor genes in milk,fat and protein production in Finnish Ayrshire dairy cattle[J].Genetics,2006,173(4):2151-2164.
[9] 徐龙鑫,杨胜林,李爱萍,等.中国矮马群体mtDNA Cytb基因遗传多样性及系统进化研究[J].中国农业科学,2013,46(3):623-629. XU L X,YANG S L,LI A P,et al.Genetic diversity and phylogenetic relationship among five pony populations of China[J].ScientiaAgriculturaSinica,2013,46(3):623-629.(in Chinese)
[10] 李 敏,孟 军,刘运飞,等.伊犁马速步赛成绩与体尺性状的相关性研究[J].中国畜牧兽医,2014,41(10):209-212. LI M,MENG J,LIU Y F,et al.Study on correlation between competition results and body measurements on trot race in Yili horse[J].ChinaAnimalHusbandry&VeterinaryMedicine,2014,41(10):209-212.(in Chinese)
[11] 甘肃农业大学.养马学[M].北京:农业出版社,1981:242. Gansu Agricultural University.Hippology[M].Beijing:Agriculture Press,1981:242.(in Chinese)
[12] MANLY B F J.The statistics of natural selection[M].London:Chapman & Hall,1985:272-282.
[13] GOVERS R,BROEKE T,KERKHOF P,et al.Identification of a novel ubiquitin conjugation motif,required for ligand-induced internalization of the growth hormone receptor[J].EMBOJ,1999,18(1):28-36.
[14] SANTOS C M A,BROEKE T,STROUS G J.Growth hormone receptor ubiquitination,endocytosis,and degradation are independent of signal transduction via Janus kinase 2[J].JBiolChem,2001,276(35):32635-32641.
[15] BINDER G,NEUER K,RANKE M B,et al.PTPN11 mutations are associated with mild growth hormone resistance in individuals with Noonan syndrome[J].JClinEndocrinolMetab,2005,90(9):5377-5381.
[16] 黄 勇,田松军,王荣明,等.紫云县贵州矮马资源评价[J].山地农业生物学报,2012,31(2):145-149. HUANG Y,TIAN S J,WANG R M,et al.Investigation of Guizhou pony in Ziyun county of Guizhou province[J].JournalofMountainAgricultureandBiology,2012,31(2):145-149.(in Chinese)
[17] TOMOYASU Y,YAMAGUCHI T,TAJIMA A,et al.Further evidence for an association between mandibular height and the growth hormone receptor gene in a Japanese population[J].AmJOrthodDentofacialOrthop,2009,136(4):536-541.
[18] GODDARD A D,DOWD P,CHERNAUSEK S,et al.Partial growth-hormone insensitivity:the role of growth-hormone receptor mutations in idiopathic short stature[J].JPediatr,1997,131(1 Pt2):S51-55.[19] SAVAGE M O,ATTIE K M,DAVID A,et al.Endocrine assessment,molecular characterization and treatment of growth hormone insensitivity disorders[J].NatClinPractEndocrinolMetab,2006,2(7):395-407.[20] JIAO B,HUANG X,CHAN C B,et al.The co-existence of two growth hormone receptors in teleost fish and their differential signal transduction,tissue distribution and hormonal regulation of expression in seabream[J].JMolEndocrinol,2006,36(1):23-40.
[21] BAYRAM S,BASCIFTCI F A,KURAR E.Relationship between P561T and C422F polymorphisms in growth hormone receptor gene and mandibular prognathism[J].AngleOrthod,2014,84(5):803-809.
[22] GE W,DAVIS M E,HINES H C,et al.Association of single nucleotide polymorphisms in the growth hormone and growth hormone receptor genes with blood serum insulin-like growth factor I concentration and growth traits in Angus cattle[J].JAnimSci,2003,81(3):641-648.
[23] VANDERKUUR J A,BUTCH E R,WATERS S B,et al.Signaling molecules involved in coupling growth hormone receptor to mitogen-activated protein kinase activation[J].Endocrinology,1997,138(10):4301-4307.
(编辑 郭云雁)
Polymorphism of Five SNPs in Exon 10 of Growth Hormone Receptor Gene in Guizhou Pony(Equuscaballus)
RAN Xue-qin1*,ZHAO Xing-yan1,WANG Jia-fu2,TIAN Song-jun3,WEI Xiao-hong3
(1.FacultyofAnimalScience,GuizhouUniversity,Guiyang550025,China;2.InstituteofAgro-Bioengineering,GuizhouUniversity,Guiyang550025,China;3.BureauofAnimalHusbandryandVeterinaryofZiyunofGuizhou,Ziyun550800,China)
To explore the reason for the slow growth of Guizhou pony,sequences of exon 10 inGHRgene were cloned from the genome of Guizhou pony by polymerase chain reaction(PCR) and gene cloning methods.Distribution of 5 single nucleotide polymorphism(SNP) sites was determined by allele-specific PCR(AS-PCR) and single-strand conformation polymorphism(SSCP) methods.Taking Ili horse as control,the relationship between the genotypes ofGHRand body sizes of Guizhou pony and Ili horse was calculated based on population genetics and bioinformatics algorithms.The results showed that a total of 10 haplotypes of exon 10 ofGHRgene were sequenced from Guizhou pony,in which contained 10 SNP sites.Among them,5 sites,1028,1267,1471,1697 and 1732,changed the amino acid residues of GHR.Frequencies of 3 sites,1028,1267 and 1471,were tested by AS-PCR method.Compared with Ili horse,allele A at site 1028 was dominant and related with the lower rump height and higher cannon circumference in Guizhou pony.The percentage of allele E at 1471 site in Guizhou pony was higher than that in Ili horse and related to higher chest girth ratio of pony.Heterozygous genotypes of 1697 and 1732 sites were detected from the shortest male pony with 106 cm in height,6 years old.The V343A change resulted from 1028 site located in the ubiquitin-dependent endocytosis(UbE) motif and might affect the GHR internalization and degradation.Changes at S491G,Y566C and R578G sites resulted from SNP sites of 1471,1697 and 1732,might directly or indirectly impact the phosphorylation of GHR and influence the activation of signal transduction pathways.It suggested that the polymorphisms in exon 10 ofGHRgene might have an effect on the growth and development of Guizhou pony.
Guizhou pony;growth hormone receptor gene;exon 10;SNP
2014-12-19
贵州省农业攻关项目(黔科合NY字[2012]3009号;黔科合NY字[2009]3068号);贵州省农业动植物育种专项(黔农育专字2009-021号);贵州省科技创新人才团队建设专项(黔科合人才团队2009-4006)
冉雪琴(1967-),女,重庆人,博士,主要从事动物生理学与分子生物学研究
*通信作者:冉雪琴,教授,Tel:0851-8298070,Fax:0851-88298070,E-mail:as.xqran@gzu.edu.cn
10.11843/j.issn.0366-6964.2015.11.009
S821;S813.3
A
0366-6964(2015)11-1974-13
