电离辐射对小鼠骨髓c-kit阳性细胞损伤效应体外研究*
2015-03-18张俊伶李德冠孟爱民
张俊伶,刘 冰,路 璐,李德冠,孟爱民
(中国医学科学院放射医学研究所/天津市放射医学与分子核医学重点实验室,天津300192)
造血系统对电离辐射高度敏感,电离辐射能够引起造血系统损伤,包括急性骨髓抑制和持久性骨髓损伤。急性骨髓抑制在受到照射后很快发生,主要是快速增殖的造血祖细胞(hematopoietic progenitor cell,HPC)损伤所致。持久性骨髓损伤是辐射远期损伤的主要表现,主要是由于电离辐射引起的造血干细胞(hematopoietic stem cell,HSC)损伤所致[1-2]。c-kit+细胞是一群经过富集的富含HPC和HSC的一类细胞,目前利用磁珠分选系统能在短时间内快速分选出大量的c-kit+细胞,因此对c-kit+细胞电离辐射损伤的研究能够初步反应 HPC和HSC损伤情况,对辐射引起造血系统损伤机制研究及损伤防护药的初步筛选具有重要意义。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器 无血清扩增培养基SFEM,购自Stem Cell Technologies公司;c-kit磁珠,购自美天旎公司;细胞活力检测试剂盒Celltiter-Glo,购自Promega公司;甲基纤维素半固体培养基 M3534,购自Stem Cell Technologies公司;活性氧(ROS)检测试剂盒,购自碧云天生物技术有限公司;碘化丙啶(PI)染液,购自索莱宝公司;凋亡检测试剂盒,购自BD公司。多功能酶标仪,型号InfiniteM200,购自 TECAN公司。137Csγ射线辐射源,型号USD,Autocell40,购自加拿大原子能有限公司;流式细胞仪,型号C6,购自BD公司。
1.1.2 实验动物 无特定病原体(SPF)级C57BL/6雄性小鼠15只,18~25g,购自维通利华,饲养于中国医学科学院放射医学研究所实验动物中心。
1.2 方法
1.2.1 c-kit+细胞分离 无菌分离小鼠双侧股骨胫骨,去除表面附着肌肉,用2.5mL一次性无菌注射器在磷酸盐缓冲液(PBS)中将骨髓细胞冲出,计数获取的细胞数目。每1×108细胞加20μL的c-kit磁珠,冰上孵育30min,孵育结束后加入5mL PBS,离心1 500r/min,5min。离心完毕用10mL PBS重悬细胞,利用磁珠分选系统进行c-kit+细胞分离[3]。
1.2.2 实验分组 实验分为3组,对照组:取1×107个/mL浓度的c-kit+细胞悬液600μL加入至2mL EP管内,再加入无血清扩增(SFEM)培养基600μL吹打混匀。1Gy照射组:在对照组基础上进行1Gy剂量γ射线照射;4Gy照射组:在对照组基础上进行4Gy剂量γ射线照射。
1.2.3 小鼠c-kit+细胞活力检测 将细胞悬液接种于96孔板内,每孔200μL,每个实验组设置4个平行孔。每孔加入20 μL生物发光试剂,室温避光震荡孵育30min,多功能酶标仪检测细胞发光值。
1.2.4 小鼠c-kit+细胞克隆形成能力检测 0Gy接种细胞浓度1×104个/mL、1Gy接种细胞浓度2×104个/mL、4Gy接种细胞浓度1×105个/mL(根据前期系列预实验提示,以上接种细胞浓度在显微镜下计数最为适宜,克隆数目既不会太多也不会太少;随照射剂量增加,造血祖细胞损伤严重,形成克隆数目减少,所以随照射剂量增加需要加大接种细胞浓度)。调整细胞浓度为接种浓度的10倍,加0.2mL细胞至2mL M3534,振荡器充分混匀,静置2~5min,待气泡消失。用2.5 mL注射器连接16#平头注射器针头,吸取0.5mL细胞混悬液,加入24孔板,轻摇培养板,使培养基均匀分布。将培养板置入37℃,5%CO2培养箱中培养,第5天低倍观察集落形成情况,细胞数大于或等于30为阳性集落。
1.2.5 小鼠c-kit+细胞内ROS水平检测 将c-kit+细胞悬液1mL加入2mL无菌EP管内,1 500r/min,离心5min后弃上清液。每管内加入500μL ROS检测探针[无血清1640与ROS探针(DCFH-DA)比例为3 000∶1],37℃ CO2水浴锅内孵育30min后离心,弃去上清液后用无血清RPMI-1640培养基洗涤3次以洗去多余未结合探针,最后用无血清RPMI-1640培养基将细胞悬起,流式细胞仪检测荧光素(FITC)通道平均荧光强度。
1.2.6 小鼠c-kit+细胞周期检测 取c-kit+细胞悬液500 μL,加入1mg/mL的PI染液25μL,使PI染液终浓度为50 μg/mL,室温避光孵育1h。孵育结束加5mL体积的PBS溶液,1 500r/min,离心5min后弃上清液。加入200μL体积的PBS溶液重悬细胞,流式细胞仪检测细胞周期。
1.2.7 小鼠c-kit+细胞凋亡检测 取c-kit+细胞悬液,离心去上清液后加入100μL BD凋亡试剂盒内1×Binding buffer试剂,加入BD凋亡试剂盒内的Annexin V试剂和7-AAD试剂各5μL,室温避光孵育15min,再加入BD凋亡试剂盒内1×Binding buffer试剂200μL,流式细胞仪检测凋亡情况。
1.2.8 小鼠c-kit+细胞受照射后发生改变的信号通路分析取c-kit+细胞悬液,离心去上清液后加入1mL体积的Trizol试剂,交由上海康成生物工程有限公司进行全基因组的基因芯片分析后进行聚类分析。
1.3 统计学处理 采用GraphPad Prism5软件对数据进行处理,计量资料以±s表示,多组间的均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 电离辐射对小鼠c-kit+细胞活力、细胞克隆形成能力(CFU-GM)及细胞内ROS水平的影响与对照组比较,受照射后小鼠c-kit+细胞活力下降,细胞克隆形成能力下降,以上两项检测指标随细胞受照射剂量增加而递减。与对照组比较,受照射后小鼠c-kit+细胞内ROS水平升高,且随照射剂量增加递增,见表1。
2.2 电离辐射对小鼠c-kit+细胞S/G2/M 期、早期凋亡及晚期凋亡的影响与对照组比较与对照组比较,受1Gy照射后小鼠处于S/G2/M 期细胞比例增加(P<0.05),受4Gy照射后小鼠c-kit+细胞处于S/G2/M 期细胞比例明显下降(P<0.05)。与对照组比较,受照射后小鼠早期凋亡及晚期凋亡细胞比例随照射剂量加大而明显增加,见表2。
表1 受照射后c-kit+细胞细胞活力、克隆形成能力、细胞内ROS水平变化(±s)

表1 受照射后c-kit+细胞细胞活力、克隆形成能力、细胞内ROS水平变化(±s)
a:P<0.01,与对照组比较。
组别 细胞活力(RLU)克隆数目(个/105细胞) ROS(MFI)n 4 6 3对照组 333 837.5±3 339.6 705.0±53.9 733 933.0±71 742.8 1Gy组 187 787.5±2 568.5a 340.8±22.0a1 795 565.0±230 079.6a 4Gy组 101 239.3±2 197.7a 22.7±4.6a2 815 854.0±189 153.2a
表2 受照射后c-kit+细胞S/G2/M期、早期凋亡及晚期凋亡细胞比例变化(±s)

表2 受照射后c-kit+细胞S/G2/M期、早期凋亡及晚期凋亡细胞比例变化(±s)
a:P<0.05,与对照组比较。
组别 S/G2/M 期细胞比例(%)早期凋亡细胞比例(%)晚期凋亡细胞比例(%)26.3±2.6 3.2±0.4 1.3±0.2 1Gy组 32.3±0.5a 4.5±0.7a 2.3±0.3a 4Gy组 19.9±0.2a 11.0±1.0a 4.5±0.5对照组a
2.3 小鼠c-kit+细胞受照射后上调基因变化与对照组比较,c-kit+细胞受4Gy剂量γ射线照射后,氧化应激相关的2个基因表达上调、细胞周期相关的34个基因表达上调、细胞凋亡相关的35个基因表达上调,见表3。

表3 表达升高2倍以上的前10位基因
2.4 小鼠c-kit+细胞受照射后下调基因变化与对照组比较,c-kit+细胞受4Gy剂量γ射线照射后,氧化应激相关的6个基因表达下调、细胞周期相关的96个基因表达下调、细胞凋亡相关的56个基因表达下调,见表4。
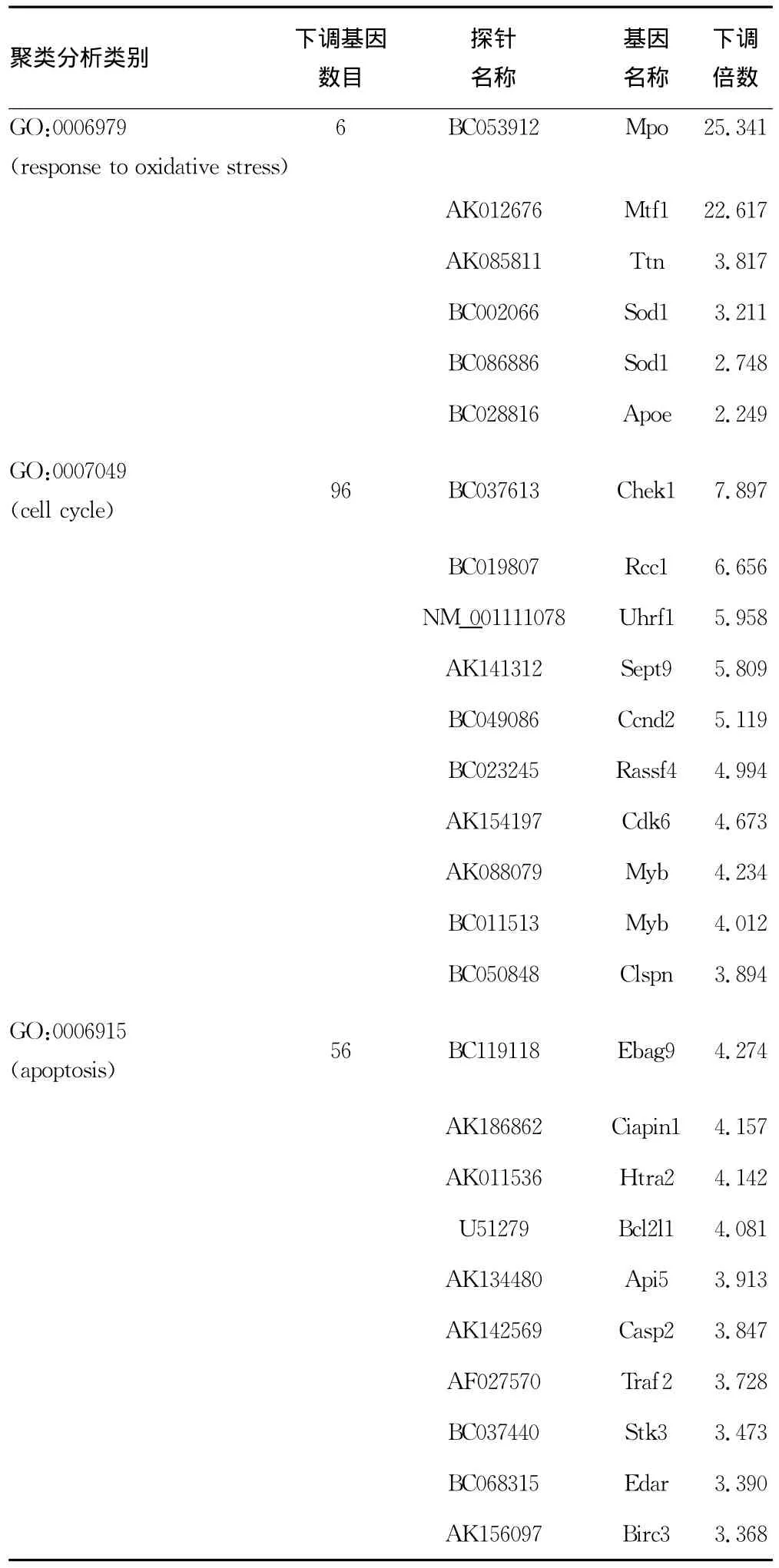
表4 表达降低2倍以上的前10位基因
3 讨 论
HSC是造血系统中一类特殊的的细胞群,在进行自我更新的同时能够定向分化为HPC及各类成熟的血液细胞。c-kit又名CD117,是特异性存在于HSC及HPC表面的抗原分子,c-kit能够与干细胞因子特异性结合,调控细胞的生存及增殖[4]。由于在已经成熟分化的造血细胞表面没有c-kit的表达,因此本研究选用c-kit+细胞群研究电离辐射对 HSC及HPC损伤效应及损伤相关的基因表达变化。
研究提示,c-kit+细胞在经过1Gy和4Gy剂量照射后,细胞活力下降,造血祖细胞克隆形成数目减少,细胞内ROS水平升高,这些变化随照射剂量的增加而呈递减或递增变化。研究结果与之前对小鼠进行整体照射后的HSC变化一致[5-7],说明对c-kit+细胞体外研究能够反映全身照射小鼠造血系统变化。本研究进一步应用流式细胞仪对电离辐射后c-kit+细胞增殖凋亡变化进行分析,结果提示,经过1Gy照射后,处于增殖期(S/G2/M 期)c-kit+细胞比例明显增加,凋亡细胞明显增加;然而经过4Gy照射后,处于增殖期(S/G2/M 期)c-kit+细胞比例明显下降,凋亡细胞明显增加。分析上述结果,低剂量的电离辐射(1Gy)较短时间内可能会刺激c-kit+细胞进入增殖期,对电离辐射引起的细胞损伤起到代偿作用,然而,受损伤后发生凋亡的细胞明显多于增殖细胞,导致1Gy照射后存活细胞减少。随着照射剂量增加到4Gy,增殖细胞减少,凋亡细胞增加,存活细胞数目进一步减少。对细胞增殖和凋亡的检测能够更深入地解释细胞活力随照射剂量的增加而下降的现象。
电离辐射引起HSC及HPC损伤的分子机制尚不完全明确,已有的研究提示电离辐射引起 ROS-NOX4-p38MAPK-p16,ATM-Chk2-p53-p21[6,8]等信号通路发生变化,对这些基因采取激活或者抑制的方法不能完全阻断电离辐射引起的HSC及HPC损伤。因此对c-kit+细胞进行4Gy照射后,提取细胞RNA进行全基因组基因芯片分析,对分析出的基因进行进一步的聚类分析,总结出经过照射后表达上调及下调的与氧化应激、细胞周期、细胞凋亡的一系列相关基因,并列表总结出涉及以上细胞生物学过程的表达上调及下调的前十位基因。结果提示,氧化应激相关的基因Srxn1[9]、Psmb5[10],细胞周期相 关 的 Cdkn1a[8]、Smc1b[11]等基因,细胞凋亡相关的Bcl2l1[12]、Lrdd[13]等基因表达上调。氧化应激相关的Mpo[14]、Mtf1[15]等基因,细胞周期相关的 Chek1[16]、Rcc1[17]等基因,细胞凋亡相关的Ebag9、Ciapin1[18]等基因表达下调。之前的关于电离辐射对小鼠造血干祖细胞损伤的研究都较少涉及以上相关基因,进一步的研究工作可以参考以上基因表达变化,因此筛选出的新基因对造血系统电离辐射损伤研究可能具有重要意义。
综上,本研究在体外水平分析了受到不同剂量照射后,ckit+细胞在细胞活力、细胞内ROS水平、细胞功能、细胞增殖及凋亡水平的变化,进一步揭示了引起这些变化可能存在的分子机制,为电离辐射导致HSC及HPC损伤的研究奠定了基础,具有重要的提示意义。
[1]Shao L,Feng W,Li H,et al.Total body irradiation causes long-term mouse BM injury via induction of HSC premature senescence in an Ink4a-and Arf-independent manner[J].Blood,2014,123(20):3105-3115.
[2]Li H,Wang Y,Pazhanisamy SK,et al.Mn(Ⅲ)meso-tetrakis-(N-ethylpyridinium-2-yl)porphyrin mitigates total body irradiation-induced long-term bone marrow suppression[J].Free Radic Biol Med,2011,51(1):30-37.
[3]Ema H,Morita Y,Yamazaki S,et al.Adult mouse hematopoietic stem cells:purification and single-cell assays[J].Nat Protoc,2006,1(6):2979-2987.
[4]Masson K,Rönnstrand L.Oncogenic signaling from the hematopoietic growth factor receptors c-Kit and Flt3[J].Cell Signal,2009,21(12):1717-1726.
[5]Zhang H,Zhai ZB,Wang YE,et al.Resveratrol ameliorates ionizing irradiation-induced long-term hematopoietic stem cell injury in mice[J].Free Radical Biol Med,2013,54:40-50.
[6]Wang Y,Liu L,Pazhanisamy SK,et al.Total body irradiation causes residual bone marrow injury by induction of persistent oxidative stress in murine hema-topoietic stem cells[J].Free Radic Biol Med,2010,48(2):348-356.
[7]Li D,Wang Y,Wu H,et al.The effects of p38MAPK inhibition combined with G-CSF administration on the hematoimmune system in mice with irradiation injury[J].PLoS One,2013,8(4):e62921.
[8]Shao L,Li H,Pazhanisamy SK,et al.Reactive Oxygen species and hematopoietic stem cell senescence[J].Int J Hematol,2011,94(1):24-32.
[9]Zhou Y,Duan S,Zhou Y,et al.Sulfiredoxin-1attenuates oxidative stress via Nrf2/ARE pathway and 2-Cys prdxs after oxygen-glucose deprivation in astrocytes[J].J Mol Neurosci,2015,55(4):941-950.
[10]Cho HY,Reddy SP,Kleeberger SR.Nrf2defends the lung from oxidative stress[J].Antioxid Redox Signal,2006,8(1/2):76-87.
[11]Takabayashi S,Yamauchi Y,Tsume M,et al.A spontaneous smc1bmutation causes cohesin protein dysfunction and sterility in mice[J].Exp Biol Med(Maywood),2009,234(8):994-1001.
[12]Wu H,Xue D,Chen G,et al.The BCL2L1and PGAM5 axis defines hypoxia-induced receptor-mediated mitophagy[J].Autophagy,2014,10(10):1712-1725.
[13]Telliez JB,Bean KM,Lin LL.LRDD,a novel leucine rich repeat and death domain containing protein[J].Biochim Biophys Acta,2000,1478(2):280-288.
[14]Mine Y,Young D,Yang C.Antioxidative stress effect of phosphoserine dimers is mediated via activation of the Nrf2signaling pathway[J].Mol Nutr Food Res,2015,59(2):303-314.
[15]Li Y,Liu X,Zhou T,et al.Inhibition of APE1/Ref-1redox activity rescues human retinal pigment epithelial cells from oxidative stress and reduces choroidal neovascularization[J].Redox Biol,2014,2:485-494.
[16]Sankunny M,Parikh RA,Lewis DW,et al.Targeted inhibition of ATR or CHEK1reverses radioresistance in oral squamous cell carcinoma cells with distal chromosome arm 11q loss[J].Genes Chromosomes Cancer,2014,53(2):129-143.
[17]Bierbaum M,Bastiaens PI.Cell cycle-dependent binding modes of the ran exchange factor RCC1to chromatin[J].Biophys J,2013,104(8):1642-1651.
[18]Yang Z,Wang WE,Zhang Q.CIAPIN1siRNA inhibits proliferation,migration and promotes apoptosis of VSMCs by regulating Bcl-2and Bax[J].Curr Neurovasc Res,2013,10(1):4-10.
