PDGF-C、PDGF-D在大鼠肾间质纤维化过程中的作用
2015-03-17刘乃国刘云启
徐 聪,刘乃国,毛 宁,刘云启
(1. 滨州医学院附属医院,山东 滨州 256603;2. 滨州医学院,山东 滨州 256600)
PDGF-C、PDGF-D在大鼠肾间质纤维化过程中的作用
徐 聪1,刘乃国2,毛 宁2,刘云启1
(1. 滨州医学院附属医院,山东 滨州 256603;2. 滨州医学院,山东 滨州 256600)

目的 探讨血小板源性生长因子-C(PDGF-C)、血小板源性生长因子-D(PDGF-D)在大鼠肾间质纤维化模型中的表达及意义。方法 将28只SD大鼠按照单侧输尿管梗阻(UUO)的方法建模,分别于造模后的3 d、1周、2周、3周分别将7只大鼠处死,取出两侧肾脏(未行手术侧的肾脏设为对照组)制作石蜡切片在光镜下观察。应用免疫组化(SABC)法检测模型大鼠肾组织中PDGF-C、PDGF-D的表达情况。结果 对照组中PDGF-C在肾小动脉的血管平滑肌细胞和肾小管上皮细胞中少量表达,PDGF-D主要在血管平滑肌细胞和肾小球系膜细胞表达。而模型组肾脏中PDGF-C、PDGF-D的表达显著上调,与对照组相比差异有统计学意义(P均<0.05),且肾间质及肾小管中PDGF-C、PDGF-D的表达强度与肾间质纤维化程度呈正相关(r=0.73,P<0.05;r=0.67,P<0.05)。结论 PDGF-C、PDGF-D均参与肾间质纤维化过程,并可能发挥着重要作用。
肾间质纤维化;PDGF-C;PDGF-D;单侧输尿管梗阻模型
肾间质纤维化和肾小管萎缩是多种原因导致肾间质损伤的共同结局,其过程是复杂的,包括多种独立和相互作用的细胞和分子途径。参与肾间质纤维化过程的细胞包括肾小管上皮细胞、成纤维细胞、纤维细胞、肌成纤维细胞、单核细胞/巨噬细胞和肥大细胞,分子介质包括肝细胞生长因子、转化生长因子-β、血小板源性生长因子(PDGF)等,它们之间的作用机制至今尚未阐明。本研究用SD大鼠,采用单侧输尿管梗阻(unilateral ureteral obstruction,UUO)的方法建立肾间质纤维化的模型,检测肾组织中PDGF-C、PDGF-D的表达情况,进一步探讨二者在肾间质纤维化中的作用,加深对肾间质纤维化发病机制的了解。
1 实验资料
1.1主要试剂 兔抗PDGF-C多克隆抗体、兔抗PDGF-D多克隆抗体(abcam 公司);生物素化山羊抗兔IgG、SABC及DAB显色试剂盒(武汉博士德生物工程有限公司)。
1.2动物及造模方法 选择清洁级雄性SD大鼠28只,体质量180~230 g,由山东中医药大学实验动物中心提供,许可证号SCXK(鲁)2011-0003。将大鼠用3%戊巴比妥钠进行麻醉(剂量为0.15 mL/kg),后行左侧输尿管结扎术(于背部肋脊角处切开皮肤,长约2 cm,取出肾脏,将其翻向脊柱侧,以湿纱布覆盖,暴露肾门,分离输尿管,用手术线上下结扎2次,中间剪断输尿管。提起切口处皮肤肌肉,使肾脏回纳原位,依次缝合肌肉、皮下组织及皮肤),分别于3 d、1周、2周和3周后随机选择7只大鼠,取其双侧肾组织进行实验。未手术侧肾脏作为对照组。
1.3肾小管间质纤维化评分方法 将组织切片进行苏木素-伊红(HE)染色,按照Banff分级[1]在光镜下对肾间质纤维化病变程度进行半定量评分,分为0~3分。肾脏结构正常,肾小管及肾间质未见明显改变计为0分;肾小管上皮细胞轻度萎缩、变性,纤维组织增生呈小灶性、少量分布,病变范围<25%计为1分;肾小管上皮细胞中度萎缩、变性、坏死轻,纤维组织中度增生,病变范围26%~50%计为2分;肾小管上皮细胞重度萎缩、变性和坏死重,成片分布,纤维组织增生呈束状、网状成片,病变范围>50%计为3分。观察10个不重复的高倍视野,取其平均值作为结果。
1.4肾组织检测 用免疫组化(SABC)法检测PDGF-C及PDGF-D在肾组织中的表达情况。切片常规脱水,灭活内源性酶,修复抗原, BSA封闭液封闭,分别滴加兔抗PDGF-C多克隆抗体、兔抗PDGF-D多克隆抗体培育过夜,山羊抗兔IgG,SABC反应30 min,DAB显色(显微镜下控制显色时间),苏木素复染;脱水、透明、封片,每一步完成后均用PBS缓冲液冲洗3次。
1.5结果判断 组织上染上棕褐色为PDGF-C、PDGF-D阳性,采用计算机彩色病理图像分析软件对PDGF-C、PDGF-D免疫组化进行半定量分析,具体操作:分别取10个不重复的肾小管间质视野(显微镜200倍),以视野面积中阳性面积的比例计算,通过半定量分析后取其平均值作为结果。

2 结 果
2.1病理学改变 光镜下,对照组大鼠肾脏肾小球、肾小管无明显病理改变,未见肾间质纤维化,肾间质纤维化程度评分为(0.2±0.1)分;UUO术后3 d大鼠肾脏肾小管轻微萎缩,未见明显的肾间质纤维化,肾间质纤维化程度评分为(0.3±0.1)分;UUO术后7 d大鼠肾脏可见肾小管轻度萎缩,少量肾间质纤维组织增生,肾间质纤维化程度评分为(1.3±0.2)分;UUO术后14 d大鼠肾脏可见肾小管上皮细胞萎缩、变性,肾间质纤维组织增生多灶状分布,肾间质纤维化程度评分为(1.7±0.3)分;UUO术后21 d大鼠肾脏可见较多肾小管上皮细胞变性、坏死,肾间质纤维化组织增生树状分布,肾间质纤维化程度评分为(2.3±0.2)分。
2.2PDGF-C在肾组织中的表达情况 在对照组,PDGF-C仅在肾脏小动脉的血管平滑肌细胞和少数的肾小管上皮细胞中表达,见图1;UUO模型组小动脉血管平滑肌细胞和肾小管上皮细胞以及肾间质及肾小管中都有PDGF-C,见图2~5;而且随着模型建立后时间的延长,PDGF-C在肾间质及肾小管中的含量升高,与对照组相比,PDGF-C在模型组肾脏中的表达明显升高(P<0.05)。见表1。PDGF-C在小管间质的阳性表达与肾小管间质纤维化积分呈正相关(r=0.73,P<0.05)。
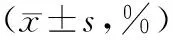
表1 不同时间段各组PDGF-C阳性表达面积占小管间质总面积
注:①与对照组相比,P<0.05。
2.3PDGF-D在肾组织中的表达情况 在对照组,PDGF-D主要表达在血管平滑肌细胞和肾小球系膜细胞及肾小管上皮细胞,在肾间质中无表达,见图6。UUO模型组,PDGF-D不仅在上述细胞中表达增多,也表达在间质纤维化区域的间质细胞中;而且随着模型建立后时间的延长,PDGF-D在肾间质中的含量逐渐升高,见图7~10。PDGF-D在小管间质的阳性表达与肾小管间质纤维化积分呈正相关(r=0.67,P<0.05)。见表2。
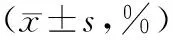
表2 2组不同时间段PDGF-D阳性表达面积占小管间质总面积
注:①与对照组相比,P<0.05。
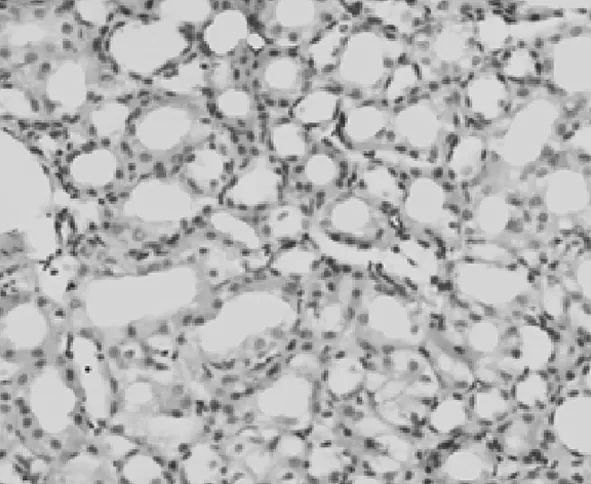
图1 PDGF-C在对照组大鼠肾脏中的表达(DAB×400)
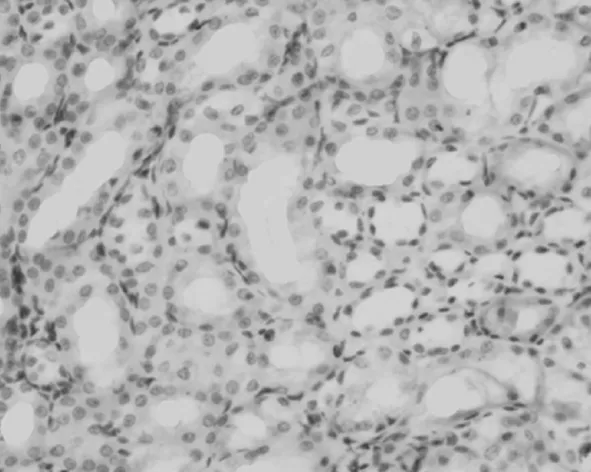
图2 PDGF-C在UUO 3 d大鼠肾脏中的表达(DAB×400)

图3 PDGF-C在UUO 7 d大鼠肾脏中的表达(DAB×400)

图4 PDGF-C在UUO 14 d大鼠肾脏中的表达(DAB×400)

图5 PDGF-C在UUO 21 d大鼠肾脏中的表达(DAB×400)
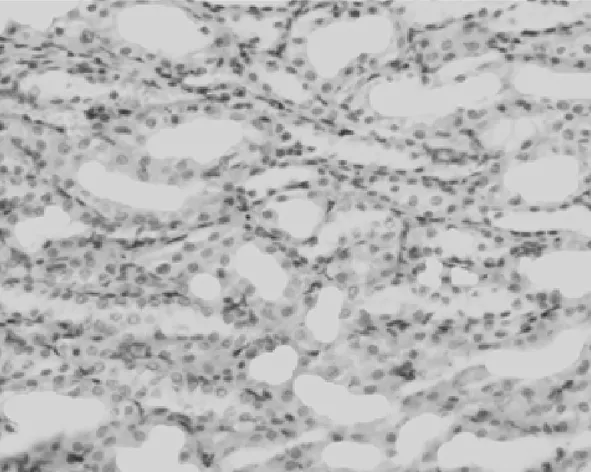
图6 PDGF-D在对照组大鼠肾脏中的表达(DAB×400)
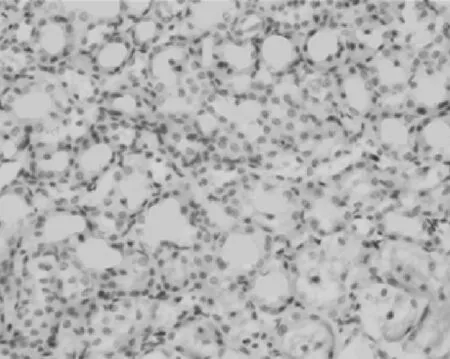
图7 PDGF-D在UUO 3 d大鼠肾脏中的表达(DAB×400)
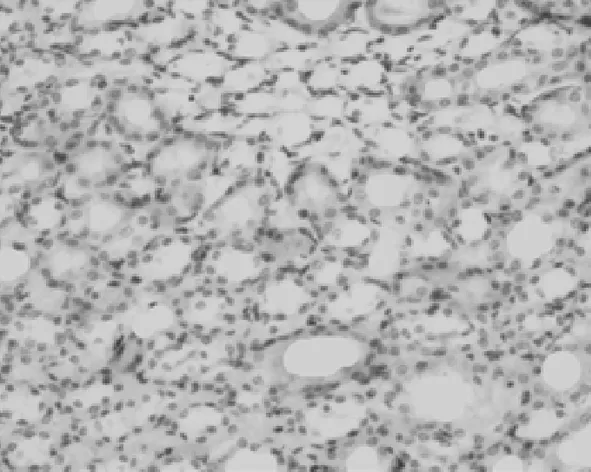
图8 PDGF-D在UUO 7 d大鼠肾脏中的表达(DAB×400)
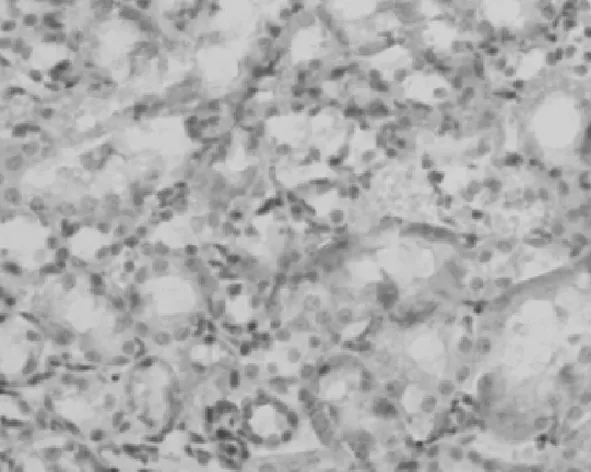
图9 PDGF-D在UUO 14 d大鼠肾脏中的表达(DAB×400)
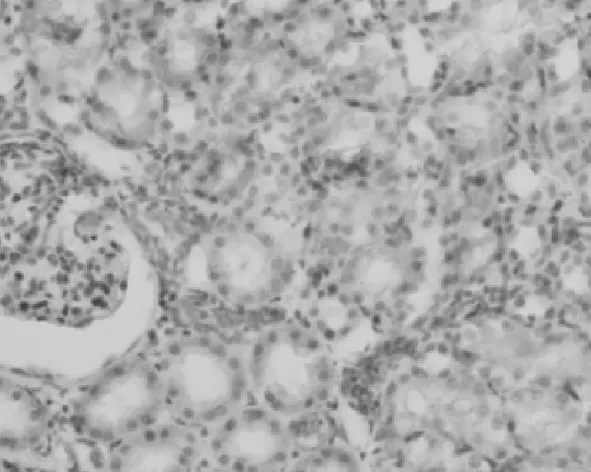
图10 PDGF-D在UUO 21 d大鼠肾脏中的表达(DAB×400)
3 讨 论
肾间质纤维化是多种肾脏疾病发展的共同途径,多种生长因子参与其中。大量研究表明,PDGF家族可刺激系膜细胞、成纤维细胞的增殖及细胞外基质的积聚[2-3],在肾间质纤维化过程中起着重要作用。UUO模型是目前比较理想的肾间质纤维化动物模型之一,与人类肾间质纤维化过程相近[4],故本研究采用UUO模型,对肾间质纤维化的机制进行了进一步的探讨。
PDGF家族包括PDGF-A,PDGF-B,PDGF-C,PDGF-D 4个成员,其所有成员均通过两个受体(PDGF-α、PDGF-β)发挥作用,并组成性或诱导性地表达于肾脏细胞,参与细胞增殖和迁移及细胞外基质蛋白的积累,亲和抗炎递质分泌的调节,在调解系膜增生改变及肾间质纤维化和肾小球血管生成中扮演着重要的角色[5-7]。
PDGF-C、PDGF-D是PDGF家族新发现的2个特殊亚型,它们有2个结构域,分别是C-末端的PDGF / VEGF结构域和N-末端的CUB结构域。它们主要由肥大细胞分泌,在胚胎发育和成人组织中均具有重要的功能。在胚胎发育过程中,PDGF-C在心、耳、脑及肾脏的生长过程中扮演着重要的角色;在成人中,肾脏和脑组织中含有较多的PDGF-C。PDGF调节多种病理生理活动,从细胞增殖、迁移,细胞外基质积聚,产生亲和抗炎递质,到组织渗透性和血流动力学。在心、肝、肺纤维化模型中均检测到了PDGF-C的过度表达[8-9]。
肾间质纤维化是多种细胞及分子参与的复杂的过程,PDGF-C是肾脏最典型的生长因子系统,越来越多的证据表明PDGF家族是肾脏纤维化发展的关键因素[10]。Gilbertson等[11]证实PDGF-C通过它的受体发挥作用,其可以促进成纤维细胞和血管平滑肌细胞有丝分裂。PDGF-C的其他功能还包括刺激血管的生成和促进伤口的愈合[12]。正常组织中,PDGF-C mRNA只在肾小球壁层上皮细胞和平滑肌细胞中表达,但在损伤组织中,PDGF-C在肾小管和肾间质中的表达明显上调,可能和肾纤维化的发病机制相关。而在肾纤维化过程中,PDGF-C诱导成纤维细胞趋化因子的表达,刺激成纤维细胞增生、上皮细胞迁移及中性粒细胞浸润[13-15],加重肾脏的炎症和纤维化。本实验说明,PDGF-C在正常大鼠肾组织中少量表达,但随着梗阻时间的延长,部分肾小管萎缩、变性、坏死,肾间质纤维组织增生,PDGF-C的表达增多,且其表达水平与肾间质的纤维化程度呈正相关,进一步表明PDGF-C可能参与了肾间质纤维化的过程且扮演着重要的角色。
PDGF-D是一种新型的肾小球系膜细胞增殖的介质[16]。PDGF-D与PDGF-B均通过PDGF β发挥作用,因此他们具有类似的生物学效应。实验研究将腺病毒结构编码的PDGF-D注入小鼠体内,结果显示血清中含有高水平PDGF-D的小鼠发展为严重的系膜增生性肾小球肾炎,这项研究为证实PDGF-D是一种肾小球系膜细胞有丝分裂原提供了有利依据[13]。Taneda等[17]的一项研究证实在UUO大鼠模型中,PDGF-D的表达在肾间质细胞迅速增加。PDGF-D表达区域与β受体上调区域紧密重叠,这表明PDGF-D通过其受体发挥促纤维化作用。本实验证实在正常肾脏中PDGF-D主要表达在血管平滑肌细胞和肾小球系膜细胞及肾小管上皮细胞中。而UUO模型组,随着梗阻时间的延长,PDGF-D不但在上述细胞中的表达增多,也表达在间质纤维化区域的间质细胞中,其阳性表达面积与肾间质纤维化的程度呈正相关。这表明PDGF-D参与肾间质纤维化并扮演着重要的角色。Ostendorf等[18]实验证实抗PDGF-D治疗可以降低肾皮质单核细胞/巨噬细胞浸润。Boor等[19]和Eisel等[20]实验证实,抗PDGF-D治疗在维持肾功能方面具有长远意义,能更好地保护肾脏的形态。
慢性肾脏疾病的主要病变之一是肾间质的纤维化及肾小球的硬化,尽早防止这种改变,对预防终末期肾病的发生意义重大。PDGF-C及PDGF-D在肾间质纤维化中起着重要的作用,因此,抗PDGF-C、PDGF-D靶向治疗有望成为今后治疗肾间质纤维化的研究热点。
[1] Solez K,Axelsen RA,Benedi RH,et al. International standardization of criteria for the histologic diagnosis of renal allograft rejection: the Banff working classification of kidney transplant pathology[J]. Kidney Int,1993,44(7):411-422
[2] Xuri Li,Ulf Eriksson. Novel PDGF family members:PDGF-C and PDGF-D[J]. Cytokine & Growth Factor Reviews,2003,14(2):91-98
[3] Chen YT,Chang FC,Wu CF,et al. Platelet-derived growth factor r-eceptor signaling activates pericyte-myofibroblast transition in obstructive and post-ischemic kidney fibrosis[J]. Kidney Int,2011,80(11):1170-1181
[4] Chevalier RL. Chronic partial ureteral obstruction and the developing kidney[J]. Pediatr Radiol,2008,38(Suppl 1):S35-40
[5] LeBleu VS,Kalluri R. Blockade of PDGF receptor signaling reduces myofibroblast number and attenuates renal fibrosis[J]. Kidney Int,2011,80(11):1119-1121
[6] Seikrit C,Henkel C,van Roeyen CR,et al. Biological responses to PDGF-AA versus PDGF-CC in renal fibroblasts[J]. Nephrol Dial Transplant,2013,28(4):889-900
[7] Boor P,Ostendorf T,Floege J. PDGF and the progression of renal disease[J]. Nephrol Dial Transplant,2014,29(Suppl 1):i45-i54
[8] Campbell JS,Hughes SD,Gilbertson DG,et al. Platelet-derived g-rowth factor C induces liver fibrosis, steatosis, and hepatocellular carcinoma[J]. Proc Natl Acad,2005,102(9):3389-3394
[9] Karin Aase,Alexandra Abramsson,Linda Karlsson,et al. Expression analysis of PDGF-C in adult and developing mouse tissues[J]. Mechanisms of Development,2010,23(2):187-191
[10] Tammo Ostendorf,Frank Eitner,Jürgen Floege. The PDGF family in renal fibrosis[J]. Pediatr Nephrol,2012,27(7):1041-1050
[11] Gilbertson DG,Duff ME,West JW,et al. Platelet-derived growth factor C (PDGF-C), a novel growth factor that binds to PDGF alpha and beta receptor[J]. J Biol Chem,2001,276(29):27406-27414
[12] Bowen-Pope DF,Raines EW. History of discovery:platelet-derived growth factor[J]. Arterioscler Thromb Vasc Biol,2011,31(11):2397-2401
[13] Laila J,Reigstad,Jan E. Structural and functional specificities of PDGF-C and PDGF-D, the novel members of the platelet-derived growth factors family[J]. FEBS Journal,2005,272(22):5723-5741
[14] Nakagawa T,Inoue H,Sasahara M. Platelet-derived growth factor and renal disease[J]. Curr Opin Nephrol Hypertens,2012,21(1):80-85
[15] Moriya J,Wu X,Zavala-Solorio J,et al. PDGF-C promotes revascularization in ischemic limbs of diabetic mice[J]. J Vasc Surg,2014,59(5):1402-1409
[16] Boor P,van Roeyen CR,Kunter U,et al. PDGF-C Mediates Glomerular Capillary Repair[J]. Am J Pathol,2010,177(1): 58-69
[17] Taneda S,Hudkins KL,Topouzis S,et al. Obstructive uropathy in mice and humans:potential role for PDGF-D in the progression of tubulointerstitial injury[J]. J Am Soc Nephrol,2003,14(10):2544-2555[18] Ostendorf T,Rong S,Boor P,et al. Antagonism of PDGF-D by human antibody CR002 prevents renal scarring in experimental glomerulonephritis[J]. J Am Soc Nephrol,2006,17(4):1054-1062
[19] Boor P,Konieczny A,Villa L,et al. PDGF-D inhibition by CR002 in late stages of experimental glomerulonephritis ameliorates tubulointerstitial fibrosis[J]. Nephrol Dial Transplant,2007,22(5):1323-1331
[20] Eisel F,Boosen M,Beck M,et al. Platelet-derived growth factor triggers PKA-mediated signalling by a redox-dependent mechanism in rat renal mesangial cells[J]. Biochem Pharmacol,2013,85(1):101-108
Role of PDGF-C and PDGF-D in renal tubulointerstitial fibrosis in rats
XU Cong1, LIU Naiguo2, MAO Ning2, LIU Yunqi1
(1.The Affiliated Hospital of Binzhou Medical University, Binzhou 256603, Shandong, China; 2.Binzhou Medical University, Binzhou 256600, Shandong, China)
Objective It is to investigate the expression of PDGF-C and PDGF-D in rat models of renal tubulointerstitial fibrosis and its significance. Methods 28 SD rats were made into models of renal tubulointerstitial fibrosis by one-side unilateral ureteral obstruction (UUO), 7 rats were killed at 3 7 14 and 21 days after surgery to get the kidneys in both side (the kidney not operated as control group) to make kidney specimen for the observation under light microscope, and expression of PDGF-C and PDGF-D in kidney were determined by immunohistochemistry. Results In the kidneys in control group, PDGF-C was found to be normally expressed in vascular smooth muscle cells of small arteries and within individual tubular cells, PDGF-D was expressed in vascular smooth muscle cells and glomerular mesangial cells. After UUO, renal PDGF-C and PDGF-D protein was significantly overexpressed as compared with healthy normal control kidneys(P<0.05), the expression of PDGF-C and PDGF-D in tubulointerstitium were positively correlated with the development of renal interstitial fibrosis (r=0.73,P<0.05;r=0.67,P<0.05). Conclusion PDGF-C and PDGF-D may play an important role in the development and progression of tubulointerstitial fibrosis.
renal interstitial fibrosis; PDGF-C; PDGF-D; models of one-side unilateral ureteral obstruction
徐聪,女,硕士研究生,研究方向为肾脏病学的基础与临床研究。
刘云启,E-mail:liuyunqi@medmail.com.cn
10.3969/j.issn.1008-8849.2015.02.006
R-332
A
1008-8849(2015)02-0132-05
2014-06-05
