脂肪细胞因子瘦素、脂联素及趋化素与胰岛素抵抗及妊娠期糖尿病的关联研究
2015-03-17杨祖菁
叶 兰,王 梅,杨祖菁
(1. 上海交通大学医学院附属新华医院崇明分院,上海 202150;2. 上海交通大学医学院附属新华医院,上海 200092)
脂肪细胞因子瘦素、脂联素及趋化素与胰岛素抵抗及妊娠期糖尿病的关联研究
叶 兰1,王 梅1,杨祖菁2
(1. 上海交通大学医学院附属新华医院崇明分院,上海 202150;2. 上海交通大学医学院附属新华医院,上海 200092)

目的 探讨血清脂肪细胞因子瘦素、脂联素及趋化素与体质量指数、各生化指标及胰岛素抵抗的关系及妊娠期糖尿病(GDM)发病中所起的作用。方法 随机选取妊娠期糖尿病孕妇100例作为GDM组,正常孕妇100例作为对照组,对受试者进行相关生化指标如空腹血糖(FBG)、空腹胰岛素(FINS)、血脂等检测,根据公式计算胰岛素抵抗指数(HOMA-IR)及胰岛β细胞功能指数(HOMA-β),并采用酶联免疫吸附法(ELISA法)测定血清瘦素、脂联素及趋化素水平,分析三者与临床生化指标及胰岛素抵抗的关系。结果 GDM孕妇血清瘦素水平明显增高(P<0.05),脂联素水平明显降低(P<0.05);趋化素在2组外周血中均有表达,差异无统计学意义(P>0.05)。GDM孕妇血清瘦素水平与产前BMI呈正相关(P<0.05),与FBG、FINS、HOMA-IR呈显著正相关(P均<0.01);正常孕妇血清瘦素水平与FBG、FINS、HOMA-IR均呈正相关(P均<0.05),与产前BMI无明显相关性(P>0.05)。2组孕妇血清瘦素水平与FINS、HOMA-IR相关系数差异有统计学意义P<0.05)。GDM孕妇血清脂联素水平与产前BMI、HOMA-IR呈明显负相关(P<0.05),而与FBG、FINS无明显相关性(P>0.05);正常孕妇血清脂联素水平与产前BMI、HOMA-IR、FINS呈负相关(P均<0.05 ),而与FBG无明显相关性(P均>0.05)。对所有受试者进行分析发现血清脂联素水平与产前BMI、 HOMA-IR、FBG、FINS呈负相关(P均<0.05),其中与产前BMI独立相关(P<0.05)。血清趋化素水平与FBG、FINS、HOMA-IR呈明显正相关(P均<0.05),而与产前BMI无明显相关性(P>0.05)。结论 GDM孕妇存在较高的血清瘦素水平,且与血糖代谢、胰岛素抵抗密切相关。瘦素通过多种途径参与胰岛素与血糖之间的调节,导致胰岛素抵抗,并参与了GDM的发病。GDM孕妇较正常孕妇脂联素水平降低,血清脂联素水平与体内脂肪含量有关,脂联素参与了孕期糖代谢的调节,不仅是妊娠期胰岛素抵抗发生的机制之一,而且参与了GDM的发病。趋化素与了妊娠期糖代谢及胰岛素抵抗,但可能与GDM的发病无关。
妊娠期糖尿病;瘦素;脂联素;趋化素;胰岛素抵抗;酶联免疫吸附法
妊娠期糖尿病(GDM)属于高危妊娠,不仅对母婴有严重影响,而且是2型糖尿病(T2DM)、高血压和动脉粥样硬化的先驱表现[1],因此,对GDM进行早期筛查、诊断和治疗十分重要。但GDM的发病机制至今仍未明确,目前多数学者公认胰岛素抵抗(IR)在GDM的发病中起重要作用,关于胰岛素抵抗的潜在调节及预测物如脂肪细胞因子的研究已有一些文献报道[2-4],但由于脂肪细胞因子众多,故研究尚未完善,结果也不尽相同,存在一些争议,需要进一步研究不同的脂肪细胞因子在GDM发病中所起的作用,以期通过早期预测及调节GDM孕妇胰岛素抵抗,减少GDM对母婴的影响。本研究分析了GDM孕妇和正常孕妇外周血血清脂肪细胞因子瘦素、脂联素及趋化素水平,与体质量指数(BMI)、各生化指标及胰岛素抵抗的关系,并探讨了三者在GDM发病中所起的作用,现将结果报道如下。
1 临床资料
1.1一般资料 随机选取2012年1月—2013年10月于上海交通大学医学院附属新华医院及新华崇明分院正规产检、住院分娩的正常孕妇(对照组)和GDM孕妇(GDM组)各100例,均为单胎初产妇,孕周均为孕28~40周。排除有吸烟或饮酒史者,患内科疾病及疾病家族史如原发性糖尿病、心脑血管疾病、高血压、血脂紊乱、甲状腺疾病及其他免疫性疾病者。对照组孕妇75 g葡萄糖耐量试验正常。GDM孕妇符合卫生部2011年7月1日发布的《妊娠期糖尿病诊断》标准:禁食10 h以上,口服75 g葡萄糖前及服用后1 h、2 h抽肘静脉血2 mL,上述3个时刻75 g OGTT上限值分别为5.1,10.0,8.5 mmol/L,其中1项以上异常诊断为GDM。2组孕妇年龄、孕周、身高、体质量、BMI、血压等比较差异无统计学意义(P均>0.05),见表1。

表1 2组一般情况比较
注:1 mmHg=0.133 kPa。
1.2研究方法
1.2.1血样标本采集 GDM组孕妇于入院后复查空腹血糖(FBG)及餐后2 h血糖。采集所有研究对象空腹8 h以上8 mL肘静脉血,4 mL置于抗凝管用于测定FBG、空腹血清胰岛素(FINS)和总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL);4 mL置于抗凝管,静置后1 000×g离心20 min,取上清,置于-80 ℃冰箱保存用于检测脂肪细胞因子瘦素、脂联素及趋化素水平。
1.2.2生化指标的测定 FPG测定采用葡萄糖氧化酶法,脂代谢相关指标采用日本日立7170S全自动生化分析仪测定,FINS采用ELISA法测定,试剂盒购自德国DRG公司,实验步骤按试剂盒说明书操作。胰岛素抵抗指数(HOMA-IR)=(FBG(mmol/L)×FINS(mIU/L)/22.5;胰岛β细胞功能指数(HOMA-β)=20×FINS(mIU/L)/(FBG(mmol/L)-3.5)。
1.2.3血清瘦素、脂联素及趋化素水平的测定 均采用ELISA测定,人瘦素定量ELISA试剂盒和人脂联素定量ELISA试剂盒购自美国TPI公司,人趋化素ELISA试剂盒购自美国R&D公司,具体实验步骤严格按试剂盒说明书操作。测定450 nm的OD值,绘制标准曲线,计算血清瘦素、脂联素及趋化素水平(单位均为μg/mL)。
1.3统计学方法 运用SPSS 13.0软件进行分析。正态分布资料以均数±标准差表示,非正态分布资料取对数转换成正态分布资料后再进行分析,率的比较用2检验,2组间比较用t检验及协方差分析,多因素相关性分析采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.12组血糖及血脂水平比较 GDM组孕妇OGTT空腹血糖、1 h血糖、2 h血糖、FBG、LDL值均高于对照组,FINS、HDL值低于对照组(P均<0.05),差异有统计学意义,见表2。

表2 2组血糖及血脂水平比较
2.22组血清瘦素、脂联素及趋化素水平及胰岛素功能比较GDM组内0,1,2 h血清瘦素水平逐渐下降,GDM组瘦素、HOMA-IR显著高于对照组(P均<0.05);GDM组内0,1,2 h血清脂联素水平逐渐上升,脂联素、HOMA-β明显低于对照组(P均<0.05);趋化素在2组外周血中均有表达,2组比较差异无统计学意义(P>0.05)。见表3。

表3 2组血清瘦素、脂联素、趋化素水平及胰岛素功能比较
注:①与对照组比较,P<0.05。
2.32组血清瘦素水平与各生化指标的相关性分析 GDM组孕妇血清瘦素水平与产前BMI呈正相关(r=0.413,P<0.05),与FBG、FINS、HOMA-IR呈显著正相关(r=0.757,0.834,0.857,P均<0.01)。对照组孕妇血清瘦素水平与FBG、FINS、HOMA-IR均呈正相关(r=0.546,0.451,0.487,P<0.05),与产前BMI无明显相关性(r=0.236,P>0.05)。见表4。
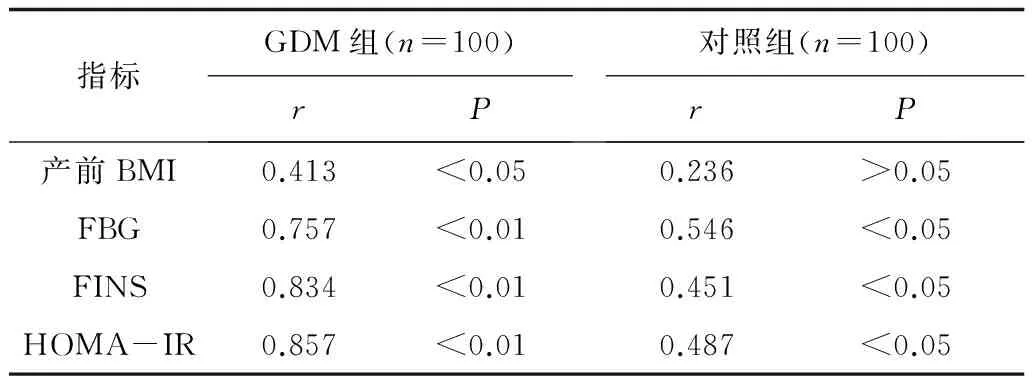
表4 血清瘦素水平与各生化指标的相关性分析
2.42组血清脂联素水平与各生化指标的相关性分析 GDM组产妇血清脂联素与产前BMI、HOMA-IR呈明显负相关(P均<0.05),而与FBG、FINS无明显相关性(P均>0.05);对照组中血清脂联素水平与产前BMI,HOMA-IR、FINS呈负相关(P均<0.05 ),而与FBG无明显相关性(P>0.05);对全部研究对象进行分析得出:血清脂联素水平与产前BMI、FBG、FINS、 HOMA-IR呈负相关(P均<0.05)。见表5。以脂联素为因变量,产前BMI、FBG、FINS、HOMA-IR为自变量进行多元线性回归分析,相关系数r=0.98。因此,综合考虑上述各因素,血清脂联素水平与产前BMI独立相关(P<0.05)。
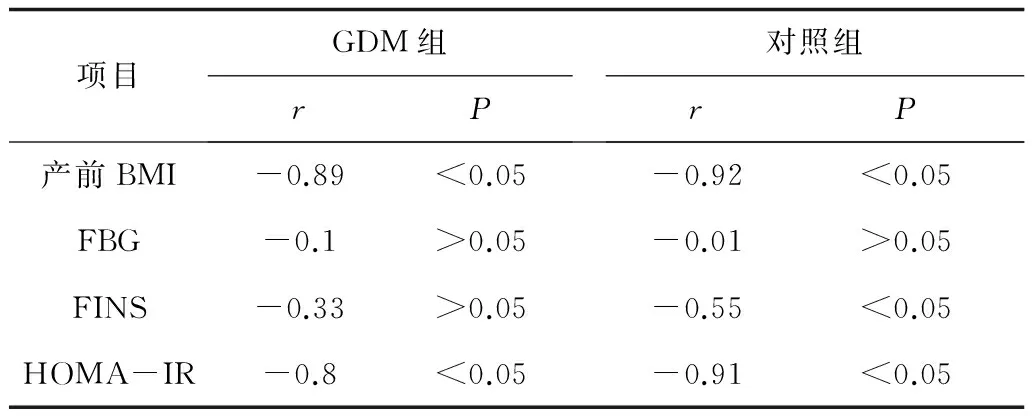
表5 血清脂联素水平与各生化指标的相关性分析
2.52组血清趋化素水平与各生化指标的相关性分析 2组血清趋化素水平差异无统计学意义(P>0.05),故此处针对所有研究对象分析血清趋化素水平与各生化指标的相关性。研究结果显示:血清趋化素水平与FBG、FINS、HOMA-IR呈明显正相关(r=0.431,0.513,0.501,P均<0.05),而与产前BMI无明显相关性(r=0.134,P>0.05)。
3 讨 论
近年来随着对GDM孕妇脂肪代谢方面研究的深入,脂肪组织被认为是一个重要的内分泌器官,它通过分泌脂肪细胞因子与内分泌系统、神经系统、胰岛以及平滑肌细胞形成复杂的反馈网络,维持糖脂代谢。这些脂肪细胞因子具有多种生物活性,可调节自身和其他组织的功能,尤其是调节胰岛素敏感性,在肥胖、胰岛素抵抗及T2DM发病机制中具有重要作用[5]。
瘦素是1994年由美国洛克菲勒大学Friedman领导的实验室成员Zhang等[6]首先克隆发现的一种蛋白质,是一种由脂肪细胞分泌的信号分子。人类编码瘦素的基因位于第7号染色体的q31.1,长20 kb,由3个外显子和2个内含子组成,编码4.5 kb mRNA。该mRNA含高度保守的开放读码框架(167个氨基酸),5’端含97 bp的先导序列,3’端为3.7 kb的非翻译序列[6-7]。瘦素主要由白色脂肪和胎盘组织产生,进入血液循环后,游离或与瘦素结合蛋白结合,最后通过瘦素受体作用于中枢及外周组织的多个位点,影响机体的生理功能和代谢通路。本研究结果显示:GDM孕妇血清瘦素水平高于正常孕妇,且血清瘦素水平与产前BMI、FBG、FINS、HOMA-IR呈正相关;正常孕妇血清瘦素水平与FBG、FINS、HOMA-IR均呈正相关,与产前BMI无明显相关性。提示GDM孕妇存在较高的血清瘦素水平,且与血糖代谢、胰岛素抵抗密切相关,这与Maghbooli 等[8]的研究结果相符。高瘦素血症可能通过影响胰岛素受体和受体后信号转导,抑制胰岛素对葡萄糖的摄取,降低胰岛素的敏感性,使胰岛素不能发挥正常的生理作用,因此代偿性分泌增加,而高胰岛素血症又能刺激机体分泌瘦素,从而进一步加重胰岛素抵抗[9]。由此可知瘦素通过多种途径参与胰岛素与血糖之间的调节,导致胰岛素抵抗,并参与了GDM的发病。
脂联素是244个氨基酸组成的多肽激素,由脂肪组织分泌,1995年由Scherer等首先报道,1996年被Maeda等[10]克隆。人脂联素被称为apM1,染色体定位3q27,编码基因长约16 kb,含3个外显子和2个内含子,外显子1为非翻译区,外显子2和3包含脂联素的编码区和部分非翻译区[11]。Ranheim等[12]和Karoly等[13]研究发现GDM时皮下脂肪组织、血浆中血清脂联素水平及脂联素基因mRNA的表达均较正常孕妇显著下降,并与体脂成反比。但Ategbo等[14]及Worda等[15]认为脂联素与胰岛素抵抗指数及其他代谢参数没有相关性,它可能不直接参与GDM胰岛素抵抗的发生。本研究结果显示:GDM孕妇血清脂联素水平明显低于正常孕妇。GDM孕妇血清脂联素水平与产前BMI、HOMA-IR呈负相关,而与FBG、FINS无明显相关性;正常孕妇血清脂联素水平与产前BMI、FINS、HOMA-IR呈负相关,而与FBG无明显相关性。对所有研究对象进行分析发现血清脂联素水平与产前BMI、FBG、FINS、HOMA-IR呈负相关,其中与产前BMI独立相关。这与文献[12-13]的研究结果相符。由此可知随着妊娠期体内脂肪含量的增加,血清脂联素水平下降,影响胰岛素信号链,导致胰岛素抵抗发生,并促使机体胰岛素敏感性下降。GDM孕妇与正常孕妇相比,具有更严重的胰岛素抵抗及脂联素水平降低,脂联素参与了孕期糖代谢的调节,不仅是妊娠期胰岛素抵抗发生的机制之一,而且参与了GDM的发病。
趋化素是1997年由Nagpal等[16]克隆发现的与肥胖和代谢综合征相关的脂肪细胞因子。Sell等[17]报道趋化素以自分泌和旁分泌方式调节脂肪细胞的分化和代谢以及脂肪组织的胰岛素敏感性,并导致胰岛素抵抗。本研究结果显示趋化素在GDM孕妇和正常孕妇外周血中均有表达,2组比较差异无统计学意义,这与Pfau等[18]的研究结果相符。而进一步研究发现血清趋化素水平与FBG、FINS、HOMA-IR呈正相关,而与产前BMI无明显相关性,提示趋化素与血糖水平及胰岛素抵抗相关,但GDM孕妇与正常孕妇相比血清趋化素水平差异无统计学意义,故趋化素引起的胰岛素抵抗是否能导致GDM的发病,仍需进一步研究。
综上所述,本研究结果表明脂肪细胞因子瘦素、脂联素及趋化素均参与孕期糖代谢、脂代谢及胰岛素抵抗的调节,可作为GDM孕妇胰岛素抵抗的标志物,瘦素和脂联素参与了GDM的发病,可能成为 GDM 治疗的新靶点及预测 GDM 远期发展为T2DM 的指标,而趋化素虽与糖代谢及胰岛素抵抗相关,但可能与GDM的发病无关,仍需更大样本及取不同组织(如胎盘、脐血)进一步研究。
[1] Freire CM,Nunes Mdo C,Barbosa MM,et al. Gestational diabetes: a condition of early diastolic abnormalities in young women[J]. J Am Soc Echocardiogr,2006,19(10):1251-1256
[2] 刘增娟,刘佩秋,丁钰,等. 妊娠期糖代谢异常孕妇血清瘦素水平及其与胰岛素和血糖关系的研究[J]. 中华妇产科杂志,2003,38(5):261-263
[3] Haluzik M,Parizkova J,Haluzik MM,et al. Adiponectin and its role in the obesity-induced insulin resistance and related complications[J]. Physiol Res,2004,53(2):123-129
[4] Palik E,Baranyi E,Melczer Z,et al. Elevated serum acylated (biologically active) ghrelin and resistin levels associate with pregnancy-induced weight gain and insulin resistance[J]. Diabetes Res Clin Pract,2007,76(3):351-357
[5] McGarry JD. Banting lecture 2001: dysregulation of fatty acid metabolism in the etiology of type 2 diabetes[J]. Diabetes,2002,51(1):7-18
[6] Zhang Y,Proenca R,Maffei,et al. Positional cloning of the mouse obeses gene and its human homologue[J]. Nature,1994,372(6505):425-432
[7] Isse N,Ogawa Y,Tamura N,et al. Structural organization and chromosomal assignment of the human obese gene[J]. J Biol Chem,1995,270(46):27728-27733
[8] Maghbooli Z,Hossein-Nezhad A,Rahmani M,et al. Relationship between leptin concentration and insulin resistance[J]. Horm Metab Res,2007,39(12):903-907
[9] Szanto I,Kahn CR. Selective interaction between leptin and insulin signal pathaway in a hepatic cell line[J]. Proc Natl Acad Sci USA,2000,97(5):2355-2360
[10] Maeda K,Okubo K,Shimomura I,et al. cDNA cloning and expression of a novel adipose specific collagen-like factor,apM1(Adipose Most abundant gene transcript l)[J]. Biochem Biophys Res Commun,1996,221(2):286-289
[11] Takahashi M,Arita Y,Yamagata K,et al. Genomic structure and mutations in adipose-specific gene,adiponectin[J]. Int J Obes Relat Metab Disord,2000,24(7):861-868
[12] Ranheim T,Haugen F,Staff AC,et al. Adiponectin is reduced in gestational diabetes mellitus in normal weight women[J]. Acta Obstet Gynecol Scand,2004,83(4):341-347
[13] Karoly C,Eva B,Zsolt M,et al. Plasma adiponectin and pregnancy-induced insulin resistance[J]. Diabetes Care,2004,27(1):274-275
[14] Ategbo JM,Grissa O,Yessoufou A,et al. Modulation of adipokines and cytokines in gestational diabetes and macrosomia[J]. J Clin Endocrinol Metab,2006,91(10):4137-4143
[15] Worda C,Leipold H,Gruber C,et al. Decreased plasma adiponectin concentrations in women with gestational diabetes mellitus[J]. Am J Obstet Gynecol,2004,191(6):2120-2124
[16] Nagpal S,Patel S,Jacobe H,et al. Tazarotene-induced gene 2(TIG2),a novel retinoid-responsive gene in skin[J]. J Invest Dermatol,1997,109(1):91-95[17] Sell H,Laurencikiene J,Taube A,et al. Chemerin is a novel adipocyte-derived factor inducing insulin resistance in primary human skeletal muscle cells[J]. Diabetes,2009,58(12):2731-2740
[18] Pfau D,Stepan H,Kratzsch J,et al. Circulating levels of the adipokine chemerin in gestational diabetes mellitus[J]. Horm Res Paediatr,2010,74(1):56-61
Study on the relationship of adipose cytokines leptin, adiponectin, chemerin and insulin resistance in gestational diabetes mellitus
YE Lan1, WANG Mei1, YANG Zujing2
(1.Chongming Branch of Xinhua Hospital,Medical College of Shanghai Jiaotong University, Shanghai 202150, China; 2.Xinhua Hospital, Shanghai Jiaotong University, Shanghai 200092, China)
Objective It is to analyze the relationship among adipose cytokines and various biochemical indexes and insulin resistance in gestational diabetes mellitus (GDM) and normal pregnant women, and to further explore the role of adipose cytokines in the pathogenesis of GDM. Methods By case-control method, 100 GDM patients (GDM group) and 100 normal pregnant women (normal control group)were screened as research subjects. We detected various biochemical indexes, such as blood glucose, fasting insulin and blood lipids, then calculated HOMA-IR and HOMA-β. By using enzyme-linked immunosorbent assay (ELISA), we determine adipose cytokines leptin, adiponectin and chemerin levels, analyze the relationship among adipose cytokines and biochemical indexes and insulin resistance. Results GDM patients compared with normal pregnant women, serum leptin levels were significantly higher, adiponectin levels were significantly lower (P<0.05), chemerin levels was not significantly different in both groups (P>0.05). In GDM patients, serum leptin levels was positively correlated with prenatal BMI (P<0.05), and was significant positively correlated with FBG, FINS, HOMA-IR (P<0.01). In normal pregnant women, serum leptin levels was positively correlated with FBG, FINS, HOMA-IR (P<0.05), was not significantly correlated with prenatal BMI (P>0.05). In both group, serum leptin and FINS, HOMA-IR correlation coefficients were statistically significant differences (P<0.05). In GDM patients, serum adiponectin levels was negatively correlated with prenatal BMI, HOMA-IR (P<0.05), and was not significant correlated with FBG, FINS(P>0.05). In normal pregnant women, adiponectin levels was negatively correlated with prenatal BMI, HOMA-IR, FINS (P<0.05), and was not significantly correlated with FBG (P>0.05). In all subjects, serum adiponectin level was negatively correlated with prenatal BMI, HOMA-IR, FBG, FINS (P<0.05), and was independently associated with prenatal BMI (P<0.05).In all subjects, serum chemerin levels was significantly correlated with FBG, FINS, HOMA-IR (P<0.05), but was not significant correlated with prenatal BMI. Conclusion GDM patients has a higher level of serum leptin, which is closely related to glucose metabolism and insulin resistance. Leptin participate a variety of pathways that regulate insulin and blood glucose, lead to insulin resistance, and involved in the pathogenesis of GDM. GDM patients has a higher level of serum adiponectin compared to normal pregnant women,serum adiponectin level is associated with body fat content, adiponectin is involved in the regulation of glucose metabolism during pregnancy, not only is one of the mechanism of insulin resistance occurs during pregnancy, and but also to be involved in the pathogenesis of GDM. Chemerin is involved in the glucose metabolism and insulin resistance during pregnancy, but may be not associated with the pathogenesis of GDM.
gestational diabetes mellitus; leptin; adiponectin; chemerin;insulin resistance; enzyme-linked immunosorbent assay
叶兰,女,在职研究生,主治医师,主要研究方向为产科学。
杨祖菁,E-mail:yzujing@sohu.com
10.3969/j.issn.1008-8849.2015.02.007
R587.1
A
1008-8849(2015)02-0136-05
2014-07-10
