类几丁质酶3蛋白1在申克孢子丝菌刺激巨噬细胞的表达和作用研究
2015-03-17黄丽林高文超李玉哲袁立燕何泰龙黄怀球
黄丽林,张 静,高文超,李玉哲,袁立燕,何泰龙,黄怀球
类几丁质酶3蛋白1在申克孢子丝菌刺激巨噬细胞的表达和作用研究
黄丽林1,张 静2,高文超2,李玉哲1,袁立燕3,何泰龙1,黄怀球1
目的 探讨巨噬细胞类几丁质酶3蛋白1在申克孢子丝菌刺激后的表达和作用研究。方法 通过测定巨噬细胞与申克孢子丝菌共孵育时杀菌率,使用实时荧光定量 PCR检测不同时间点巨噬细胞的类几丁质酶3蛋白1 mRNA表达水平,同时体外实验检测类几丁质酶3蛋白1对申克孢子丝菌的抑菌作用,同时采用空白对照和白念珠菌阳性对照比较两者的差异。结果 巨噬细胞可吞噬杀灭申克孢子丝菌分生孢子,也可吞噬阳性对照白念珠菌酵母相细胞。巨噬细胞类几丁质酶3蛋白1 mRNA表达水平在申克孢子丝菌组和空白对照组无明显差别,作用于阳性对照的白念珠菌组的巨噬细胞类几丁质酶3蛋白1 mRNA表达水平明显上调。体外实验显示类几丁质酶3蛋白1 对申克孢子丝菌分生孢子的无明显抑制作用,对白念珠菌繁殖却有较强的抑制作用。 结论 申克孢子丝菌未能诱导巨噬细胞表达类几丁质酶3蛋白1 抑制其增殖从而逃逸清除,而白念珠菌感染可上调巨噬细胞类几丁质酶3蛋白1 表达从而抑制其增殖减轻感染,这可能是申克孢子丝菌特有的致病作用机制之一。
申克孢子丝菌;白念珠菌;分生孢子;类几丁质酶3蛋白1
几丁质(Chitin) 是真菌细胞壁的重要成分, 对真菌生长和致病性具有重要作用[1]。引起孢子丝菌病的双相型真菌孢子丝菌复合体中各相细胞包含大量几丁质,在出芽繁殖过程中需要几丁质酶、葡聚糖酶等降解芽生部位的几丁质、葡聚糖等细胞壁成分。高等哺乳类动物不存在几丁质,其消化道、呼吸道、泌尿道等可分泌几丁质酶或几丁质结合活性的几丁质酶样蛋白防御含几丁质的病原体感染,起到机体固有免疫的防御作用[2-3]。类几丁质酶3蛋白1(chitinase 3-like-1,CHI3LI)属第18家族哺乳动物几丁质酶家族成员,起催化活性作用的氨基酸发生突变可导致其丧失降解几丁质的活性,研究表明机体感染多种病原体时均可诱导巨噬细胞分泌CHI3L1参与机体免疫功能 。巨噬细胞CHI3L1在防御申克孢子丝菌和白念珠菌感染的表达和作用未见报道。本研究通过检测巨噬细胞时CHI3L1在申克孢子丝菌分生孢子、白念珠菌酵母相细胞刺激下的表达和作用,初步探讨巨噬细胞CHI3L1在孢子丝菌病发病中的作用及其与白念珠菌感染的差异,将有助进一步探索申克孢子丝菌新的致病作用机制。
1 材料和方法
1.1 材料
1.1.1 菌株来源 申克孢子丝菌CBS359.36株由荷兰皇家科学和技术院真菌多样性研究中心提供,白念珠菌ATCC90028株,由中山大学附属第三医院医学真菌研究中心提供。
1.1.2 实验动物 雌性6~8周BALB/c小鼠由中山大学医学院动物中心提供,体重20~25 g,实验通过中山大学动物实验伦理委员会批准。
1.1.3 主要试剂和仪器 沙氏培养基(SDA)、马铃薯葡萄糖琼脂斜面培养基(PDA)(广东环凯微生物科技有限公司),无菌磷酸缓冲液(1×PBS)(赛默飞世尔生物化学制品有限公司),低糖DMEM细胞培养基、RPMI-1640培养基、6孔和96孔圆底培养板和细胞培养瓶、胎牛血清、小鼠重组纯化几丁质酶3样蛋白1(广州德为生物公司),RNA提取试剂盒(上海碧云天公司),THUNDERBIRD SYBR®qPCR Mix Kit 和 first strand cDNA syhthesis kit (Toyobo公司),实验中所用的引物由广州中美泰和公司合成,CO2细胞培养箱(ThermoFisher scientific),超净工作台(苏净BHC-1300ⅡA/B3,苏州安泰空气技术有限公司)。超微量紫外、可见光分光光度计(ThermoFisher scientific), 实时荧光定量PCR系统(BIO-RAD IQ5)。
1.2 实验方法
1.2.1 申克孢子丝菌分生孢子、白念珠菌酵母相细胞菌悬液制备 将申克孢子丝菌CBS359.36株(菌丝相)转种至SDA斜面培养基,于培养箱中25 ℃培养活化7 d,然后转种至马铃薯葡萄糖琼脂(PDA)斜面培养基上,培养1周后有产孢。用枪头将2 mL生理盐水注入长满菌落的斜面,轻轻吹打,然后吸出至EP管。室温下静置20 min左右,待菌丝沉淀后,轻轻将上清吸出至另一EP管。12 000 r/min 5 min,将上清去除,然后加入1 mL生理盐水。用血球计数板调整菌悬液浓度至1×105cfu/mL。将已配置菌悬液稀释后接种于PDA平板,验证菌悬液活力及浓度。白念珠菌ATCC 90028转种至SDA斜面培养基,室温下培养72 h后,显微镜下观察真菌细胞的形态是否以酵母相孢子为主。
1.2.2 小鼠巨噬细胞的制备 取20~25 g健康雌性6~8周,BALB/c小鼠36只,颈椎脱臼处死,消毒小鼠腹部皮肤,持镊提起腹中部皮肤并剪开,暴露腹膜,避开血管分别腹腔注射无菌1×PBS 8 mL,反复轻揉腹壁5 min后,无菌注射器分别取腹腔液5~6 mL,5 000 r/min离心5 min,弃上清,加入DMEM培养液调整细胞浓度至1.0×106/mL,细胞悬液置入培养瓶,37 ℃,5% CO2细胞培养箱2 h后,吸弃上清,用预热培养液洗2次,留下贴壁细胞,吉姆萨染色光学显微镜下显示95%以上为巨噬细胞,加入DMEM培养加10%胎牛血清液孵育细胞。
1.2.3 申克孢子丝菌清除率的测定 将申克孢子丝菌分生孢子、白念珠菌酵母相细胞按每瓶1 mL(1.0×106/mL)接种于上述含1.0×106/mL,巨噬细胞的培养瓶中,每个时间点培养3份, 以等量的真菌孢子悬液和酵母相细胞作为空白对照,放入5%的CO2细胞培养箱,37 ℃孵育24 h、48 h、72 h、96 h后取出,在光学显微镜下观察巨噬细胞外的申克孢子丝菌分生孢子、白念珠菌酵母相细胞出芽生殖和菌株形态改变并与空白对照组比较。然后转至25 ℃下分别培养5 d、3 d,温度的改变是为了更容易菌落计数。巨噬细胞活力通过台盼蓝染料的实验证实。申克孢子丝菌分生孢子的杀伤率=[1-(CFU实验组/CFU空白对照组)]×100%[4]。
1.2.4 Real-time PCR 检测巨噬细胞CHI3L1 mRNA表达水平 实验组为将申克孢子丝菌分生孢子、白念珠菌酵母相细胞按每瓶1 mL(1.0×106/mL)接种于上述含1.0×106/mL巨噬细胞的培养瓶中,空白对照组为1 mL生理盐水加入含1.0×106/ mL巨噬细胞的培养瓶中,每个时间点培养3份,收集各个时间点共培养的巨噬细胞用RNA提取试剂盒法按照说明书提取细胞总RNA,核酸凝胶电泳提示28 s、18 s、5 s 3条清晰的条带,采用紫外分光光度计评估其完整性并估算其产量。按FSQ-101反转录试剂盒说明书分别以0.5~1 μg 的总 RNA 为模板逆转录合成 cDNA。按照说明书采用FastStart DNA Master SYBR Green (Roche Diagnostics, Indianapolis, IN)嵌合荧光法,对目标基因进行相对定量分析,real-time PCR中用到的引物 CHI3L1 forward 5′- GTACAAGCTGGTCTGCTACTTC-3′ 和CHI3L1 reverse 5′- ATGTGCTAAGCATGTTGTCGC-3′,内参βactin forward 5′-CAGTAACAGTCCGCCTAGAA-3′ 和 βactin reverse 5′-GATTACTGCTCTGGCTCCTA-3′。
1.2.5 CHI3L1蛋白抑制孢子丝菌分生孢子芽生能力测定 配制RPMI-1640培养基稀释CHI3L1蛋白并模拟体内37 ℃环境,验证CHI3L1蛋白在体外对申克孢子丝菌分生孢子、白念珠菌酵母相细胞作用及其差异。96孔板第1至第6列孔浓度为0.5~16 μg/mL。将蛋白稀释至2倍终浓度,按第1至第6列孔浓度由高至低的顺序加样,第7列及第8列孔分别作为阴性对照。取100 μL上述申克孢子丝菌分生孢子加入1至3列,而白念珠菌酵母相菌悬液加入4至6列孔混匀,并于37 ℃恒温培养箱孵育120 h,取出后在倒置显微镜观察真菌形态改变,然后转种到固体PDA斜面培养基25 ℃下分别培养5 d、3 d。
1.2.6 统计学分析 采用SPSS 19.0统计软件分析。量资料数据以均数±标准差表示。符合方差齐性采用组内采用t检验,组间采用方差分析,检验前检查方差齐性,方差不齐者用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 巨噬细胞体外非调理性杀菌率 巨噬细胞在不同时间点对申克孢子丝菌、白念珠菌的杀菌率如图1所示。巨噬细胞在24 h对申克孢子丝菌清除率为13.5%,48 h为16.7%,72 h为18.9%,96 h为22.1%,而对白念珠菌的清除率24 h为16.5%,48 h为21.7%,72 h为28.9%,96 h为31.1%。巨噬细胞对申克孢子丝菌分生孢子、白念珠菌酵母相细胞的非调理性杀菌率随时间延长有所增多。结果显示巨噬细胞对申克孢子丝菌及白念珠菌均可以吞噬及杀伤,在此过程中存在真菌细胞壁破坏和几丁质的暴露,其中巨噬细胞对白念珠菌的杀菌能力高于申克孢子丝菌,各时间点组间比较菌存在统计学差异(P<0.05)。见图1。

图1 巨噬细胞的非调理性杀菌率
2.2 巨噬细胞外真菌形态观察 采用光学显微镜下观察巨噬细胞与孢子丝菌分生孢子、白念珠菌共培养过程中巨噬细胞外培养基中未吞噬的孢子丝菌分生孢子、白念珠菌的出芽及菌丝生长情况, A图中黑色箭头所示为巨噬细胞外申克孢子丝菌出芽,B图中黑色箭头为白念珠菌出芽及菌丝伸长,C图和D图为空白对照的申克孢子丝菌和白念珠菌。见图2。

图2 巨噬细胞外真菌的出芽和菌丝形成(×400)
Fig.2 Germination and hyphae of fungi outside macrophages(×400)
2.3 真菌对巨噬细胞的CHI3L1诱导表达 采用real-time PCR方法定量检测CHI3L1 mRNA转录水平,结果显示孢子丝菌共培养组和空白对照组相比,各时间点CHI3L1转录水平无明显差异(P>0.05),而白念珠菌组CHI3L1的转录水平明显上调,各时间点与申克孢子丝菌及空白对照组相比均有统计学差异(P<0.05)。见图3。说明申克孢子丝菌不能有效诱导巨噬细胞表达CHI3L1,而白念珠菌可上调巨噬细胞CHI3L1的表达。

图3 真菌对巨噬细胞的CHI3L1诱导表达差异
Fig.3 CHI3L1 differential expression in macrophages upon fungal stimulation
2.4 小鼠源性CHI3L1对真菌繁殖体外抑制实验 光学显微镜下观察显示在 CHI3L1蛋白大于2 μg/ mL 浓度作用72 h作用后,在孢子丝菌和白念珠菌形态轻微异常,菌落计数结果显示孢子丝菌的菌落形成数与空白对照组无明显差异(P>0.05),说明CHI3L1蛋白对申克孢子丝菌分生孢子出芽生殖无明显影响。而白念珠菌组菌落数量与对照组相比明显减少(P<0.05),提示CHI3L1可抑制白念珠菌的繁殖。见图4。
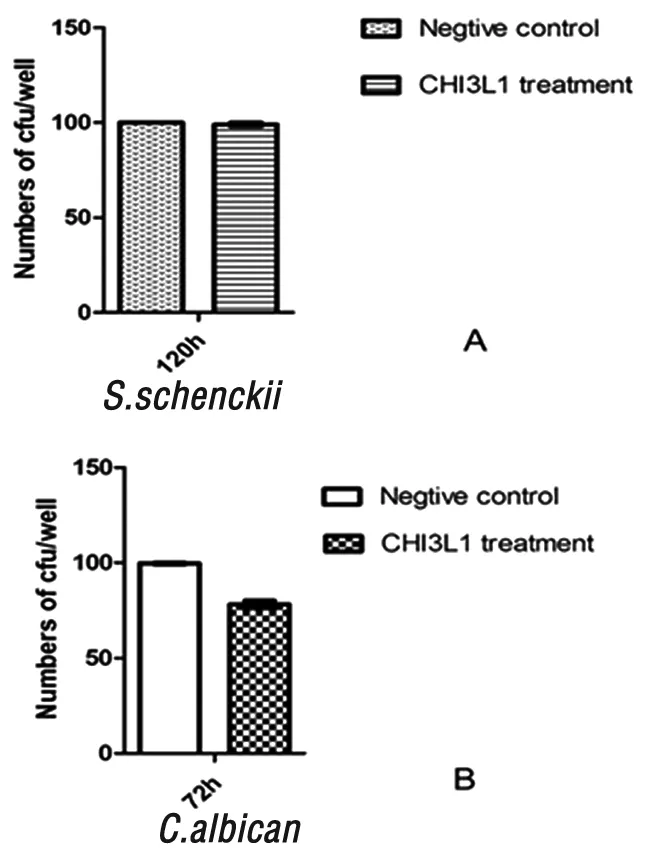
图4 小鼠源性CHI3L1对真菌繁殖的抑制试验
Fig.4 Fungal colony inhibition assay of mouse CHI3L1invitro
3 讨 论
几丁质是由其底物 N- 乙酰- D- 氨基葡萄糖通过 β- 1,4糖苷健聚合形成的直链大分子, 广泛存在自然界中[5],作为申克孢子丝菌、白念珠菌等真菌细胞壁的重要成分,其与细胞的发生、维持和分隔形成有密切关系,对真菌生长、生理功能和致病性有重要意义[1]。高等哺乳类动物不含几丁质,其消化道、呼吸道、泌尿道等可分泌几丁质酶或有几丁质结合活性的几丁质酶样蛋白防御含几丁质的病原体感染[2-3]。其中CHI3LI属第18家族哺乳动物几丁质酶家族成员,起催化活性作用的氨基酸发生突变可导致其丧失降解几丁质的活性,研究表明机体感染多种病原体时均可诱导巨噬细胞分泌CHI3L1参与调节机体免疫功能[6-7],含几丁质的真菌等病原体感染时更为明显。巨噬细胞是固有免疫的中重要的免疫细胞,可识别、吞噬、杀灭和消化提呈病原体,同时分泌一些蛋白酶、细胞因子参与机体免疫反应。申克孢子丝菌分生孢子、白念珠菌酵母相细胞等刺激巨噬细胞时,主要通过模式识别受体如TLR2、TLR4、DECTIN-1等识别、吞噬,然后利用胞内的多种杀菌机制杀灭胞内病原菌,如呼吸爆发产生ROS、蛋白酶、溶酶体等,发挥其固有免疫和抗原提呈功能[8-12]。探讨巨噬细胞CHI3L1蛋白在孢子丝菌病发病中的作用及其与白念珠菌感染的差异,将有助进一步探索申克孢子丝菌新的致病作用机制。本研究通过检测申克孢子丝菌分生孢子、白念珠菌酵母相细胞作用于巨噬细胞时CHI3L1的表达差异和观察其对真菌的清除和抑制状况,初步探讨CHI3L1在孢子丝菌病发病中的作用及其与白念珠菌感染可能差异。
虽然申克孢子丝菌分生孢子可被巨噬细胞膜上免疫识别受体识别,进而被吞噬和杀灭。真菌细胞壁含有几丁质,在其出芽生殖过程中需要几丁质酶、葡聚糖酶等降解芽生部位等几丁质和葡聚糖。但研究显示培养上清中巨噬细胞外的孢子丝菌分生孢子出芽生殖和形态无明显改变,体外实验证实CHI3L1对孢子丝菌、白念珠菌形态改变无明显作用,发现白念珠菌菌落计数明显减少,但申克孢子丝菌数量却无明显异常。Real-time PCR 结果显示申克孢子丝菌未能有效诱导CHI3L1的表达,白念珠菌却能明显上调巨噬细胞的CHI3L1表达,这可能与申克孢子丝菌细胞壁几丁质含量较少和具有白念珠菌不同的结构特征有关。CHI3L1蛋白可通过结合几丁质与真菌自身的几丁质酶竞争结合位点,影响真菌细胞形态和阻碍真菌的出芽生殖,从而防御真菌感染增殖,而非直接催化降解几丁质的功能。在肺炎链球菌、肝片吸虫等病原体感染过程中,巨噬细胞主要通过诱导性分泌CHI3L1[6-7],促进分泌TGFβ1等Th2型细胞因子,从而促进纤维母细胞增殖,纤维化限制病原体扩散,同时促进M2型巨噬细胞转化、抑制巨噬细胞凋亡等[6-7]。研究显示CHI3L1可在炎症性、过敏性疾病、肿瘤等非感染性疾病中诱导表达,CHI3L1已作为支气管哮喘的诊断和疾病严重程度评估的分子标记和探索作为哮喘的免疫治疗手段[13-14]。含有几丁质的申克孢子丝菌未能有效诱导巨噬细胞CHI3L1的表达,孢子丝菌病常见病理表现为肉芽肿性炎症改变,表现为炎症细胞浸润、纤维组织增生、血管新生等,其病理改变与Th2型细胞因子的作用有关,容易导致真菌感染迁延难愈[15]。如此认为,申克孢子丝菌未能诱导巨噬细胞表达类几丁质酶3蛋白1 抑制其增殖从而逃逸清除,而白念珠感染可上调巨噬细胞类几丁质酶3蛋白1 表达从而抑制其增殖减轻感染,这可能是申克孢子丝菌特有的致病作用机制之一。申克孢子丝菌分生孢子如何逃避巨噬细胞所诱导CHI3L1表达的杀伤作用机制需要通过进一步研究进行探讨。
[1]Walker LA, Lenardon MD, Preechasuth K, et al. Cell wall stress induces alternative fungal cytokinesis and septation strategies[J]. J Cell Sci, 2013, 126(Pt 12):2668-2677. DOI:10.1242/jcs.118885
[2]Homer RJ, Zhu Z, Cohn L, et al. Differential expression of chitinases identify subsets of murine airway epithelial cells in allergic inflammation[J]. Am J Physiol Lung Cellul Mol Physiol, 2006, 291(3):L502-511. DOI:10.1152/ajplung.00364.2005
[3]Mizoguchi E. Chitinase 3-like-1 exacerbates intestinal inflammation by enhancing bacterial adhesion and invasion in colonic epithelial cells[J]. Gastroenterology, 2006, 130(2):398-411. DOI:10.1053/j.gastro.2005.12.007
[4]Dong BL, Li DS, Liu WH, et al. Differential expression of reactive oxygen species in human neutrophils stimulated by the yeast phase of Sporothrix Schenckii and Candida albicans[J]. Chin J Dermatol, 2013, 46(4):253-257. (in Chinese) DOI:10.3760/cma.j.issn.0412-4030.2013.04.009 董碧麟, 李东升, 柳卫凰, 等.申克孢子丝菌酵母相与白念珠菌诱导中性粒细胞活性氧簇的差异性表达[J].中华皮肤科杂志,2013,46(4):253-7. DOI:10.3760/cma.j.issn.0412-4030.2013.04.009
[5]Wagener J, Malireddi RK, Lenardon MD, et al. Fungal chitin dampens inflammation through IL-10 induction mediated by NOD2 and TLR9 activation[J]. PLoS Pathog, 2014, 10(4):e1004050. DOI:10.1371/journal.ppat.1004050
[6]Dela Cruz CS, Liu W, He CH, et al. Chitinase 3-like-1 promotesStreptococcuspneumoniaekilling and augments host tolerance to lung antibacterial responses[J]. Cell Host Microbe, 2012, 12(1):34-46. DOI:10.1016/j.chom.2012.05.017
[7]Flynn RJ, Irwin JA, Olivier M, et al. Alternative activation of ruminant macrophages byFasciolahepatica[J]. Vet Immunol Immunopathol, 2007, 120(1-2):31-40. DOI:10.1016/j.vetimm.2007.07.003
[8]Martinez-Alvarez JA, Perez-Garcia LA, Flores-Carreon A, et al. The immune response againstCandidaspp. andSporothrixschenckii[J]. Revista Iberoamericana de Micologia, 2014, 31(1):62-66. DOI:10.1016/j.riam.2013.09.015
[9]de CNT, Ferreira LS, Arthur RA, et al. Influence of TLR-2 in the immune response in the infection induced by fungusSporothrixschenckii[J]. Immunolog Investigat, 2014, 43(4):370-390. DOI:10.3109/08820139.2013.879174
[10]Sassa MF, Saturi AE, Souza LF, et al. Response of macrophage Toll-like receptor 4 to aSporothrixschenckiilipid extract during experimental sporotrichosis[J]. Immunology, 2009, 128(2):301-309. DOI:10.1111/j.1365-2567.2009.03118.x
[11]Kajiwara H, Saito M, Ohga S, et al. Impaired host defense againstSporothrixschenckiiin mice with chronic granulomatous disease[J]. Infect Immun, 2004, 72(9):5073-5079. DOI:10.1128/IAI.72.9.5073-5079.2004
[12]Gow NA, Netea MG, Munro CA, et al. Immune recognition ofCandidaalbicansbeta-glucan by dectin-1[J]. J Infect Dis, 2007, 196(10):1565-1571. DOI:10.1086/523110
[13]Duru S, Yuce G, Ulasli SS, et al. The relationship between serum YKL-40 levels and severity of asthma[J]. Iranian J Allergy Asthma Immunol, 2013, 12(3):247-253.
[14]Muzzarelli RA. Chitins and chitosans as immunoadjuvants and non-allergenic drug carriers[J]. Marine Drugs, 2010, 8(2):292-312. DOI:10.3390/md8020292
[15]Carlos IZ, Sassa MF, da Graca Sgarbi DB, et al. Current research on the immune response to experimental sporotrichosis[J]. Mycopathologia, 2009, 168(1):1-10. DOI:10.1007/s11046-009-9190-z
Differential expression and function of chitinase 3-like-1 in macrophage stimulated bySporothrixschenckii
HUANG Li-lin1,ZHANG Jin2,GAO Wen-chao2,LI Yu-zhe1,YUAN Li-yan3,HE Tai-long1,HUANG Huai-qiu1
(1.DepartmentofDermatologyandVenereology,theThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China;2.DepartmentofDermatologyandVenereology,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China;3.DepartmentofDermatology,GuangdongProvincialCenterforSkinDiseasesandSTIsControlandPrevention,Guangzhou510500,China)
We evaluated the differential expression and function of chitinase 3-like-1 in macrophage stimulated bySporothrixschenckiiandCandidaalbicansfungicidal ability of macrophage after stimulation withSporothrixschenckiiandCandidaalbicansseparately was detected. The expression of CHI3L1 gene in macrophage stimulated bySporothrixSchenckiiandCandidaalbicanswas evaluated with real-time PCR. The function of CHI3L1 protein in macrophages against the reproduction ofSporothrixschenckiiandCandidaalbicanswas detectedinvitro. Results showed that macrophages could engulf and killSporothrixSchenckiiandCandidaalbicansinvitro. The expression of CHI3L1 gene in macrophage stimulated byCandidaalbicanswas increased obviously. At the same time, CHI3L1 protein can damper the reproduction ofCandidaalbicans. However, the expression of CHI3L1 gene was not elevated when macrophage was stimulated bySporothrixschenckiiand CHI3L1 protein played little role in reproduction ofSporothrixschenckii. The expression of CHI3L1 gene in macrophage was elevated after stimulation withCandidaalbicans, but was not elevated withSporothrixSchenckii. In correspondence with differential expression, CHI3L1 in macrophages could impair the reproduction ofCandidaalbicansbut had a weak function onSporothrixschenckiiwhich might contribute to the pathogenesis of sporotricosis. Keywords:Sporothrixschenckii;Candidaalbicans; conidium; chitinase 3-like-1
Huang Huai-qiu, Email:hhuaiqiu@medmail.com.cn
国家自然科学基金面上项目(No.81371746),广东省省级科技计划项目(No.2013B010404013)
黄怀球,Email:hhuaiqiu@medmail.com.cn
1.中山大学附属第三医院皮肤病科,广州 510630; 2.中山大学孙逸仙纪念医院皮肤病科,广州 510120; 3.广东省皮肤性病防治中心,广州 510500
10.3969/j.issn.1002-2694.2015.10.009
R379.2
A
1002-2694(2015)10-0938-05
2015-03-03;
2015-08-03
Supported by the National Nature Foundation of China (No. 81371746) and the Guangdong Provincial Science and Technology Foundation Committee (No. 2013B010404013)
