羊布鲁杆菌脂蛋白OMP19单克隆抗体制备与鉴定
2015-03-17廖卿宇胡飞环吴静波罗佩芳王文敬黎诚耀
廖卿宇,胡飞环,吴静波,罗佩芳,王文敬,黎诚耀
羊布鲁杆菌脂蛋白OMP19单克隆抗体制备与鉴定
廖卿宇1,胡飞环1,吴静波2,罗佩芳1,王文敬1,黎诚耀1
目的 制备与鉴定羊布鲁杆菌脂蛋白OMP19单克隆抗体,用于布菌感染免疫机制研究。方法 将OMP19基因连接入pET-30a(+)表达载体中,构建pET-30a(+)/OMP19质粒,转化入大肠埃希氏菌BL21(E3),以不同浓度异丙基-β-D硫代半乳糖苷(IPTG)进行诱导表达,采用镍金属螯合亲和层析(NI-NTA)纯化;以布菌阳性血清检测重组蛋白免疫反应性,并利用杂交瘤技术制备单克隆抗体,以天然OMP19蛋白及布菌外膜蛋白提取物(NMP)对制备的单克隆抗体进行Western Blot及酶免疫染色试验(IEST)鉴定。结果 表达了OMP19蛋白,分子量约19 kDa,通过纯化纯度可达95%,Western Blot分析显示蛋白具有良好的抗原性,并制备了OMP19抗原23株鼠源性单克隆抗体,鉴定结果显示22(95.65%)株能与天然OMP19蛋白反应,18(78.26%)株能与NMP反应,其中IgG1(k)亚型占91.30%;4株能与羊种布鲁氏菌菌涂片反应。结论 成功制备具有良好抗原性的重组OMP19蛋白,筛选出识别天然蛋白的单克隆抗体,已初步应用于布菌的检测,为OMP19抗原B细胞表位的筛选奠定基础。
布鲁杆菌;OMP19;蛋白表达;单克隆抗体
布鲁氏菌病(Brucellosis,布病),是布鲁杆菌(简称布菌)引起的急性或慢性传染病,属严重人兽共患传染病。近年来,通过接触带菌动物造成羊、牛布鲁杆菌病感染的病例大量增加,根据中国疾病预防控制中心公布数据,2013年布病发病人数比2008年增加57%,达43 486例,以每年10% 新增速度成为发病数增加最快的疾病之一[1],而2014年发病人数已达57 222例(http://www.chinacdc.cn/tjsj/fdcrbbg/),死亡2例,形势极其严峻。
动物的检验检疫是控制布病的有效手段,布菌的外膜包括脂多糖、外膜蛋白和磷脂层,其中外膜蛋白是布菌的主要免疫原和保护性抗原。根据分子量大小,已发现的外膜蛋白分为3类,OMP19属于第I类脂蛋白[2-3];研究指出OMP19是造成布菌免疫逃避以及持续性感染十分重要的一部分,本研究重组表达OMP19蛋白,分析其免疫原性,制备其单克隆抗体,为布菌感染免疫学机制研究和疫苗的开发奠定实验基础。
1 材 料
1.1 主要材料和试剂 大肠杆菌DH5α、BL21(DE3)、表达载体pET-30a、布菌膜蛋白混合物(NMP)和SP2/0骨髓瘤细胞为南方医科大学输血医学系实验室贮存;OMP19基因、羊布鲁杆菌疫苗菌株63290由新疆石河子大学陈创夫教授惠赠;阳性血清为疫苗株接种后的免疫羊血清,阴性血清由北京疾病与预防控制中心购买所得;羊种布鲁氏杆菌菌涂片由广州市疾病预防控制中心提供。核酸电泳分子量标准DL2000、DL10000、pMD19-T Vector、T4 DNA连接酶、Taq DNA 聚合酶dNTP及DAB-H2O2(大连宝生物工程公司);蛋白质电泳分子量标准SM1811(Fermentas 公司);Fast Star DNA聚合酶(Roche公司);NdeⅠ、XhoⅠ限制性内切酶(NEB公司);质粒小提取试剂盒和DNA凝胶回收试剂盒购自(天根生化科技(北京)有限公司);辣根过氧化物酶(HRP)标记的羊抗鼠IgG & IgM抗体(Rockland公司);Ni-NTA亲和层析填料购自GE-Healthcare公司;RPMI-1640基础培养基购自Hyclone公司;HAT、HT、弗氏完全佐剂、弗氏不完全佐剂、PEG 1450均购自Sigma-Aldrich公司。
1.2 试验动物 3只BALB/c小鼠,SPF级,雌性,6~8周龄,体重15~25 g,购自南方医科大学实验动物中心,饲养于南方医院实验动物中心。
2 方 法
2.1 目的基因的扩增和克隆 利用GenBank中提供的羊布菌OMP19基因序列,截除OMP19 N端24个氨基酸信号肽的基因序列的引物:5′-GGAATTCCATATGTGCCAGAGCTCCCG-3′,5′- CCGCTCGAGGCGCGACAGCGT -3′,由上海英骏生物技术有限公司合成。以菌株63290基因组为模板,扩增条件94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 40 s,循环35次;72 ℃ 10 min结束。扩增产物经1%琼脂糖凝胶电泳鉴定,割胶纯化目的基因,用NdeⅠ、XhoⅠ内切酶双酶切,酶切后扩增产物和表达质粒PET-30a在T4 DNA连接酶作用下16 ℃连接过夜,连接产物转化大肠杆菌DH5α,挑取阳性克隆,提取质粒双酶切鉴定,由上海英骏生物技术公司测序。
2.2 目的蛋白诱导表达与鉴定 将测序正确的质粒转化大肠杆菌BL21(DE3),挑取单克隆至3 mL含Kan+抗性LB中,37 ℃诱导表达,分别设5个IPTG浓度(为0.2、0.4 、0.6 、0.8 、1 mmol/L)。收菌后超声破碎,SDS-PAGE分离鉴定诱导前后的菌体破碎上清和沉淀。
2.3 蛋白纯化及Western-Blot鉴定 纯化采用镍金属螯合亲和层析(Ni-NTA)方法,将收集的菌破碎液上清经Ni-NTA亲和层析纯化,100 mmol/L咪唑洗脱杂蛋白,300 mmol/L咪唑洗脱目的蛋白。收集纯化后目的蛋白,SDS-PAGE后转至硝酸纤维素膜上,阳性和阴性血清1∶1 000稀释后作为一抗,辣根过氧化物酶标记的兔抗羊抗体作为二抗,洗涤与二氨基联苯胺(DAB)进行底物显色。
2.4 动物免疫与测定 将浓缩后的重组OMP19蛋白(rOMP19)与弗氏完全佐剂按1∶1乳化后,皮下多点注射BALB/c小鼠3只,每只小鼠抗原接种剂量为100 μg,2周后将重组蛋白与弗氏不完全佐剂按1∶1乳化后皮下多点注射,每只小鼠抗原接种剂量为50 μg,两周后间接ELISA法检测血清抗体效价。若效价达1∶51 200以上时,融合前3 d经腹腔注射50 μg抗原加强免疫。
2.5 杂交瘤细胞株的建立 无菌条件下取小鼠脾脏制成细胞悬液,在1 mL 50% PEG1450介导下,融合小鼠骨髓瘤SP2/0细胞与脾细胞 (1∶5),融合后加入HAT RPMI1640选择培养基,37 ℃培养箱培养,培养10 d后取细胞上清液,用间接ELISA法筛选分泌抗omp19单克隆抗体的杂交瘤细胞株。阳性细胞株用有限稀释法连续亚克隆3次后,获得稳定高分泌单克隆抗体的杂交瘤细胞株。
2.6 单克隆抗体免疫特性和亚型分析 将rOMP19和NMP分别按1∶1加入2×SDS上样缓冲液,沸水浴煮10 min,12 000 r/min离心10 min,取上清10 μL进行12% SDS-PAGE电泳分离,电转移至PVDF膜上,含5%脱脂奶粉的TBST封闭2 h,随后与1∶3稀释后的各株单抗的细胞上清分别孵育1 h,TBST洗膜3次,每次10 min;HRP标记的羊抗鼠IgG & IgM作为二抗孵育1 h,TBST洗膜后化学发光显影。以非相关病原HCV一株单抗(实验室制备)作为阴性对照。另用鼠单克隆抗体快速分型试纸条 (Hycult Biotech Inc 或Sigma-Aldrich) 进行亚型鉴定。
2.7 酶免疫染色试验鉴定单克隆抗体 3%过氧化氢处理菌涂片,0.01 mol/L pH7.4 PBS洗涤后滴加50 μL omp19单克隆抗体株细胞上清,37 ℃孵育1 h。PBS洗涤后滴加PBS1∶10 000稀释的HRP标记羊抗鼠IgG &IgM 50 μL,37 ℃孵育45 min。PBS洗涤后,滴加50 μL DAB-H2O2,避光显色15 min,纯水终止反应;中性树胶封片后油镜下观察。以菌体膨大,呈黄棕色至棕黑色判定为阳性结果;不显色或仅呈浅黄色判定为阴性。以HCV NS3单克隆抗体作为对照。
3 结 果
3.1 目的基因的克隆和表达 成功扩增534 bp的目的条带(图1A),与pET-30a双酶切目的基因条带大小符合(图1B),送测序后与GenBank (http://www.ncbi.nlm.nih.gov/)中序列号为gb|CP002931.1|羊种布菌OMP19序列100%匹配。
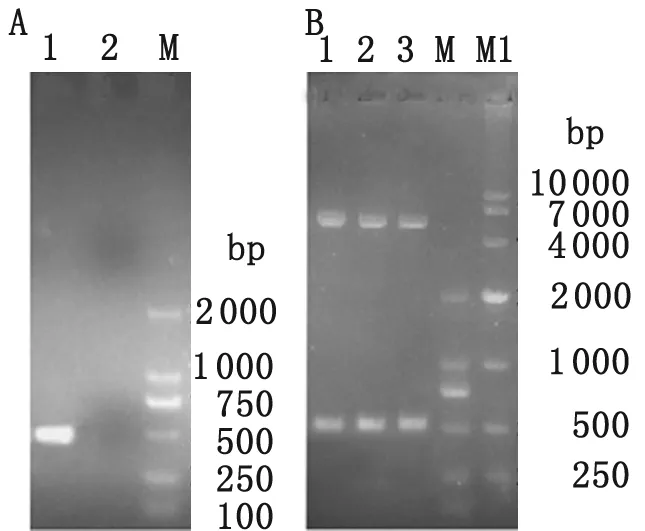
(A) PCR products of OMP19 gene; 1:PCR products; 2:negative control;
(B) Double enzymes restriction identification; 1-3:XhoI,NdeI double enzymes restriction products.
图1 OMP19基因扩增及表达载体双酶切鉴定
Fig.1 PCR and double enzymes restriction identification
3.2 目的蛋白诱导表达与纯化 经SDS-PAGE分析,5个IPTG诱导表达情况相似,菌破碎上清电泳后在19 kDa左右有明显条带,与目的蛋白大小吻合,即重组OMP19以可溶性蛋白形式存在(图2)。Ni-NTA纯化后蛋白,在280 nm波长下测得浓度为5.5 mg/mL,经SDS-PAGE分析,所得蛋白纯度可达到95%左右(图3A)。
3.3 rOMP19抗原性检测 Western Blot检测rOMP19与布菌阳性抗血清出现较强的反应,阴性血清无反应,证明蛋白有良好的抗原性(图3B)。
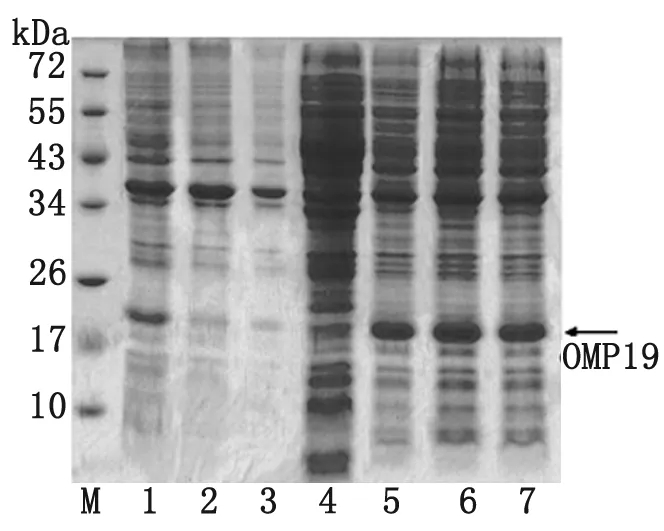
M:Protein marker; 1-3:0.4,0.6, 1 mmol/L IPTG induced precipitation; 4:negative control before induction; 5-7:0.4,0.6, 1 mmol/L IPTG induced supernatant.
图2 MP19蛋白表达SDS-PAGE电泳鉴定
Fig.2 SDS-PAGE analysis for OMP19 expression

M:Protein marker; A-1:Purified protein; A-2:negative control before induction; B-1:positive serum; B-2:negative serum.
图3 rOMP19纯度和免疫反应性检测
Fig.3 Analysis for purity and immunoreactivity of rOMP19
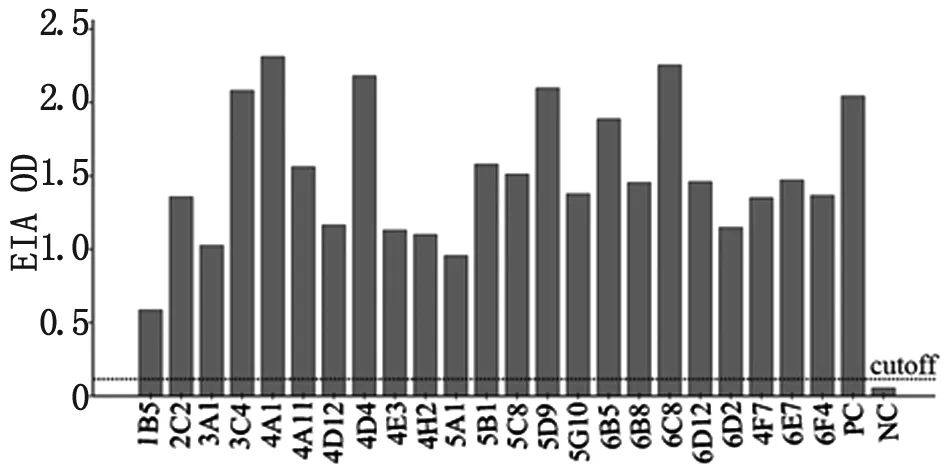
NC:anti-NS3 antibody;PC:positive serum
Fig.4 Detection of supernatants of hybridomas for monoclonal antibodies to rOMP19 by ELISA
3.4 OMP19单抗的制备 经过1次细胞融合,以rOMP19为抗原,ELISA检测杂交瘤上清共筛选出23株抗rOMP19单克隆抗体,包括3C4、4A1、4D4、5C8、5B1、6B5、5A1、6D2、4A11、6C8、1B5、4D12、4E3、6D12、4F7、3A1、4H2、6E7、2C2、6F4、5D6、5G10、6B8(图4)。
3.5 单抗免疫特性和亚型分析 rOMP19和NMP分别与各株单抗(mAb)培养上清Western-Blot鉴定结果显示,22(95.65%)株单抗能与rOMP19反应(图5A),其中18(78.26%)株mAb能识别NMP,于19 kDa 大小处可见显色带(图5B)。21株(91.30%)单抗亚型为IgG1(k),1株(4.35%)为IgG2b (k),1株(4.35%)为 IgM(k)。
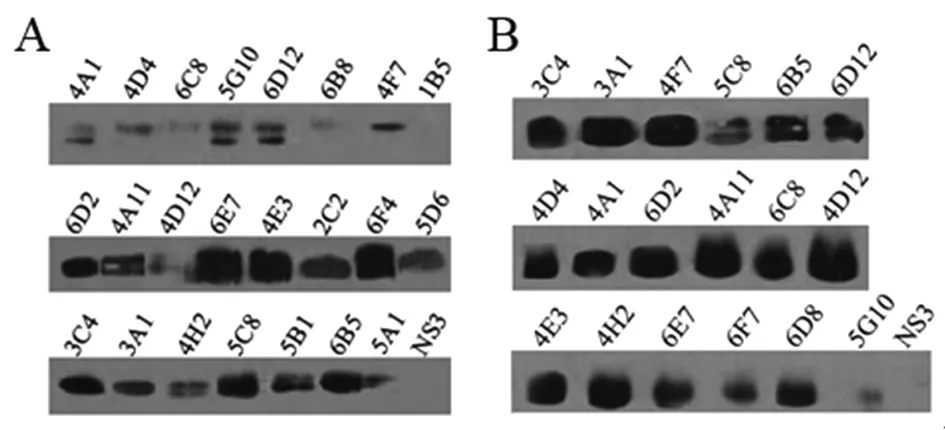
(A) mAb reacted with rOMP19; (B) mAb reacted with NMP.
图5 Western-Blot鉴定单抗免疫特性分析
Fig.5 Western Blot analysis
3.6 酶免疫染色试验鉴定单克隆抗体 经鉴定,6F4,6B8,3C4,5A1共4株omp19单克隆抗体培养上清能与羊种布鲁氏菌菌涂片反应。其中,6F4和6B8单抗上清与菌涂片反应较强(图6)。

图6 酶免疫染色试验鉴定单克隆抗体
4 讨 论

要研究布鲁氏菌外膜蛋白OMP19的抗原性和免疫原性,需要大量重组蛋白和抗OMP19单克隆抗体作为前提条件。本研究构建的布鲁氏菌表达的融合蛋白分子量约19 kDa,主要以可溶性蛋白形式存在,37 ℃条件下,不同IPTG浓度下目的蛋白表达量差别不大,利用镍金属螯合亲和层析(Ni-NTA)方法纯化后可得到>95%的高纯度蛋白,经阳性血清检测显示出良好的抗原性;利用杂交瘤技术成功制备出23株抗OMP19的单克隆抗体,其中21株能与变性的重组OMP19蛋白反应,18株能与变性的天然OMP19抗原反应,即极有可能为识别线性表位抗体。酶免疫染色试验显示布菌omp19单克隆抗体可与羊种布氏菌菌涂片反应,提示该抗体可初步应用于布氏菌抗原检测,为进一步鉴定其B细胞表位,研究布菌感染的免疫学分子机制,以及研发布菌疫苗奠定了基础。
[1]Wang WJ, Wu JB, Qiao J, et al. Evaluation of humoral and cellular immune responses to BP26 and OMP31 epitopes in the attenuatedBrucellamelitensisvaccinated sheep[J]. Vaccine, 2014, 32(7):825-833.
[2]Tibor A, Decelle D, Letesson J, et al. Outer membrane proteins Omp10, Omp16, and Omp19 ofBrucellaspp. are lipoproteins[J]. Infect Immun, 1999, 67(9):4960-4962.
[3]Giambartolomei GH, Zwerdling A, Cassataro J, et al. Lipoproteins, not lipopolysaccharide, are the key mediators of the proinflammatory response elicited by heat-killedBrucellaabortus[J]. J Immunol, 2004, 173:4635-4642.
[4]Smaldini PL, Ibanez AE, Fossati CA, el al. Oral delivery ofBrucellaspp. recombinant protein U-Omp16 abrogates the IgE-mediated milk allergy[J]. Human Vaccine Immunotherapeutics, 2014, 10(7):2015-2023.
[5]Clapp B, Skyberg JA, Yang XH, et al. Protective live oral brucellosis vaccines stimulate Th1 and Th17 cell responses[J]. Infect Immun, 2011, 79(10):4165-4174.
[6]Hu JF, Cui BY, Gaun PY, et al. Progress in research on outer membrane proteins ofBrucella[J]. Dis Surveill, 2010, 25(5):380-389. (in Chinese)
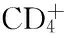
[8]Salcedo SP, Marchesini MI, Lelouard H, et al.Brucellacontrol of dendritic cell maturation is dependent on the TIR-containing protein Btp1[J]. PLoS Pathog, 2008, 4(2):e21.
[9]Barrionuevo P, Delpino MV, Velasquez LN, et al.Brucellaabortusinhibits IFN-γ-induced FcγRI expression and FcγRI-restricted phagocytosis via toll-like receptor 2 on human monocytes/macrophages[J]. Microbes Infect, 2011, 13(3):239-250.
[10]Barrionuevo P, Cassataro J, Delpino MV, et al.Brucellaabortusinhibits major histocompatibility complexclass II expression and antigen processing through interleukin-6 secretionvia Toll-like receptor 2[J]. Infect Immun, 2008, 76:250-262.
Production and identification of monoclonal antibodies againstBrucellamelitensisU-lipoprotein OMP19
LIAO Qing-yu1,HU Fei-huan1,WU Jing-bo2,LUO Pei-fang1,LI Cheng-yao1,WAGN Wen-jing1
(1.DepartmentofTransfusionMedicine,SchoolofBiotechnology,SouthernMedicalUniversity,Guangzhou510515,China;2.ShaoguanColloge,Shaoguan512005,China)
We produced and identified the monoclonal antibodies againstBrucellamelitensisU-lipoprotein OMP19. A DNA fragment coding omp19 ofBrucellamelitensiswas amplified by PCR, and inserted into the vector of pET-30a(+), the resultant recombinant plasmid, which we designated as pET-30a(+)/omp19. We then transformed the plasmid into BL21(DE3) competent cells for the expression of the OMP19 protein. After induction with different concentrations of IPTG, the colleted cells were analyzed by SDS-PAGE, and then OMP19 monoclonal antibodies were prepared through hybridoma technology. These mAbs were tested to reactivity to rOMP19 and nature membrance proteins (NMP) ofBrucellamelitensisby Western blot and IEST. We successfully constructed an expression vector of pET30a(+)/omp19. An IPTG-induced expression of the OMP19 protein (19 kDa in molecular weight) was demonstrated by SDS-PAGE. The fusion protein existed in the form of soluble, and the OMP19 protein of high purity could be obtained by Ni-NTA. Western blot assay showed that the refolded protein could be recognized by the anti-serum againstBrucellamelitensis. Twenty-three mAbs to OMP19 was produced in which 91.30% were IgG1, twenty-two (95.65%) mAbs could recognize nature OMP19 protein, and eighteen (78.26%) mAbs could recognize NMP, four mAbs could react withBrucellamelitensis. The protein maintained good immunogenicity and twenty-three mAbs were obtained, which we believe provides a good protein candidate for the immunological research.
Brucella; OMP19; protein expression; monoclonal antibody
Wang Wen-jing, Email:wenjingking77@126.com
国家自然科学基金项目(31372443、31100657);广东省自然基金项目(2011B090400407)
王文敬,Email:wenjingking77@126.com
1.南方医科大学生物技术学院输血医学系,广州 510515; 2.韶关学院英东生命科学学院,韶关 512005
10.3969/j.issn.1002-2694.2015.10.001
R378.5
A
1002-2694(2015)10-0899-04
2015-03-15;
2015-08-03

Supported by the National Natural Science Foundation of China (No. 31372443 and 31100657), and the Guangdong Provincial Science and Technology Foundation (No. 2011B090400407)
