新生儿聋病易感基因筛查的研究进展*
2015-03-16李倩综述王秋菊审校
李倩 综述 王秋菊 审校
新生儿聋病易感基因筛查的研究进展*
李倩1综述 王秋菊1审校
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20140612.1511.001.html
先天性聋已成为世界性的公共卫生问题,WHO 2014年估计,全球因聋致残人数高达3.6亿,约占世界总人口5.14%(3.6亿/70亿),其中约80%生活在中、低收入发展中国家[1]。语前重度和极重度聋及先天性聋不仅严重阻碍患儿的言语和认知发育,甚至严重影响患儿的智力发育,更会是人际交往的严重障碍,给家庭和社会带来沉重负担。先天性聋在新生儿期的发病率约为1‰~1.86‰,是由多种环境和/或遗传因素共同作用导致,也可由单一基因或不同基因的复合突变所导致[2]。1970年美国成立了婴儿听力联合委员会(Joint Committee of Infant Hearing,JCIH),至今,该机构已公布了新生儿重症监护病房(NICU)住院超过5天、儿童期永久性听力障碍家族史等13种新生儿耳聋相关的高危因素[3]。随着新生儿听力筛查工作开展,耳聋患儿的检出增加和诊断的日益完善,遗传因素导致耳聋的比例也在显著增加。Fortnum[4]和Nance等[5]在对4岁及以内听力损失婴幼儿进行病因分析发现,遗传因素致聋比例已由1991年报道的50%上升至61%~66%,而且迟发性和有些基因缺陷所导致的耳聋并不一定在新生儿期表现出来,因此,对新生儿听力筛查的同时进行聋病易感基因的筛查可以弥补听力筛查的不足[3,6~8],自王秋菊[6~8]提出新生儿听力及基因联合筛查的新理念和策略,以及Morton等[9]提出对所有新生儿进行遗传因素的检测以后,至今聋病易感基因筛查在新生儿和先天性聋新生儿中逐步开展,本文对新生儿聋病易感基因筛查的研究及其进展综述如下。
1 聋病易感基因筛查种类与位点
截止2014年5月,全世界学者共定位克隆了84个非综合征型耳聋基因,46个综合征型耳聋基因[10],而先天性聋在新生儿期的发病率仅为1‰~1.86‰,因此,从经济卫生学和操作可行性角度考虑,针对全部新生儿进行的普遍基因筛查策略需要选择人群中最高发的基因或突变位点进行筛查。先天性聋可由不同的等位基因或者基因座突变所引起,具有明显的异质性,因此,各国聋病易感基因的筛查都是建立在对耳聋人群进行大规模分子流行病学调查基础之上[11~21]的。GJB2是迄今报道的引起非综合征性耳聋最常见的致病基因,所以,在各国报道的聋病易感基因筛查中,GJB2均为第一候选基因。在我国,针对聋校学生的调查研究显示,先天性聋哑患儿中至少36%是由GJB2、SLC26A4和MTRNR1基因突变导致的,其中,GJB2约占18.31%[19],SLC26A4约占13.73%[19],MTRNR1约占3.96%[20]。因此,在我国进行的新生儿聋病易感基因筛查研究的候选基因除GJB2外,尚包括SLC26A4、MTRNR1。GJB3为我国学者最早克隆的致聋基因,其与迟发性高频听力下降有关[21],在遗传性耳聋家系患者中有一定的比例,近年来随着对由遗传因素导致迟发性聋的关注度升高,该基因在2014年被我国学者尝试纳入了新生儿聋病易感基因筛查研究范围,但尚未见其在新生儿中的突变情况与听力状态相关性及突变新生儿听力跟踪随访的报道。
1.1 GJB2基因及其常见突变 该基因是最早认识的与先天性聋相关的最重要的核染色体基因,其编码蛋白是connexin 26,即一种由六个单体组成的缝隙连接蛋白。该蛋白广泛分布于耳蜗支持细胞和结缔组织,构成细胞间缝隙连接通道,参与转运毛细胞至血管纹的钾离子,维持耳蜗内淋巴电位。GJB2基因突变将导致耳蜗钾离子循环障碍,从而影响细胞间信息传递,导致感音障碍。该基因突变导致的耳聋表型多样,可表现为先天性聋、非先天性的语前聋、语后聋和迟发性聋,发病年龄从6~8个月至20岁,部分GJB2基因突变者还表现为轻度聋或进行听力性下降。在各个不同种族人群GJB2基因导致的突变频率差异也很大,在蒙古人种约为3.8%~20.71%,高加索人种约为3.8%~26.3%,尼格罗人种约为4%。2009年Hamid等[11]报道,非综合征性聋患者中,高加索人种的GJB2基因突变率高达34.0%~50.3%。在我国,单纯由GJB2基因突变导致的极重度耳聋高达30%~50%[12]。
目前各国学者已发现GJB2基因150多种突变,但不同人种中常见突变位点不同,如欧美高加索人中以35delG突变为主,其在致聋突变中占60%~85%[12],因此,在欧美新生儿聋病易感基因筛查多选择GJB2 c.235del G。在中国人群中最常见的致聋突变形式为c.233_235delC,约占74.14%[14],新生儿和耳聋人群中也主要针对该位点进行筛查。近年来研究发现,c.109G>A、c.176-191del16、c. 299-300del AT、c.167del T也是中国耳聋人群中GJB2基因的常见突变,因此,我国的部分筛查研究中也逐渐包含了上述位点,但对c.109G>A的致病性尚存在争议。
目前认为,GJB2基因筛查为纯合突变或复合杂合突变,同时新生儿听力筛查未通过,则可以第一时间诊断该新生儿为GJB2基因突变导致的耳聋,患儿需尽早接受医学干预;若该基因筛查为阳性,而听力筛查通过,则可能为GJB2基因突变导致迟发性聋患儿,需密切关注听力状况。筛查结果为杂合携带时,则提示该新生儿携带GJB2基因致聋突变,不发病,但成年后与具有相同基因型的携带者婚配时则其后代发病率为25%。
1.2 GJB3基因及其常见突变 GJB3基因与GJB2同属于缝隙连接蛋白家族,于1998年由夏家辉院士最早克隆并将该基因定位于1p33-35,并报道了导致显性遗传高频听力下降的两个突变c.538C>T、c.547G>A。GJB3基因突变既可导致常染色体显性遗传非综合征型聋,也与常染色体隐性遗传非综合征型聋有关。李学忠等[15]在141名非综合征型遗传性聋患者中进行该基因突变研究,发现其突变发生率为17.2%。该研究提示GJB3基因可能在我国迟发性聋患者中发挥一定的作用,因此,2014年我国学者首次报道了在新生儿中对该基因的筛查。虽然GJB3主要与后天的高频性听力下降有关,其是否可以作为筛查候选基因存在较大争议,但目前认为该基因突变携带者可能为迟发性耳聋患者,虽然在新生儿期无耳聋症状,但需要密切关注听力状况,一旦出现听力下降,便于及时干预。
1.3 SLC26A4基因及其常见突变 SLC26A4基因编码跨膜溶质载体蛋白—pendrin蛋白,其在内耳中表达于内淋巴囊、外螺旋沟和部分支持细胞,作为一种氯化物/负离子(如碘化物)转运体,调节耳蜗内淋巴的离子平衡。该基因突变将导致pendrin蛋白功能障碍,从而使内耳淋巴液体量增加,导致蜗管的扩大融合,内淋巴囊、内淋巴管和前庭水管膨胀扩大及听力下降,即大前庭水管综合征。赵亚丽等[16~17]发现,97.8%的前庭导水管扩大患者存在SLC26A4基因突变,共发现57种突变,最常见突变是位于内含子7的c.919-2A>G,89名患者中,70名发生此种突变,占78.7%。Guo等[18]对西北地区的1 288名聋哑学生进行了聋病的分子流行病学研究,发现由SLC26A4基因的纯合及复合杂合突变所致耳聋患者93例(7.22%)。Yuan等[19]在对中国耳聋患者的研究中发现,SLC26A4基因突变导致的耳聋约占13.73%。
SLC26A4基因筛查为纯合或复合杂合突变,则可确诊大前庭水管综合征患儿,若同时听力筛查未通过,则需立即医学干预;若听力筛查通过,则为迟发型耳聋患儿,必须进行定期检测,对发现听力下降者给与早期干预和治疗;同时需要通过预防感冒,避免颅脑外伤、剧烈运动等防止听力波动和防止聋哑的发生。排除合并其他位点突变,单位点杂合携带为非致病,与具有相同基因型的携带者婚配时则其后代发病率为25%。
1.4 MTRNR1基因及其常见突变 MTRNR1基因是与氨基糖苷类药物致聋相关的线粒体DNA突变,在临床上如果不采用基因筛查方法很难在药物致聋前发现和提前预知。目前该基因最常见的突变为m.1555A>G,但全球报道该突变在非综合征型聋患者中突变频率存在明显差异,如高加索人种突变频率为0%~20.8%,蒙古人种为2.83%~15.5%,在中国人群中,该突变频率报道为2.83%~15.5%[22]。在西班牙对该基因的研究还发现,即使没有使用氨基糖苷类药物,许多年老的家族成员也可发生因MTRNR1 m.1555A>G突变导致的听力下降。Zhao等[23]在中国群体中还发现并证明了MTRNR1 m.1494C>T突变与母系遗传性聋和药物性聋有关。
目前认为,MTRNR1基因突变者对氨基糖苷类药物极其敏感,使用该类药物可发生“一针致聋”,同时该新生儿的所有母系成员都可能是突变携带者,需筛查该基因位点,携带该基因突变者必须终生避免使用氨基糖苷类药物。
2 聋病易感基因筛查的模式及突变率检出情况
根据对象不同,在新生儿中聋病易感基因的筛查可分为目标人群和普遍人群筛查。其中,目标人群为已诊断为先天性耳聋患儿及耳聋高危人群——NICU新生儿。根据是否与听力筛查同时进行或与听力筛查结果综合分析,报道的筛查模式也分为单纯基因筛查与听力及基因联合筛查。在PUBMED数据库进行检索,对新生儿中进行的普遍筛查多见我国学者报道,且均选择了听力及基因联合筛查模式;国外仅巴西报道了在8 974例新生儿中进行的听力及基因联合的普遍筛查;俄罗斯作者综述了其国内筛查结果;其他国家均为目标人群筛查,候选基因为GJB2 c.35delG或MTRNR1,且为单纯基因筛查模式。
2.1 目标人群筛查 对目标人群进行的GJB2聋病易感基因筛查,其价值在于作为对新生儿听力筛查未通过并诊断为耳聋的患儿的诊断补充,若发现该基因纯合突变则可以确定病因学诊断,并提供遗传咨询。2005年Zaputovic等[24]、Medica等[25]、Preciado等[26]分别对克罗地亚、斯洛文尼亚及美国新生儿听力筛查未通过且诊断为先天性聋的患儿进行GJB2 c.35delG突变筛查,其检出率从12.0%~33.33%不等。由此可见,在确诊为听力损失患儿中耳聋基因GJB2 del35G突变的发生率在各个不同种族耳聋人群中存在差异,见表1。2011年英国Ealy等[27]对703例NICU的新生儿进行MTRNR1基因5个突变位点m.A827G、m.961del TtC(n)、m. 1095 T>C、m.1494 C>T、m.1555 A>G的筛查,发现其突变率为1.85%,与对照组普通产房新生儿(MTRNR1突变率为1.83%)比较,两者间无明显差异;该研究虽然未发现NICU耳聋患儿,但结果提示在新生儿人群中有几近2%的药物性聋敏感者,存在“一针致聋”的风险,因此,在新生儿中进行MTRNR1基因筛查,并同时筛查未通过者的母系成员,对避免或减少药物性聋的发生具有重要意义。
2.2 普遍人群筛查 对新生儿进行耳聋基因筛查最先开展的国家为葡萄牙和美国[27,28]。Piatto等[28](2005年)和Norris等[29](2006年)分别在233例和342例新生儿中对GJB2c.35delG进行筛查研究。除了报道其突变率外,Norris等还发现了3例GJB2 c.35delG突变复合杂合子、6例纯合子共9例致病突变新生儿,其出生时未出现耳聋,之后他们出现听力损失的年龄在12~60个月之间。这9个病例说明现行的听力筛查不能全部筛查出GJB2突变的新生儿,提示约3.8%或更高比例的聋儿在出生时不外显,即在一定时间内听力筛查正常,对新生儿进行单纯听力筛查对聋儿检出,尤其是迟发型聋患儿存在明显的不足。
2.3 新生儿听力与基因联合筛查 为了弥补新生儿普遍听力筛查的不足和局限,王秋菊等[6~8]在2007年倡导在广泛开展新生儿听力筛查的同时进行聋病基因(GJB2、SLC26A4、MTRNR1)同步筛查,即新生儿听力与基因联合筛查的理念,并在441例新生儿中首次实施该策略,除听力筛查检出19例未通过者外,还发现23例基因突变者,突变检出率达4.08%。由此提出听力及基因联合筛查结合定期的随诊及监测是目前早期发现处于语前听力损失或迟发型高危患儿,或者是致聋基因的携带者最有力的筛查策略。至今,联合筛查策略已在中国和中国台湾地区及巴西[30]、俄罗斯[31]开展,虽然各地区联合筛查的基因种类、位点及突变检出率存在差异[30~38](表2),但结果均提示,听力与基因联合筛查对聋儿和致聋基因携带者的检出率明显高于单纯听力筛查,对聋儿及高危人群听力损失的早期诊断、干预,甚至手术治疗具有重要价值。其中,中国人群中GJB2 c.235delC、SLC26A4 c.919-2A>G、MTRNR1 m.1555 A>G突变检出率为2.05%~2.37%,较单纯听力筛查0.1%~0.3%的检出率提高约15~20倍。2012年,Zhang等[35]报道了甘肃省10 043例新生儿联合筛查结果,发现高达83.5%的致聋基因携带者未能通过单纯的听力筛查检出。除上述位点外,中国学者也在联合筛查中对其他位点进行了筛查研究,如Wu等[33]报道了在台湾地区新生儿中GJB2 c.109G>A检出率为17.0%;Chen等[38]在上海新生儿中对GJB2c.109G>A进行了单独筛查,发现其突变率高达8.87%;Zhang等[39]增加GJB3基因并将筛查位点扩增为20个,首次将迟发性致聋基因GJB3纳入筛查范围,发现基因突变率达到4.63%,较之前的3个基因4个位点检出率明显提高。但新增位点是否可以作为新生儿耳聋基因普遍筛查的候选基因仍需要大规模分子流行病学调查和经济卫生学评价研究。
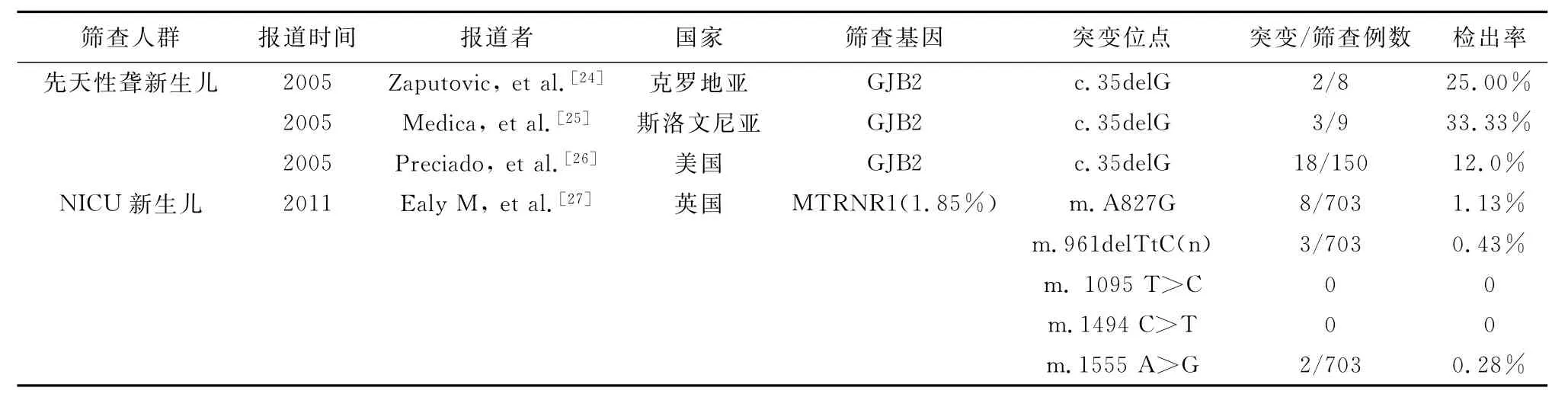
表1 先天性聋和NICU新生儿的聋病易感基因筛查(来源:PUBMED)
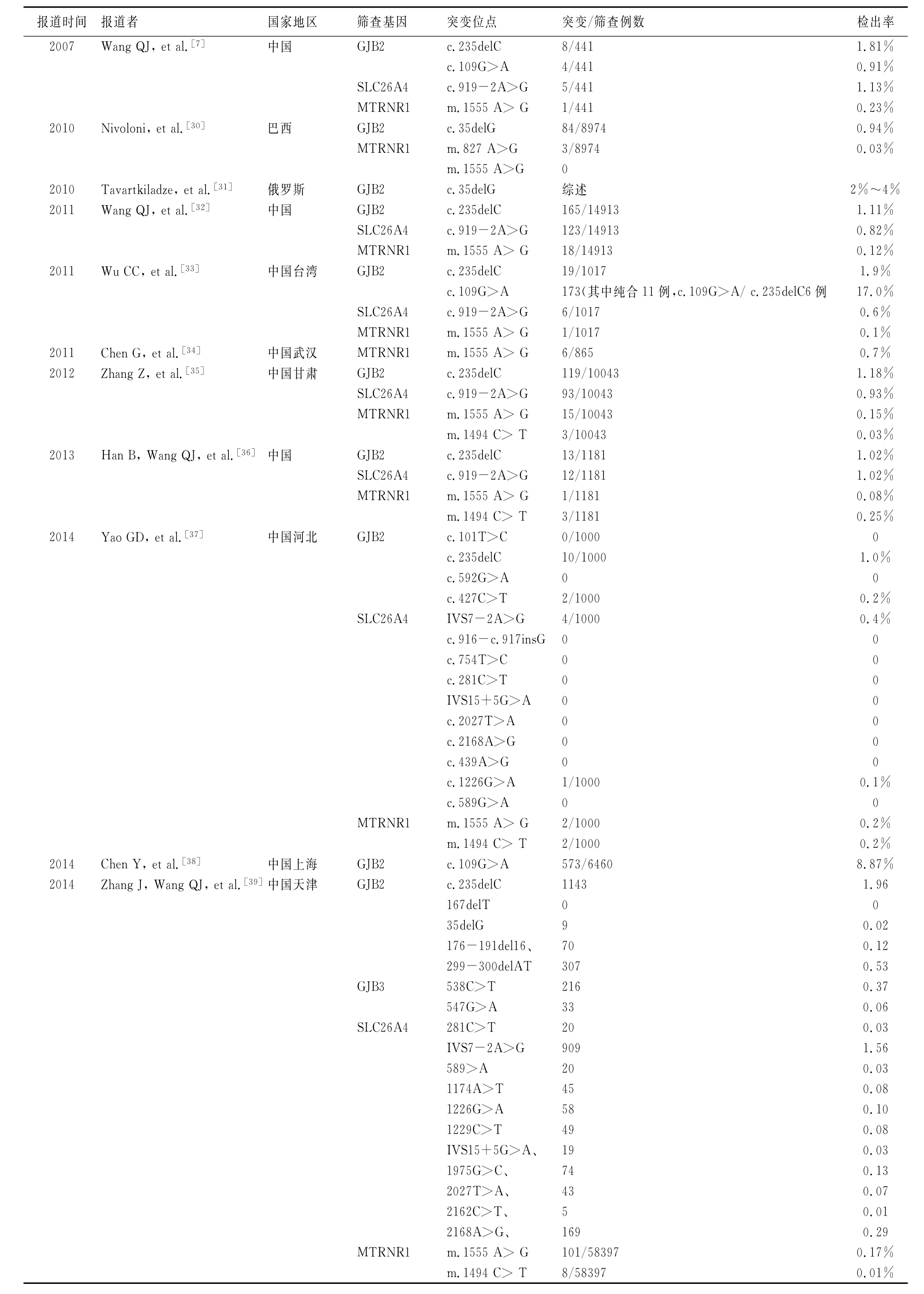
表2 不同年份报道的新生儿听力及聋病易感基因联合普遍筛查情况(来源:PUBMED数据库)
综上所述,目前在新生儿中进行聋病易感基因筛查经历了由单纯的基因筛查到听力及基因联合筛查模式的逐渐演进,接受筛查的人群也日益广泛,除可以明确部分遗传性聋的原因外,对新生儿听力筛查结果和基因筛查结果联合分析,既保证了传统听力筛查检出耳聋患者的优势,也增加了重要的遗传信息,还可以指导临床上抗生素(氨基糖苷类)的应用,尽量避免"一针致聋";指导部分耳聋患者,如:SLC26A4基因突变导致大前庭水管综合征患儿,减缓耳聋的发展;可预测人工耳蜗植入的疗效;并为耳聋患者及家庭进行遗传咨询,评价再次生育子女出现耳聋的几率;指导产前耳聋基因诊断,尽早采取有效措施避免聋儿出生。
近年来,随着对先天性聋人群中致病新基因及常见致聋突变谱的研究进展,及高通量测序技术的发展与筛查成本的降低,部分学者也在尝试调整筛查候选基因种类和数量。但是应该强调的是,新生儿聋病易感基因筛查不等同于基因诊断,无论是目标人群还是普遍人群筛查,最终诊断均需结合听力学诊断。
1 http://www.who.int/mediacentre/factsheets/fs300/en.
2 Nance WE.The genetics of deafness[J].Ment Retard Dev Disabil Res Rev,2003,9:109.
3 Assachusetts.Universal Newborn Hearing Screening Program[R].2004 Annual Report.
4 Fortnum HM,Summerfield AQ,Marshall DH,et al.Prevalence of permanent childhood hearing impairment in the United Kingdom and implications for universal neonatal hearing screening:questionnaire based ascertainment study[J].Bmj,2001,323:536.
5 Nance WE,Lim BG,Dodson KM.Importance of congenital cytomegalovirus infections as a cause for prelingual hearing loss[J].J Clin Virol,2006,35:221.
6 王秋菊.新生儿聋病基因筛查——悄然的革命[J].听力学及言语疾病杂志,2008,16:83.
7 王秋菊,赵亚丽,兰兰,等.新生儿聋病基因筛查实施方案与策略研究[J].中华耳鼻咽喉头颈外科杂志,2007,42:809.
8 王秋菊.新生儿聋病易感基因筛查的意义与策略[J].中国医学文摘耳鼻咽喉科学,2007,1:21.
9 Morton CC,Walter E,Nance D.Newborn Hearing Screening—A Silent Revolution[J].N Engl J Med,2006,354:2 151.
10 http://hereditaryhearingloss.org.last update:May 19 th,2014(aes)
11 Hamid M,Karimipoor M,Chaleshtori MH,et al.A novel 355-357delGAG Mutation and frequency of connexin-26(GJB2)mutations in Iranian patients[J].J Genet,2009,88:359.
12 王国建,戴朴,韩东一,等.非综合征型聋患者GJB2 235delC及线粒体DNA A1555G突变分析[J].听力学及言语疾病杂志,2007,15:114.
13 Putcha GV,Bejjani BA,Bleoo S,et al.A multicenter study of the frequency and distribution of GJB2 and GJB6 mutations in a large North American cohort[J].Genet Med,2007,9:413.
14 关静,郭玉芬,徐百成,等.中国西北地区部分语前聋患GJB2基因突变的分子流行病学研究[J].解放军医学杂志,2006,31:303.
15 李庆忠,王秋菊,赵立东,等.国人非综合征型遗传性聋患者GJB3基因突变分析[J].听力学及言语疾病杂志,2005,13:145.
16 赵亚丽,李庆忠,翟所强,等.国人前庭水管扩大患者SLC26A4基因的特异性突变[J].听力学及言语疾病杂志,2006,14:93.
17 赵亚丽,王秋菊,兰兰,等.大前庭水管综合征家系SLC26A4基因突变分析[J].中华耳科学杂志,2006,4:322.
18 Guo YF,Liu XW,Guan J,et al.GJB2,SLC26A4 and mitochondrial DNA A1555G mutations in prelingual deafness in Northern Chinese subjects[J].Acta Otolaryngol,2008,128:297.
19 Yuan Y,You Y,Huang D,et al.Comprehensive molecular etiology analysis of nonsyndromic hearing impairment from typical areas in China[J].J Transl Med,2009,7:79.
20 Lu J,Li Z,Zhu Y,,et al.Mitochondrial 12S r RNA variants in 1642 Han Chinese pediatric subjects with aminoglycosideinduced and nonsyndromic hearing loss[J].Mitochondrion,2010,10:380.
21 Xia JH,Liu CY,Tang BS,et al.Mutations in the gene encoding gap junction protein beta-3 associated with autosomal dominant hearing impairment[J].Nat Genet,1998,20:370.
22 纪育斌,兰兰,王大勇,等.中国非综合征型聋患者GJB2基因突变流行病学文献荟萃分析[J].听力学及言语疾病杂志,2011,19:323.
23 Zhao H,Young WY,Yan QF,et al.Functional characterization of the mitochondrial 12S r RNA C1494T mutation associated with aminoglycoside-induced and non-syndromic hearing loss[J].Nucleic Acids Res,2005,33:1 132.
24 Zaputovic S,Stimac T,Prpic I,et al.Molecular analysis in diagnostic procedure of hearing impairment in newborns[J]. Croat Med J,2005,46:797.
25 Medica I,Rudolf G,Prpi′cI,et al.Incidence of the del35G/GJB2 mutation in Croatian newborns with hearing impairment[J].Med Sci Monit,2005,11:CR533.
26 Preciado DA,Lawson L,Madden C,et al.Improved diagnostic effectiveness with a sequential diagnostic paradigm in idiopathic pediatric sensorineural hearing loss[J].Otol Neurotol,2005,26:610.
27 Ealy M,Lynch KA,Meyer NC,et al.The prevalence of mitochondrial mutations associated with aminoglycoside-induced sensorineural hearing loss in an NICU population[J]. Laryngoscope,2011,121:1184.
28 Piatto VB,Oliveira CA,Alexandrino F,et al.Prospects for genetic hearing loss screening:35delG mutation tracking in a newborn population[J].J Pediatr(Rio J),2005,81:139.
29 Norris VW,Arnos KS,Hanks WD,et al.Does universal newborn hearing screening identify all children with GJB2(Connexin 26)deafness?Penetrance of GJB2 deafness[J]. Ear Hear,2006,27:732.
30 Nivoloni K,da Silva-Costa,Pomilio,et al.Newborn hearing screening and genetic testing in 8974 Brazilian neonates[J].International journal of pediatric otorhinolaryngology,2010,74:926.
31 Tavartkiladze GA,Polyakov AV,Markova TG,et al.Genetic screening for hearing disorders in newborn infants in combination with audiological screening[J].Vestnik Otorinolaringologii,2010,3:15.
32 Wang QJ,Zhao YL,Rao SQ,et al.Newborn hearing concurrent gene screening can improve care for hearing loss:A study on 14,913 Chinese newborns[J].Int J Pediatr Otorhinolaryngol,2011,75:535.
33 Wu CC,Hung CC,Lin SY,et al.Newborn genetic screening for hearing impairment:a preliminary study at a tertiary center[J].PLoS One,2011,6:e22314.
34 Chen G,Wang X,Fu S.Prevalence of A1555G mitochondrial mutation in Chinese newborns and the correlation with neonatal hearing screening[J].Int J Pediatr Otorhinolaryngol,2011,75:532.
35 Zhang Z,Ding W,Liu X,et al.Auditory screening concurrent deafness predisposing genes screening in 10,043 neonates in Gansu province,China[J].Int J Pediatr Otorhinolaryngol,2012,76:984.
36 Han B,Zong L,Li Q,et al.Newborn genetic screening for high risk deafness-associated mutations with a new Tetraprimer ARMS PCR kit[J].Int J Pediatr Otorhinolaryngol,2013,77:1 440.
37 Chen Y,Li L,Sun LH,et al.Newborn dried blood-spot screening of the p.V37I variant of GJB2 by high-resolution melting analysis[J].Int J Pediatr Otorhinolaryngol,2014,pii:S0165-5876(14)00201-8.
38 Yao GD,Li SX,Chen DL,et al.Combination of hearing screening and genetic screening for deafness-susceptibility genes in newborns[J].Exp Ther Med,2014,7:218.
39 Zhang J,Wang P,Han B,et al.Newborn hearing concurrent genetic screening for hearing impairment-a clinical practice in 58,397 neonates in Tianjin,China[J].Int J Pediatr Otorhinolaryngol,2013,77:1 929.
(2014-06-06收稿)
(本文编辑 周涛)
10.3969/j.issn.1006-7299.2015.01.026
时间:2014-6-12 15:11
R764.43
A
1006-7299(2015)01-0091-06
* 本研究由国家重大科学研究计划项目(2014CB943001)、国家自然基金重点项目(30830104)、国家自然基金重大国际合作项目(81120108009)、全军“十二五”重点项目(BWS11J026)及解放军总医院博士创新基金项目(12BCZ05)联合资助
1 中国人民解放军总医院耳鼻咽喉头颈外科解放军耳鼻咽喉研究所(北京 100853)
王秋菊(Email:wqcr@sina.com;wqcr@263.net)
·综述·
