人肝细胞生长因子基因重组慢病毒载体的构建及其在成肌干细胞中的表达*
2015-03-16汤维芳刘菲陈世彩陈东辉李孟朱敏辉郑宏良
汤维芳 刘菲 陈世彩 陈东辉 李孟 朱敏辉 郑宏良
人肝细胞生长因子基因重组慢病毒载体的构建及其在成肌干细胞中的表达*
汤维芳1刘菲1陈世彩1陈东辉1李孟1朱敏辉1郑宏良1
目的 构建人肝细胞生长因子(human hepatocyte growth factor,h HGF)基因重组pCMV-G&NR -U6-h HGF慢病毒载体,并检测其在成肌干细胞系C2C12细胞中的h HGF表达,为治疗失神经喉肌纤维化的研究提供依据。方法 采用RT-PCR法扩增并纯化得到h HGF基因片段,并将其克隆到pCMV-G&NR-U6上,再将重组慢病毒载体转化入感受态大肠杆菌DH5α,筛选阳性菌落并行Bam HI和HindⅢ双酶切鉴定。对筛选后的重组质粒阳性克隆行PCR鉴定和测序,将表达质粒与包装质粒共转染293T细胞包装h HGF慢病毒,荧光显微镜检测病毒滴度,再进一步转染C2C12细胞(分为空白对照组、空载体组、HGF重组慢病毒过表达组),最后行PCR和WB检测HGF的表达情况。结果 PCR鉴定和测序结果显示所构建的慢病毒载体正确无误,包装后的病毒滴度>1×109IU/m L;慢病毒过表达组的HGF表达量均较空白对照组、空载体组明显增高,而且72 h仍有稳定的表达。结论 本实验成功构建了慢病毒载体pCMV-G&NR-U6-h HGF,并能够在离体培养的成肌干细胞系C2C12细胞中稳定高效表达HGF,为治疗失神经喉肌等骨骼肌纤维化、提高神经修复效果的实验研究提供了依据。
人肝细胞生长因子; 慢病毒; 喉肌; 成肌干细胞
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20141231.1128.007.html
声带麻痹多由于喉返神经损伤所致,虽然通过修复喉返神经治疗取得了较好的疗效[1],但随着失神经时间的延长,细胞外基质成分不断聚积,喉肌内肌肉成分和结缔组织构成比例会发生改变,导致失神经喉肌萎缩纤维化并最终丧失肌功能,直接影响晚期喉返神经修复术的效果。肝细胞生长因子(hepatocyte growth factor,HGF)最初由日本人发现[2],它是一种多效细胞因子,分布于全身多个组织器官,具有多种生物学功能。有文献报道HGF有抗肝脏纤维化[3]、肾脏纤维化[4]、肺纤维化[5]的作用;且已有文献报道HGF对神经元有保护作用[6],并且在周围神经损伤,如坐骨神经[7]、面神经[8]等损伤后,对轴突再生具有促进作用。前期研究发现HGF可促进喉返神经再生[9],然而对失神经喉肌纤维化有无作用未见相关文献报道。为此,本研究拟通过构建人肝细胞生长因子(h HGF)基因重组慢病毒载体并观察其在成肌干细胞中的表达,以期为治疗失神经喉肌纤维化、提高神经修复效果的实验研究提供依据。
1 材料与方法
1.1 主要试剂与材料 慢病毒核心质粒p CMVG&NR-U6(上海吉凯基因化学技术有限公司);包装质粒VSV-G、pol/gag(addgene公司);293T细胞(美国模式培养物集存库);感受态大肠杆菌DH5α(Transgen公司);LA Taq酶、DNA marker(Takara公司);T4 DNA连接酶、Bam HI和HindⅢ限制性内切酶(Thermo公司);质粒抽提试剂盒(OMEGA公司);琼脂糖凝胶DNA回收试剂盒(Solarbio公司);脂质体转染试剂盒(invitrogen公司);BCA蛋白定量试剂盒(thermo公司);细胞基础培养基DMEM(Gibco公司);胎牛血清(杭州四季清生物技术有限公司);小鼠成肌干细胞C2C12(中国科学院细胞库);引物合成及DNA测序。
1.2 实验方法
1.2.1 重组慢病毒载体p CMV-G&NR-U6-h HGF的构建及鉴定 针对目的基因h HGFmRNA序列的CDS区域,采用premier5.0设计特异性引物(上海捷瑞生物有限公司合成)。上游引物5'端引入保护性碱基CG及Bam HI酶切位点;下游引物引入保护性碱基CC及HindⅢ酶切位点。引物序列为:h HGF-F:5'CGGGATCCC ATGTGGGTGACCAAACTCCT3'。h HGF-R:5'CCAAGCTTG TTATGTCTCGCATGTTTTAAT3'。PCR反应条件:95℃预变性2 min,95℃变性20 s,58℃退火20 s,72℃延伸15 s,循环35次,最后72℃延伸5 min;15℃保温。扩增产物进行琼脂糖凝胶电泳,纯化回收获得h HGF基因片段。
利用Bam HI和HindⅢ分别双酶切HGF扩增产物、pCMV-G&NR-U6质粒,37℃过夜,回收并纯化目的基因片段和线性化的载体。双链DNA片段和线性化载体片断于20℃25 min进行连接反应后,采用热激法将重组慢病毒载体pCMV-G& NR-U6-h HGF转化感受态大肠杆菌DH5α。转化后的平皿于37℃培养16 h后,随机挑取长出的转化子进行菌落PCR鉴定,筛选阳性菌落,提取质粒,用Bam HI和HindⅢ进行双酶切鉴定,挑选各组阳性克隆菌液进行测序分析。
1.2.2 细胞培养 293T和C2C12细胞在含10%胎牛血清及1%双抗的细胞培养基DMEM中,于37℃、5%CO2饱和湿度条件下恒温孵育箱中培养,取对数生长期的细胞用于实验。
1.2.3 重组慢病毒包装及滴度测定 将293T细胞传至6孔板中,当细胞融合度达80%~90%时进行转染及慢病毒包装。分别取两个灭菌的2.0 ml的离心管,分别标号A、B,A管中加入250μl Opti -MEM I Redu Mced Serum和5μL脂质体,B管中加入250μL Opti-MEM I Redu Mced Serum和2μg DNA(p CMV-G&NR-U6-HGF:1 000 ng;VSV-G:100 ng;pol/gag:900 ng);载体DNA与脂质体按1:2的比例。A、B管分别室温静置5 min后,混合A、B,形成DNA与转染试剂的转染复合物,室温静置20 min;将转染复合物转至已经消化传代并更换为无血清培养液的293T细胞中,混匀,共转染293T细胞,孵育过夜后更换含血清DMEM培养液。再过48 h后观察细胞荧光发生情况,收集富含病毒颗粒的上清液进行浓缩。3 000 r/min离心10 min,过滤去除细胞碎片;90 000 g高速离心90 min,弃上清,保存病毒原液。
将293T细胞接种于24孔板中,其中一孔细胞为阴性对照。第二天用DMEM原液按梯度稀释病毒液,依次为10-3、10-5、10-7、10-9和10-11,每孔细胞加入100μl稀释的病毒液,每个梯度设置3个重复;48 h后在荧光显微镜下观察HGF重组慢病毒感染的细胞每孔中GFP的表达,若10-9感染的细胞孔中有1个GFP阳性细胞,则此病毒滴度为1 ×109IU/ml。
1.2.4 慢病毒感染C2C12细胞 将C2C12细胞接种于6孔板,分为空白对照组、空载体组、HGF重组慢病毒过表达组,每组加入病毒原液2μl,空白对照组加入相同量的PBS;24 h检测HGF mRNA的表达量,72 h检测HGF蛋白的表达量。
1.3 统计学方法 采用SPSS18.0对数据进行单因素方差分析(ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 h HGF目的基因PCR产物鉴定 PCR扩增h HGF目的基因,用1%琼脂糖凝胶电泳分析,发现扩增出750~1 000 bp之间的特异性片段,与预期产物实际大小874 bp结果一致(图1)。
2.2 重组慢病毒表达载体(pCMV-G&NR-U6 -h HGF)的鉴定及测序 挑取的6个单克隆,在750~1 000 bp之间均可见清晰的条带,与预期结果一致,说明h HGF与pCMV-G&NR-U6质粒构建成功(图2)。在750~1 000 bp之间及6 000 bp处,分别可见清晰的条带(图3),上方条带为线性pCMV-G&NR-U6片段,下方条带为h HGF基因片段,与预期结果一致。由此可见,h HGF已正向准确插入到pCMV-G&NR-U6质粒的特异位点间,测序结果与GenBank基因序列同源性100%,说明重组慢病毒表达载体pCMV-G&NR -U6-h HGF构建成功。
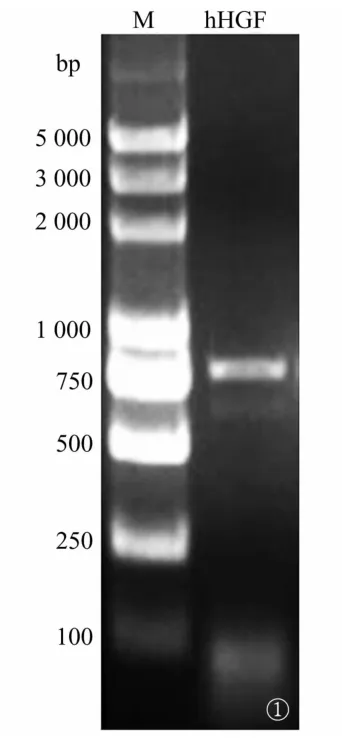
图1 h HGF目的基因扩增产物琼脂糖凝胶电泳图
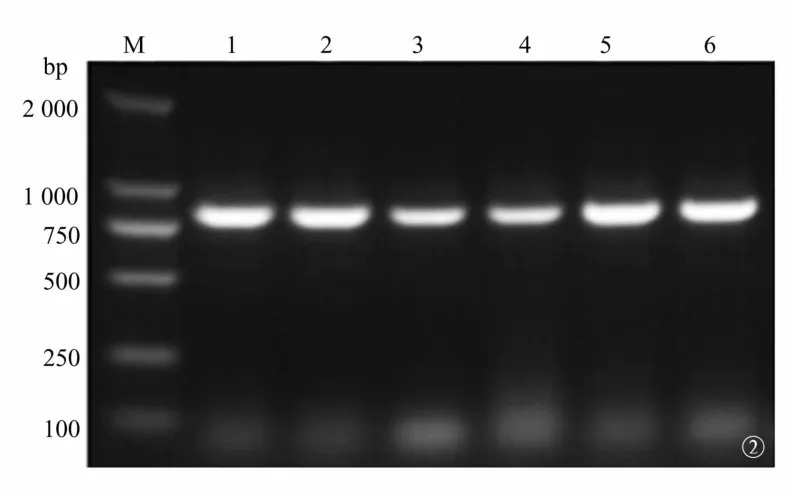
图2 菌落PCR扩增产物琼脂糖凝胶电泳图
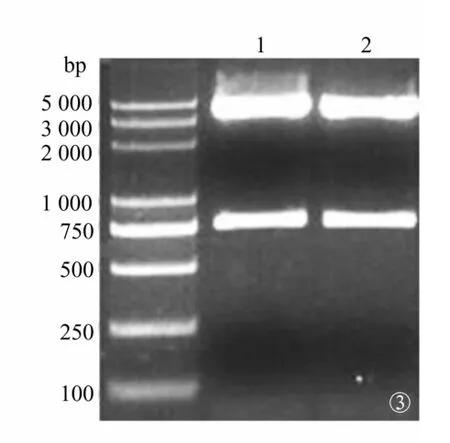
图3 双酶切产物检测琼脂糖凝胶电泳图
2.3 慢病毒颗粒包装结果及病毒滴度测定 重组慢病毒表达质粒p CMV-G&NR-U6-h HGF和慢病毒包装质粒VSV-G、pol/gag共转染293T细胞,转染48 h后在荧光显微镜下可观察到特异性绿色荧光(图4),证明病毒包装成功。
将原始病毒按10-3稀释,直至10-11(图5),在10-11还有荧光出现,说明病毒的滴度大于1×109IU/ml。
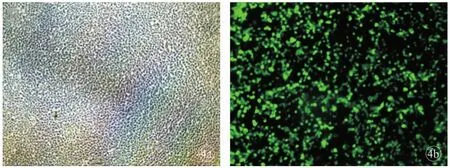
图4 三质粒共转染293T细胞前后显微镜观察


图5 不同稀释度的病毒液感染C2C12细胞后48 h荧光显微镜观察
2.4 重组质粒HGF过表达效率检测 与空白对照组和空载体组相比,慢病毒过表达载体组HGF的表达明显增加,差异有统计学意义(P<0.01)(表1)。Western blot条带图显示慢病毒过表达载体组的HGF蛋白表达量明显高于空白对照组及空载体组,差异有统计学意义(P<0.01)(图6、表1)。
表1 各组HGF mRNA及蛋白的表达(±s)

表1 各组HGF mRNA及蛋白的表达(±s)
注:*与对照组比较,P<0.01
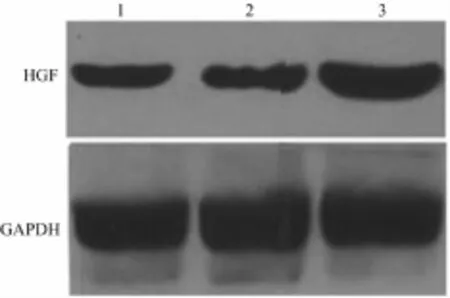
图6 各组细胞中HGF蛋白表达的Western blot图
3 讨论
保持骨骼肌的正常结构和功能依赖骨骼肌的神经支配,失神经支配会将导致肌纤维萎缩纤维化[10]。喉返神经损伤引起的喉肌萎缩纤维化将引起不同程度的发音、呼吸、吞咽功能障碍,严重影响患者生存质量。近年来对于早中期喉返神经损伤导致的声带麻痹的神经修复治疗已经取得成功[11],但随着病程延长,喉返神经损伤导致的喉肌萎缩纤维化不断加重,可能影响喉返神经修复效果。所以,如何避免喉返神经等周围神经损伤后引起的肌肉萎缩纤维化仍是亟待解决的问题。
近年来针对预防和治疗肝、肾、肺等组织纤维化的研究发现,HGF可抑制多种类型组织的成纤维细胞激活表达TGFβ1,具有明显的抗纤维化作用[12],且与抗纤维化的进程密切相关[13]。HGF可能成为抗失神经喉肌等骨骼肌萎缩纤维化,促进长期失神经喉肌等骨骼肌再生的一种更有潜力的生长因子[14]。慢病毒载体为自杀性病毒,作为一种转基因载体,其特点在于感染目的细胞后不会再感染其他细胞,也不会在宿主细胞产生新的病毒颗粒。与逆转录病毒和腺病毒载体相比有很多优良特性,如:能与宿主基因组稳定整合且长时间表达;对于分裂细胞和非分裂细胞都有感染能力;且有广泛的组织嗜性,包括一些基因治疗和细胞治疗的靶细胞;在转染之后不会表达病毒基因的蛋白质,细胞毒性小,宿主细胞免疫反应小等。已有文献报道针对肾脏纤维化的治疗构建了慢病毒载体,并能够有效减轻肾脏纤维化的发生[15]。
通过慢病毒载体构建,基因可以有效持续表达,从而为HGF对失神经骨骼肌抗纤维化作用的研究提供了良好的载体。本实验成功构建了pCMV-G &NR-U6-sh RNA-h HGF表达质粒,再通过该表达质粒和包装质粒VSV-G、pol/gag共转染293T细胞,48 h后荧光显微镜下GFP表达明显,在10-11的浓度还有荧光出现,说明病毒的滴度大于1 ×109IU/m L,表明h HGF目的基因在293T细胞中高效表达,提示慢病毒载体构建成功;研究中,通过对C2C12细胞进行靶基因h HGF转染,使靶基因在成肌细胞内稳定表达;通过比较空白对照组、空载体组及HGF过表达组的mRNA和蛋白表达水平,发现HGF过表达组的转染率均较空白对照和空载体组高,表明所构建的慢病毒载体能够稳定、高效的表达,从而为下一步深入研究过表达HGF的成肌干细胞移植,促进失神经萎缩的喉肌等骨骼肌的再生动物实验提供了必备的材料,也为治疗失神经骨骼肌纤维化,提高神经修复效果的实验研究提供了依据。
1 李孟,郑宏良.甲状腺手术单侧喉返神经损伤手术探查与修复[J].中国实用外科杂志,2012,32:364.
2 Nakamum T,Nawa K,Ichihara A.Partial purification and characterization of hepatocyte growth factor from 8enlm of hepatectomized rats[J].Biochem Biophys Res Commun,1984,122:1450.
3 Tojima H,Kakizaki S,Kosone T,et al.Hepatocyte growth factor overexpression ameliorates liver inflammation and fibrosis in a mouse model of nonalcoholic steatohepatitis[J].Hepatology International,2012,6:620.
4 Schievenbusch S,Strack I,Scheffter M,et al.Profiling of anti-fibrotic signaling by hepatocyte growth factor in renal fibroblasts[J].Biochem Biophys Res Commun,2009,385:55.
5 Chakraborty S,Chopra P,Hak A,et al.Hepatocyte growth factor is an attractive target for the treatment of pulmonary fibrosis[J].Expert Opin Investig Drugs,2013,22:499.
6 Tsuzuki N,Miyazawa T,Matsnmoto K,et al.Hepatocyte growth factor reduces infarct volume after transient focal cerebral ischemia in rats[J].Acta Neurochir Suppl,2000,76:311.
7 Hashimoto N,Yamanaka H,Fukuoka T,et al.Expression of HGF and c Met in the peripheral nervous system of adult rats following sciatic nerve injury[J].Neuroreport,2001,12:1403.
8 周翠英.肝细胞生长因子对面神经损伤修复作用的实验初探[J].重庆医学,2003,32:299.
9 李孟,陈世彩,陈东辉.肝细胞生长因子对喉返神经损伤后再生的作用[J].听力学及言语疾病杂志,2012,20:467.
10 Batt J,Bair J,Concalves J,et al.Differential gene expres-sion profiling of short and long term denervated muscle[J]. FASEB J,2006,20:115.
11 Wang W,Chen S,Chen D,et al.Contralateral ansa cervicalis-to-recurrent laryngeal nerve anastomosis for unilateral vocal fold paralysis:a long-term outcome analysis of 56 case[J].Laryngoscope,2011,121:1027.
12 Jiang D,Jiang Z,Han F,et al.HGF suppresses the production of collagen type III and alpha-SMA induced by TGF-beta1 in healing fibroblasts[J].Eur J Appl Physiol,2008,103:489.
13 Ishikawa H,Jo JI,Tabata Y.Liver anti-fibrosis therapy with mesenchymal stem cells secreting hepatocyte growth factor[J].J Biomater Sci Polym Ed,2012,23:2259.
14 Narmada BC,Chia SM,Tucker-Kellogg L,et al.HGF regulates the activation of TGF-betal in rat hepatocytes and hepatic stellate cells[J].J Cell Physiol,2013,228:393.
15 Yang T,Zhang B,Pat BK,et al.Lentiviral-mediated RNA interference against TGF-beta receptor type II in renal epithelial and fibroblast cell populations in vitro demonstrates regulated renal fibrogenesis that is more efficient than a nonlentiviral vector[J].J Biomed Biotechnol,2010,2010:859240.
(2014-06-30收稿)
(本文编辑 李翠娥)
Construction of Human Hepatocyte Growth Factor Gene Recombinant Lentivirus Vectors and Its Expression in MyobIasts
Tang Weifang,Liu Fei,Chen Shicai,Chen Donghui,Li Meng,Zhu Minhui,Zheng HongIiang
(Department of OtorhinoIaryngoIogy Head&Neck Surgery,Second MiIitary MedicaI University,Shanghai,200433,China)
Objective To construct a gene recombinant lentiviral vector pCMV-G-U6-h HGF and detect its expression in C2C12 myoblast cells.Methods h HGF gene fragments were obtained and purified by RT-PCR method,and were cloned to pCMV-G&NR-U6,then the restructured lentiviral vector was transformed into e. coli DH5 alpha,the positive colonies were identified by Bam HI and HindⅢenzyme digestion.The selected positive colonies were tested by PCR and sequencing analysis.The expression plasmids and packing plasmids were co-transfected into 293 T cells,and virus titer was observed under the fluorescence microscope.Furthermore,transfected C2C12 cells with lenti virus,and the expression of HGF was detected by PCR and WB methods.ResuIts PCR and sequencing analysis showed that the lentiviral vector was constructed correctly and successfully,the virus titer was above 1 x 109IU/mL.The results of PCR and WB showed that HGF expression level in the lentiviral vector group was much higher than those of in blank control and negative control groups,and yet the expression was stable after 72 hours.ConcIusion The lentiviral vector pCMV-G&NR-U6-h HGF has been successfully constructed,and stable expressed in C2C12 cells.It provides references for experimental study in the fields of the denervated skeletalmuscle fibrosis and nerve regeneration treatment.
Human hepatocyte growth factor; Lenti virus; Laryngeal muscle; Myoblasts
10.3969/j.issn.1006-7299.2015.01.012
时间:2014-12-31 11:28
R767.6+2
A
1006-7299(2015)01-0045-05
* 国家自然科学基金(81070774/H1302)资助
1 第二军医大学长海医院耳鼻咽喉头颈外科(上海 200433)
汤维芳,女,安徽人,医学硕士,主要研究方向为喉失神经支配修复研究。
郑宏良(zheng_hl2004@163.com)
·信 息·
