双氧水与FeCl2反应的最佳浓度配比及反常现象分析
2015-03-13卢博迪
卢博迪 田 婷
(南京师范大学教师教育学院 江苏 南京 210097)
一、问题的提出
Fe2+与Fe3+的相互转化是铁及其化合物的重要化学性质,教学中常用双氧水与氯化亚铁溶液反应来表现Fe2+转化为Fe3+,预期的实验现象是:浅绿色的氯化亚铁溶液中滴入无色的双氧水后转化为黄色的三氯化铁溶液。但实际操作中常常会出现溶液变红褐色、有大量气体逸出、甚至出现沉淀等“反常”现象。为寻找双氧水与氯化亚铁溶液反应的最佳配比,并对“反常”现象加以解释, 笔者分别取了不同浓度的双氧水和氯化亚铁溶液进行了四组实验,并利用pH 传感器、温度传感器、X-射线衍射等对实验现象进行了分析。
二、实验探索
饱和FeCl2溶液配制过程:
经查,FeCl2在20℃时的溶解度为64.5g, 换算成FeCl2·4H2O 为151.7g, 精确称量15.096g FeCl2·4H2O固体溶于10mL 蒸馏水中, 配制成体积为18.8mL 的FeCl2饱和溶液,此时溶液的浓度为c=4.035mol·L-1。
[实验一]
实验过程: 取浓度分别为4mol·L-1、1mol·L-1、0.1mol·L-1、0.01mol·L-1的FeCl2溶液各2mL, 将30%的过氧化氢(pH=3.67)逐滴滴加至上述溶液中,测定反应前后溶液的pH,观察现象并记录:

表1 30%过氧化氢滴加不同浓度FeCl2 溶液的现象记录
用KSCN 检测,生成物均含有氧化产生的Fe3+,且除4 号实验外,均呈现明显放热现象。
由试管1 中的实验现象笔者发现向氯化亚铁饱和溶液(4mol·L-1)中滴加30%的过氧化氢时,生成了棕黄色沉淀。这一现象似乎反常,因为此时溶液是较强酸性的(pH=0.93),并不在Fe(OH)3生成的pH 范围内。为探究试管1 中沉淀(以下简称混合物A)是什么,笔者进行了以下实验:
[实验二]
取混合物A 适量于另一洁净试管中, 滴加蒸馏水,沉淀溶解生成红褐色胶体,测pH 为1.27,后再滴加浓盐酸至再次出现棕黄色浑浊,测pH 为0.93。
由实验二可知,此沉淀应该不是Fe(OH)3沉淀,且只在pH=1 的强酸环境中才存在。经查文献,朱华英(2012)在其文章《双氧水跟KI、FeCl2溶液反应的化学表达式》 中指出Fe2+与H2O2溶液反应的副产物之一FeOCl 在pH=1 时[1]为棕黄色沉淀[2]。为验证该物质是否为FeOCl,笔者对其进行了XRD 检测。
[实验三]
将混合物A 抽滤、置于烘箱中60℃真空烘干20小时,将得到的固体取出,研磨成粉末,再进行X 射线衍射, 取2θ 衍射角为0 到60°的范围进行分析检测。用jade 和origin 软件处理得到混合物A 与FeOCl 标准PDF 卡片的对照谱图如下(见图1)。
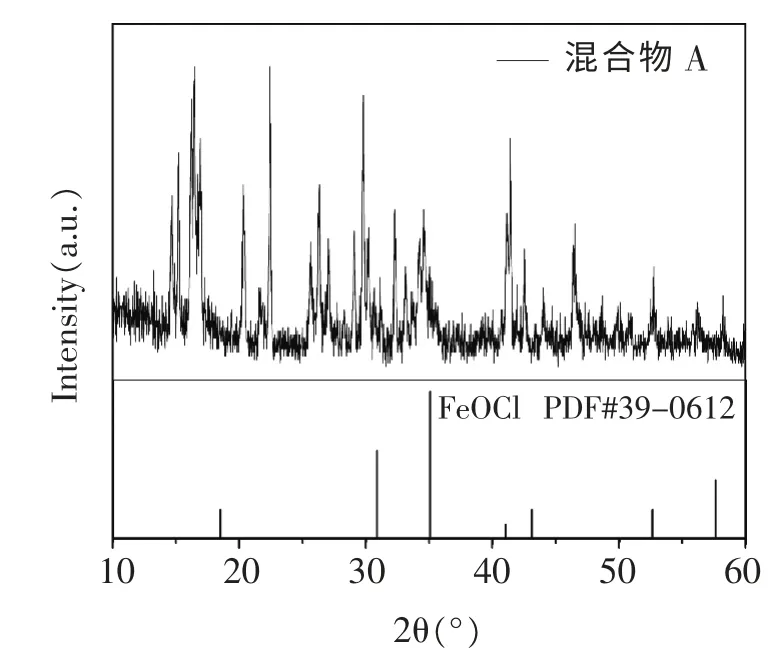
图1 混合物A 的衍射峰与FeOCl 的标准PDF 卡片对照
由图1 所示的谱图我们可以看出FeOCl 的三强线都未能与混合物A 的衍射峰重叠,因此,混合物A中不存在FeOCl。
通过XRD 衍射,排除了FeOCl 存在的可能。同时发现, 混合物A 除了含有较多的FeCl2·4H2O 晶体和少量的FeCl3·6H2O 晶体外, 还含有Fe2O3(见图2)。

图2 混合物A 的衍射峰与Fe2O3 的标准PDF 卡片对照
由此对比图可看出,Fe2O3的标准卡片中大部分的特征峰都能与混合物A 中的衍射峰重合, 因此,混合物A 中还含有Fe2O3。此外,混合物A 所展现的棕黄色固体的形貌也是符合这一结论的。
整合混合物A 与FeCl2·4H2O、FeCl3·6H2O 及Fe2O3的标准PDF 卡片如下图所示(见图3)

图3 混合物A 的XRD 谱图
由图3 可看出,混合物A 的衍射峰与Fe2O3、FeCl2·4H2O 和FeCl3·6H2O 三种晶体组合的标准衍射峰基本吻合,因此可得出结论:混合物A 的主要成分为FeCl2·4H2O 和FeCl3·6H2O 及Fe2O3。
三、理论思考
那么,Fe2O3在这样的一个反应过程中是如何生成的呢?
根据文献分析,Fe2O3可以由FeOCl 和Fe(OH)3热分解而来。FeOCl 的分解温度为375℃[3];Fe(OH)3(Fe2O3·nH2O) 加热脱水生成α-Fe2O3的最低温度达200℃以上[4]。经测量,实验一中1 号试管反应最高温度为82℃。因此, 排除Fe2O3来自FeOCl 和Fe(OH)3的热分解可能。
Schwermann(1999)在其文章《From Fe(Ⅲ)ions to ferrihydrite and then to hematite》中指出Fe3+在水相中会发生聚合反应, 当OH-/Fe3+等 于3 时, 会生成FeOOH 或Fe2O3,且当pH 趋近于0 时,会促进FeOOH向Fe2O3的转化[5]。混合物A 的XRD 分析显示只存在Fe2O3, 没有FeOOH。因此本实验中的Fe2O3可能由Fe2+氧化生成的Fe3+与水中的OH-聚合而成,但是关于Fe2O3的生成目前还没有文献能够明确的说明该过程,因此还需进一步探究。
四、教学建议
由以上实验可知:
1. c(FeCl2)=4mol·L-1,ω(H2O2)=30%时,可以产生棕黄色沉淀现象。
2. c(FeCl2)=1mol·L-1,ω(H2O2)=30%时,实验现象最明显,有利于观察; 生成物为Fe(OH)3胶体(可作为中学配制Fe(OH)3胶体的另一种方式)。
3. c(FeCl2)=0.1mol·L-1,ω(H2O2)=30%时,双氧水超过10 滴时会出现暴沸现象, 在教学演示实验中不利于实验安全;且暴沸现象导致实验过程复杂不易向学生解释。
4. c(FeCl2)=0.01mol·L-1,ω(H2O2)=30%时,反应缓慢现象不明显,不建议在教学中使用该浓度配比。
[1]朱华英,刘怀乐. 谈谈双氧水跟KI、FeCl2溶液反应的化学表达式[J]. 中学化学教学参考,2012,(04):45-6
[2]朱华英. 双氧水分别与氯化亚铁和碘化钾反应的问题探究[J]. 化学教育,2013,(04):87-8
[3]Dai Y-D.Thermal decomposition of iron oxychloride as studied by thermal analysis,X-ray diffraction and Mössbauer spectroscopy [J].Materials Chemistry and Physics,2003
[4]北京师范大学,华中师范大学,南京师范大学无机化学教研室. 无机化学下册(第四版)[M]. 北京:高等教育出版社,2003
[5]Schwertmann. From Fe(Ⅲ)Ions to Ferrihydrite and then to Hematite[J]. Journal of Colloid and Interface Science,1999
