例谈初中化学教学的拓展与延伸
2015-03-13陈良政
陈良政
(宿迁中学开发区分校 江苏 宿迁 223800)
课堂教学中, 教师若能尊重学生的个性差异,因人而异地选择有效教学策略,并且在立足文本的基础上突破文本的限制, 对文本进行有效的拓展和延伸,就能全面提升学生的学习能力。几年来,笔者在课堂教学中就如何进行有效拓展与延伸作了一些实践和尝试,旨在进一步深化落实新课程目标,优化课堂教学,提高教学质量;同时让学生感受到知识的奥妙与博大精深,以此来激发学生的探究欲望,让学生在求知的道路上欲罢不能。
一、问题的提出
常态课堂中经常会遇到这样的情况,学生在所学知识的基础上产生了新的疑问,提出了教师事先没有预设的问题,而且这个问题不在教学目标范围内,教师便认为学生提的问题超出课标要求,不愿意把课堂时间浪费在这些问题上,通常对这些问题避而不提、不答。例如:在学习“溶液酸碱性”这节内容时,学生提出了这样的问题:为什么pH 值越小溶液的酸性越强? pH 值是怎么得出来的? 碳酸氢钠不是可溶的吗? 为什么氨盐水吸收二氧化碳后生成碳酸氢钠能以晶体形式析出? 再如,为什么原子的核外电子排布第一层最多只能排两个电子,第二层最多只能排八个电子? 为什么最外层是七个电子的原子不稳定?……。当学生提出这些不解问题时,有的教师往往会说“这个记住就行了,不需要知道为什么,考试又考不到。”“你们把我讲的掌握好就足够了,完全可以面对中考,至于其他的留你们以后再学。”教师的这种做法无可厚非,但是却反映了这些教师无视学生的心理需求和内心体验,一味地把自己的观点强加给学生,用堂而皇之的方法平息了学生的疑问和继续追问。
二、问题的解决
肖川在《解读学习的革命》一书中有这样一段话:“教师,儿童的‘天国引路人’。在我们越来越关注学习者的时候,教师的作用不会受到丝毫的削弱,相反,他们需要承担更关键、更艰巨的职责,体现出更大的‘不可替代性’,教师将面临新的挑战。”这段话触及了我的心灵,引发了我的思考:我在教育教学中面临的挑战是什么? 我该如何面对我的课堂和我的学生? 在教学中,我不断地反思与实践,渐渐地懂得了教师面临的教学的挑战, 那就是唤醒学生已有的经验和智慧,激发他们的高水平思维,组织有效的合作学习,帮助他们对知识深层的理解, 诱发和激发他们的求知欲望,让他们在求知路上迎难直上,寻找捷径,尽情驰骋,而不是在他们的求知路上充当拦路虎。
1.不回避学生提出“超标”问题
俗话说:“站得高,看得远。”学习要抓住知识间的本质联系,才能做到一通百通,融会贯通。我发现对学生课堂上提出的生成性问题不回避, 进行及时解答,不仅能激发学生的学习思维, 唤起对知识的渴望,更能让学生感受到知识的奥妙与博大精深。所以,我在课堂中不回避学生提出的“超课程标准”问题,经常会随机地“浪费”一点时间给学生简单的介绍他们想知道的知识。有时也会根据以往的课堂经验在备课中事先有目的地诱导和设计这些问题。
案例1:教学中发现,学生在学习“溶液的酸碱性强弱和溶液的pH 值的关系”时总是死记硬背,虽然能够应对习题,但不会变通,对所学知识停留在表面上,没有真正掌握知识的内在联系。他们往往提出这样的问题:为什么pH 值越小溶液的酸性越强? pH 值是怎么得出来的?
针对学生提出的问题,我在教学中试着向他们简单介绍了溶液中氢离子浓度和氢氧根离子浓度的关系和pH 值的计算方法,告诉他们公式:pH =-lg[H+](即溶液的pH 值用氢离子浓度的负对数来表示),列举酸性溶液、中性溶液、碱性溶液中pH 值的实例呈现给学生看(PPT)。

常温下,水溶液中:[H+]×[OH-]=10-14 =Kw(定值,叫水的离子积常数)。例如:当[H+]=0.1 mol·L-1 时,[OH-]=Kw /0.1=10-13 mol·L-1 pH =1当[OH-]=0.01 mol·L-1 时,[H+]=Kw /0.01 =10-12 mol·L-1 pH =12由此得出以下结论:中性水溶液:[H+]=[OH-]=10-7 mol·L-1 pH =7酸性水溶液:[H+]>[OH-],[H+]>10-7 mol·L-1 pH <7碱性水溶液:[H+]<[OH-],[H+]<10-7 mol·L-1 pH >7注意:pH 值与[H+]成负对数关系,[H+]越大,pH 值越小。
虽然学生还没有学过对数公式,但学生根据以上信息能够了解pH 值是根据一定的公式计算出来的,这里并不要求学生掌握这个公式及计算方法。通过以上的信息呈现和简单讲解,学生很容易理解为什么在中性溶液中pH =7,酸性溶液中pH <7,碱性溶液中pH >7 。这个部分,在课堂上5 分钟就可以完成。其实这也是课堂教学中重难点突破的一种手段,学生对知识的理解和掌握上升了高度,更有利于他们以后的学习,记得有位教育家说过,成功的教师是把学生推向求知的道路上欲罢不能。
2.及时解答生成性的“超标”问题
案例2:海水“制碱”的方法:向饱和食盐水中通入氨气,再压入二氧化碳气体,析出溶解度相对较小的碳酸氢钠。学生在课堂上提出了这样的问题:氨盐水吸收二氧化碳的产物中不是也有氯化铵吗? 为什么生成碳酸氢钠以晶体形式析出而氯化铵不析出呢? 碳酸氢钠不是可溶的吗? 一般老师都会说“因为碳酸氢钠溶解度小,氯化铵溶解度大,所以会析出,记住就行了。”这样,学生便很勉强地接受了这个知识。面对这个问题,我在教学中是这样处理的。
首先,在PPT 上向学生呈现以下表格和数据:
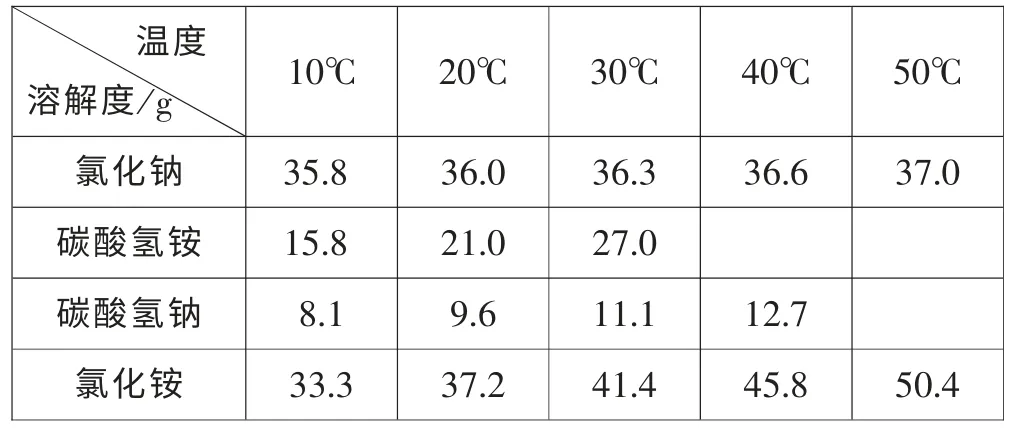
温度溶解度/g 10℃ 20℃ 30℃ 40℃ 50℃氯化钠 35.8 36.0 36.3 36.6 37.0碳酸氢铵 15.8 21.0 27.0碳酸氢钠 8.1 9.6 11.1 12.7氯化铵 33.3 37.2 41.4 45.8 50.4
然后,带着学生算出假设在20℃,向1000g 水中溶解食盐达饱和状态,最多能溶解多少克食盐? 若向此饱和溶液中通入足量的氨气和二氧化碳,计算理论上生成碳酸氢钠和氯化铵的质量。

上述计算数据说明:20℃,1000g 水最多能溶解360g 食盐, 通入氨气和二氧化碳, 最多生成516.9 g碳酸氢钠和329.2g 氯化铵; 从表中数据知:1000g 水最多能溶解96g 碳酸氢钠和372g 氯化铵, 对比知,碳酸氢钠可以析出420.9g 晶体,而氯化铵未饱和。学生很容易理解为什么碳酸氢钠会析出来, 同时也知道了生成的氯化铵没有达到饱和,不会以晶体的形式析出。
3.把握好问题拓展的度
义务教育阶段的化学课程以提高学生的科学素养为主旨,目的是为激发学生学习化学的兴趣,帮助学生了解科学探究的过程和方法,培养学生的科学探究能力,使学生获得进一步学习和发展所需要的化学基础知识和基本技能。教学中拓展内容要在深入研究《课程标准》和《中考说明》基础上进行,还要建立在学生已有的知识基础上进行,有些拓展内容可以让学生理解,但并不一定要求掌握。
教学的魅力在于度的把握,任何事物都是一分为二的,课堂上生成的“超课程标准”的问题把握得好,对学生学习兴趣的提升、探究能力的发展能起到一定的推动作用,用得不好可能会对学生的学习产生很大的负面影响。什么问题该拓展,什么问题不宜拓展,拓展到什么程度,完全要由学生的具体情况来定,以学定教永远是提高教学效率的法宝。
三、经验与反思
课堂教学并不是只为了学生应对中考,而是为了他们终生的发展奠基。课本出现的是知识,教师传授的是方法, 不能把孩子对知识的好奇和向往打消,课本知识都是基础知识,学生通过自己的独立学习基本上能理解和接受,但学生往往在这些知识的基础上想知道更多,知其然而更想知其所以然,所以这时候,我们不能让学生的思维急刹车。课堂上学生的沉默和出错不就说明他们真正地投入了自主的学习和思考吗?如果教师对学生的这些情况处理不当,学生的疑问得不到解决,学生在学习新知识时就可能无法全身心投入,影响新知识的学习,更不利于培养学生的学习热情,易导致学生失去提问的勇气,最终不愿意、不习惯思考和提问了。这样,教师不但没有点燃学生的求知欲望之火,更是将本可成为燎原的火种给浇灭了。学习成了一种简单的复制。如果, 作为生命活动的场所——课堂,不能让学生感受自己认真思考而带来的愉悦,课堂怎能让学生产生深深的眷恋呢?
近几年, 我在尝试着不断改进我的课堂教学,勇敢面对课堂中的挑战, 不断地诱发学生提问题,凡是学生提出的疑问,我觉得对学生有利的,有助于学生对所学知识理解的,学生能够接受的,我就会积极引导学生去发现和学习,出于内心追求的一种高度自觉,我在课堂中始终要求自己保持求变求新的心态。在我的课堂上,我经常这样说:“谁要是能把这道题解出来,我喊你老师。” “有疑问就说,机会有限,难道就没有想知道更多的? ” “你太牛了,你是怎么想到的?快给我们说说。” 在这种激励下,学生一个接一个问题出现,一个又一个地被解决。
[1]肖川,王文宝.解读学习的革命[M].北京:中国青年出版社,1999
[2]方明.陶行知教育名篇[M].北京:教育科学出版社,2005
