富含游离态异黄酮豆豉的制曲工艺优化
2015-03-13高玉荣徐国栋李大鹏王洪江张丽媛刘伟卢旭华
高玉荣,徐国栋,李大鹏,王洪江,张丽媛,刘伟,卢旭华
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.黑龙江农垦宝泉岭香其酱业有限公司)
豆豉是以黑豆或大豆为材料,经过微生物发酵而成的一种具有传统历史的发酵食品[1]。豆豉不仅可以用于烹调,也可替代菜供人们食用[2]。依据豆豉制曲工艺中所使用微生物的不同,豆豉可分为毛霉、根霉、曲霉和细菌型豆豉[3]。
豆豉的发酵过程是利用在制曲过程中由微生物代谢产生的蛋白酶等酶系分解大豆中的蛋白质、淀粉、结合态异黄酮等物质,生成氨基酸、糖和游离态异黄酮等,再经过一些生化反应,从而使豆豉具有独特的风味和营养[4-5]。但目前传统工艺制得的豆豉中游离态异黄酮含量很低,主要是以与糖苷结合态形式存在[6-8]。通过糖苷酶可将结合态的异黄酮水解成的游离态的异黄酮苷元小物质,游离态异黄酮在预防癌症、预防骨质疏松、预防心血管疾病等方面具有较好效果[9]。
为了制备富含游离态异黄酮的豆豉,实验以前期筛选的高产β-葡萄糖苷酶的菌株为制曲菌种,以蛋白酶活力与β-葡萄糖苷酶活力为指标,通过单因素和响应面法进行豆豉制曲工艺优化,以期为富含游离异黄酮的功能性豆豉的工业化生产提供理论参考与数据支持。
1 材料与设备
1.1 菌种
曲霉:D30,自行筛选获得,β-葡萄糖苷酶酶活达到257.621 U·L-1,黑龙江八一农垦大学食品学院实验保藏。
1.2 材料与试剂
黄豆为市售;Folin-酚试剂,上海三杰生物技术有限公司;pNPG,北京诺博莱德科技有限公司,均为分析纯。
1.3 仪器与设备
722S型可见分光光度计,沈阳市博腾仪器设备有限公司;BSA224S型电子分析天平,德国赛多利斯公司;XFH-50MA型电热式压力蒸汽灭菌锅,深圳市鼎鑫宜实验设备有限公司;HH-S4型电热恒温水浴锅,常州市万合仪器制造有限公司。
2 实验方法
2.1 制曲工艺的单因素实验
选择颗粒饱满均匀、无虫蚀的新鲜大豆,加入大豆质量2倍的水,25℃浸泡8 h。121℃蒸煮35min,冷却至35℃进行制曲[10]。以蛋白酶和β-葡萄糖苷酶活力为指标,采用单因素实验研究接种量、制曲温度、制曲时间对制曲的影响。每个处理重复3次,取平均值。
2.2 三元二次回归正交旋转组合实验设计
在单因素实验基础上,以蛋白酶和β-葡萄糖苷酶酶活性为指标,进行三元二次回归正交旋转组合实验设计,数据用Design-Expert 8.0.6软件处理,确定最优制曲工艺参数。
2.3 酶活力测定
蛋白酶活力测定:采用Folin-酚法[11]。β-葡萄糖苷酶活力测定:采用比色法[12]。
2.4 统计学分析
3 结果与分析
3.1 富含游离异黄酮豆豉的制曲工艺的单因素实验
豆豉制曲的目的主要是产生大量的蛋白酶,在发酵过程中可将大豆中的蛋白质水解成氨基酸。为了制备富含游离异黄酮的豆豉,豆曲中不仅要含有较高的蛋白酶活性,而且要含有较高的β-葡萄糖苷酶的活性[13]。因此,实验以蛋白酶活力和β-葡萄糖苷酶活力为指标,进行富含游离异黄酮豆豉的制曲工艺研究。
3.1.1 接种量对制曲工艺的影响
每克冷却的黄豆分别接种 104、105、106、107、108个孢子,28℃培养3 d,测定蛋白酶活力和β-葡萄糖苷酶活力,实验结果如图1所示。
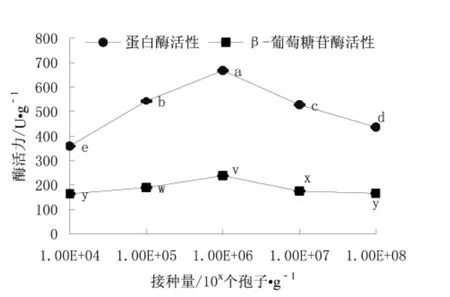
图1 接种量对酶活力的影响Fig.1 Effects of inoculation amount on enzyme activity注:a~e代表不同接种量对蛋白酶活性的差异显著性,v~z代表不同接种量对β-葡萄糖苷酶活性的差异显著性,字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P>0.05)。
从图1可以看出,在104~106个孢子·g-1黄豆范围内,接种量对蛋白酶活力和β-葡萄糖苷酶活力影响显著(P<0.05)。随着接种量的增加,酶活呈先升高后下降的趋势,这是因为当接种量过大时,菌种生长消耗了大量的营养物质,影响了代谢产物的产生,导致酶活力降低,因此单因素确定适宜的接种量为106个孢子·g-1黄豆。
3.1.2 温度对制曲工艺的影响
每克冷却的黄豆接种106个孢子,分别在24、28、32、36、40℃下培养3 d,测定蛋白酶和β-葡萄糖苷酶活力,实验结果如图2所示。
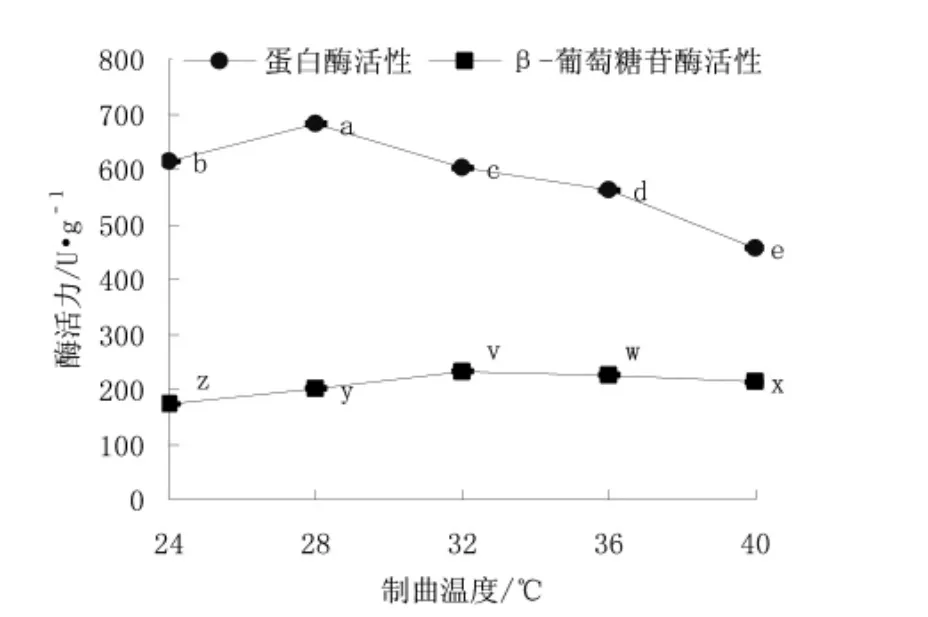
图2 制曲温度对酶活力的影响Fig.2 Effects of koji-making temperature on enzyme activity注:a~c代表不同的制曲温度对蛋白酶活性的差异显著性,x~z代表不同制曲温度对β-葡萄糖苷酶的差异显著性,字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P>0.05)。
从图2可以看出,在实验选取的温度范围内,温度对蛋白酶活力和β-葡萄糖苷酶活力影响显著(P<0.05)。蛋白酶活力最大的温度为28℃,β-葡萄糖苷酶活力最大的温度为32℃,因此,单因素实验确定的制曲温度范围为28~32℃。
3.1.3 时间对制曲工艺的影响
每克冷却的黄豆接种106个孢子,在28℃下分别培养1、2、3、4、5 d,测定蛋白酶和β-葡萄糖苷酶活力,实验结果如图3所示。
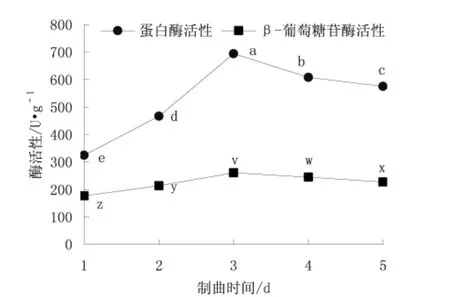
图3 制曲时间对酶活力的影响Fig.3 Effects of koji-making time on enzyme activity注:a~c代表不同制曲时间对蛋白酶活性的差异显著性,x~z代表不同制曲温度对β-葡萄糖苷酶的差异显著性,字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P>0.05)。
从图3可以看出,制曲时间对蛋白酶活力和β-葡萄糖苷酶活力的影响显著(P<0.05)。在1~3 d范围内,随着时间的延长,酶活性逐渐升高,当制曲时间大于3 d,两种酶活力开始下降。这是由于制曲后期,曲霉生长进入衰亡期,代谢能力减慢,并有一部分酶发挥酶解作用,从而使曲中总酶含量减少。因此根据单因素确定适宜的制曲时间为3 d。
3.2 响应面法优化制曲工艺条件
在单因素实验的基础上,选择接种量、制曲温度、制曲时间作为自变量,以蛋白酶活力和β-葡萄糖苷酶活力作为指标,进行二元三次旋转组合实验,因素编码及实验结果见表1和表2[14]。
采用Design-Expert 8.0.6对实验数据进行回归分析,得到蛋白酶活性(y1)、β-葡萄糖苷酶活性(y2)与接种量(x1)、制曲温度(x2)和制曲时间(x3)编码值的二次回归方程如下:
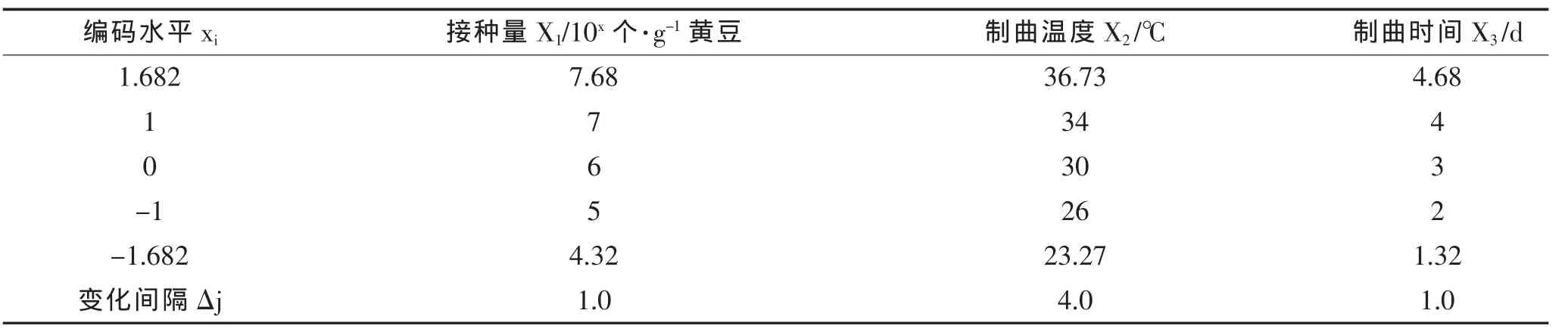
表1 因素水平编码Table 1 Coding table of factor level
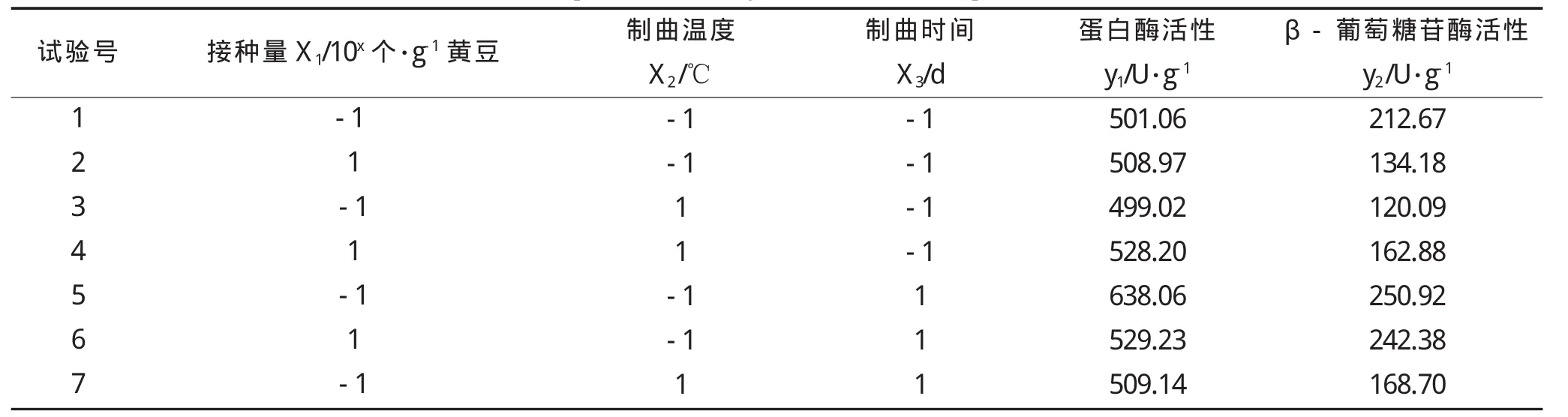
表2 响应面实验设计及结果Table 2 Experimental design and results of response surface
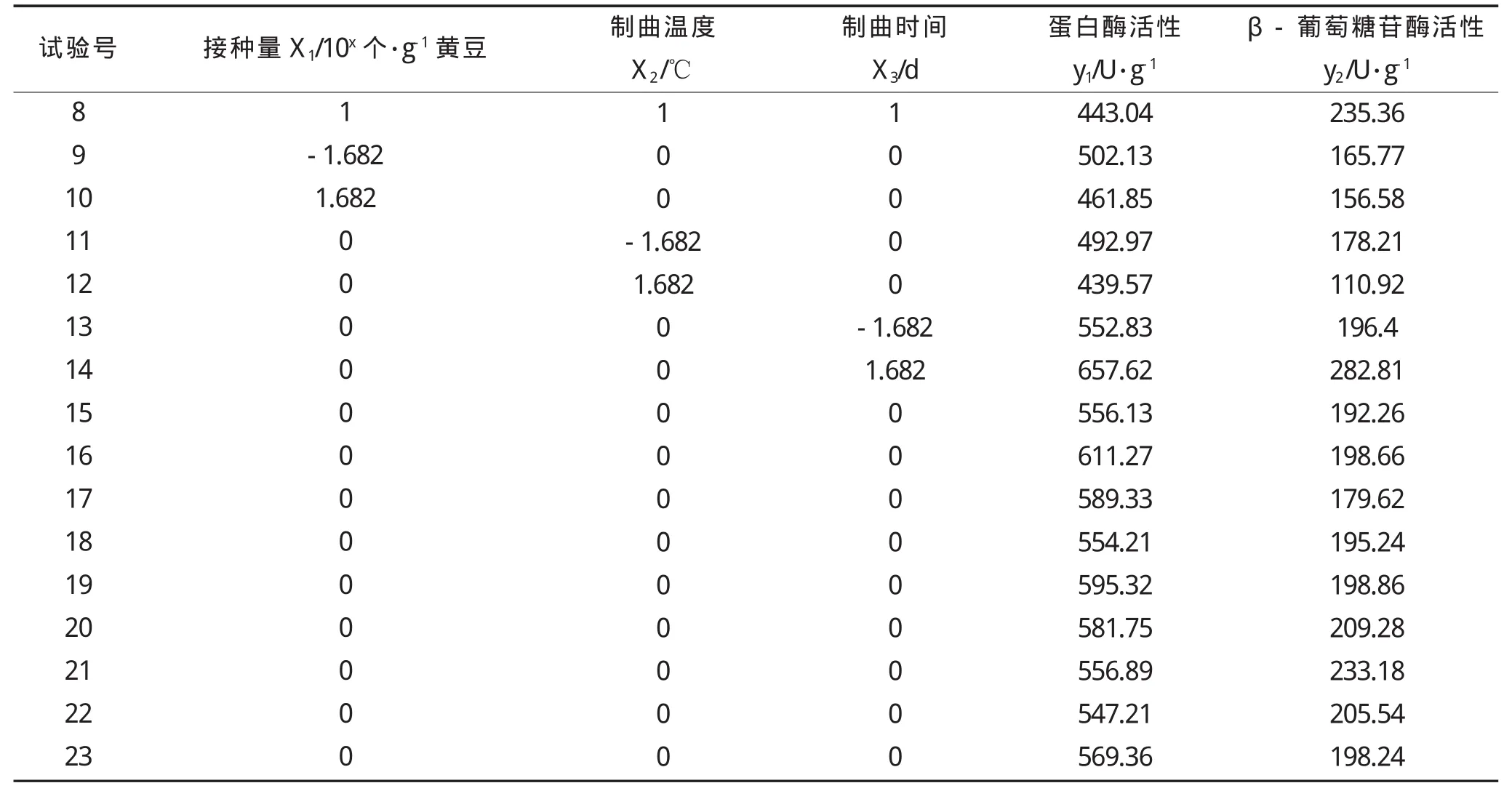
续表2 响应面实验设计及结果Continued table 2 Experimental design and results of response surface
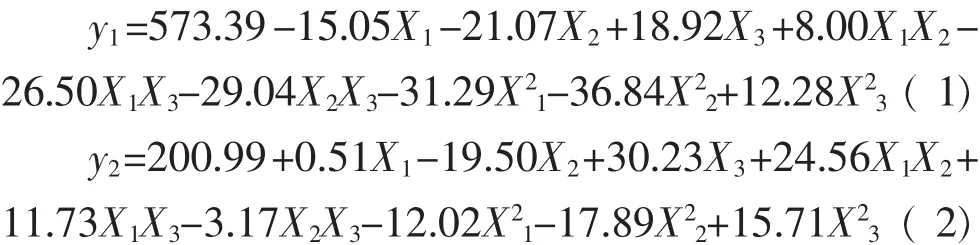
蛋白酶活性模型的决定系数R2=0.919 4,校正R2=0.863 6,β-葡萄糖苷酶活性模型的决定系数R2= 0.930 5,校正R2=0.882 4。
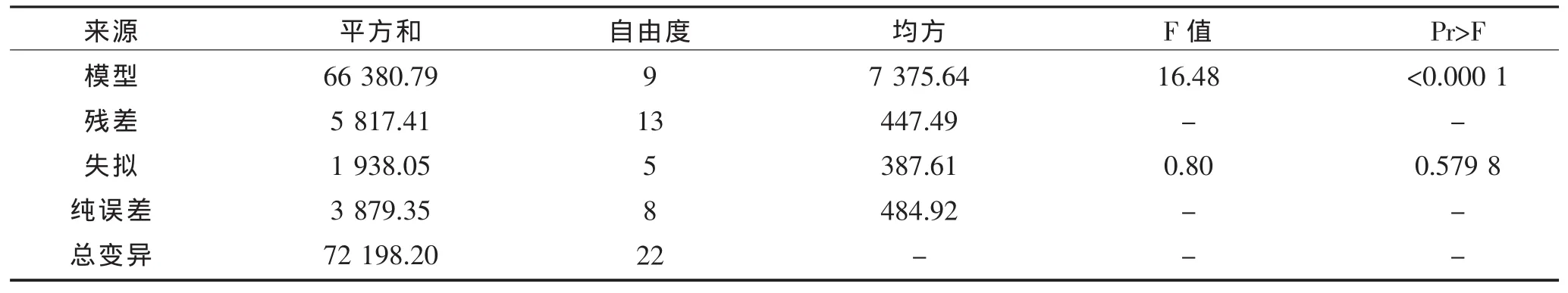
表3 蛋白酶活性方差分析Table 3 Variance analysis of protease activity
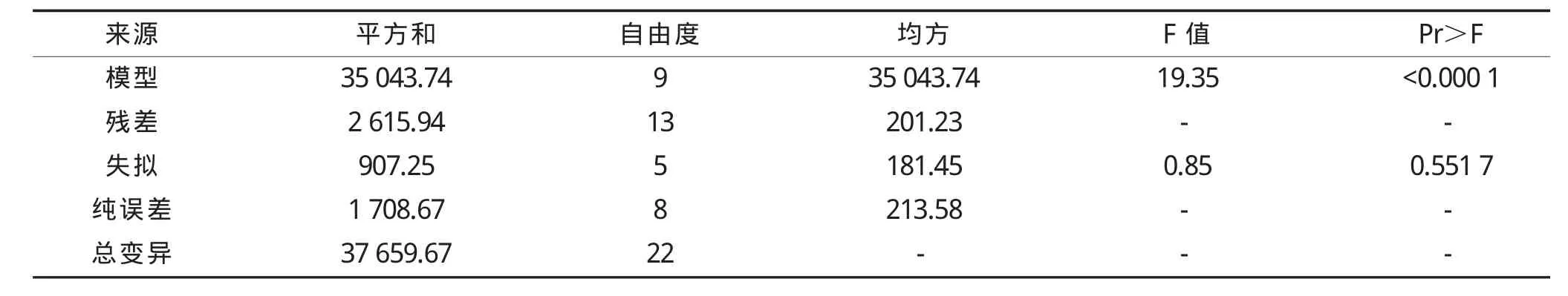
表4 β-葡萄糖苷酶活性方差分析Table 4 Variance analysis ofβ-glucosidase activity
由表3和表4可以看出蛋白酶活性模型的F值为16.48,P<0.000 1,模型极显著,失拟项的P值为0.579 8,大于0.05,说明该模型拟合程度较好,可用此模型对制曲工艺条件进行优化。影响蛋白酶酶活力的因素主次顺序依次为:制曲时间>制曲温度>接种量。
β-葡萄糖苷酶活性模型的F值为19.35,对应的P<0.000 1,说明模型极显著,失拟项的P值为0.551 7,大于0.05,说明该模型拟合程度较好,可用此模型对制曲工艺条件进行优化。影响β-葡萄糖苷酶活力因素主次顺序依次为:制曲温度>接种量>制曲时间。
为了得到最佳的制曲条件,分析蛋白酶和β-葡萄糖苷酶模型,进入 Design-Expert软件,选择Numerical选项,在Criteria选项下,将两种酶活性设置为maximize,得到最优的蛋白酶和β-葡萄糖苷酶活力的制曲条件:接种量为105.36个孢子·g-1大豆、制曲温度为26.48℃、制曲时间为4 d,理论的蛋白酶酶活力为 638.44 U·g-1,β-葡萄糖苷酶活力254.10 U·g-1。
3.3 验证实验
根据优化的结果,取最佳制曲条件为接种量105.4(约为2.5×105)个孢子·g-1大豆,制曲温度26.5℃,制曲时间4 d,进行三次验证实验,实验结果见表5。

表5 验证实验结果Table 5 Results of test plans
由表5可以看出,在最佳的制曲条件下,豆曲中蛋白酶和β-葡萄糖苷酶活力分别为623.17 U·g-1和245.24 U·g-1。
4 结论
(1)接种量、发酵温度和发酵时间对豆曲中蛋白酶和β-葡萄糖苷酶的活力影响显著(P<0.05)。
(2)采用三元二次正交旋转组合实验设计对制曲工艺进行优化,确定最佳的制曲工艺条件为接种量105.4个孢子·g-1大豆、制曲温度26.5℃、制曲时间4 d,在此条件下,β-葡萄糖苷酶酶活力为245.24 U·g-1,蛋白酶酶活力为623.17 U·g-1,为富含游离态异黄酮豆豉的制备奠定了基础。
[1]林晓华.曲霉型豆豉的发酵条件及挥发性成分的研究[D].南昌:南昌大学,2013.
[2]陈廷涛.发酵乳和豆豉中微生物菌群DGGE分析及益生作用研究[D].南昌:南昌大学,2013.
[3]蒋立文.发酵豆豉的研究进展[J].食品安全质量检测学报,2013,4(6):1803-1809.
[4]孙森,宋俊梅,曲静然.豆豉后发酵过程中微生物菌相的变化[J].中国食品添加剂,2008,87(2):139-143.
[5]张建华.曲霉型豆豉发酵机理及其功能性的研究[D].北京:中国农业大学,2003.
[6]钱丽丽,左锋,唐彦军.大豆异黄酮提取方法的研究进展[J].黑龙江八一农垦大学学报,2006,18(5):64-67.
[7]刘锦绣.豆豉混菌发酵及其功能成分的研究[D].泰安:山东农业大学,2013.
[8]齐斌,刘贤金.产大豆异黄酮β-葡萄糖苷酶菌株的筛选及酶学性质研究[J].食品科学,2007,28(8):290-293.
[9]李宁.影响大豆异黄酮抗氧化活性的物理因素及其生物学功效的研究[D].哈尔滨:东北农业大学,2008.
[10]刘勤华,马汉军.香辛料对酱鸭酱制工艺的影响究[J].河南科技学院学报:自然科学版,2014,42(1):12-15.
[11]缪素娜,邓少雅,谭丽贤,等.一种测定酱油曲中蛋白酶活力方法研究[J].中国酿造,2014,33(2):37-41.
[12]刘颖,刘婧美,王佳瑞,等.传统发酵豆酱高β-葡萄糖苷酶活力制曲工艺研究[J].食品与机械,2009,134(6):134-137.
[13]刘婧美.富含大豆异黄酮苷元营养型豆酱生产工艺研究[D].哈尔滨:哈尔滨商业大学,2010.
[14]杨丽娟,陆海燕,贝丽霞,等.响应面法优化副干酪乳杆菌增菌培养基[J].黑龙江八一农垦大学学报,2013,25(1):1-6.
