基于腐败微生物的低温肉制品货架期预测研究进展
2015-03-13贺旺林俞龙浩
贺旺林,俞龙浩
(黑龙江八一农垦大学食品学院,大庆 163319)
随着消费者逐渐追求天然、安全、高质的低温肉制品,所以高温肉制品逐渐被风味和营养齐全的低温肉制品取代。低温肉制品[1]是指在常压下通过蒸、煮、熏、烤等加工工艺,使肉加工熟制时介质的温度低于100℃、产品中心温度达到72~85℃,保持30min,成品的运输、贮藏、销售要求在低温(0~4℃)条件下的肉制品。低温肉制品经热加工后仍然残存着真菌孢子、细菌芽孢和部分耐热细菌,低温肉制品本身营养丰富、水分活度高,有利于微生物的生长和繁殖;再加上销售、运输和冷链贮藏条件的不完善,所以低温肉制品极易发生腐败变质。低温肉制品的货架期(shelf-life,SL)[2]是指低温肉制品贮藏在冷链条件下,能够保证安全和确保理想的感官、理化、微生物特性以及标签声明的营养值的一段时间。货架期预测技术克服了传统理化分析的滞后性,能够有效地控制肉类生产企业的经济损失以及为消费者的健康提供保障。由于低温肉制品货架期限制的主要因子是微生物,所以以计算机为基础,描述特定环境下各种微生物的消长情况,借此预测细菌的生长、残存、 死亡情况的预报微生物学(predictive microbiology,PM)[3]是低温肉制品货架期预测的主体部分。从特定产品出发,建立大量的微生物动力学生长模型后,通过计算机和配套软件,无需进行繁琐的分析检测就可快速地预知产品的货架期。
据估测,全球约25%的食物因发生微生物腐败而损失[4]。为了有效地控制损失,预报微生物学激起了全球研究者的兴趣,有关各种食品预测微生物学的研究报道呈增多的趋势,但主要集中在水产品和冷鲜肉方面,然而有关低温肉制品的预报微生物学研究鲜有报道。在预测微生物学探索过程中,国内外的研究者逐渐明确主要从以下三大方面进行研究:一是食品储藏过程中的菌相分析;二是结合环境因子,建立特定腐败微生物的动力学生长模型和开发适用的货架期预测软件[5];最后是对建立的生长模型和预测软件进行验证、改良。其中菌相分析是微生物预测技术的主体,所以菌相分析方面的研究内容较多。主要综述了货架期预测的主要技术及其应用现状,旨在为肉类生产企业提供借鉴和参考,进而使低温肉制品的生产销售链趋于健全和完善。
1 菌相分析
国内外许多研究结果表明,低温肉制品初始带菌量一般为102~103cfu·g-1[6-7],然而初始菌相中占有优势的微生物对产品的腐败变质不一定起主导作用。仅仅用细菌总数很难评估肉及其制品的腐败程度,如在低温条件下致使冷鲜肉腐败可接受的最高水平是107~109cfu·g-1,肉制品中约107~108cfu·g-1,微生物数量只是一个大概的范围[8-11],研究室研究红肠储藏过程中菌落总数的结果表明,菌落总数作为微生物腐败变质的准确评定标准是不可靠的。事实上,决定产品质量的微生物为腐败微生物,其数量增加或代谢产物的积累将会影响产品质量。因此,可以通过过程参数针对性地限制腐败微生物的生长,来控制产品的货架期。
确定特定腐败菌(specific spoilage organism,SSO)对预测和控制产品质量极为重要[12],通过分析肉制品在储藏过程中的菌相及其变化进而确定肉制品在特定环境下的SSO。目前鉴定SSO的方法分为两大类:一是传统的生理生化鉴定方法,二是新兴的生物学系统技术。
1.1 肉制品中主要腐败菌
食品中的菌相分析和确定特定产品中的SSO及其腐败限是微生物预测技术的前提条件,预测微生物学中的菌相分析最初主要集中在食品中的一些病原菌(单核增生李斯特菌、沙门氏菌、金黄色葡萄球菌等),随着研究的深入发现致病菌的数量在腐败的过程中并未得到大量增加,因此致病菌并不是引起食物腐败变质的根源。早在20世纪90年代中期研究发现水产品在捕获时存在多种微生物,但是只有很少一部分细菌参与腐败过程,这些适合生存繁殖并产生腐败臭味代谢产物的菌群,就是该产品的SSO[13]。
国外有关低温肉制品SSO的研究较早,研究发现储藏初期,SSO所占比率可能不高,但对环境的忍耐力强、生长繁殖快、腐败活性强。目前已经确定了真空包装低温肉制品中的SSO主要是乳酸菌[14-17]。近年来,国内有关肉制品SSO的研究报道呈增多的趋势,并且国内的研究结果与国外基本相近。综合国内外的研究结果,乳酸菌是真空包装低温肉制品中的优势腐败菌群,其他次要菌群主要有肠杆菌[16]和热杀索丝菌[18]等,其中次要菌群和特定产品的加工和储藏环境有关。有关特定腐败菌的腐败特征见表1。

表1 各种腐败菌细菌腐败特性Table 1 All kinds of corruption bacteria spectrum
1.2 传统菌相分析技术
特定腐败菌的常规鉴定方法是利用选择性培养基对其进行培养和分离纯化,通过观察菌株的菌落形态(大小、颜色、有无鞭毛等)、微观结构、生化特征(革兰氏染色、营养类型、最适生长条件等),然后查阅细菌鉴定手册(《伯杰氏细菌鉴定手册》、《常见细菌鉴定手册》等),基本上可以准确鉴定到属,并且有的研究者提出对产品货架期的预测研究,准确鉴定到属即可。这种传统的方法,对设备技术要求不高,常规实验室都能完成,所以该方法被广泛应用。但是生理生化鉴定不但耗时、操作繁琐而且主观因素影响较大,通常需要经验丰富的微生物专家才能得到准确鉴定,所以往往都是在生理生化鉴定的基础上结合16S rRNA分子生物学方法进行鉴定,得到的结果相对准确可靠。
16S rRNA技术在微生物鉴定的应用中极其广泛,几乎所有涉及到微生物的领域都有所应用。在肉品方面,Andrase等[23]利用16S rRNA鉴定发现伊比利亚火腿表面出现的“黑斑”是假单胞菌(Pseudomonas sp.)引起的;金鑫[24]对冷却猪肉储藏过程中的菌相分析也是利用了16S rRNA技术。利用传统的培养分离纯化技术结合16S rRNA技术在基因水平上的鉴定具有操作简单、成本低、结果相对可靠、重复性好等优点,因此应用较广泛。
1.3 新兴菌相分析技术
优势腐败菌在初始菌相中含量一般较少,利用传统分离培养的方法往往很难检出[25](<102cfu·g-1),新兴的菌相分析技术能够检出非培养微生物并克服传统方法检测限低的难题,于是分子诊断技术逐渐被用于SSO的鉴定。目前应用的新兴菌相分析技术主要有:DNA指纹技术中的聚合酶链式反应—变性梯度凝胶电泳(PCR-DGGE)、以生化理论为基础的微生物鉴定系统的应用和宏基因组学技术等。
1.3.1 PCR-DGGE技术
DGGE是根据DNA片段熔解性质的不同使其分离。以混合微生物的总DNA为模板进行扩增得到不同的DNA片段,经变性梯度凝胶电泳可以得到亮度差异的条带,对条带进行回收测序即可得到样品中微生物信息。目前PCR-DGGE技术在菌相分析鉴定方面已趋于成熟。起初PCR-DGGE技术主要应用到土壤中菌相分析研究,如Ma等[26]应用PCR-DGGE技术分析灌木的根系真菌,通过和土壤中菌群比对,发现了一株新的根系真菌。受此启发,后来该技术逐渐被用于肉制品中的菌相研究:胡萍等[19]利用16S rRNA结合DGGE技术研究了真空包装的切片火腿在4℃储藏条件下的主要腐败菌,最终成功确定优势腐败菌是清酒乳杆菌和弯曲乳杆菌;潘康成等[27]利用PCR-DGGE技术研究了肉鸡中肠道菌群的多样性。PCR-DGGE技术能够有效地、全面地分析生物圈内微生态的结构和功能,很好地指导人们认识微生物世界,更加有效地调控微生物的消长,进而有针对性地控制食品的腐败变质。将PCR-DGGE技术和其他分析技术进行综合分析菌相是总的发展趋势。
1.3.2 微生物鉴定系统
随着引起食物腐败变质微生物的不断增加,传统的利用单个试验鉴定微生物已不能满足需求,拥有巨大资料库的微生物鉴定系统逐渐取代传统鉴定方法。目前市场上以生化理论为基础的微生物鉴定系统平台产品主要有法国的手工API、半自动的ATB及全自动的 Vitek2Compact鉴定系统[28],美国的Biolog和Phoenix100鉴定系统。目前国内在微生物鉴定中用到的鉴定系统主要是API和Biolog。API鉴定系统是以微生物生化理论为基础,借助微生物信息编码技术,为微生物检验提供了简易、快捷、科学的鉴定程序,是一种全球金标准,涵盖了美国FDA的细菌鉴定标准、欧洲药典的细菌鉴定标准以及中国的GB 4789的内容。API鉴定系统具有系统化、操作简易和快速报道的优点,经过近30年的积累,拥有的菌种资料超过25 000种,相关的应用文献已超过1 500篇。国内近几年API鉴定系统在菌相分析上研究报道较多,如陈伟胜等[29]利用API鉴定系统研究了药品的微生物污染鉴定和溯源分析,戴小波等[30]将API和DL-96鉴定系统分析室间质控菌相结果进行对比,其中API得到的数据库比DL-96大,并且两者的准确率相近,姜英杰[31]对初步鉴定为肠杆菌的菌株,进行API 20E鉴定,并成功鉴定大肠杆菌[32]。法国梅里埃开发的鉴定系统平台具有广泛的认可性,但是目前国内的API鉴定系统主要集中在医学领域,有关食品中微生物菌相的研究应用鲜有报道,将API鉴定系统应用到低温肉制品货架期的预测研究具有研究意义。
Biolog鉴定系统是基于微生物利用的碳源或化学敏感物质进行鉴定的,由于该系统并非以经典的伯杰式细菌鉴定手册为基础建立的,所以在业界内颇具争议。Biolog鉴定系统一般和其他鉴定方法进行综合分析,因其要求专业化的操作人员,所以主要用于科研用途。如邢华铭等[33]利用PCR-DGGE和 Biolog技术比较土壤微生物多样性,其中Biolog得到的数据不稳定、反应的信息量和敏感度不及PCRDGGE技术,所以Biolog在菌相研究中应用较少,主要集中在有关碳源代谢机理方面的研究。
1.3.3 宏基因组学技术
1988年Handelsman等最初提出来的新名词宏基因组(metagenome)是指生物环境中全部微小生物遗传物质的总和[34]。其研究对象是环境样品中细菌界和真菌界基因组总和。宏基因组学[35](metagenomics)是一种新的研究宏基因组的方法,一般包括宏基因组文库的构建以及文库的筛选两部分研究内容,其中文库的构建是主体一般需要进行DNA的提取、克隆DNA到合适的载体、导入合适宿主细胞,筛选目的转化子等工作。宏基因组学最主要的应用是研究微生物群落结构及其功能。目前新兴的宏基因组学技术在海洋、土壤、农业、医学、新能源、环境保护和污染修复的研究等方面得到了广泛应用,随着宏基因组技术的成熟,国内陆续有研究者将宏基因组学技术应用到食品中的菌相分析的研究中,如醋醅中的菌相分析[36]和大曲酒中的菌相分析等[37]。虽然新兴的宏基因组学技术检出限低、稳定性好,但是目前最大的障碍是肉制品中动物基因组的干扰,所以目前并未应用到肉制品中的菌相分析再加上检测成本高。
随着微生物世界认识的不断深入以及微生物的自身进化变异,菌相分析对以16SRNA为基础的分子生物学新技术和产品化的微生物鉴定平台提出了更高的要求。分子生物学新技术由原先的保守区段发展到全基因组比对,随着Maldi-TOF(基质辅助激光解析飞行时间质谱仪)在蛋白质分析上的成熟,科学家们着眼于细菌核质体蛋白分析来鉴定菌株,细菌快速鉴定飞行质谱法是未来食品安全检测的发展趋势[38]。Maldi-TOF将会使低温肉制品特定腐败菌的确定更加趋于快速、准确,从而更加有效地监控食品腐败,为低温肉制品的货架期预测提供基础。
2 微生物生长模型研究概况
在菌相分析研究得到SSO丰度的基础上,国内外研究者建立了微生物的生长模型,根据变量的类型可将模型分为一级模型、二级(次级)模型和三级模型,初级模型反映的是微生物生长的对数和时间的关系,通过一级模型可以推断出SSO的初始菌数、迟滞期以及最大生长浓度等特征值;二级模型反映的是一级模型中的特征值受各种环境参数的变化情况;三级模型主要是将一级、二级模型结合起来,开发出来的可以直接面向用户的软件系统。
初级模型主要有Gompertz函数、Richard方程、Logistic方程、Schnute方程、Baranyi模型、Stannard方程等[39-40]。其中修正的Gompertz方程能够有效地描述微生物的生长,修正的Gompertz方程表达式如下:
lgN(t)=lgN0+lg(Nmax/N0)×exp{-exp[2.718μmax/lg(Nmax/N0)×(Lag-t)+1]}
式中:t为时间(d),N(t)为t时的菌数(cfu·g-1),Nmax、N0为最大和初始菌数(cfu·g-1),μmax为微生物生长的最大比生长速率(d-1),Lag为微生物生长的延滞时间(d)。
在一级模型建立的基础上,建立起来的二级模型主要有Arrhennius模型、Belehradek平方根模型[41-42]、概率模型和响应面模型[36]等。次级模型中Belehradek平方根模型是基于微生物生长速率的平方根与温度之间的线性关系[43],是Ratkowsk等根据微生物在不同温度条件下,生长速率或迟滞期倒数的平方根与温度之间存在的线性关系提出的经验模型。在食品中特定腐败菌生长动力学研究中被广泛地应用。Belehradek方程如下所示:
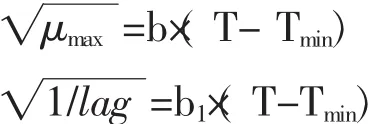
式中Tmin是一个假设的概念,指的是在此温度条件下微生物的代谢活动为0。
随着科学技术的更新发展,国外对食品货架期预测的研究,除了利用数学模型来预测食品的货架期外,更多的趋向于借助计算机来进行简便、快速地预测。在初级和次级模型的基础上建立起来的三级模型(应用软件),能够有效地反映在既定的环境条件下微生物的数量和环境之间的关系。
1983年开发的腐败菌生长数据库,拉开了预测微生物学的序幕。研究者和资金的大量投入,使得预测微生物学蓬勃发展。目前国外建立的预测模型有美国农业部开发的PMP(病原菌模型)、加拿大的MKES、英国的FMM[44],新西兰的TFI(温度函数积分模型)[45]和ComBase等软件,并且这些软件基本上都已经相当成熟。PMP是预测微生物学中比较简单的学习方法,研究的对象主要是一些病原菌,将病原菌的所处条件即食品的加工品质特性输入,便可得到病原菌的生长数据;其中Combase在线预测软件能够很好地预测某些特定产品的货架期。
与国外相比,国内的微生物预测技术起步相对较晚。目前国内建立的预测软件主要有中国水产研究所开发的FLSP(Fish Shelf Life Predictor),姜英杰建立的大肠杆菌和假单胞菌在冷却猪肉中的预测软件来预测猪肉的货架期[31]。但是这些软件都比较简单,涵盖和涉及到的SSO的范围比较局限。因此,开发出适应低温肉制品所处复杂条件的货架期预测软件,有待进一步探索研究,并对其进行验证和改良的必要。
3 模型的验证和改良
在国外成熟预测技术的基础上,尤其是那些可以进行在线预测的软件,一方面可以很好的引导国内研究者对低温肉制品预测软件的开发,另一方面也可对建立的预测软件进行验证。然而对建立的一级模型和二级模型的有效性进行评价,一般将模型的预测值和实验的实测值相比较,采用偏差因子(Bias factor,Bf)和准确因子(Accuracy factor,Af)来进行评价所建立模型的可靠性。Bf和Af并不能作为评判所建立模型的唯一指标,因为它们不能描述系统偏差,而采用预测值和观察值的直观对比图能够揭示系统偏差,所以在评判模型时进行两者的综合评判。Af和Bf如下式所示:
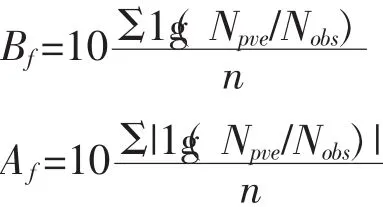
式中,Nobs是试验实际测得的菌落数,Npve是应用生长动力学模型预测得到的与Nobs同一时间的菌落数,n表示试验的次数。
针对前面建立的模型和预测软件进行验证,如果模型和软件的误差过大,则需要对其进行重新建模;如果模型的误差在可接受的范围内,将对建立的模型进行改良,使其预测的货架期的误差尽量最小。
4 货架期预测技术的意义及展望
低温肉制品货架期预测技术的研究使得肉类生产企业合理规划生产,有效地避免损失。随着越来越多的新兴技术和新理论引入货架期预测,今后PCRDGGE技术、全自动的微生物鉴定系统及宏基因组学等技术将会应用到低温肉制品的菌相分析研究;随着低温肉制品的微生物生长数据库的不断丰富,将会开发出越来越多的适合低温肉制品的预测软件,更加准确地预测低温肉制品的货架期。
[1]孙然然.乳酸菌及其代谢产物对低温切片火腿生物防腐作用的研究[D].石河子:石河子大学,2013.
[2]David K,Persis S.The stability and shelf-life of food[J].Food Trade Review,2002,72(9):541-541.
[3]李除夕.豆腐特定腐败菌研究及货架期预测模型建立[D].南京:南京农业大学,2008.
[4]Huisintveld J H.Microbial and biochemical spoilage of foods:an overview[J].International Journal of Food Microbiology,2006,33(1):1-18.
[5]Thomas A,Meekin M,Thomas R.Shelf life prediction:status and future possibilities[J].International Journal of Food Microbiology,2006,33(1):65-83.
[6]Christison C A D,Lindsay D,Holy von A.Microbiological survey of ready-to-eat foods and associated preparation surfaces in retail delicatessens,Johannesburg,South Africa[J].Food Control,2008,19(7):127-733.
[7]Naknean,Phisut.Improvement in Shelf Life and Safety of Pasteurized Palm Sap(Borassus flabellifer Linn.)by the Addition of Nisin[J].Journal of Food Safety,2013,33(4):515-525.
[8]胡萍.真空包装烟熏火腿切片特定腐败菌及靶向抑制研究[D].南京:南京农业大学,2008.
[9]Blixt Y,Borch E.Comparison of shelf life of vacuumpacked pork and beef[J].Meat Science,2002,60(4):371-378.
[10]Borch E,KantMuemans M L,Blixt Y.Bacterial Spoilage of meat Products and cured meat products[J].International Journal of Food Microbiology,1996,33(1):103-120.
[11]Liu F,Yang R Q,Li Y F.Correlations between growth parameters of spoilage microorganisms and shelf-life of pork stored under air and modified atmosphere at-2,4 and 10℃[J].Food Microbiology,2006,23(6):578-583.
[12]李琳,潘子强.水产品特定腐败菌的确定及生长模型建立研究进展[J].食品研究与开发,2011,32(6):152-156.
[13]Chris Bell.The Microbiological Safety and Quality of Food Volumes I and II[J].International Food Safety News,2000,9(7-8):12-13.
[14]Samelis J,Georgiadou K G.Themicrobial association of Greek taverna sausage stored at 4 and 10℃ in air,vacuum or 100% carbon dioxide,and its spoilage potential[J].Journal of Applied Microbiology,2000,88(1):58-68.
[15]Chenoll E,Macian M C,Elizaquivel P,et al.Lactic acid bacteria associated with vacuum-packed cooked meat product spoilage:population analysis by rDNA-based methods[J].Journal of Applied Microbiology,2007,102(1):498-508.
[16]Samelis J,Kakouril A,Remenltzis J.Evaluation of the extent and type of bacterial contamination at different stages of processing of cooked ham[J].Journal of Applied Microbiology,2000,84(4):649-660.
[17]Korkeala H J,Bjorkroth K J.Microbiological spoilage and contamination of vacuum-packaged cooked sausages[J].Journal of Food Protection,1997,60(6):724-731.
[18]Olga S,Papadopoulou,Efstathios Z,et al.Sensory and microbiological quality assessment of beef fillets using a portable electronic nose in tandem with support vector machine analysis[J].Food Research International,2013,50:241-249.
[19]吴伟伟.生猪屠宰过程中小肠结肠炎耶尔森氏菌的调查研究及预测模型研究[D].南京:南京农业大学,2007.
[20]李苗云.冷却猪肉中微生物生态分析及货架期预测模型的研究[D].南京:南京农业大学,2006.
[21]王宁.冷却羊肉腐败菌菌相变化及其控制技术研究[D].武汉:华中农业大学,2007.
[22]全拓.肉制品中主要微生物的检测与研究[D].重庆:西南大学,2012.
[23]Andrase T,Rudiger P,Drik B,et al.Influence of Myristoylation,Phosphorylation,and Deamidation on the Structural Behavior of the N-Terminus of the Catalytic Subunit of CAMP-Dependent Protein Kinas[J].Biochemistry,2001,40(1):225-231.
[24]金鑫.热鲜猪肉食用品质及其特定腐败菌预测模型的研究[D].南京:南京农业大学,2012.
[25]胡萍,徐兴莲.Lactobacillus sakei对真空包装切片火腿的特定腐败菌研究[J].肉类工业,2010(8):19-24.
[26]MaW K,Siciliano SD,Germida JJ.PCR-DGGEmethod for detecting arbuscular mycorrhizal fungi in cultivated soils[J].Soil Biology and Biochemistry,2005,37(9):1589-1597.
[27]潘康成,陈正礼,崔恒敏,等.利用ERIC-PCR和PCRDGGE技术分析喂服枯草芽孢杆菌肉鸡肠道菌群的多样性[J].动物营养学报,2010,22(4):985-991.
[28]李蕾蕾,任怡然,王素英.虾蛄在低温贮藏过程中的细菌菌相分析[J].食品工业科技,2013,34(18):331-335.
[29]陈伟盛,关倩明,朱荣峰,等.药品微生物限度检查中微生物污染的鉴定和溯源分析[J].药物分析杂志,2014(1):58-63.
[30]戴小波,曾朱君,许坚锋,等.API与DL-96微生物鉴定系统在鉴定室间质控菌株中的对比研究[J].国际检验医学杂志,2013,34(11):1437-1439.
[31]姜英杰.假单胞菌和大肠杆菌在冷却猪肉中生长预测模型的建立[D].南京:南京农业大学,2008.
[32]Gospvic R,Kreyenschmidt J,Brucken S,et al.Mathematicalmodelling for predicting the growth of Pseudomonas spp.in poultry under variable temperature conditions[J].International Journal of Food Microbiology,2008,127(3):290-297.
[33]刑华铭,杜海涛,张黎黎,等.PCR-DGGE与Biolog技术在土壤微生物多样性研究中的比较[J].农业开发与装备,2013,10:48-49.
[34]Handelsman J,Rondon M R,Brady S F,et al.Molecular biological accesses to the chemistry of unknown soil microbes:A new frontier for natural products[J].Chemistry Biology,1988(10):245-249.
[35]Henne A,Daniel R,Schmitz RA,et al.Construction of environmental DNA libraries in Escherichia coli and screening for the presence of genes conferring utilization of 4-hydroxybutyrate[J].Applied and Environmental Microbiology,1999,65:3901-3907.
[36]聂志强,韩玥,郑宇,等.宏基因组学技术分析传统食醋发酵过程微生物多样性[J].食品科学,2013,34(15):198-203.
[37]黄祖新.宏基因组学及其在大曲酒微生物研究中的应用[J].酿酒科技,2009(10):17-21.
[38]孙大庆,王颖,张东杰.抗微生物药物残留检测方法研究新进展[J].黑龙江八一农垦大学学报,2014,26(1):50-54.
[39]Laurence M,Derlinden E V,Jan FV.Comparing experimental design schemes in predictive food microbiology:Optimal parameter estimation of secondary models[J].Journal of Food Engineering,2012,112(3):119-133.
[40]Anat Bren,Yuval Hart.The last generation of bacterial growth in limiting nutrient[J].BMC System Biology,2013,7(1):1-9.
[41]Zwietering M H,Rombouts F M.Some aspects of modeling microbial quality of food[J].Food Control,1993,4(2):89-96.
[42]Ratkowsky D A,Lowry R K.Model for bacterial culture growth rate throughout the entire biokinetic temperature range[J].Journal of Bacteriology,1983,154(3):1222-1226.
[43]Davey K R.Applicability of the davey linear Arrhenius predictivemodel to the lag phase ofmicrobial growth[J].Journal of Application Bacteriology,1991,70(3):253-257.
[44]刘伟,刘卫东,应华清.预测微生物学及其在食品安全领域的应用[J].中国预防医学杂志,2007,8(4):511-512.
[45]Neil H A.Use of Predictivemicrobiology inmeat hygiene regulatory activity[J].International Journal of Food Microbiology,1997,36(2):103-109.
