羊口疮病毒B2L基因克隆及表达
2015-03-13赵文博李瑞航贺鹏亮李朋娅王梦醒杨春华于永忠崔玉东
赵文博,李瑞航,贺鹏亮,李朋娅,王梦醒,杨春华,于永忠,崔玉东
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
羊口疮是由羊口疮病毒引发的羊属动物接触性皮肤传染病,主要侵害2~5月龄羔羊,引起感染部位皮肤以及粘膜增生性病变[1]。临床上主要以感染动物的唇、鼻孔、口腔黏膜、乳房、阴部等部分皮肤形成红斑、水疱、脓疱、丘疹和疣状痂皮为特征,在感染羊群中采用抗病毒药物以及抗生素治疗,发病率依然能达到60%,死亡率达到24.7%,并且偶尔感染人的一种人畜共患传染病[2]。羊口疮病毒属于痘病毒科副痘病毒属,病毒粒子长250~280 nm,宽170~200 nm,呈椭圆形的线团样,且病毒粒子外有囊膜包裹,ORFV基因组长134~139 kb,病毒基因组中间是一个长的中心编码区,两头是相同的反向末端重复序列[3]。在ORFV全基因组中,第11号基因为B2L基因,位于病毒的保守区,基因全长1 137 bp,是一个完整的阅读框,编码蛋白质大小为42 kDa。该蛋白是病毒囊膜的成分之一,可刺激机体产生强烈的抗体反应,并刺激淋巴细胞释放[4-5]。然而,目前专门针对这种疾病的药物相对较少,国内外对于ORFV中蛋白质的抗原性研究较少,但已经肯定的是B2L蛋白是羊口疮病毒优势抗原之一[6]。因此实验借助PCR技术扩增B2L基因将其定向克隆至pET-30a,成功构建pET30a-B2L表达载体,为进一步研究羊口疮病毒,分析鉴定细胞表位以及基因工程疫苗的制作夯实基础。
1 材料与方法
1.1 材料
羊口疮病毒保存于黑龙江八一农垦大学生命技术学院分子病毒研究室。病毒DNA提取试剂盒、质粒提取试剂盒、胶回收试剂盒、pET-30a载体、PMD18-T载体、T4DNA连接酶、限制性内切酶HindⅢ和EcoRⅠ购自Promega公司;DNA Marker DL2000、LA Taq DNA聚合酶、氨苄青霉素购于TaKaRa宝生物工程(大连)有限公司。
1.2 引物
根据ORFV标准株NZ2,利用primer5设计一对引物,F:CCAAAGCTTTACATAATCGGGGTTGCC,R:CCGAATTCTCACACGATGGCCGTGACC,分别带有HindⅢ和EcoRⅠ酶切位点。预计PCR产物大小为1 137 bp,引物由上海生工生物工程技术服务有限公司合成。
1.3 PCR扩增B2L基因
25μLPCR体系中加入模板2μL,dNTPs 2μL,Taq酶 0.5μL,F引物 0.5μL,R引物 0.5μL,10× buffer2.5μL,ddH2O 17μL。PCR反应条件是在95℃,5min,95℃,30 s,52℃,30 s,72℃,30 s,进行30个循环,最后在72℃延伸10 min。取扩增产物2μL,0.8%琼脂糖凝胶电泳进行鉴定。
1.4 B2 L目的基因克隆
首先,将目的基因连接至T载体,连接体系混匀后瞬时离心,16℃水浴4 h或过夜。之后将连接产物做全量转化。事先将恒温水浴的温度调到42℃。于-70℃冰箱中取出一支100μL的感受态细胞,手心融化后立即放入冰盒中,把连接产物全量加入到100μL感受态细胞中,轻旋混匀,置冰上放置30 min,然后42℃热休克90 s,注意不要摇动,立即冰浴5 min,在超净工作台中向上述管中加入1 mL事先37℃水浴的LB液体培养基中,然后固定到空气摇床的弹簧架上37℃震荡1 h。瞬时放在离心机上3 000 rpm离心5min,将上清液留约200μL,其余倒掉,旋涡震荡混匀菌体,将其涂布于含有氨苄抗性的LB琼脂平板培养基上,用酒精灯烧过的玻璃涂布棒涂布均匀,37℃温箱中培养过夜,经HindⅢ和EcoRⅠ酶切鉴定阳性的质粒送至金唯智生物技术有限公司测序。
1.5 重组蛋白原核表达载体构建
取序列测定正确的克隆质粒用HindⅢ和EcoRⅠ内切酶酶切,与同样经过双酶切的pET-30a载体在T4连接酶作用下16℃连接4 h,构建原核表达载体,转化至BL21感受态细胞中,涂布平板,37℃过夜培养,挑单菌落培养,并进行质粒的提取,HindⅢ和EcoRⅠ双酶切鉴定和PCR检测,筛选阳性克隆。取经酶切鉴定为阳性的质粒送金唯智生物技术有限公司进行测序。
1.6 重组蛋白的诱导表达与纯化
测序结束后,别将测序正确的50μLpET30a-B2L重组菌接种于含Amp+的50mL的LB液体培养基中,37℃培养至OD600值为0.6时,取1 mL菌液于1.5 mLeppendorf管中,12 000 rpm离心1 min,倒掉上清。在剩余49 mL菌液中加入100 mM的诱导剂IPTG至终浓度为1 mM,继续剧烈振荡培养,在 3 h取1mL菌液,12 000 rpm离心1min,倒掉上清,在沉淀中加入90μL1×上样缓冲液和10μLDTT,吹打混匀,煮沸5min,取10μL进行SDS-PAGE。将重组菌按最佳诱导时间培养后,12 000 rpm离心1min,沉淀重悬后超声波破碎,12 000 rpm再离心5 min,分别取10μL上清和沉淀进行SDS-PAGE电泳,以确定重组菌是否为可溶性表达。重组蛋白N末端含有6个连续His残基,利用能与Ni2+结合的特性,应用MagneHisTM蛋白纯化系统进行纯化。
2 结果
2.1 PCR扩增B2L基因
利用特异性引物,以提取的羊口疮病毒DNA为模板进行PCR扩增,在1 137 bp处有一个条特异性亮带与预期大小相符(图1)。
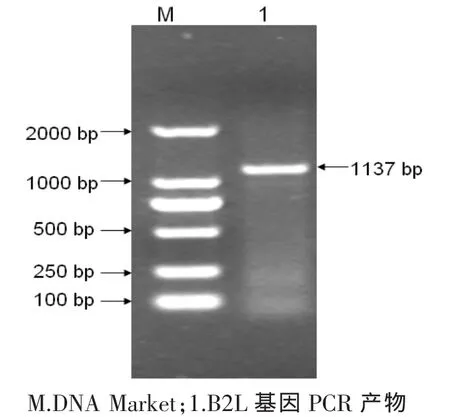
图1 PCR扩增B2L基因Fig.1 PCR amplification of B2L gene
2.2 重组质粒的鉴定
挑单菌落接种于LB液体培养基中37℃培养6个小时,然后提取质粒,以质粒为模板进行质粒PCR,得到的特异条带与预期相符(图2),以及用HindⅢ和EcoRⅠ双酶切,酶切得到的两个片段一个大约5 400 bp与pET-30a大小相等,另一个片段大约1 137 bp与目的片段大小相符(图3)。
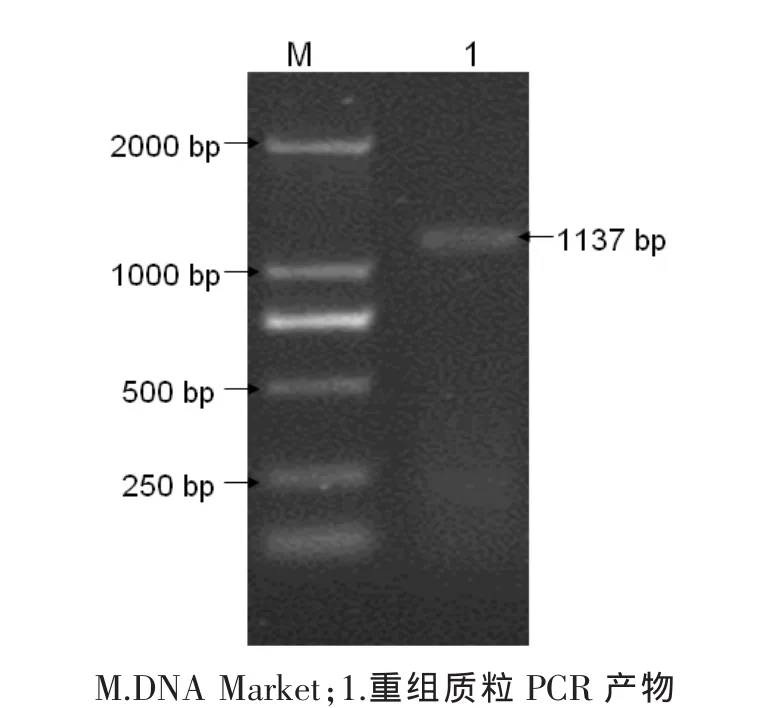
图2 pET30a-B2L重组质粒PCR鉴定Fig.2 PCR identification of recombination plasmid
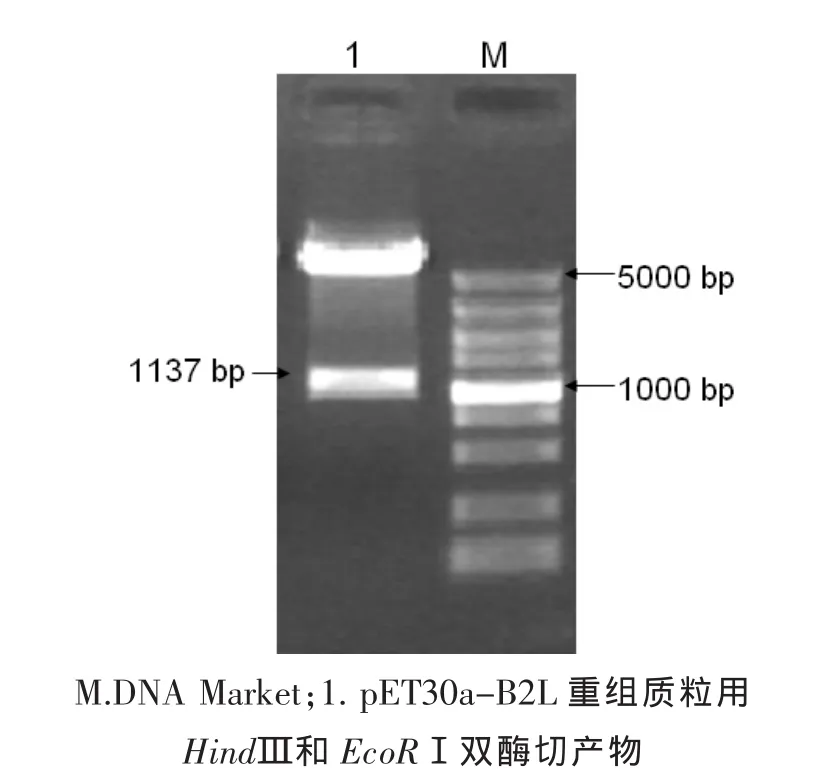
图3 重组质粒酶切鉴定结果Fig.3 Identification of recombination plasmid by restriction endonuclease digestion
2.3 B2L重组蛋白的表达与纯化
含重组表达质粒pET30a-B2L的大肠杆菌BL21(DE3)经IPTG诱导处理后,在进行SDS-PAGE分析。诱导菌分别在约49 kDa处有一大量表达的蛋白条带,与预期蛋白大小相符,通过镍颗粒纯化方法获得比较纯净重组蛋白(图4)。
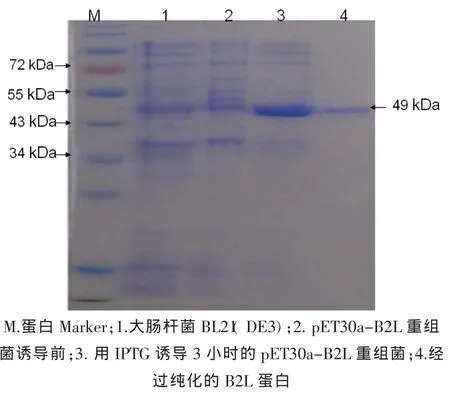
图4 重组B2L蛋白表达以及纯化Fig.4 Expression and purification of recombinant B2L protein
3 讨论
近年来,随着生活水平的不断提高,人们对肉类食品的需求越来越大,养殖业迅猛发展,养羊业也随之蓬勃发展,羊群数量大幅增加,饲养密度越来越大,但在养殖过程中,与之相关的一些疾病也越发明显,羊口疮就是一种常见的疾病,一旦染病,就给养殖户带来较大损失[7-10]。羊传染性脓疱病毒基因组是双链DNA,基因组全长130~150 kb,编码产生几十种蛋白。由于该病毒编码蛋白种类众多,因此对该病毒编码蛋白的研究并不十分全面。目前本病在国内外普遍存在,特别是我国的黑龙江、新疆、内蒙、西藏、青海、吉林等地近年频频爆发。给养羊业造成巨大经济损失。虽然ORFV感染机体后引起的免疫反应以细胞免疫为主,但是由ORFV011(B2L)基因编码产生的42 kDa蛋白因其所具有的良好的免疫原性仍然受到世界各国学者的高度重视[11]。实验通过分子生物学方法,成功构建原核表达载体并成功表达,为下一步制作单克隆抗体以及细胞表位筛选打下坚实基础。
[1]Tikkanen M K,McInnes C J,Mercer A A,et al.Recent isolates of parapoxvirus of Finnish reindeer(Rangifer tarandus tarandus) are closely related to bovine pseudocowpox virus[J].Journal of General Virology,2004,85(6):1413-1418.
[2]Hosamani M,Bhanuprakash V,Scagliarini A,et al.Comparative sequence analysis of major envelope protein gene(B2L)of Indian orf viruses isolated from sheep and goats[J].Veterinary Microbiology,2006,116(4):317-324.
[3]于永忠,谭强,赵文博,等.羊口疮病毒黑龙江省分离株的分离鉴定[J].中国预防兽医学报,2013,35(8):678-680.
[4]Sullivan JT,Mercer A A,Fleming SB,et al.Identification and characterization of an orf virus homologue of the vaccinia virus gene encoding the major envelope antigen p37K[J].Virology,1994,202(2):968-973.
[5]赵魁.羊传染性脓疱病毒重组 DNA疫苗的构建与实验免疫研究[D].长春:吉林大学畜牧兽医学院,2010.
[6]Zhao K,He W,Gao W,et al.Orf virus DNA vaccines expressing ORFV 011 and ORFV 059 chimeric protein enhances immunogenicity[J].Virology Journal,2011,8
(1):1-12.
[7]武迎红,张久华,王俊杰,等.羊传染性脓疱病的诊断和治疗[J].内蒙古民族大学学报:自然科学版,2014,29(6):673.
[8]Zhang K,Lu Z,Shang Y,et al.Diagnosis and phylogenetic analysis of Orf virus from goats in China:a case report[J].Virology Journal,2010,7(1):78.
[9]罗云.羊传染性脓疱病毒生物学特性及PCR检测方法的研究[D].呼和浩特:内蒙古农业大学,2006.
[10]于永忠,王欢,谭强,等.羊膜上皮细胞对于生长因子和ORFV的敏感性研究[J].黑龙江八一农垦大学学报,2013,25(4):40-44.
[11]于永忠,吴志军,朱战波,等.羊口疮病毒分子特征与免疫逃逸策略[J].病毒学报,2012,28(3):278-284.
