抗HER2靶向药物治疗胃癌的临床研究进展
2015-03-12冉文华综述审校
冉文华(综述),张 敬(审校)
(重庆市黔江中心医院普外科,重庆 409000)
抗HER2靶向药物治疗胃癌的临床研究进展
冉文华(综述),张敬※(审校)
(重庆市黔江中心医院普外科,重庆 409000)
摘要:胃癌是全球发病率第4位的恶性肿瘤,也是癌症相关死亡的重要原因之一。约20%的患者胃癌组织中可以检测到人表皮生长因子受体2(HER2)的表达。虽然HER2与胃癌预后的关系无确切定论,但曲妥珠单抗用于治疗HER2阳性晚期胃、胃食管结合部癌能显著延长该类患者的生存期、改善预后。越来越多的临床研究探索不同类型的抗HER2药物单独或与其他靶向药物、不同化疗方案联合治疗HER2阳性胃癌的效果,以寻找针对HER2阳性胃癌更优、更精确的治疗方案,实现胃癌治疗的个体化。
关键词:胃癌;胃食管结合部癌;人表皮生长因子受体2;靶向治疗;临床试验
胃癌是全球发病率居第4位的恶性肿瘤,也是癌症相关死亡的第二大原因,仅次于肺支气管癌,其在亚洲地区的发病率远高于其他地区[1]。国家癌症中心2014年最新发布的数据显示胃癌在中国男性和女性的恶性肿瘤发病构成比中分别居第2位和第4位,死亡构成比中居第3位和第2位[2]。胃癌已成为威胁生命值得重视的“健康杀手”。科技的进步使肿瘤的治疗多样化,各种抗肿瘤药物如5-氟尿嘧啶、卡培他滨、铂类、紫杉醇类、蒽环类等单独或联合使用的不同方案作为辅助治疗手段使胃癌患者的预后得到改善;但对于进展期胃癌,其5年生存率仅为5%~20%[3],是造成胃癌患者高病死率的主要原因。随着对胃癌分子生物学研究不断加深,在深入理解关键信号通路基础上对关键分子的靶向治疗被认是一种有前途的新手段。分子靶向药物以其不同于细胞毒药物的作用机制、疗效和不良反应成为近年来的研究焦点,其种类也越来越多,例如人表皮生长因子受体(epidermal growth factor receptor,EGFR)家族抗体、血管内皮细胞生长因子受体抗体、促凋亡因子硼替佐米、细胞周期抑制剂、基质金属蛋白酶抑制剂等。抗人表皮生长因子受体2(human epidermal growth factor 2,HER2)药物是研究较为成熟的一类,其有效性、安全性得到了广泛、深入的研究。现主要对常见抗HER2药物所涉及的Ⅱ、Ⅲ期临床试验进行综述。
1HER2简介
1.1EGFR家族及HER2分子HER2属于酪氨酸激酶受体EGFR家族,该家族受体包括HER1或ErbB1,也就是通常所指的EGFR、HER2或ErbB2、HER3或ErbB3、HER4或ErbB4,它们具有类似结构,即一个胞外配体结合域、一个短螺旋型的跨膜部分和一个细胞内酪氨酸激酶域。HER2蛋白的相对分子质量为185 000, 其编码基因位于17q21,是致癌基因CerbB2/neu的产物。HER2没有具体的配体,被称为孤儿受体,在没有配体存在时亦保持活化态构象,主要作为其他EGFR 家族成员的二聚化协同分子,其与EGFR、HER3、HER4的结合可增加该受体与相应配体的亲和性。HER2受体的同二聚化或与家族其他受体的异二聚化使酪氨酸激酶域磷酸化,进一步激活下游的磷脂酰肌醇3-激酶途径(磷脂酰肌醇-3-羟基酶/蛋白激酶B/雷帕霉素靶蛋白,磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白)、脂蛋白激酶途径(磷酸脂酶C-γ1/蛋白激酶C,磷脂酶C-γ/蛋白激酶C)和丝裂原活化蛋白激酶途径(单体小分子的调节性GTP酶/丝裂原活化的蛋白激酶激酶的激酶/丝裂原蛋白激酶激酶——丝裂原蛋白激酶,Ras/Raf/丝裂原活化蛋白激酶的激酶/丝裂原活化蛋白激酶),参与肿瘤细胞的增殖、分化、迁移、黏附、抗凋亡和细胞转化[4-7]。此外,HER2还可作为细胞周期蛋白D1和p53的转录因子,协助核定位[8]。国内外众多研究表明HER2的过表达与许多肿瘤,如乳腺癌、前列腺癌、肺癌、卵巢癌等的发生、发展及预后密切相关。
1.2HER2在胃癌中的表达及预后意义Fukushige等[9]首次在胃癌中发现HER2蛋白高表达,此后由于样本量大小、HER2检测方法及评判标准的影响,不同文献报道的HER2检测阳性率及其在胃癌中的预后价值不尽相同。此外,胃癌组织中HER2的表达因病理类型(Lauren分型)和解剖部位而异,较多研究得出肠型胃癌HER2表达阳性率明显高于弥漫型和混合型胃癌[10-13],胃食管结合部癌(gastro-esophageal junction cancer,GJC)和近端胃癌明显高于远端胃癌[12-14]。Jφrgensen等[15]总结大量关于胃癌的研究,对样本量多于100例进行HER2检测的文献荟萃分析,各研究HER2阳性率为4.4%~53.4%,17338例患者总体阳性率为17.9%(95%CI14.8~20.9) ;在将HER2结果与临床病理特征和预后进行相关性分析的39个研究中,15个研究证明HER2阳性提示不良的预后,另有13个研究结果显示HER2表达与淋巴结转移、浆膜浸润、TNM分期和远处转移等临床特点相关联,其余11个研究中HER2状态与上述两者均无统计学相关。Chua和 Merrett[11]的系统分析也得出HER2阴性的患者无病生存率和总生存率均优于HER2过表达的患者。Janjigian等[10]检测381例转移性胃、胃食管结合部腺癌,HER2阳性率为20%,且在肝转移患者中显著高于非肝转移患者(31%比11%,P=0.025),肠型胃癌高于弥散型和混合型(33%比8%,P<0.001);但该研究中同HER2阴性患者相比,HER2阳性患者的总生存期更长(11.4个月比13.9个月,P=0,047)。此研究与ToGA试验[16]得到的结论相同。
1.3HER2的临床应用及检测尽管HER2表达与胃癌预后的关系存在争议,但具有里程碑意义的ToGA研究[16]证明曲妥珠单抗能使HER2阳性的进展期胃癌患者获得生存获益。曲妥珠单抗联合化疗组较化疗组相比对治疗的总体反应率提高(47%比35%,P=0,00175),总生存期(13.8个月比11.1个月,HR=0.74,95%CI0.60~0.91)和无进展生存期(progression free survival,PFS)(6.7个月比5.5个月,HR=0.71,95%CI0.59~0.85)均显著延长,而两种方案的不良事件发生率差异无统计学意义。该研究使曲妥珠单抗在晚期胃癌的治疗中展现了振奋人心的效果,继欧洲药监局后美国食品药品管理局于2010年10月批准曲妥珠单抗用于HER2阳性晚期胃癌的一线治疗[17]。HER2检测是抗HER2靶向治疗的前提,肿瘤的异质性、不同检测方法、同种方法使用不同试剂等因素都可能导致检测结果不一致,使HER2阳性的判定缺乏一个统一和公认的标准,这也是存在于HER2在胃癌的应用研究中一个较为重要的问题。Rüschoff等[18]借鉴乳腺癌HER2扩增的检测标准,制订了用于胃、GJC HER2检测的实践指南,从标本获取、材料使用、操作步骤、评判标准、质控等各个方面进行规范,以确保HER2检测的可重复性。
2抗HER2靶向药物的临床研究进展
2.1曲妥珠单抗曲妥珠单抗是研究得最多的抗HER2药物,其作用靶点为HER2的胞外结构域,与HER2结合后阻止二聚体的形成,进而阻断下游信号通路的活化。ToGA研究已经证实曲妥珠单抗联合卡培他滨/氟尿嘧啶+顺铂能改善晚期胃癌患者的预后[16],之后罗氏公司又设计了一项Ⅲ期临床试验(NCT01450696/HELOISE),通过对照使用不同剂量的曲妥珠单抗,寻求最低有效浓度。HELOISE拟纳入400例HER2阳性的晚期胃癌、GJC患者随机分为两组,曲妥珠单抗的起始剂量仍为8 mg/kg,其中一组维持剂量为每3周使用6 mg/kg, 另一组每3周使用10 mg/kg;试验的首要终点是总生存期、总缓解期。期望能通过该研究找到曲妥珠单抗的最优使用剂量和方法,提高临床获益。继ToGA后一些学者开始研究曲妥珠单抗与其他化疗方案联合的抗肿瘤效果(表1),以寻求治疗HER2阳性胃癌的最佳治疗方案。曲妥珠单抗与卡培他滨+奥沙利铂(CapeOx)联合是研究的热点之一,北京大学(NCT01364493)、中山大学(NCT02004769)和解放军总医院(NCT02250209)都正在进行该项研究。关于曲妥珠单抗的多数临床试验研究对象均为Ⅳ期患者,少数试验研究其用于可手术患者辅助治疗的有效性。NCT01472029对局部晚期胃癌患者使用曲妥珠单抗联合氟尿嘧啶、亚叶酸和多西紫杉醇术前行4周期新辅助化疗,研究曲妥珠单抗是否有助于提高该类患者的完全病理缓解率和R0切除率;解放军总医院进行的NCT02250209试验对行D2根治术的pⅢ期患者行曲妥珠单抗+CapeOx辅助治疗,主要研究这部分患者的3年无病生存情况。
2.2帕妥珠单抗帕妥珠单抗与曲妥珠单抗均作用于HER2的胞外结构域。罗氏公司开展的关于帕妥珠单抗的随机对照Ⅲ期临床试验(NCT01774786)和ToGA类似,研究在卡培他滨/氟尿嘧啶+顺铂的基础上联合帕妥珠单抗能否给患者带来生存上的获益(表1)。虽然帕妥珠单抗和曲妥珠单抗的结合靶点均为HER2的胞外部分,但两者所结合的子域不同,因此推断它们在抗HER2机制上可能互补,具有协同作用[19-20]。这两种单克隆抗体的联合使用在转移性乳腺癌的治疗中取得显著疗效,其加上多西紫杉醇已作为转移性乳腺癌的一线治疗方案,且在胃癌的小鼠模型中也得到了同样的效果[21-22]。NCT02205047(INNOVATION)和NCT01461057两项研究将曲妥珠单抗和帕妥珠单抗同时应用于进展期胃癌、GJC,探索两种抗体联合应用于胃癌的抗肿瘤效应(表1)。

表1 关于曲妥珠单抗和帕妥珠单抗联合不同治疗方案的临床研究
曲妥珠单抗*:首剂8 mg/kg,维持剂量6 mg/kg,每3周1次;曲妥珠单抗#:首剂8 mg/kg,维持剂量10 mg/kg;帕妥珠单抗*:负荷剂量840 mg,此后每3周420 mg;帕妥珠单抗#:每3周840 mg;HER2:人表皮生长因子受体2;GJC:胃食管结合部癌;PFS:无进展生存期
INNOVATION将患者按1∶2∶2分为单独化疗组、化疗联合曲妥珠单抗组、化疗联合曲妥珠单抗及帕妥珠单抗组,通过三组患者比较可以明确曲妥珠单抗与帕妥珠单抗联合是否能增强对肿瘤组织的杀伤作用、提高可局部进展期胃癌、GJC患者的完全病理缓解率。
2.3拉帕替尼拉帕替尼是一种口服小分子EGFR、HER2双向胞内酪氨酸激酶可逆性抑制剂,其与曲妥珠单抗或帕妥珠单抗的抗肿瘤机制不同,且有着更泛的抗EGFR家族的作用,对于经曲妥珠单抗或帕妥珠单抗治疗失败的晚期胃癌患者是一个很好的二线药物选择。目前关于拉帕替尼与各种化疗方案联合治疗晚期胃癌、GJC的临床研究较多(表2)。葛兰素史克公司目前所进行的两项研究拉帕替尼的多中心随机对照试验(NCT00486954/TyTAN、NCT00680901/LOGiC)已基本完成(表2)。TyTAN试验分为两部分:第一部分预试验的目的是确定拉帕替尼的最优剂量;第二部分随机试验的261例亚裔受试者接受紫杉醇单药化疗,连续3周每周80 mg/m2,休息1周后开始下一疗程,其中132例同时给予拉帕替尼1500 mg/d口服与单用紫杉醇化疗进行对照。在这项Ⅲ期开放性对照试验中,紫杉醇加或不加拉帕替尼作为HER2扩增阳性晚期胃癌的二线治疗方案,在这之前患者因为复发转移已接受过包括5-氟尿嘧啶和(或)铂类在内的药物化疗但肿瘤继续进展。虽然紫杉醇加拉帕替尼组的总体反应率同单用紫杉醇组相比有所提高(P<0.001),但中位总生存期并无明显延长(11.0 个月比8.9个月,P=0.1044)[23]。LOGiC试验采取随机、双盲的方法研究在CapeOx化疗的基础上,给予拉帕替尼能否延长转移性胃、食管癌的生存期。183个研究中心的545例患者中分别有272、273例受试者随机分入接受CapeOx方案化疗加上拉帕替尼或安慰剂治疗。该研究的首要研究终点为总生存期,其次还有无病生存期、达到临床完全缓解和部分缓解的患者数、药物起效时间及有效时间等。从目前该研究所得随访数据分析,拉帕替尼组与安慰剂组患者的总生存期的差异无统计学意义(P=0.3244),但从欧洲癌症研究与治疗组织生活质量评分问卷量表来看,拉帕替尼组的患者有着更高的生活质量[24]。
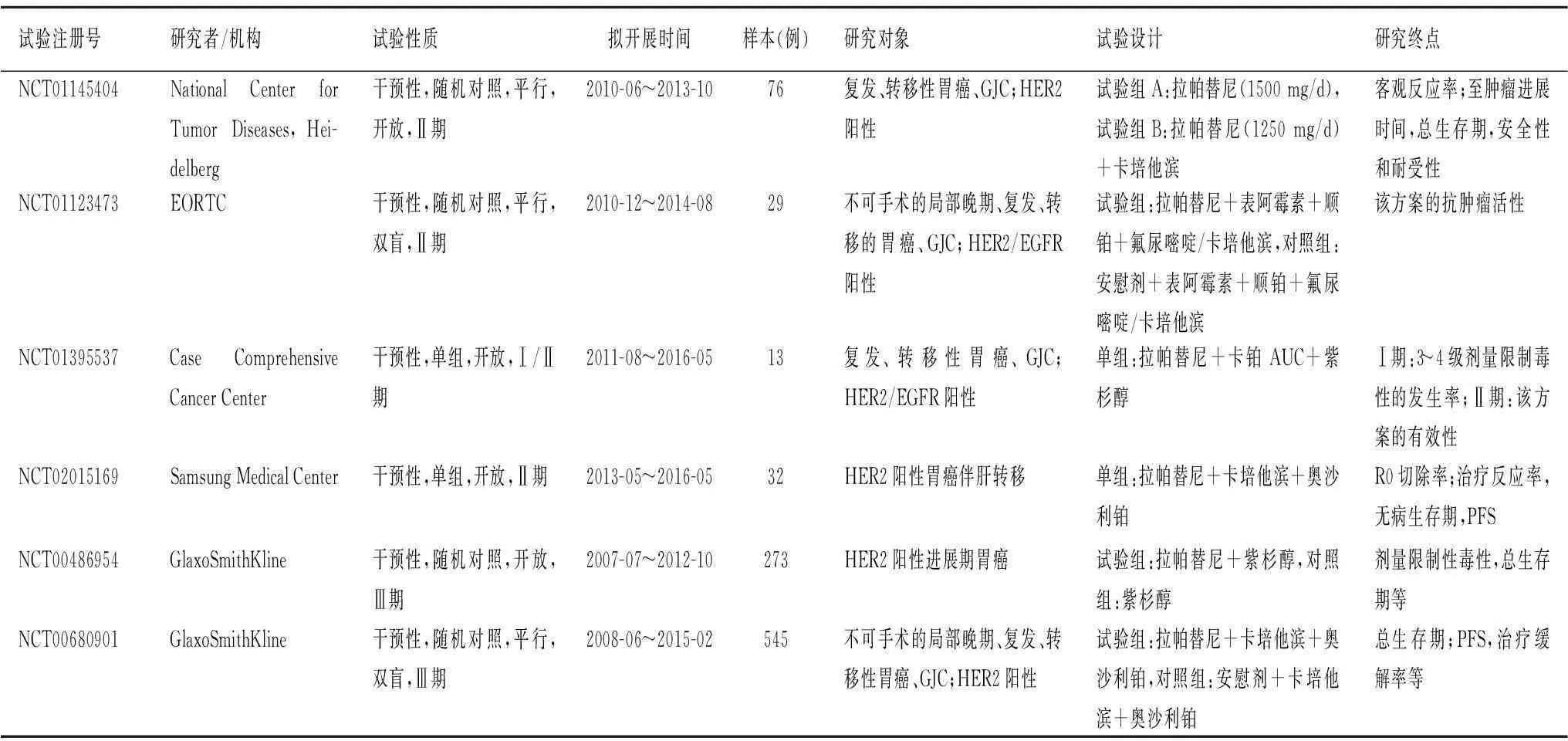
表2 关于拉帕替尼的临床应用研究
GJC:胃食管结合部癌;HER2:人表皮生长因子受体2;PFS:无进展生存期
2.4其他T-DM1(Kadcyla,ado-trastuzumab emtansine)是一种抗体药物偶联物,含巯基的抗微管细胞毒药物美登醇(Maytansinol)通过特殊的连接分子结合于曲妥珠单抗,通过曲妥珠单抗与HER2的结合将细胞毒药物带至靶细胞,受体介导的内化使抗微管细胞毒药物在细胞内释放发挥作用,其在胃癌的细胞株和小鼠模型上都表现出很好的抗肿瘤效应[25]。NCT01641939是一项随机对照的开放性Ⅲ期临床试验,研究和比较T-DM1和紫杉醇在经一线方案治疗失败的HER2阳性晚期胃癌、GJC患者中的有效性和安全性,其中一线治疗必须包括以铂类和氟尿嘧啶为基础的化疗方案,抗HER2靶向治疗为非必要条件。研究分为两个阶段,通过第一阶段确定第二阶段T-DM1的使用方法和剂量,其试验设计如图1所示。NCT01702558旨在研究T-DM1单用与联合卡培他滨在晚期乳腺癌、胃癌患者中的疗效,而这部分患者必须已经过化疗和曲妥珠单抗(分开或联合使用)治疗且病情出现进展。此外,还有学者研究泛表皮生长因子受体酪氨酸激酶抑制剂阿法替尼与曲妥珠单抗联合治疗HER2阳性胃食管癌的效果(NCT01522768),目前该研究还正在进行中,尚无相关结果的正式文献发表。有研究者在HER2阳性的乳腺癌、胃癌、卵巢癌、胰腺癌等肿瘤患者中进行的一项Ⅰ期临床试验(NCT01384253),利用曲妥珠单抗的靶向性携带放射性α粒子铅212(212Pb-TCMC-Trastuzumab)到达肿瘤部位,实现靶向放射免疫治疗,将抗HER2靶向治疗推向了另一个高度;当然,该药物进入临床使用之前,其有效性、毒性、优化剂量均必须经过充分的循证医学论证。
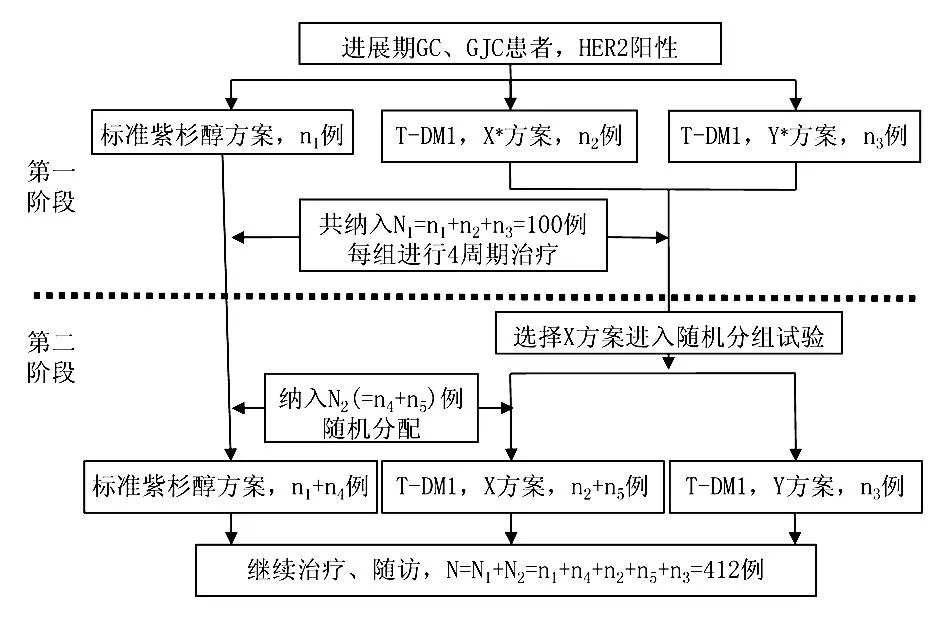
图1NCT01641939试验设计路线图X和Y为以下两种方案中一种:3.6 mg/kg,每3周1次;2.4 mg/kg,每周1次。其中X为经过第一阶段试验后所选择的较优剂量方案; GC:胃癌;GJC:胃食管结合部癌
3小结
虽然胃癌中针对HER2的靶向治疗取得了巨大进展,但仍然存在诸多值得深入和提升的地方。现有的关于HER2靶向药物用于治疗胃癌大多限于局部晚期和转移复发患者,常常作为晚期患者的解救治疗,极少数临床试验以可手术患者为对象进行辅助治疗研究。再者,分子靶向药物价格昂贵,需要更多的临床研究探索其有效性、安全性和优化的使用方法,为实现其在胃癌中的规范化、个体化治疗提供令人信服的循证医学证据,提高医药卫生/经济比值,改善胃癌患者的生存期和生活质量。
参考文献
[1]Jemal A,Bray F,Center MM,etal.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014,23(1):1-10.
[3]Piazuelo MB,Correa P.Gastric cancer:Overview[J].Colomb Med,2013,44(3):192-201.
[4]Shepard HM,Brdlik CM,Schreiber H.Signal integration:a framework for understanding the efficacy of therapeutics targeting the human EGFR family[J].J Clin Invest,2008,118(11):3574-3581.
[5]Meric-Bernstam F,Hung MC.Advances in targeting human epidermal growth factor receptor-2 signaling for cancer therapy[J].Clin Cancer Res,2006,12(21):6326-6330.
[6]Holbro T,Civenni G,Hynes NE.The ErbB receptors and their role in cancer progression[J].Exp Cell Res,2003,284(1):99-110.
[7]Korkaya H,Paulson A,Iovino F,etal.HER2 regulates the mammary stem/progenitor cell population driving tumorigenesis and inva-sion[J].Oncogene,2008,27(47):6120-6130.
[8]Lin SY,Makino K,Xia W,etal.Nuclear localization of EGF receptor and its potential new role as a transcription factor[J].Nat Cell Biol,2001,3(9):802-808.
[9]Fukushige SI,Matsubara KI,Yoshida M,etal.Localization of a novel v-erbB-related gene,c-erbB-2,on human chromosome 17 and its amplification in a gastric cancer cell line[J].Mol Cell Biol,1986,6(3):955-958.
[10]Janjigian YY,Werner D,Pauligk C,etal.Prognosis of metastatic gastric and gastroesophageal junction cancer by HER2 status:a European and USA International collaborative analysis[J].Ann Onco,2012,23(10):2656-2662.
[11]Chua TC,Merrett ND.Clinicopathologic factors associated with HER2-positive gastric cancer and its impact on survival outcomes--a systematic review[J].Int J Cancer,2012,130(12):2845-2856.
[12]Huang D,Lu N,Fan Q,etal.HER2 Status in Gastric and Gastroesophageal Junction Cancer Assessed by Local and Central Laboratories:Chinese Results of the HER-EAGLE Study[J].PLoS One,2013,8(11):e80290.
[13]Bang YJ,Chung HC,Xu JM,etal.Pathological features of advanced gastric cancer:relationship to human epidermal growth factor receptor 2 positivity in the global screening programme of the ToGA trial[J].J Clin Oncol,2009,27 Suppl 15:Abstr4556.
[14]Gravalos C,Jimeno A.HER2 in gastric cancer:a new prognostic factor and a novel therapeutic target[J].Ann Oncol,2008,19(9):1523-1529.
[15]Jφrgensen JT,Hersom M.HER2 as a Prognostic Marker in Gastric Cancer- A Systematic Analysis of Data from the Literature[J].J Cancer,2012,3:137-144.
[16]Bang YJ,Van Cutsem E,Feyereislova A,etal.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA):a phase 3,open-label,randomised controlled trial[J].Lancet,2010,376(9742):687-697.
[17]U.S.Food and Drug Administration.Approval History BLA 103792[EB/OL].[2010-10-20]http://www.accessdata.fda.gov/drugsatfda_docs/label/2010/103792s5256lbl.pdf.
[18]Rüschoff J,Hanna W,Bilous M,etal.HER2 testing in gastric cancer:a practical approach[J].Mod Pathol,2012,25(5):637-650.
[19]Cho HS,Mason K,Ramyar KX,etal.Structure of the extracellular region of HER2 alone and in complex with the Herceptin Fab[J].Nature,2003,421(6924):756-760.
[20]Franklin MC,Carey KD,Vajdos FF,etal.Insights into ErbB signaling from the structure of the ErbB2-pertuzumab complex[J].Cancer Cell,2004,5(4):317-328.
[21]Baselga J,Cortés J,Kim SB,etal.Pertuzumab plus trastuzumab plus docetaxel for metastatic breast cancer[J].N Engl J Med,2012,366(2):109-119.
[22]Yamashita-Kashima Y,Iijima S,Yorozu K,etal.Pertuzumab in combination with trastuzumab shows significantly enhanced antitumor activity in HER2-positive human gastric cancer xenograft models[J].Clin Cancer Res,2011,17(15):5060-5070.
[23]Satoh T,Bang Y,Wang J,etal.Interim safety analysis from TYTAN:A phase Ⅲ Asian study of lapatinib in combination with paclitaxel as second-line therapy in gastric cancer[J].J Clin Oncol,2010,28 Suppl:Abstract 4057.
[24]Glaxo SmithKline.LOGiC-Lapatinib optimization study in ErbB2 (HER2) positive gastric cancer:A phase Ⅲ global,blinded study designed to evaluate clinical endpoints and safety of chemotherapy plus lapatinib[EB/OL].[2014-04-16]URL:http://clinicaltrials.gov/ct2/show/results/NCT00680901 term=NCT00680901&rank=1§=X01256#all.
[25]Barok M,Tanner M,K ninki K,etal.Trastuzumab-DM1 is highly effective in preclinical models of HER2-positive gastric cancer[J].Cancer Lett,2011,306(2):171-179.
Advances in Clinical Research of Targeted Therapy for HER2 Positive Gastric Cancer
RANWen-hua,ZHANGJing.
(DepartmentofGeneralSurgery,QianjiangCentralHospital,Chongqing409000,China)
Abstract:Gastric cancer(GC) ranks the forth in incidence rate among malignant tumors in the world,and it is one of the main causes of cancer-related death.Expression of human epidermal receptor 2(HER2) can be found in 20% of the cancer tissues in GC patients.By now,although no definite conclusion has been achieved about the relationship between HER2 status and GC prognosis,trastuzumab has shown significant effect on HER2-positive GC and gastro-esophageal junction cancer,that it can prolong the survival time of the patients and improve prognosis.Dozens of clinical trials has been exploring the anti-tumor efficacies of different anti-HER2 target drugs,either single application or combined application with other regimens,in order to find more optimal,precise and individualized treatment plans for patients with HER2-positive GC and GJC.
Key words:Stomach carcinoma; Gastro-esophageal junction cancer; Human epidermal receptor 2; Targeted therapy; Clinical trials
收稿日期:2013-08-16修回日期:2014-12-26编辑:相丹峰
doi:10.3969/j.issn.1006-2084.2015.10.017
中图分类号:R735.2
文献标识码:A
文章编号:1006-2084(2015)10-1773-05
