缺血后处理对梗阻性黄疸肾缺血再灌注损伤大鼠血清TNF-α水平的影响
2015-03-11李毅张雪霞贾英斌李文华张百萌中山大学附属第五医院广东珠海519000
李毅,张雪霞,贾英斌,李文华,张百萌(中山大学附属第五医院,广东珠海519000)
缺血后处理对梗阻性黄疸肾缺血再灌注损伤大鼠血清TNF-α水平的影响
李毅,张雪霞,贾英斌,李文华,张百萌(中山大学附属第五医院,广东珠海519000)
摘要:目的探讨缺血后处理对梗阻性黄疸肾缺血再灌注损伤大鼠血清TNF-α水平的影响。方法60只SD大鼠随机分成梗阻性黄疸对照组(S组)、梗阻性黄疸肾缺血再灌注组(I/R组)、梗阻性黄疸肾缺血再灌注缺血后处理组(IPO组),每组20只。根据缺血后再灌注时间点各组又分为再灌注0 h(T0)、1 h(T1)、3 h(T2)、6 h(T3)4个亚组各5例。检测再灌注后的各时点血清中尿素氮(BUN)、肌酐(Cr)、TNF-α水平,观察肾组织的病理改变。结果 I/R组和IPO组血清BUN、Cr、TNF-α水平均高于S组(P均<0.05), IPO组T2时间点血清Cr、BUN、TNF-α水平均低于I/R组(P均<0.05)。结论 缺血后处理可以下调大鼠血清TNF-α水平,从而减轻梗阻性黄疸大鼠肾缺血再灌注损伤,其机制可能与抑制炎症反应有关。
关键词:梗阻性黄疸;缺血后处理;缺血再灌注损伤;肾脏;肿瘤坏死因子-α;大鼠
缺血后处理是指以反复短暂的再灌注、停灌注的方式在器官、组织缺血后恢复血流前进行处理的方法,可减轻组织的缺血再灌注损伤[1,2]。肾脏对缺血缺氧较敏感,而在梗阻性黄疸(OJ)中表现得更明显[3],然而对于缺血后处理对OJ肾缺血再灌注损伤的影响尚无定论。TNF-α是重要的炎症促进因子,对缺血再灌注损伤有重要的影响[4]。2013年1~8月,我们研究缺血后处理对OJ大鼠肾缺血再灌注后大鼠TNF-α表达的影响,并探讨其对肾脏作用的可能机制。
1材料与方法
1.1材料选取体质量150~200 g清洁级成年雄性SD大鼠60只(购自中山大学北校区动物实验中心),SPF级,雄性,许可证号:SCXK(粤)2011-0029。随机分成OJ对照组(S组)、OJ肾缺血再灌注组(I/R组)、OJ肾缺血再灌注缺血后处理组(IPO组),每组20只。根据缺血后再灌注时间点各组又分为缺血再灌注0 h(T0)、1 h(T1)、3 h(T2)、6 h(T3)4个亚组各5只。HITACH7170S全自动生化分析仪TNF-α试剂盒购自武汉博士德生物工程有限公司。
1.2模型制备①OJ模型:各组均参照Bostanci方法[5]建立OJ模型,大鼠术前禁食12 h、禁水2 h。腹腔注射1%戊巴比妥钠(30 mg/kg)麻醉后,取剑突下正中切口约2 cm进腹,游离出胆总管后结扎并切断,缝合切口。②肾缺血再灌注损伤模型:分组处理7 d后,I/R组、IPO组取剑突下正中切口约3 cm进腹,分别暴露双侧肾动脉,用无损伤动脉夹夹闭阻断45 min后取下血管夹,恢复肾脏供血。肾脏表面颜色变灰,质地变软为肾缺血标准,肾脏表面颜色恢复红润为再灌注成功标准。S组仅行开腹,游离出双侧肾脏,分离双侧肾蒂不夹闭,暴露45 min不作肾缺血处理;IPO组采用Tan等[6]的方法:夹闭阻断肾动脉45 min,再灌注10 s,缺血10 s,反复3次后,完全恢复肾血流。
1.3标本采集及结果判定各组大鼠在常温下分别于T0、T1、T2、T34个时间点自大鼠下腔静脉采血,3 000 r/min离心10 min并取血清。处死大鼠,取左肾组织并分成两半(沿矢状面剖开),一半用甲醛溶液固定石蜡包埋行病理切片;另一半肾组织置-80 ℃冰箱保存。采用HITACH 7170S全自动生化分析仪检测血清BUN、Cr水平,全过程按照试剂盒说明书进行。血清中TNF-α蛋白水平采用双抗体夹心酶联免疫吸附法测定, 具体操作过程严格按照试剂盒说明书进行。
2结果
2.1OJ模型大鼠一般情况OJ大鼠麻醉1~2 h后清醒,胆总管结扎24 h后小便颜色加深,48 h后耳尖及鼠尾出现黄染。随胆道梗阻时间的延长,黄疸加深明显。
2.2各组组织学改变光镜观察T2时间点肾组织变化情况见图1。
2.3各组血清生化指标变化见表1。
3讨论
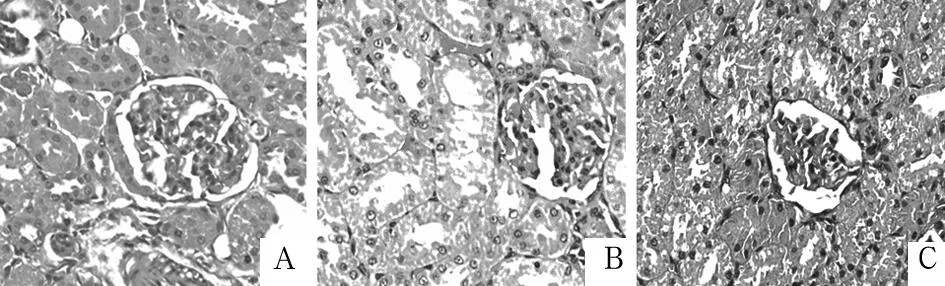
注:A: S组肾小球血管少许扩张,肾小管形态变化不明显;B: I/R组肾小球血管扩张、充血,肾小管上皮细胞浊肿、排列紊乱;C: IPO组与I/R组比较,肾小球血管扩张明显减轻,肾小管上皮细胞形态及排列趋于正常。
图1 T2时间点三组大鼠的肾组织病理改变(HE×200)
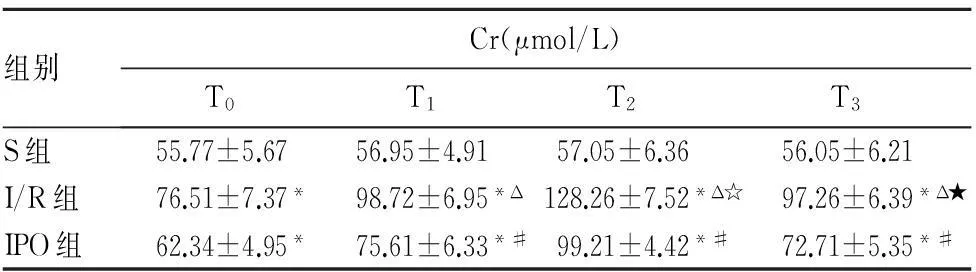
组别Cr(μmol/L)T0T1T2T3S组55.77±5.6756.95±4.9157.05±6.3656.05±6.21I/R组76.51±7.37*98.72±6.95*Δ128.26±7.52*Δ☆97.26±6.39*Δ★IPO组62.34±4.95*75.61±6.33*#99.21±4.42*#72.71±5.35*#
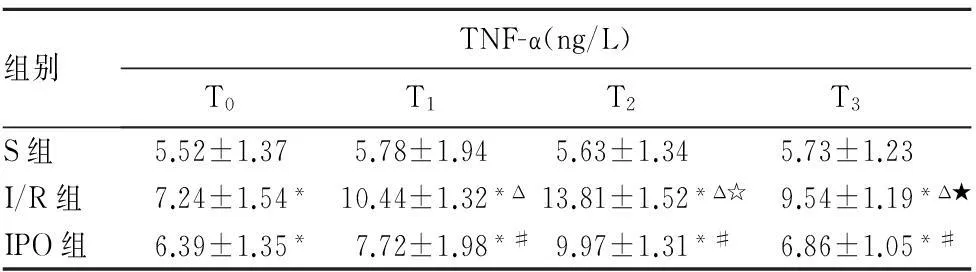
组别TNF-α(ng/L)T0T1T2T3S组5.52±1.375.78±1.945.63±1.345.73±1.23I/R组7.24±1.54*10.44±1.32*Δ13.81±1.52*Δ☆9.54±1.19*Δ★IPO组6.39±1.35*7.72±1.98*#9.97±1.31*#6.86±1.05*#
注:与S组比较,*P<0.05;与I/R组比较,#P<0.05;组内与T0比较,ΔP<0.05;组内与T1比较,☆P<0.05;组内与T2比较,★P<0.05。
急性肾衰竭(ARF)是OJ在围术期患者中的常见并发症[7]。OJ术后ARF发生的基础一般认为与OJ血容量的减少使肾脏处于缺血、低灌注状态有关。早在1997年,Tajiri等[8]就发现,OJ发生的急性肾损伤与缺血再灌注损伤密切相关;但直到现在,其发生机制仍不完全明确。本研究建立了OJ肾缺血再灌注损伤模型,结果表明当肾缺血再灌注时大鼠肾脏T0~T3时均出现了不同程度的病理学改变,血清BUN、Cr也出现了不同程度的增高,而且以T2时为高峰,说明建模成功。
缺血后处理可以减轻组织的缺血再灌注损伤,但确切机制仍不明确,一般认为可能与氧化应激反应相关,也有研究表明其与抑制炎症反应有关[9,10]。本研究采用缺血再灌注前反复短暂的预灌注、停灌注的方法行缺血后处理,选用炎症促进因子TNF-α作为观察指标,目的在于观察其与炎症反应的相关性。
TNF-α来源于单核细胞和巨噬细胞,是重要的炎症促进因子。OJ术后易发生并发症与肠黏膜屏障损害发生肠道细菌移位、菌血症、内毒素血症等原因有关,而以上原因使单核—巨噬细胞株产生大量TNF-α,OJ时肝功能受到损害,肝清除TNF-α能力下降,导致TNF-α在肝内处于较高水平[11]。Rong等[12]证实了TNF-α水平升高能加重肾脏的损伤,原因是其激活多核粒细胞,释放蛋白水解的相关酶而导致细胞生物膜结构受到破坏。本研究结果表明,发生OJ肾缺血再灌注的大鼠给予缺血后处理,血清TNF-α水平下降,因此认为缺血后处理对OJ肾缺血再灌注损伤有保护作用。其机制可能与减少炎症时的渗出反应、解除小血管平滑肌痉挛、改善微循环障碍相关,从而可减轻OJ大鼠肾脏的缺血缺氧情况。
综上所述,缺血后处理可减轻OJ肾缺血再灌注引起的肾损伤,其机制可能与抑制炎症因子的释放有关。本实验对缺血后处理在大鼠肾缺血再灌注肾损伤保护作用研究的缺血时间只限于6 h内,至于缺血时间更长的情况对大鼠肝缺血再灌注肾损伤的影响以及缺血后处理的保护作用有待进一步研究。
参考文献:
[1] 段明科,王继武,兰峻斌,等.缺血后处理减轻肺缺血再灌注损伤的效果及机制探讨[J].山东医药,2013,53(14):15-17。
[2] Shi L, Jia XG, Luo M, et al. Effects of ischemic postconditioning on pneumocyte apoptosis after lung ischemia/reperfusion injury in rats[J]. Zhongguo Yingyong Shenglixue Zazhi, 2014,30(1):60-63。
[3] Bostanci EB, Yol S, Teke Z, et al. Effects of carbon dioxide pneumoperitoneum on hepatic function in obstructive jaundice: an experimental study in a rat model[J]. Langenbecks Arch Surg, 2010,395(6):667-676。
[4] 杨洁,张海霞,赵东伟,等.参附注射液对肠缺血再灌注大鼠肝肾功能及TNF-α、IL-6水平的影响[J].山东医药,2012,52(19):27-28
[5] Herbet M, Gawronska-Grzywacz M, Graca A, et al. Influence of combined therapy with rosuvastatin and amitriptyline on the oxidation-reduction status in rats[J].Acta Pol Pharm, 2013,70(5):913-917。
[6] Tan X, Zhang L, Jiang Y, et al. Postconditioning ameliorates mitochondrial DNA damage and deletion after renal ischemic injury[J]. Nephrol Dial Transplant, 2013,28(11):2754-2765。
[7] Naranjo A, Cruz A, Lopez P, et al. Renal function after dopamine and fluid administration in patients with malignant obstructive jaundice. A prospective randomized study[J]. J Gastrointestin Liver Dis, 2011,20(2):161-167。
[8] Tajiri K, Miyakawa H, Liu J, et al. Enhanced renal susceptibility to ischemia-reperfusion injury in the rat with obstructive jaundice[J]. Hepatogastroenterology, 1997,44(15):789-795。
[9] Du X, Hu X, Wei J. Postconditioning with rosuvastatin reduces myocardial ischemia-reperfusion injury by inhibiting high mobility group box 1 protein expression[J]. Exp Ther Med, 2014,7(1):117-120。
[10] Zhao H, Wang R, Tao Z, et al. Ischemic postconditioning relieves cerebral ischemia and reperfusion injury through activating T-LAK cell-originated protein kinase/protein kinase B pathway in rats[J]. Stroke, 2014,45(8):2417-2424。
[11] Padillo FJ, Cruz A, Segura-Jimenez I, et al. Anti-TNF-alpha treatment and bile duct drainage restore cellular immunity and prevent tissue injury in experimental obstructive jaundice[J]. Int J Immunopathol Pharmacol, 2007,20(4):855-860。
[12] Rong S, Hueper K, Kirsch T, et al. Renal PKC-epsilon deficiency attenuates acute kidney injury and ischemic allograft injury via TNF-alpha-dependent inhibition of apoptosis and inflammation[J]. Am J Physiol Renal Physiol, 2014,307(6):718-726。
Effect of ischemic postconditioning on kidney ischemia-reperfusion injury and the
expression of TNF-α in obstructive jaundice rats
LIYi,ZHANGXue-xia,JIAYing-bin,LIWen-hua,ZHANGBai-meng
(TheFifthAffiliatedHospitalofSunYat-senUnivesity,Zhuhai519000,China)
Abstract:ObjectiveTo investigate effect of ischemic postconditioning on kidney ischemia-reperfusion injury and the expression of TNF-α in obstructive jaundice rats. MethodsTotally 60 SD rats were randomly divided into three groups (n=20): obstructive jaundice group (group S), obstructive jaundice renal Ischemia-reperfusion group( group I/R), obstructive jaundice + ischemic postconditioning group (group IPO). According to the time of ischemia reperfusion, each group was divided into four subgroups (n=5): 0 h reperfusion (T0), 1 h reperfusion (T1), 3 h reperfusion (T2), 6 h reperfusion (T3) . In each period, the serum urea of nitrogen (BUN), creatinine (Cr) and TNF-α were collected and observed, kidney pathological changes were observed. ResultsCompared with group S, the serum levels of BUN and Cr increased, TNF-α in renal tissue were upregulated in groups I/R and IPO (all P<0.05). At T2, compared with group I/R,the serum levels of BUN, Cr and TNF-α decreased (all P<0.05). ConclusionsIschemic postconditioning can downregulate the expression of TNF-α and alleviate the renal ischemia-reperfusion injury in obstructive jaundice rats, whith may be through inhibiting inflammatory reactions。
Key words:ischemic postconditioning; ischemia reperfusion injury; kidney;obstructive jaundice; tumor necrosis factor-α; rats
(收稿日期:2014-10-16)
通信作者:张百萌
基金项目:珠海市科研计划基金项目(2014D0401990018)。
中图分类号:R364.1
文献标志码:A
文章编号:1002-266X(2015)05-0025-03
doi:10.3969/j.issn.1002-266X.2015.05.009
