大蒜油对黑素瘤B16细胞增殖、凋亡及其血管内皮生长因子表达的影响
2015-03-10叶克许爱娥
叶克,许爱娥
(1.浙江省绍兴市上虞区中医医院,绍兴312300;2.浙江省杭州市第三人民医院,杭州310009)
研究证实,大蒜油(其生物活性物质主要为大蒜辣素)能抑制细胞恶性增殖,诱导细胞凋亡,促进细胞分化等作用,但具体机制仍不完全清楚。研究发现,血管内皮生长因子(Vascular endothelial growth factor,VEGF)的表达在恶性肿瘤的血管和淋巴管新生及转移过程中发挥重要作用。因此,抑制VEGF及其受体的表达成为目前抑制肿瘤的研究热点。本实验旨在研究大蒜油对黑素瘤B16 细胞增殖、凋亡及其VEGF 表达的影响,探讨其抑制恶性黑素瘤进展和转移的可能机制,为其临床应用进一步提供理论依据。
1 材料与方法
1.1 材料 黑素瘤B16 细胞购于中国科学院上海细胞库;RPMI 1640 培养基为Gibco 公司产品;二甲基亚砜为Sigma 公司产品;胎牛血清为杭州四季青公司产品;原位凋亡检测试剂盒为Roche 公司产品;C-myc、P16、VEGF、VEGFRs 鼠抗人单克隆抗体为Santa Cruz 公司产品;羊抗鼠IgG 二抗、SP 试剂盒购于北京中杉公司;噻唑蓝、TritonX-100、DAB 购于Ameresco 公司;RNA-Solv Reagent 试剂盒购于Bio-tek 公司;VEGF 引物由生工生物工程(上海)股份有限公司合成(基因库序列号:NM_003376,上游:5′-GGAGGAGGGCAGAATCATCACGAA-3′,下游:5′-CACCGCCTCGGCTTGTCACAT-3′)。
1.2 方法
1.2.1 药物制备及实验分组 精选优质大蒜,参照《中国药典》2005 版附录XD 挥发油测定甲法,按优选工艺提取[1]。获挥发油,加生理盐水调至每1 mL药液相当于含生药1 g 的浓度。取大蒜油1 g,再用吐温-80 2 g 和生理盐水100 mL 制成10 g/L 大蒜油乳剂,4 ℃冰箱保存,临用前再用培养基配置成10~200 mg/L 处理液。确定最佳浓度后,将实验分为2组,即对照组、大蒜油处理组。
1.2.2 细胞培养黑素瘤B16 细胞常规培养于含10%胎牛血清、0.3 g/L L-谷氨酰胺及青、链霉素各1×105U/L 的DMEM 培养液中,置于37 ℃、5%CO2孵箱中培养。
1.2.3 细胞增殖的测定 取对数生长期细胞,制成单细胞悬液,调整细胞密度为1.5×107个/L,按每孔200 μL 接种于96 孔板,培养24 h 待细胞贴壁后,各孔依次加入10,25,50,75,100,200 mg/L 的大蒜油,并设细胞对照(只加细胞)及空白对照(只加培养液),设6 个复孔,同时点4 块板(每24 h 取1块)。分别培养24,48,72,96 h 后,加入MTT 20 μL/孔,置37 ℃继续培养4 h,吸弃孔内上清,每孔加入DMSO 150 μL 充分振荡,使紫色沉淀充分溶解,在30 min内用酶标仪测定波长490 nm 处的光吸收值(A490),并计算不同时间点不同浓度的大蒜油对B16 细胞的抑制率。抑制率=[(对照组A490-实验组A490)/对照组A490]×100%。
1.2.4 细胞凋亡的检测 取对数生长期细胞,调整细胞密度为8×107个/L,以90 μL/片接种于12 孔板中的盖玻片上培养。待细胞贴壁后,加入100 mg/L大蒜油处理液,并设对照组(不含大蒜油)。48 h 后,取出盖玻片严格按照原位细胞凋亡检测试剂盒说明书操作。细胞核呈棕黄色者为阳性细胞(即凋亡细胞)。于光镜下计数5 个高倍视野中>1 000 个细胞,分别计数总细胞数和凋亡的细胞数,结果以凋亡指数(Apoptosis index,AI)表示。AI=凋亡细胞数/总细胞数×100%。
1.2.5 免疫组化检测 取对数生长期细胞,调整细胞密度接种于盖玻片。次日对照组和大蒜油处理组分别加入含2%胎牛血清培养液及100 mg/L 大蒜油处理液。48 h 后终止培养,PBS 冲洗3 遍,5 min/次,晾干,冰丙酮固定,3%H2O2室温下孵育,10%山羊血清封闭,滴加鼠抗人P16、C-myc 一抗(空白对照以PBS 代替)4 ℃过夜,PBS 洗涤,加二抗,DAB 显色,自来水冲洗,苏木素复染,脱水、透明、封片、镜检。P16 的表达以细胞核或细胞质中有棕黄色颗粒者为阳性,C-myc 的表达以细胞核有棕黄色颗粒者为阳性,细胞未着色或仅轻微着色者为阴性。阳性表达率的比较采用HPIAS2000 型软件随机选取5 个高倍视野,取其平均值进行统计分析。
1.2.6 RT-PCR 检测 按对照组和大蒜油处理组分别加入培养液及100 mg/L 大蒜油处理液。48 h 后终止培养。 TRIzol 法抽提总RNA,逆转录后进行PCR 反应检测VEGF mRNA 的表达。PCR 反应体系25 μL,包括10 pmol 各对上下游引物、200 mmol/L dNTP、2.5 mmol/L MgCl2、50 mmol/L KCl、2 U Taq 酶、1 μL cDNA、DEPC 水补足25 μL。反应程序:96 ℃3 min,1 循环;96 ℃1 min 10 s,57 ℃1 min 10 s,72 ℃1 min 20 s,35 循环;72 ℃7 min。阴性对照为无逆转录酶的逆转录样本,以排外可能来源于污染的基因组DNA 的扩增。反应产物在含有适量溴化乙锭的1.5%的琼脂糖凝胶中电泳,在凝胶成像仪观察并拍照。
1.2.7 Western Blot 检测 100 mg/L 大蒜油作用细胞48 h 后,WB 法检测VEGF 蛋白的表达。细胞裂解法提取总蛋白,定量后加上样缓冲液,行SDSPAGE 电泳,转膜,免疫反应(孵一抗二抗),ECL 反应及曝光、显影。
1.3 统计学处理 所有数据应用SPSS13.0 软件分析。抑制率及细胞凋亡指数(AI)之间的比较,均采用方差分析及两两比较的q 检验。P16、C-myc 阳性表达率的比较采用t 检验,P<0.05 有统计学意义。
2 结果
2.1 大蒜油对黑素瘤B16 细胞增殖的影响 MTT法结果显示,10 mg/L 和25 mg/L 的大蒜油对B16 细胞无明显抑制作用,200 mg/L 的大蒜油对B16 细胞的作用接近100 mg/L 大蒜油的抑制作用。当大蒜油在50~100 mg/L 范围时,表现出以下特点:①从24 h开始,不同浓度的大蒜油对B16 细胞的增殖表现出不同程度的抑制作用,到96 h 达到最大抑制率,与对照组相比较均有统计学意义(P<0.01),见表1;②当大蒜油浓度从50、75 mg/L 一直到100 mg/L 时,抑制率逐渐增高。③以细胞的存活率与剂量的对数作图,并按作图法求出药物的半数抑制浓度值IC50为26.94~45.27 mg/L。
表1 大蒜油对黑素瘤B16 细胞增殖的抑制作用(±s)
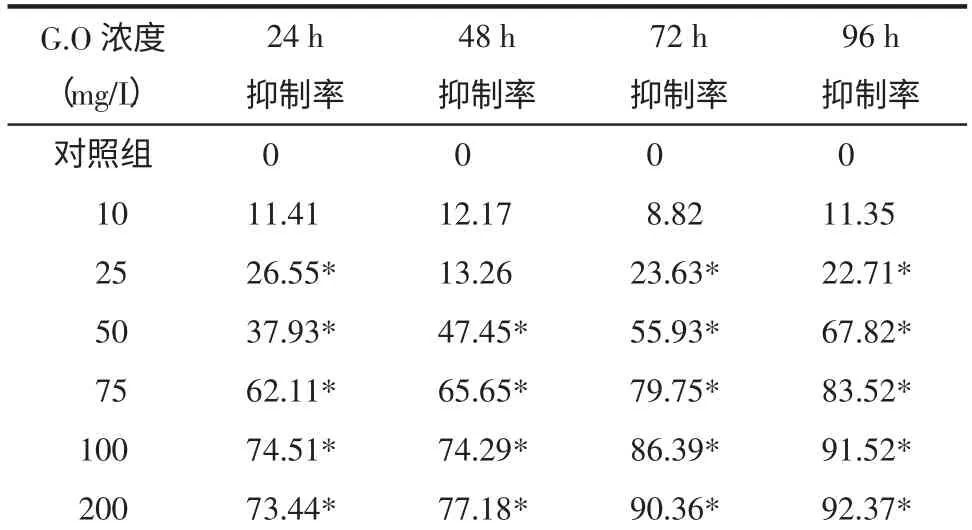
表1 大蒜油对黑素瘤B16 细胞增殖的抑制作用(±s)
注:*表示P<0.01 vs.对照组。
G.O 浓度(mg/L)24 h 48 h 72 h 96 h抑制率 抑制率 抑制率 抑制率对照组 0 0 0 0 10 11.41 12.17 8.82 11.35 25 26.55* 13.26 23.63* 22.71*50 37.93* 47.45* 55.93* 67.82*75 62.11* 65.65* 79.75* 83.52*100 74.51* 74.29* 86.39* 91.52*200 73.44* 77.18* 90.36* 92.37*
2.2 大蒜油诱导黑素瘤B16 细胞凋亡的检测 结果表明,以0、50、100 mg/L 的大蒜油诱导后,黑素瘤B16 细胞的AI 分别为0.37±0.12、8.86±2.16、23.49±3.28,与对照组相比较有统计学意义(P<0.01)。
2.3 免疫组化检测结果 100 mg/L 的大蒜油诱导黑素瘤B16 细胞48 h,P16、C-myc 蛋白的表达率分别为(0.318±0.021)%、(0.216±0.021)%,对照组P16、C-myc 的表达率为(0.229±0.015)%、(0.456±0.018)%,2 组相比差异均有统计学意义(P<0.01)。
2.4 RT-PCR 检测结果 黑素瘤B16 细胞VEGF的PCR 扩增产物测序结果与GenBank 中相应序列完全一致。100 mg/L 的大蒜油诱导黑素瘤B16 细胞48 h,其VEGF mRNA 表达较对照组显著下降,见图1,半定量分析后,差异均有统计学意义(P<0.05)。

图1 VEGF mRNA 表达电泳图
2.5 Western Blot 检测结果 VEGF 为分子质量为24 ku 的条带。100 mg/L 的大蒜油诱导黑素瘤B16细胞48 h,其VEGF 蛋白质的表达亦较对照组显著下降,见图2,半定量分析后,差异亦均有统计学意义(P<0.05)。
3 讨论

图2 VEGF 的蛋白质表达印迹图
因大蒜油来源充足且毒性小,近年来对其研究日益增多。大蒜油的有效成分为大蒜辣素[1],大量的药理实验证明,具有抗菌、抗病毒作用,并对多种肿瘤细胞亦有直接杀伤和抑制增殖的作用[2-3],其抗肿瘤效应可能存在多种作用机制。陈思远等[4]阐明,大蒜素抑制和杀伤黑素瘤细胞的作用可能与下调Ras基因的表达有关。为进一步阐明大蒜油在防治肿瘤过程中的作用及机制,我们研究了大蒜油对黑素瘤B16 细胞增殖、凋亡及其VEGF 表达的影响,探讨大蒜油抑制恶性黑素瘤进展和转移的可能机制,为其临床应用进一步提供理论依据。
本研究中,我们观察了不同浓度的大蒜油对黑素瘤B16 细胞作用不同时间增殖的抑制作用。结果显示,终浓度为50~100 mg/L 的大蒜油对黑素瘤B16 细胞有显著的抑制作用,且呈剂量依赖性,最高抑制率达92.54%。TUNEL 法结果显示,以100 mg/L的大蒜油诱导细胞48 h 后,AI 与对照组相比较差异有统计学意义。p16 基因是一种参与细胞周期调控的抑癌基因,其失活可导致P16 蛋白表达缺失,引起细胞增殖失控而导致肿瘤发生。C-myc 基因是与细胞生长调节有关的原癌基因,具有促进细胞增殖和诱导细胞凋亡的双重作用。免疫组化结果显示,100 mg/L 的大蒜油可引起人黑素瘤B16 细胞P16 表达的上调,而C-myc 蛋白表达下降。以上结果表明,大蒜油对黑素瘤B16 细胞具有显著的抑制其增殖及诱导其凋亡的作用,其诱导黑素瘤B16 细胞凋亡的机制可能与上调P16 而下调C-myc 蛋白的表达有关。
对实体肿瘤的研究证实,瘤体需要有新生血管供氧及营养支持才能继续生长。通常在肿瘤的早期或中期,肿瘤获得了促进血管生成的能力,此过程称为“血管生成开关”[5]。这是因为肿瘤细胞和宿主细胞能分泌多种促进血管生成的因子,打破体内促血管生成因子和抑制血管生成因子间的平衡,其中起主要作用并且研究较多的是VEGF。VEGF 家族被认为是一组与肿瘤血管和淋巴管生成关系最为密切的生长因子,特异性地作用于内皮细胞,由VEGF-A、B、C、D、E 及胎盘生长因子(PIGF)等6 个成员组成。VEGF 通过与受体及辅助受体特异性结合发挥生物学效应。在许多实体肿瘤,都观察到VEGF 及其受体表达增加,并与常规化疗效果和预后不良有关。恶性黑色素瘤组织中VEGF 的高表达是更为准确的预后不良因素[6]。许多研究发现恶性黑素瘤VEGF-A 的表达率增高,并与瘤组织血管密度增高、血管侵犯、淋巴结转移、骨髓微转移及其他远处转移高有关[6-8]。
本实验通过RT-PCR 和Western Blot 检测了黑素瘤B16 细胞中VEGF mRNA 和蛋白质表达情况,研究发现:在黑素瘤B16 细胞中有VEGF mRNA 和蛋白质的高表达。本研究还发现黑素瘤B16 细胞经100 mg/L 大蒜油处理48 h 后VEGF 的mRNA 和蛋白质的表达显著下降,与对照组相比差异均有统计学意义(P<0.01),即大蒜油对两者的表达具有显著的抑制作用。综上所述,在黑素瘤B16 细胞中可见VEGF mRNA 及蛋白质的高表达,从而为肿瘤细胞生长及转移提供条件。而100 mg/L 大蒜油作用48 h后,两者的表达显著下降,可见大蒜油通过下调两者的表达而抑制肿瘤细胞的增殖和转移。
[1] 刘丽梅,孙作德,王瑞海,等.大蒜挥发油水蒸气蒸馏提取工艺[J].中国中药杂志,2007,32(8):744-766.
[2] Rose P,Whiteman M,Moore PK,et al.Bioactive S-alk(en)yl cysteine sulfoxide metabolites in the genus Allium:the chemistry of potential therapeutic agents[J].Nat Prod Rep,2005,22:351-368.
[3] Arditti FD, Rabinkov A, Miron T, et al. Apoptotic killing of Bchronic lymphocytic leukemia tumor cells by allicin generated in situ using a rituximab-alliinase conjugates [J]. Mol Cancer Ther,2005,4:325-331.
[4] Miron T,Mironchik M,Mirelman D,et al.Inhibition of tumor growth by a novel approach: in situ allicin generation using targeted alliinase delivery[J].Mol Cancer Ther,2003,2:1295-1301.
[5] 陈思远,黄长征,钱悦.大蒜素对小鼠黑素瘤细胞B16-F1 增殖和凋亡的影响[J].中国皮肤性病学杂志,2006,20(1):13-15.
[6] Hanahan D,Weinberg RA.The hallmarks of cancer [J]. Cell, 2000,100:57-70.
[7] Ria R,Reale A,Castrovilli A,et al.Angiogenesis and progression in human melanoma[J].Dermatol Res Pract,2010,2010:185 687.
[8] Takeyama H, Hoon DS, Saxton RE, et al. Growth inhibition and modulation of cell markers of melanoma by S-allyl cysteine[J].Oncology,1993,50:63-69.
[9] Taylor P, Noriega R, Farah C, et al. Ajoene inhibits both primary tumor growth and metastasis of B16/BL6 melanoma cells in C57BL/6 mice[J].Cancer Lett,2006,239:298-304.
