自体培养黑素细胞治疗白癜风患者疗效观察
2015-03-10王红娟安彩霞胡雯张德志普雄明
王红娟,安彩霞,胡雯,张德志,普雄明
(新疆维吾尔自治区人民医院,乌鲁木齐830001)
白癜风是一种常见的色素减退性疾病,发病机制尚不清楚,治疗困难[1-2]。在现阶段治疗白癜风的方法主要有物理疗法、药物疗法及外科疗法。如果白斑处黑素细胞完全丧失则采用传统的药物和物理治疗方法难以复色,此时需要外科治疗将自体黑素细胞移入白斑区域。外科疗法主要包括自体表皮移植、自体表皮黑素细胞悬液移植和自体黑素细胞体外培养移植等方法[3]。但自体表皮移植和自体表皮黑素细胞悬液移植受患者皮损面积的限制,而自体黑素细胞经体外扩增后,很小面积的表皮即可培养出大量的黑素细胞,从而治疗面积较大的白癜风皮损。本研究应用自体纯培养黑素细胞移植治疗了43 例稳定期白癜风患者,探讨不同分型和不同部位白癜风患者的疗效差异,现将结果报道如下。
1 资料与方法
1.1 临床资料 43 例稳定期白癜风患者(男18 例,女25 例),年龄10~59 岁(平均28.83 岁),病程1~20 年,面积2~130 cm2。临床类型:散发型14 例,节段型14 例,局限型15 例。共有皮损87 块,其中面颈部18 块,躯干24 块,四肢45 块。移植前1 年病情稳定,均有药物或中波紫外线(UVB)治疗史,疗效不佳,无其他自身免疫病(如甲状腺疾病、红斑狼疮等),无疤痕体质等。试验方案经本院伦理委员会批准,所有患者均签署知情同意书。
1.2 试剂 M2 黑素细胞生长培养基[DEMEM/F12,含5 μg/L 碱性成纤维细胞生长因子(bFGF),购自Promocell 公司],0.25%胰酶(含0.02%EDTA),胎牛血清(购自Gibco 公司)。S-100 单克隆抗体,左旋多巴(L-Dopa,购自Sigma 公司)。
1.3 方法
1.3.1 黑素细胞的分离培养 使用表皮分离吸疱仪在白癜风患者腹部正常皮肤处吸疱6 个(负压50kPa,时间60~90 min,每个疱直径0.8 cm),皮肤发疱后,用注射器将疱液吸出,放入5 mL 离心管中,0.22 μm针头滤器过滤,-20 ℃保存备用。沿疱壁基底边缘剪下疱壁,加入含双抗(青霉素和链霉素)100 U/mL 的PBS,室温放置10 min,加入PBS 洗2~3 次,将PBS吸干净,组织剪碎,加入0.25%胰酶放入4 ℃消化12~16 h,胎牛血清终止消化,吹打使细胞分散,试管内液体混浊后1 500 r/min 离心3 min 弃上清,缓冲液冲洗后再次离心和弃上清,加入M2 黑素细胞选择性培养基中,置37 ℃,5%二氧化碳培养箱内培养。每3 天更换培养液1 次,并在显微镜下观察黑素细胞生长及增殖状况,当黑素细胞融合后,进行传代。
1.3.2 黑素细胞的鉴定
1.3.2.1 L-DOPA 染色 调整黑素细胞浓度为4×104个/mL,接种于放有盖玻片的6 孔板中,待细胞爬满盖玻片80%时,取出盖玻片,用冰PBS 洗2 次,5%的甲醛固定30 min,再用冰PBS 洗2 次,加入0.1%左旋多巴磷酸盐缓冲液(pH7.4),放入37 ℃温箱中温浴4 h,弃去多巴液,观察细胞显色程度。
1.3.2.2 抗S-100 免疫细胞化学染色 将细胞爬片置于载玻片上,用95%的乙醇固定10 min,自然干燥,PBS 液冲洗1 次,滴加TritonX-100 室温下10 min,滴加1 滴3%H2O2室温下10 min,以阻断内源性过氧化物酶活性,PBS 液冲洗3 次,滴加1 滴一抗鼠抗S-100 蛋白单克隆抗体,4 ℃过夜。滴加二抗山羊抗小鼠IgG 抗体-HRP 多聚体,加DAB 显色5 s,冲洗,复染,脱色,透明,封片即完成。
1.3.3 黑素细胞的移植 黑素细胞用胰酶消化,收集,PBS 洗3 次,用患者疱液混悬黑素细胞(8 μL/cm2),每位患者可获得疱液为1~2 mL。白斑区常规消毒,超脉冲二氧化碳激光磨削,深度以可见点状毛细血管出血为度,将混悬的黑素细胞种植于移植区创面,细胞密度为(8~14)×104个/cm2,油纱布覆盖创面,外敷含有患者疱液的无菌纱布,待患者平卧休息1 h 后用无菌敷料包扎,7~10 d 后去除纱布。
1.4 临床疗效判断标准 根据白癜风临床分型及疗效标准《草案》。痊愈:色素恢复>90%为痊愈。显效:白斑部分消失或缩小,恢复正常肤色面积占皮损面积50%~90%。好转:白斑部分减退或缩小,恢复正常肤色面积占皮损面积10%~49%。无效:白斑无变化或缩小,恢复正常肤色面积占皮损面积<10%。有效率=(痊愈+显效)/总块数×100%。
1.5 统计学方法 应用SPSS 13.0 统计软件处理,各组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 白癜风患者黑素细胞的培养及鉴定 将组织剪碎,胰酶消化,细胞混悬液放入培养瓶中培养,开始细胞形态都是小圆点状,并且有大量漂浮的细胞,培养1 周左右,一部分细胞逐渐由圆形变成梭型,并有2~3 个树突,约2 周后,黑素细胞数量明显增多,连接成网状,细胞内充满黑素颗粒,细胞呈梭形。原代细胞呈多极性、有折光性的纤维样细胞,传代细胞多为双极性、细长、平行排列。L-DOPA 染色:细胞胞质及树突呈黑色或棕褐色,呈阳性反应,见图1,S-100 免疫细胞化学染色呈阳性,证实为成熟的黑素细胞,可正常合成黑素。

图1 黑素细胞(L-DOPA染色×40)
2.2 白癜风患者疗效观察 移植4 个月以上观察疗效,随访时间最长12 个月,平均随访时间为8 个月。43 例稳定期白癜风患者,平均种植面积为23 cm2,25例复色面积超过90%,见图2~4。痊愈率为58.14%,11 例复色面积50%~90%,有效率为83.72%。87 块皮损中,有51 块皮损获得了90%以上的复色,痊愈率为58.62%,74 块皮损获得了50%以上的复色,有效率为85.05%。

图2 腿部白癜风患者移植前后皮损变化

图3 腰部白癜风患者移植前后皮损变化
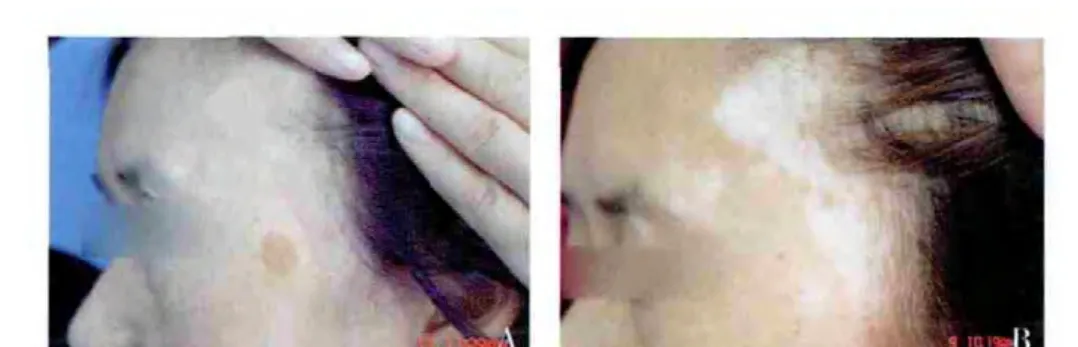
图4 面部白癜风患者移植前后皮损变化
2.3 不同临床分型患者移植后疗效比较 43 例中,散发型14 例,痊愈率为42.86%,有效率71.43%;节段型14 例,痊愈率57.14%,有效率85.71%;局限型15 例,痊愈率73.33%,有效率93.33%。不同分型患者的痊愈率比较:局限型患者的疗效高于节段型和散发型,差异均具有统计学意义(χ2分别为17.405、25.745,均P<0.05)。见表1。
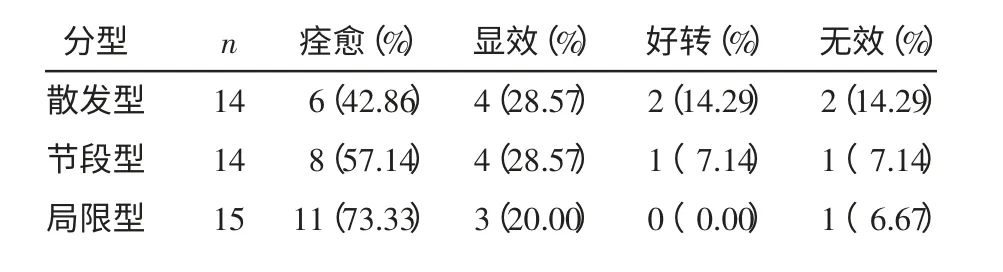
表1 不同临床分型白癜风患者移植后疗效比较 例
2.4 不同部位移植后疗效比较 共移植皮损87 块,其中面颈部18 块,痊愈率为77.78%,有效率88.89%;躯干24 块,痊愈率45.83%,有效率79.17%;四肢45块,痊愈率57.78%,有效率86.67%。面颈部的疗效显著高于躯干和四肢,差异均具有统计学意义(χ2分别为24.915 和12.076,均P<0.05)。见表2。
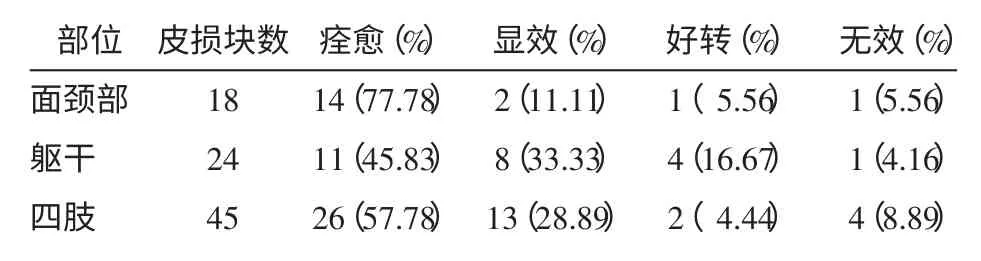
表2 不同部位白癜风患者移植后疗效比较 块
2.5 不良反应 供皮区未发生同形反应现象,其中有3 例患者恢复一段时间后有色沉,见图3,随着时间推移逐渐变淡。这可能是由于这3 例患者在黑素细胞种植时单位面积滴加的细胞数相对较高。
3 讨论
黑素细胞在普通培养基中很难生长,这是因为正常皮肤中黑素细胞数量很少,约占表皮细胞的2%~4%,其增殖能力较角质形成细胞和成纤维细胞弱,体外培养的黑素细胞早期常因角质形成细胞或成纤维细胞的过度生长而失败。因此体外培养黑素细胞培养液中的添加成分对黑素细胞的生长起重要作用。为了使黑素细胞能在体外连续传代培养,早期的培养基中含有十四酰佛波醇乙酸酯(TPA)、霍乱毒素(CT)、异丁酰甲基黄嘌呤(IMBX)及牛脑垂体提取物(BPE)等促进细胞分裂或生长剂。TPA是一种强有丝分裂促进剂,不排除有致癌的危险性,CT 有毒性作用,BPE 也存在一定的风险。因此,科研工作者以DMEM/F12 作为基础培养基,加入了一定浓度的碱性成纤维细胞生长因子bFGF 及其他成分,成功培养了黑素细胞[4]。市售的以此成分为主的黑素细胞专用培养基有ScienCell 公司的Melanocyte Medium-2(MelM-2)和Promocell 公司的M2。MelM-2 不含有TPA,但含有一些必需和非必需氨基酸、维生素、其他有机物质、微量元素和无机盐、激素和生长因子等,使用时需添加黑素细胞生长添加剂MelGS-2(不含TPA)和少量的胎牛血清,但此培养基含有牛垂体提取物(BPE)。M2 培养基包括DMEM/F-12,使用时只含有碱性成纤维细胞生长因子[5],是一种高平衡、不添加TPA 的无血清培养基,黑素细胞培养效果比较理想,其生物学安全性较高。此外,本研究采用负压吸疱疱液来混悬黑素细胞,种植于白斑处,这样有可能提高黑素细胞移植后的生物安全性和成活率。
自体黑素细胞移植是一种治疗白癜风的有效方法,适用于传统方法治疗无效的稳定期白癜风患者。1987 年Lerner 等[6]首次应用培养的自体黑素细胞移植治疗白癜风获得成功,此后国内外相继开展此类研究,国内最早则由徐小珂等[7]于1996 年报道。本研究采用负压吸疱获取患者正常表皮片,制成细胞悬液经2~5 次传代后收集黑素细胞,白斑区用超脉冲CO2激光磨削后进行黑素细胞移植(43 例患者在移植后均未进行其他辅助治疗),随访观察复色效果,痊愈率为58.14%,有效率为83.72%。本研究结果表明,白癜风临床分型和白斑部位可影响自体黑素细胞移植的疗效,其中局限型白癜风治疗效果明显好于节段型和散发型,这与姚蕾等[8]的研究结果基本类似。面颈部治疗效果最好,其次为四肢和躯干,这与Hong 等[9]的研究结果类似。总之,自体纯培养黑素细胞移植是治疗稳定期白癜风的有效治疗手段,其移植疗效与白癜风类型和皮损部位密切相关。
[1] Zhang XJ, Chen JJ, Liu JB. The genetic concept of vitiligo[J]. J Dermatol Sci,2005,39:137-146.
[2] Matz H,Tur E.Vitiligo[J].Curr Probl Dermatol,2007,35:78-102.
[3] Patel NS, Paghdal KV, Cohen GF. Advanced treatment modalities for vitiligo[J].Dermatol Surg,2012,38:381-391.
[4] 罗卫,赵广,向培德,等.正常人黑素细胞的体外培养与观察[J].华南国防医学杂志,2007,51(21):4-5.
[5] Czajkowski R, Placek W, Drewa T, et al. Autologous cultured melanocytes in vitiligo treatment [J].Dermatol Surg, 2007, 33: 1027-1036.
[6] Lerner AB, Halaban R, Klaus SN, et al. Transplantation of human melanocytes[J].J Invest Dematol,1987,89:219-224.
[7] 徐小珂,何威,张春明,等.黑素细胞原代培养自体移植治疗节段型白癜风[J].临床皮肤科杂志,1996,25(6):379-380.
[8] 姚蕾, 钟淑霞, 李珊山, 等. 自体黑素细胞移植治疗不同临床类型白癜风患者的疗效评价 [J].吉林大学学报(医学版),2012,38(6):1187-1190.
[9] Hong WS, Hu DN, Qian GP, et al. Treatment of vitiligo in children and adolescents by autologous cultured pure melanocytes transplantation with comparison of efficacy to results in adults[J].J Eur Acad Dermatol Venereol,2011,25:538-543.
