便携式电流型葡萄糖传感器快速检测致奶牛乳腺炎金黄色葡萄球菌的研究
2015-03-09窦文超赵广英
郭 燕,窦文超,赵广英
(浙江工商大学 食品与生物工程学院/浙江省食品安全重点实验室,浙江 杭州 310018)
奶牛乳腺炎是奶牛场最常见、经济损失最严重的疾病之一,其中作为发病率较高的隐性乳腺炎,无明显的临床症状,但如不及时确诊和治疗,可影响奶的质量和安全。在致奶牛乳腺炎的病原微生物中,金黄色葡萄球菌(Staphylococus aureus)是引起奶牛乳腺炎最为主要的病原菌[1],因此建立S.aureus性乳腺炎的快速诊断方法十分必要。
利用便携式电流型葡萄糖传感器(Personal Amperometric Glucose Meter,简称血糖仪)检测血糖,具有仪器价格低,操作简单,便携等优点[2],现已成为一项成熟技术并被广泛地应用于糖尿病患者的血糖监控[3]。由于该技术的诸多优点,已引起其他领域研究者的关注。例如,通过利用蔗糖酶标记功能DNA 检测非葡萄糖(Glucose,Glc)的目标物,包括DNA、生物标记物、小分子毒素和金属离子[4-7],这些方法虽然有效地扩大了血糖仪的检测范围,但使用的DNA、抗体以及酶标记物等生物制剂的制备较繁琐,活性等易受贮存时间和贮存环境等条件作用而降低,影响检测结果的准确性。因此,探求借鉴于血糖仪的更加简便、准确和稳定的检测体系很有意义。本研究将血糖仪应用于S.aureus 的定性和定量初步快速检测,避免了使用DNA、抗体、酶等生物制剂,建立了一种简便、快速、稳定、灵敏和经济的S.aureus 定性和定量初步快速检测技术,为奶牛乳腺炎的临床诊断提供了新的检测方法。
1 材料和方法
1.1 主要实验材料 S.aureus(ZJGSMC1S0605)、大肠埃希氏菌(E.coli,ATCC 8739)、枯草芽孢杆菌(B.Subtilis,ATCC 6633)、蜡样芽孢杆菌(B.cereus,ATCC 10987)、阪崎肠杆菌(E.sakazakii,ATCC 29544)、副溶血性弧菌(V.parahaemolyticus,ZIGSFSL 1P0901)、沙门氏菌(Salmonella,CMCC 50770)、费式柠檬酸杆菌(C.freundii,ATCC 43864)、腐败希瓦氏菌(S.putrefaciens,ATCC 8071)均购自中国工业微生物菌种保藏中心;鸡白痢沙门氏菌(S.pullorum,79-1)购自国家兽医微生物菌种保藏中心;检测用培养基:Glc-Baird-Parker 培养液、Glc-7.5 % NaCl 肉汤培养基和Glc-7.5 % NaCl-Baird-Parker 培养液均由本实验室制备;On Call Plus 血糖仪、血糖测试条购自艾康生物技术有限公司。
1.2 检测用培养基的选择与改进
1.2.1 培养基的初步确定 基于培养基的选择原则[8-11],初步确定Baird-Parker 培养液和7.5 % NaCl 肉汤为基础培养基以确保对目的菌的高选择性,经研究确定需要添加Glc 的适宜初始浓度后,即可作为后期研究用培养基,根据研究结果,经进一步选择或改进后,即可确定作为快速检测目标菌的专用培养基。
1.2.2 菌种液的制备 将S.aureus 斜面菌种接种于50 mL 营养肉汤培养基中,于37±1 ℃下静置培养20 h,作菌种培养液(国标法[8]测得S.aureus 含量为108cfu/mL)。
1.2.3 培养基中Glc 初始浓度的选择 在血糖仪可测Glc 浓度范围内,分别配制Glc 浓度为5.0 mmol/L、10.0 mmol/L、15.0 mmol/L、20.0 mmol/L 的Baird-Parker 培养液和7.5 % NaCl 肉汤培养基各50 mL 于锥形瓶中,分别从每个锥形瓶移取5 mL 培养液于试管中,再分别吸取1 mL 种子液加于上述培养液中,混匀,于37±1 ℃下振荡培养,分别按对应时间(0 h,2 h,4 h,6 h,8 h)将试管取出,通过血糖仪及其配套酶修饰电极测定培养物中Glc 的浓度,并计算Glc 浓度变化的差值ΔC[ΔC=C1-C2,其中C1为培养物中0 h 测得的Glc 浓度,C2为同一培养物中一定待确定测试条件(如菌液浓度、pH 值、培养温度等)下培养一定时间测得的Glc 浓度。
1.3 菌液浓度及培养时间的选择 在多支试管中分别加入5 mL 各含适量Glc 的上述两种培养基,使用生理盐水将菌种液稀释至浓度为101cfu/mL~108cfu/mL,分别取1 mL 加至上述试管中,混匀,于37±1 ℃下振荡培养,分别按对应时间(0 h、2 h、4 h、6 h、8 h)将试管取出,利用血糖仪及其配套酶修饰电极测定培养液中Glc 浓度。
1.4 测试底液最适pH 值的选择 将浓度为108cfu/mL 的菌种液分别加入pH 值6.0~8.0 并含适量Glc 的上述两种培养基中,混匀,于37±1 ℃下振荡培养,分别在0 h 和培养最佳检测时间,使用血糖仪及其配套酶修饰电极测定培养液中Glc 浓度,计算培养前后培养物中Glc 浓度变化的差值,并确定最适pH 值。
1.5 最适培养温度的选择 将浓度为108cfu/mL 的菌液分别加至含适量Glc 的上述两种培养基中,混匀,分别在30±1 ℃~45±1 ℃下振荡培养,在0 h和培养最佳检测时间,通过血糖仪及其配套酶修饰电极测定培养液中Glc 浓度,计算培养前后培养物中Glc 浓度变化的差值,并确定最适培养温度。
1.6 特异性试验 选取浓度108cfu/mL 大肠埃希氏菌、副溶血性弧菌、阪崎肠杆菌、鸡白痢沙门氏菌、蜡样芽孢杆菌、枯草芽孢杆菌、沙门氏菌、费式柠檬酸杆菌及腐败希瓦氏菌进行特异性试验。在最适条件下,采用血糖仪及其配套酶修饰电极对含有不同菌的培养液进行Glc 浓度的检测,分别在0 h和最佳培养检测时间检测每个菌液的Glc 浓度,计算前后培养物中Glc 浓度变化的差值,并对比分析,必要时进行深入的改进研究。
1.7 标准曲线建立与验证试验
1.7.1 标准曲线建立 将菌种液进行101~107倍稀释,在最适条件下,使用血糖仪及其配套酶修饰电极对不同浓度菌液培养物中的Glc 浓度进行测定,分别在0 h 和最佳培养检测时间检测每个菌液稀释度的Glc 浓度,计算前后培养物中Glc 浓度变化的差值,对照国家标准BG47891.0-2010[8]计数S.aureus的含量,制作标准曲线。
1.7.2 验证试验 对照S.aureus 国标检测方法中第二法的Baird-Parker 平板计数法检测计数不同浓度菌液样品,验证标准曲线的准确性。
1.8 抗干扰性试验 在多支试管中分别加入5 mL含适量Glc 的7.5 % NaCl 肉汤-Baird-Parker 培养液,先接种浓度为108cfu/mL 的S.aureus 1 mL,再分别接种1 mL 浓度为108cfu/mL 大肠埃希氏菌、副溶血性弧菌、阪崎肠杆菌、鸡白痢沙门氏菌、蜡样芽孢杆菌、枯草芽孢杆菌、沙门氏菌、费式柠檬酸杆菌及腐败希瓦氏菌。以接种2 mL 浓度为108cfu/mL S.aureus 为对照。混匀后置于37 ℃培养,分别在0 h和最佳培养检测时间采用血糖仪及其配套酶修饰电极检测每个菌液的Glc 浓度,计算前后培养物中Glc 浓度变化的差值,并进行对比。
1.9 准确性试验 将市售5 种牛奶样品共75 份,分别随机加入S.aureus 制备人工模拟试验样品,试验样品中的S.aureus 浓度在101cfu/mL~105cfu/mL,采用血糖仪进行检测,并将检测结果与国标法进行对比。
2 结果
2.1 检测条件的确定 为获得最佳检测效果,我们通过实验对培养基/培养物中Glc 初始浓度、检测时间、培养基pH 值及培养温度进行优化,结果如表1 所示。对于培养基/培养物中Glc 初始浓度的确定,浓度为108cfu/mL 菌种液置于不同浓度的Glc-Baird-Parker 液体培养物和Glc-7.5 % NaCl 肉汤培养物中,分别在不同时间(0 h,2 h,4 h,6 h,8 h)采用血糖仪测定培养物中Glc 浓度,得出的计算结果显示,Glc-Baird-Parker 培养物中,20.0 mmol/L的培养物中Glc 浓度变化的差值(ΔC)最大、最明显,而在Glc-7.5% NaCl 肉汤培养物中,Glc 初始浓度为15.0 mmol/L 时,培养物中ΔC 最大、最明显。因此,结果如图1 所示,在后续研究中选择Baird-Parker 培养液的Glc 的初始浓度为20.0 mmol/L,7.5%NaCl 肉汤培养基的Glc 的初始浓度为15.0 mmol/L。对于检测时间的确定,培养物中ΔC 随菌液浓度的增加也相应增大,且都随培养时间的增长而增大,培养6 h 时Glc 浓度已与0 h 有较明显差别,因此,确定检测培养时间为6 h。如S.aureus 含量过少,培养6 h 后ΔC 过小难以判定时可延长培养时间至24 h,差值会变大而易于计数。对于适宜pH 和适宜温度的确定,pH 值7.4 时,ΔC 值达最大,即变化最明显,因此选择培养液pH7.4。培养温度为37±1 ℃时,ΔC 达最大值,因此最适培养温度选择37±1 ℃。
2.2 特异性的测定 为验证该方法的特异性,在最佳检测条件下,对10 种致病菌进行了检测,结果显示,除B.cereus 和B.subtilis 培养物中ΔC 变化较大,其它几种菌培养物中ΔC 变化不明显(图1A),分析认为是Glc-Baird-Parker 培养基的选择性不强所致。V.parahaemolyticus 培养物中ΔC 变化没有其它几种菌明显,但较S.aureus 的明显要小(图1B),分析认为V.parahaemolyticus 是嗜盐性细菌,使它培养物中的ΔC 变化没其它几种菌的ΔC 变化大,但它在此盐浓度下受到了生长抑制而导致消耗Glc量明显少于S.aureus 消耗的。图1A 和图1B 显示,这两种培养基不能实现对S.aureus 严格的特异性选择,而特异性是衡量检测方法优劣的一个非常重要的指标,好的检测方法在特异性方面应该达到高标准。为此,根据相关文献[12-13],进一步总结、分析和研究,设计一种新型改良培养液,测试结果如图1C 所示:S.aureus 的ΔC 值远大于其它致病菌的,特异性较好。因此确定该培养液为血糖仪及其配套酶修饰电极测定S.aureus 的专用培养基,定名为“便携式血糖仪专用改良Baird-Parker 培养液(PGMmodified Baird-Parker liquid culture medium)”。

表1 检测条件的确定Table 1 Optimization of the measurement conditions
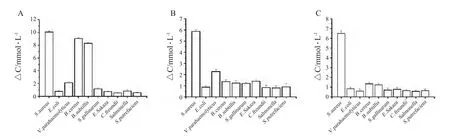
图1 特异性试验Fig.1 Specificity tests of the PGM
2.3 标准曲线设定与验证
2.3.1 线性关系与标准曲线设定 最佳条件下培养6 h 后检测得目标菌不同基础含量与ΔC 在103cfu/mL~107cfu/mL(国标方法测得),与菌液浓度的对数成良好线性关系(图2A),线性方程:ΔC=0.74 lg[cfu·ml-1]-0.75,相关系数为0.992,检出下限为2.6×102cfu/mL(S/N=3)。对菌含量少于检出限者可延长培养时间至24 h,菌液浓度为101cfu/mL~102cfu/mL 检测获得的ΔC 如图2B 所示,保证满足计数要求,线性方程:ΔC=2.92 lg[cfu·ml-1]-2.93,相关系数为0.993,检出限为2.3×101cfu/mL(S/N=3)。
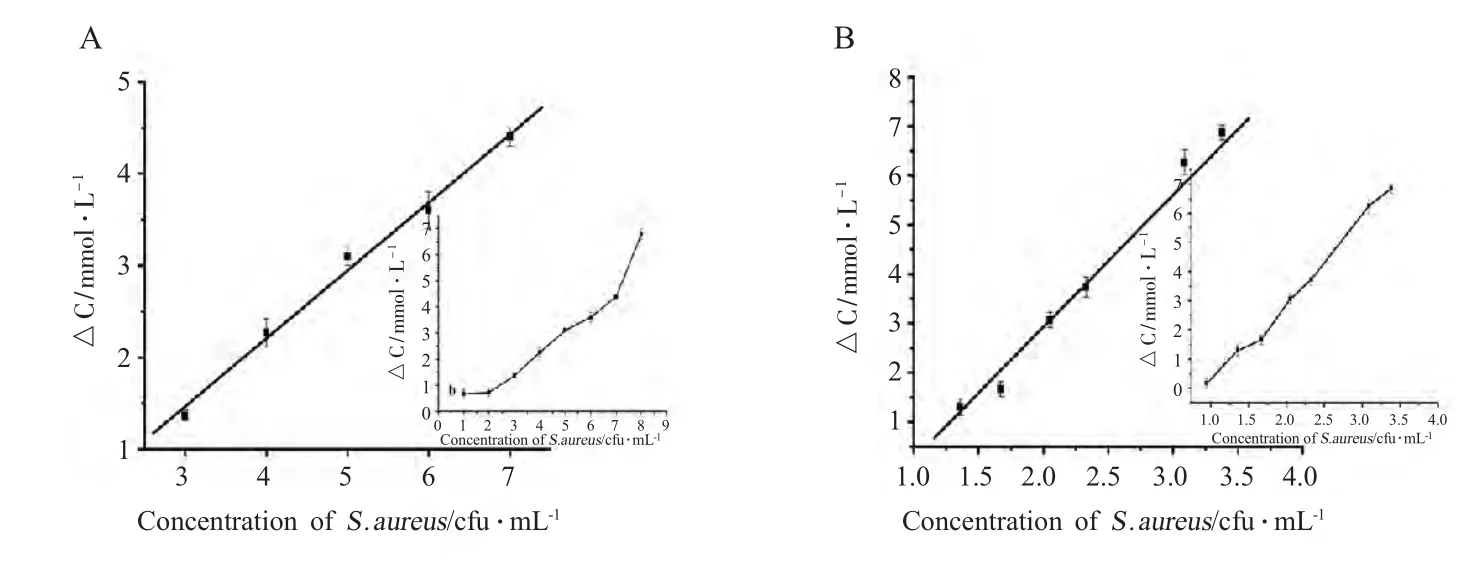
图2 Glc 浓度变化(ΔC)与S.aureus 浓度对数的关系Fig.2 The standard curve between the logarithmic value of S.aureus concentration and the change of the glucose concentration(ΔC)in culture medium under optimal condition
2.3.2 标准曲线验证 将新建立的方法对照标准方法的检测结果进行相关性分析后建立线性回归模型(图3),结果表明对于S.aureus 含量在101cfu/mL~107cfu/mL 的样品,血糖仪快速检测法和国标法检测结果的相关性良好,即快速检测方法是可行的。
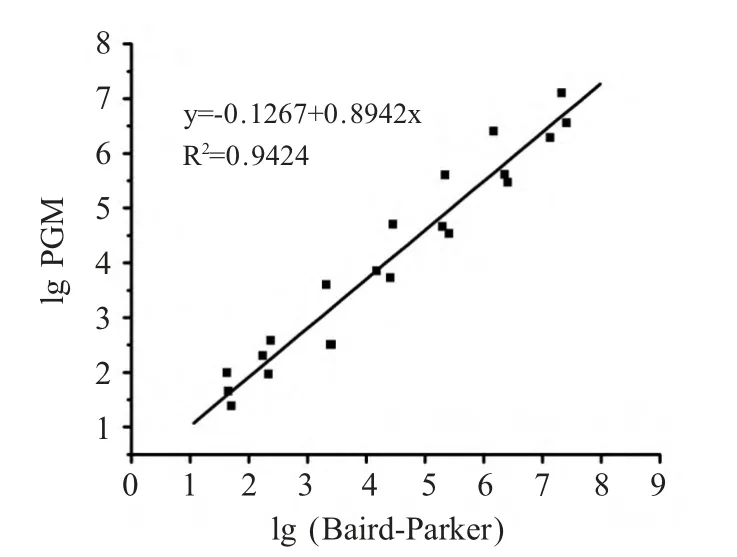
图3 两种检测方法的对数值标准曲线Fig.3 The logarithmic standard curve by Baird-Parker and PGM
2.4 抗干扰能力检验 评定在同一个培养物中共存的其它种类细菌可能产生的对血糖仪快速检测S.aureus 结果准确性的影响的试验结果显示,在S.aureus和其它几种菌的接种量均为108cfu/mL 时,S.aureus与对照组的ΔC 差距不大(图4)。因此,这几种菌的存在,对S.aureus 检测结果的影响很小,表明该检测体系的抗干扰能力强。
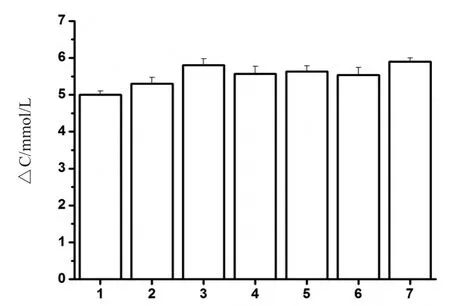
图4 干扰性试验Fig.4 Detection of S.aureus in the presence of other bacteria
2.5 准确性 为验证该方法的准确性,将人工制备的模拟样品,在最佳条件下,分别用该方法与国标法对各样品进行检测,结果显示,与国标法相比,该方法具有较高的准确率(表2),两者符合率为94.67 %,表明血糖仪可以用于临床牛奶样品中S.aureus 的检测。
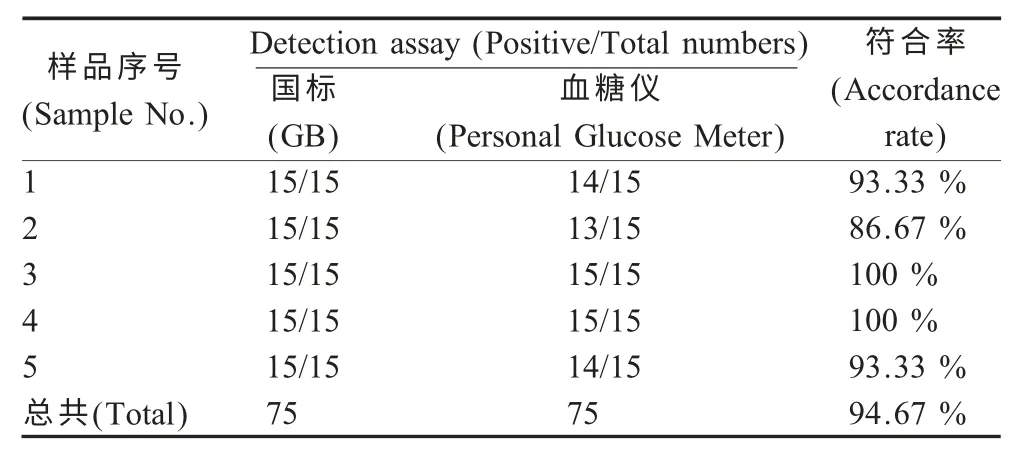
表2 国标法与血糖仪方法检测结果对照Table 2 Comparisons of two methods for S.aureus detections
3 讨论
S.aureus 是最常引起奶牛乳腺炎的细菌,在S.aureus 感染引起的奶牛乳腺炎中存在着不同程度的乳腺纤维化,严重的导致乳腺硬化,最终失去泌乳功能[1],而且S.aureus 一旦在畜群中定植则很难或几乎不能根除,同时它也是乳腺炎复发和使宿主机体终生带菌的主要原因[14]。因此,对引起奶牛乳腺炎的S.aureus 进行快速检测十分重要,将血糖仪用于快速检测致奶牛乳腺炎S.aureus 具有简便、快速、灵敏、经济安全等优势。该方法将乳汁样品直接混入改良Baird-Parker 培养液中,不用增菌和分纯培养,37±1 ℃培养,目标菌含量在103cfu/mL 以上培养6 h,在101cfu/mL~102cfu/mL 培养24 h,即可直接对培养物进行检测,经计算可获得S.aureus的定性和定量检测结果;并且不需要贵重仪器、耗材和试剂,检测一份样品仅需人民币2~3 元,不需要接触和释放有毒有害试剂。
本研究采用血糖仪及其配套酶修饰电极,对改良Baird-Parker 培养液接种待测样品的37±1 ℃的6 h培养物进行检测和计算,通过获得的Glc 浓度变化的差值ΔC,对S.aureus 即可实现初步快速检测,又可实现在103cfu/mL~107cfu/mL 浓度范围内的定量快速检测,检出限为2.6×102cfu/mL(S/N=3);将培养时间延长至24 h 再检测,即可实现对于101cfu/mL~102cfu/mL 浓度菌液样品的初步快速检测,检出限为2.3×101cfu/mL(S/N=3)。由此证明,血糖仪及其配套酶修饰电极能够初步快速定性和定量检测改良Baird-Parker 培养液6 h/24 h 培养物中的S.aureus,具有非常简便、快速和经济的显著突出优点,为兽医临床对致奶牛乳腺炎S.aureus 的快速检测提供了方法。
[1]吴建美,王凤龙,丁玉林,等.金黄色葡萄球菌对体外培养的奶牛乳腺上皮细胞PDGF-BB mRNA 及蛋白表达的影响[J].中国预防兽医学报,2015,37(1):19-22.
[2]Wang J.Electrochemical glucose biosensors[J].Chem Rev,2008,108(2):815-825.
[3]Newman J D,Turner A P.Home blood glucose biosensors:a commercial perspective[J].Biosens Bioelectron,2005,20(12):2435-2453.
[4]Xiang Yu,Lu Yi.Using personal glucose meters and functional DNA sensors to quantify a variety of analytical targets[J].Nat Chem,2011,3:673-703.
[5]Xiang Yu,Lu Yi.Portable and quantitative detection of protein biomarkers and small molecular toxins using antibodies and ubiquitous Personal Glucose Meters[J].Anal Chem,2012,84:4174-4178.
[6]Xiang Yu,Lu Yi.Using commercially available Personal Glucose meters for portable quantification of DNA[J].Anal Chem,2012,84:1975-1980.
[7]Xiang Yu,Lu Yi.An invasive DNA approach toward a generalmethod for portable quantification of metal ions using a personal Glucose meter[J].Chem Commun,2013,49:585-587.
[8]GB 4789.10-2010.食品微生物学检验,金黄色葡萄球菌检验[S].
[9]凌秀梅,陈礼玲,张敏,等.TEMPO/STA 法与Baird-Parker平板计数法测定食品中金黄色葡萄球菌的比较研究[J].食品科学,2013,34(20):246-249.
[10]van Doorne H,Baird R M,Hendriksz D T,et al.Liquid modification of Baird-Parker's medium for the selective enrichment of Staphylococcus aureus[J].Antonie Van Leeuwenhoek,1981,47:267-278.
[11]胡秀杰,张相萍,包小兵.金黄色葡萄球菌增菌培养基增菌效果观察[J].医药论坛杂志,2005,26(18):3-5.
[12]薛振菲,李莹,陈晓珑,等.金黄色葡萄球菌选择培养基成分筛选及优化[J].食品科技,2013,38(11):299-302.
[13]冯翠兰,林海权,刘富来.产肠毒素金黄色葡萄球菌显色培养基的制备[J].畜牧与兽医,2014,46(7):19-22.
[14]刘萍,郝满良,秦建华,等.金黄色葡萄球菌诱发小鼠实验性乳腺炎研究[J].河北农业大学学报,2008,31(2):96-100.
