鞍带石斑鱼(Epinephelus lanceolatus)♂×斜带石斑鱼(Epinephelus coioides)♀杂交子一代青龙斑血液学及血液生理生化特性的比较研究*
2015-03-08杨丽冬李小梅侯丽萍张海发
舒 琥 杨丽冬 李 燕 李小梅 侯丽萍 王 吉 张海发
(1. 广州大学生命科学学院 广州 510006; 2. 广东省大亚湾水产试验中心 惠州 516081)
鞍带石斑鱼(Epinephelus lanceolatus)又称龙胆石斑鱼、龙趸, 斜带石斑鱼(Epinephelus coioides)俗名为青斑, 均隶属于鲈形目、鱼旨科、石斑鱼属(Heemstra et al, 1993; Nelson, 2006), 为海洋暖水性珊瑚礁鱼类,同时也是海水养殖中的重要名贵物种。其不仅营养丰富, 肉质鲜美, 而且生长迅速, 拥有巨大的市场潜力,深受广大消费者青睐。其中, 青斑的苗种繁育问题已经基本解决, 可以进行大规模种苗繁育工作。但是,由于在人工养殖过程中出现种质资源退化, 病害频发等问题, 人工繁殖龙趸这一难题尚未解决, 目前只能通过捕捞天然苗种来进行龙趸的人工养殖。然而,日益减少的天然海洋资源促使石斑鱼的市场价格逐渐提升, 远不能满足消费者对石斑鱼的需求。因此,本文作者致力于对石斑鱼种质进行改良, 并希望在繁育养殖石斑鱼过程中解决其存在的一系列难题,长期以来, 在广东大亚湾水产试验中心开展石斑鱼杂交试验, 以斜带石斑鱼为母本, 鞍带石斑鱼为父本进行种间远缘杂交, 得到斜带石斑鱼♀×鞍带石斑鱼♂的杂交子一代青龙斑(广东省大亚湾水产试验中心, 2010), 子一代肉质美、生长快、抗病力强、优质高产, 具有明显的优势, 同时在杂交子一代青龙斑群体中发现了少量三倍体(约 8%), 这些三倍体青龙斑在生长、肉质、抗病等方面都表现出明显的优势, 青龙斑是迄今为止首次在石斑鱼类杂交育种得到三倍体个体, 为进一步深入开展石斑鱼育种、改良石斑鱼种质资源状况打下良好基础。
迄今为止有关青龙斑的研究报道较少。有繁养殖、群体遗传分析等方面的研究(周翰林等, 2012; 吕国敏等, 2013; 王燕等, 2014)。对于青龙斑的血细胞和血液生化指标的研究尚未见报道, 而弄清血液学指标, 对其病害防治、免疫、生长繁殖等一系列生理生化指标检测具有重大意义。本文通过对其杂交子一代青龙斑二倍体和三倍体血液中的生理生化等指标以及红细胞和白细胞的形态进行相关研究, 得出二倍体与三倍体青龙斑的血液指标差异, 可为青龙斑二倍体和三倍体的鉴别提供理论依据。同时可以丰富青龙斑的血液生理学研究资料, 为石斑鱼的遗传育种提供理论依据和基本资料。
1 材料与方法
1.1 实验材料
实验鱼均由广东省大亚湾水产试验中心提供,以人工培育出的斜带石斑鱼为母本、鞍带石斑鱼为父本进行远源杂交获得的子一代青龙斑, 分养在中心水泥池, 2011年5月—2012年5月期间分别随机选择体表无伤、发育正常的健康二倍体与三倍体青龙斑各20尾。二倍体平均体质量为(1166.67±622.49)g, 平均体长为(34.50±8.06)cm, 三倍体平均体质量(1776.58±422.65)g, 平均体长为(39.67±10.17)cm。
1.2 实验方法
1.2.1 血细胞比较 用5% EDTA浸润1mL注射器, 选取身体健康、体表无损的青龙斑, 用 MS-222 (100 mg/L)麻醉后从尾静(动)脉抽血。采血样后进行下述指标测定:
红细胞计数: 将血液置于 0.8%的生理盐水中, 稀释200倍, 并滴加50μL EDTA标准溶液, 混匀, 然后吸取适量血液置于血球计数板, 于 OLYMPUS-BX51显微镜下观察计数, 每尾鱼取4组数据的平均值。
红细胞大小、形态统计: 先进行瑞氏染色, 将血液在载玻片上推成薄薄一层血膜, 待血膜干后, 瑞氏染色液染色 1min, 加缓冲液混染 5—10min, 蒸馏水缓慢冲洗去染液, 干燥。于OLYMPUS-BX51显微镜下随机选取 10个视野进行观察并拍照, 每个样本各测量50个细胞, 取平均值。
白细胞分类计数: 在显微镜下观察每张血涂片并随机选取其中的 10个视野进行拍照, 对每个视野中出现的各种白细胞进行计数并分类, 并对各种白细胞所占比例分别进行统计。各种观测细胞50次测量的平均值即为其细胞的大小。
白细胞、红细胞及其核的面积和体积按公式S =πa⋅b/4 和核体积 V = a2⋅b/1.91 (a 为短轴, b 为长轴)(楼允东, 2009)计算。
1.2.2 血液生化指标比较 将采集的血液样品放置在4°C冰箱静置4—6h, 4°C条件下以12000 r/min速度离心5—8min, 小心吸取上层血清, 用7170A全自动生化分析仪测定各项生化指标。
1.2.3 数据处理 实验结果均采用 Excel和 SPSS 17统计软件进行单因素方差分析(One-Way ANOVA),Duncan氏检验法进行多重比较及t检验进行差异显著性分析, P<0.05表示差异显著, P<0.01表示差异极其显著。实验数据以平均值±标准误(Mean±SE)表示。

表1 二倍体与三倍体青龙斑血液常数值的比较Tab.1 Comparison of haematological parameters between diploid and triploid Qinglong groupers
2 结果与分析
2.1 二倍体与三倍体青龙斑血液常数值的比较
二倍体和三倍体青龙斑血液常数值的比较见表1, 由表 1可知, 青龙斑的二倍体血液常数值与青龙斑的三倍体血液常数值在白细胞、红细胞、平均血小板体积、平均血细胞体积、血红蛋白以及红细胞分布宽度等指标中, 二者差异极显著, 而血细胞压积和血细胞分布宽度差异显著, 血小板压积差异不显著。其中红细胞、血红蛋白和血小板含量随着倍性升高而降低; 而白细胞、平均血细胞体积、红细胞分布宽度、平均血小板体积和血小板分布宽度随着倍性升高而升高。二倍体与三倍体的血细胞指数在总体上存在显著性差异。
2.2 二倍体与三倍体青龙斑红细胞计数值
从表2可以看出, 青龙斑的二倍体血细胞中的红细胞数是 3.53×1011个/L, 三倍体红细胞数是 2.33×1011个/L, 二倍体红细胞数是三倍体的1.52倍。青龙斑二倍体血细胞中的红细胞数明显多于三倍体红细胞数。

表2 二倍体与三倍体青龙斑红细胞数量比较Tab.2 Comparison on amount of erythrocyte in diploid and triploid Qinglong groupers
2.3 二倍体与三倍体青龙斑红细胞及其细胞核的大小
二倍体和三倍体青龙斑红细胞和细胞核大小测量结果见表 3, 从表 3可知, 青龙斑的三倍体红细胞中短径、长径、核短径、核长径、体积、面积、核面积以及核体积等多项指标的数值均比其二倍体数值更大。由 t检验可知, 在青龙斑的三倍体中, 其红细胞的短径、红细胞核长、红细胞面积、核体积、长径及核面积与二倍体间差异极显著(P<0.01); 三倍体青龙斑红细胞体积为二倍体的 1.52倍, 红细胞核的体积为二倍体的1.59倍, 差异显著(P<0.05)。青龙斑三倍体红细胞短径/长径比值为 0.69, 小于二倍体的比值0.79, 从以上数值中可以看出青龙斑二倍体红细胞形态较圆, 而三倍体红细胞形态较为狭长。

表3 二倍体与三倍体青龙斑中红细胞和细胞核大小的对比Tab.3 Comparison in the size of red blood cell and nucleus in diploid and triploid Qinglong groupers
2.4 二倍体与三倍体青龙斑白细胞大小
青龙斑二倍体和三倍体白细胞大小见表 4, 由表4可知, 青龙斑三倍体淋巴细胞、嗜中性粒细胞、嗜酸性粒细胞和单核细胞体积、短径和长径等均比二倍体大, 但只有其中的单核细胞的长径、嗜中性粒细胞、短径和体积显著大于二倍体, 其体积比分别为1.59和1.58。

表4 二倍体与三倍体青龙斑白细胞大小比较Tab.4 Comparison in size of leukocyte in diploid and triploid Qinglong groupers (μm)
2.5 二倍体与三倍体青龙斑血细胞形态比较
2.5.1 红细胞形态观察 在二倍体和三倍体青龙斑的血涂片中, 观察到数量最多的细胞是红细胞, 其中包括成熟的红细胞、幼红细胞和原红细胞, 老化的核影细胞和红细胞时而出现。而二倍体和三倍体青龙斑血细胞的形状无明显差别, 均呈圆形或椭圆形, 但肉眼可见其大小有较大差异。两种倍性的原红细胞呈圆形或近圆形, 细胞核呈椭圆型, 居中, 核质比大,染色质较疏松, 细胞质较少(图 1a, 图 1b); 圆形或略呈椭圆形的幼红细胞以及成熟的红细胞, 它们形状相似, 往往以群体的形式出现, 幼红细胞的细胞核大于成熟的红细胞, 呈圆形或椭圆形, 核质比较大, 细胞质显著增加, 松散的染色质结构, 着色浅(图 1c,图 1d)。成熟的红细胞为长椭圆形, 椭圆形的细胞核位于整个细胞中央, 核质比较小, 致密的染色质, 着色为绛紫色(图 1e, 图 1f), 衰老的红细胞及其细胞核比正常的红细胞大, 疏松网状的染色质, 染色为淡紫红色, 没有细胞质(图1g, 图1h)。血影红细胞似裸核,染色质疏松网状, 染成淡紫色, 无细胞质(图 1i, 图1j)。在观察中发现三倍体血液中存在一些异常形状的红细胞, 一般呈纺锤形和月牙形(图 1s), 这在二倍体红细胞中是没有观察到的。
2.5.2 白细胞形态观察 二倍体和三倍体青龙斑的血涂片中观察到的白细胞包括单核细胞、嗜酸性粒细胞、嗜中性粒细胞和淋巴细胞。
淋巴细胞多为圆形、心形(图 1k, 图1l), 核染色质浓密, 着色较深, 染成紫色。淋巴细胞核较大, 占据整个细胞大部分面积, 细胞质较少, 在细胞核外周仅一窄环。
嗜中性粒细胞: 呈圆形或者不规则形状(图 1m,图1n), 细胞核相对于淋巴细胞稍小, 约占细胞的1/3,且形状各异, 呈马蹄形, 分叶形等多种形态。细胞核染色质浓密, 着色较深, 染成红色或紫色, 细胞质染色较浅, 颜色为灰蓝色。且可以观察到细胞中有微小蓝色颗粒。
嗜酸性粒细胞: 细胞呈圆形(图1o, 图1p), 胞质内充满粗大、整齐、均匀、紧密, 排列的砖红色或鲜红色嗜酸性颗粒, 折光性强。细胞核呈深紫色, 形状各异通常有 2—3叶分支或者眼镜型。细胞质着色较浅, 呈淡蓝色。嗜酸性粒细胞容易破碎, 颗粒可分散于细胞周围。
单核细胞: 单核细胞一般呈现圆形或近圆形(图1q, 图 1r), 细胞核较大, 呈心形, 或者马蹄形。细胞核染色质较为疏松, 着色较浅, 染成蓝紫色。细胞质染成淡蓝色, 且分布着蓝紫色颗粒。
2.6 二倍体与三倍体青龙斑红细胞生化指标比较
青龙斑二倍体和三倍体血液生化指标的检测统计结果见表5。从表5可以看出, 大部分三倍体青龙斑的生化指标与二倍体差异明显。经t检验, 得出谷丙转氨酶、白蛋白、球蛋白、总蛋白、总胆汁酸、高密度脂蛋白胆固醇、尿素、肌酐、甘油三酯、钾以及氯和磷的含量有显著性差异; 而谷草转氨酶、γ-谷氨酰基转移酶、碱性磷酸酶、葡萄糖、总胆固醇、钠和钙的含量差异不显著。
3 讨论
3.1 青龙斑二倍体与三倍体血液学特点比较
研究表明, 细胞大小与 DNA的含量或染色体数目有关, 通常三倍体细胞和细胞核比二倍体的细胞和细胞核要大(Gregory, 2002)。本研究的结果得出,青龙斑三倍体核体积约等于二倍体核体积的 1.5倍(即三倍体红细胞体积∶二倍体红细胞体积 = 3∶2),实际结果是其红细胞体积分别为681.05和447.51, 比值为1.52, 随着倍性增加而增大。与其它鱼类一样(陈侠君等, 2010), 虽然青龙斑三倍体红细胞的大小显著大于二倍体的, 但其数目明显减少, 同时三倍体红血细胞核的长轴也明显增加, 导致三倍体红细胞多呈椭圆形, 这与舌齿鲈、泥鳅等的结果一致(Stefano et al,2005; Gao et al, 2007; Del et al, 2011), 由于三倍体与二倍体红细胞差异显著, 红细胞体积大小已成为鱼类检测多倍体的快速、简便、便宜、有效的方法, 并在多种鱼类得到证实(Small et al, 1987; Sezaki et al,1988, 1991; Benfey, 1999; Stefano et al, 2005; Gao et al, 2007; 邹拓谜等, 2011)。该方法与常用的倍性检测方法染色体制片及流式细胞仪检测比较具有如下优点: (1) 不需将鱼处死, 只需抽少量血制作血涂片即可, 比染色体制片省时省药省钱; (2) 与流式细胞仪比, 检测成本低, 不需购买贵重仪器, 这更适合一般科研机构和生产单位。
白细胞数量相对于红细胞而言, 数目较少, 且种类不齐全。本文观察到的白细胞种类数目的多少依次为淋巴细胞、嗜中性粒细胞、单核细胞以及嗜酸性粒细胞, 而嗜碱性粒细胞则很少见到, 这与张海发等(2004)报道的结果基本一致; 白细胞的作用是保护机体, 在机体的免疫反应中起着重要的作用(林浩然,2007), 白细胞的数目差别反应鱼类抗病和耐受性,作者发现青龙斑三倍体血细胞中的淋巴细胞和嗜中性粒细胞显著超过二倍体, 且嗜中性粒细胞和单核细胞的体积显著大于二倍体, 血液中白细胞含量明显高于二倍体, 这可能与三倍体抗病能力强有关。
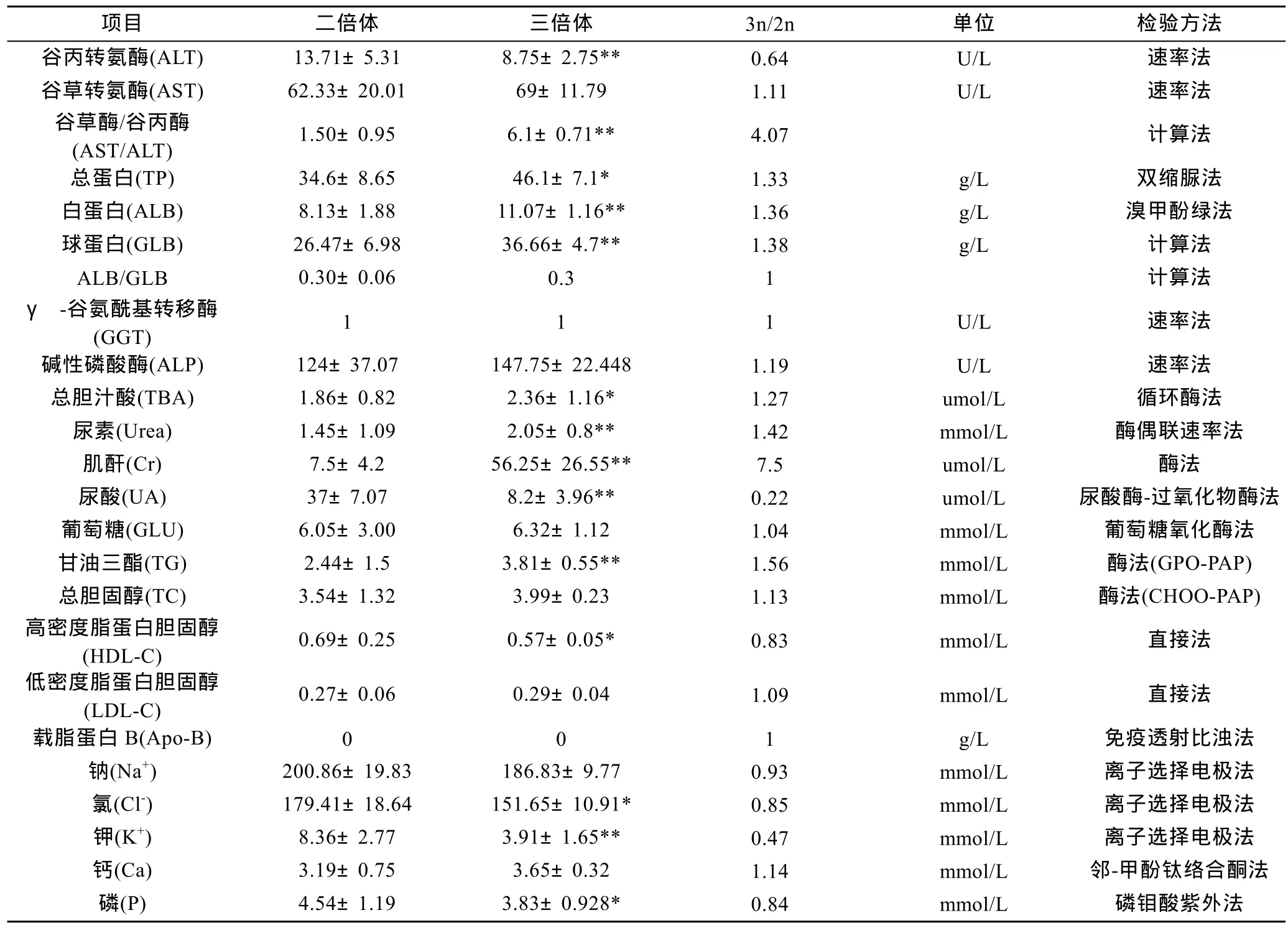
表5 二倍体和三倍体青龙斑生化指标比较Tab.5 Comparison in biochemical index between diploid and triploid Qinglong groupers
3.2 青龙斑二倍体与三倍体血液生理生化特性的比较
作者发现青龙斑三倍体血红蛋白含量显著少于二倍体, 而平均血细胞体积(MCV)、血细胞压积(HCT)等血液参数值明显高于二倍体, 这与对舌齿鲈的研究结果一致(Stefano et al, 2005), 而与泥鳅等(Gao et al, 2007)结果相反, 这种异同可能与各物种的特性及其生活环境的异同有关。林光华等(1996)发现, 运动活跃的鱼类其血液性状指标要比少运动的鱼类高,而杂食性鱼类低于草食性鱼类, 草食性鱼类低于肉食性鱼类, 因此得出鱼类习性及食性影响其血液性状指标的高低。自然生长的石斑鱼生活在珊瑚礁和沙泥底的海区, 快速游泳、肉食性, 青龙斑作为斜带石斑鱼♀×鞍带石斑鱼♂的杂交子一代, 保留双亲的生活习性; 而泥鳅属钻泥沙、底栖、少运动的生活方式; 青龙斑鱼血液性状指标正好与其生活习性特点相吻合。同时三倍体中存在一些如纺锤形和月牙形的异常红细胞, 可能是由于三倍体的红细胞存在一些异常无丝分裂造成的, 这也为区分青龙斑的二倍体与三倍体提供一个判断依据。
鱼的血液组成包括水、无机成分和有机成分。尾畸久雄(1982)已对鱼类血液中的部分无机成分含量进行了归纳总结, 得出了相应的范围: (1) 主要的阴离子: 作为阴离子的主要部分——氯离子, 硬骨鱼的含量通常处于 150—180mmol/L之间; 对于磷离子, 已有报道很少, 尚不清楚其合适范围, 而硫酸盐和磷酸盐离子在不同的鱼类中存在很大差异。(2) 主要的阳离子: 钠离子作为血液中阳离子的重要组成部分, 其在硬骨鱼中含量为 150—200mmol/L; 钾离子较少,其含量小于 10mmol/L; 而钙离子, 不同的鱼差别很大, 一般在5mmol/L以下; 镁略少于钙。本文实验结果得出的二倍体和三倍体青龙斑血液中的各项无机盐含量均符合上述限定值, 在正常范围之内; 但三倍体含量低于二倍体, 这与舌齿鲈的结果基本一致, 其中原因有待于进一步研究。
广东省大亚湾水产试验中心, 2010. 广东首次批量培育出石斑鱼新品种. 科学养鱼, (02): 74
王 燕, 张 勇, 张海发等, 2014. 两种杂交石斑鱼及其亲本的形态差异分析. 水产学报, 36(6): 780—785
吕国敏, 黄小林, 李 涛等, 2013. 青龙斑高位池人工育苗技术研究. 江苏农业科学, 41(11): 249—251
邹拓谜, 肖 俊, 刘少军等, 2011. 洞庭湖水域不同倍性野生鲫的血液相关特点. 水产学报, 35(10): 1488—1493
张海发, 王云新, 林 蠡等, 2004. 斜带石斑鱼血液性状及生化指标的研究. 华南师范大学学报(自然科学版), 1: 102—107
陈侠君, 王炳谦, 刘 奕等, 2010. 二倍体和三倍体虹鳟外周血细胞的比较研究. 东北农业大学学报, (01): 86—92
林光华, 张丰旺, 洪一江等, 1996. 团头鲂和日本白鲫血液的比较研究. 动物学报, 42(3): 260—268
林浩然, 2007. 鱼类生理学. 广州: 广东高等教育出版社, 89—94
周翰林, 张 勇, 齐 鑫等, 2012. 两种杂交石斑鱼子一代杂种优势的微卫星标记分析. 水产学报, 36(2): 161—168
楼允东, 2009. 鱼类育种学. 北京: 中国农业出版社, 129
尾畸久雄著, 许学龙, 熊国强, 缪圣赐译, 1982. 鱼类血液与循环生理. 上海: 上海科学技术出版社, 55—92
Benfey T J, 1999. The physiology and behaviour of triploid fishes. Rev Fish Sci, 7: 39—67
Del O B, Fajer-Avila E J, Alamazan-Rueda P et al, 2011.Hematological characteristics of the spotted rose snapper Lutjanus guttatus (Steindachner, 1869) healthy and naturally infected by dactylogyrid. Tissue and Cell, 43: 137—142
Gao Z X, Wang W M, Khalid A, 2007. Haematological characterization of loach Misgurnus anguillicaudatus:Comparison among diploid, triploid and tetraploid specimens.Comparative Biochemistry and Physiology, Part A, 147: 1001—1008
Gregory T R, 2002. Genome size and developmental parameters in the homeothermic vertebrates. Genome, 45(5): 833—838 Heemstra P C, Randall J E, 1993. Groupers of the world. FAO Fisheries Synopsis, 16(125): 130—132
Nelson J S, 2006. Fishes of the World. 4thed. New York: Wiley Press, 383—384
Sezaki K, Watabe S, Hashimoto K, 1988. Haematological parameters and erythrocyte enzyme activities associated with increase in ploidy status of the spinous loach, Cobitis biwae Jordan and Snyder. J Fish Biol, 32: 149—150
Sezaki K, Watabe K, Tsukamoto K et al, 1991. Effects of increase in ploidy status on respiratory function of ginbuna,Carassius auratus Langsdorfi (Cyprinidae). Comp Biochem Physiol A, 99: 123—127
Small S A, Benfey T J, 1987. Cell size in triploid salmon. J Experi Zoology, 241: 339—342
Stefano P, Stamatis V, Beatrice C, 2005. Haematological and physiological characteristics of diploid and triploid sea bass,Dicentrarchus labrax L. Aquaculture, 244: 359—367
猜你喜欢
杂志排行
海洋与湖沼的其它文章
- 俄罗斯鲟(Acipenser gueldenstaedtii)家系构建及不同家系间生长性能比较*
- 杂色鲍(Haliotis diversicolor)硒结合蛋白1基因的克隆及其应激表达*
- 盐度调控对花鲈(Lateolabrax maculatus)生长相关基因表达的影响*
- 鳗弧菌(Vibrio anguillarum)侵染对青蛤(Cyclina sinensis)髓样分化因子88基因表达的影响*
- 连续降温对大菱鲆(Scophthalmus maximus)成鱼血清生化指标及Wap65-1基因表达的影响*
- 洞庭青鲫(Carassius auratus var. Dongtingking)与三个鲫品系群体遗传多样性的ISSR分析*
