HOXC6通过激活转化生长因子β信号通路增强肿瘤细胞活性
2015-03-07曹晓玮阎锡新刘姣姣河北省石家庄市第一医院呼吸内科河北石家庄0500河北医科大学第二医院呼吸内科河北石家庄050000河北省石家庄市第一医院普外科河北石家庄0500
曹晓玮,阎锡新,刘姣姣,杨 涛(.河北省石家庄市第一医院呼吸内科,河北 石家庄 0500;2.河北医科大学第二医院呼吸内科,河北 石家庄 050000;.河北省石家庄市第一医院普外科,河北 石家庄0500)
·论著·
HOXC6通过激活转化生长因子β信号通路增强肿瘤细胞活性
曹晓玮1,阎锡新2*,刘姣姣1,杨涛3(1.河北省石家庄市第一医院呼吸内科,河北 石家庄 050011;2.河北医科大学第二医院呼吸内科,河北 石家庄 050000;3.河北省石家庄市第一医院普外科,河北 石家庄050011)
[摘要]目的通过转染肿瘤细胞,探讨同源异型盒C6(homeobox C6,HOXC6)在肿瘤进展中的作用机制。方法应用质粒转染、transwell、免疫荧光及Western blot检测肿瘤细胞中HOXC6表达对转化生长因子β(transforming growth factor-β,TGF-β)信号通路及肿瘤细胞活性的影响。结果过表达HOXC6的肝癌细胞Huh-7细胞迁移数明显高于未转染HOXC6组(P<0.01),磷酸化Smad2表达明显高于未转染HOXC6组(P<0.01),而Smad2/3表达明显少于未转染HOXC6组(P<0.01)。过表达HOXC6的肝癌细胞Huh-7 Smad2在细胞核中表达强。结论HOXC6过表达可激活TGF-β信号通路,增强肿瘤细胞活性。
[关键词]肿瘤细胞,培养的;基因,同源异型盒;转化生长因子β
doi:10.3969/j.issn.1007-3205.2015.12.015
恶性肿瘤是目前威胁人类生命健康的主要疾病,其中肺癌、肝癌等恶性肿瘤又是世界上主要的致死癌症[1-2]。恶性肿瘤目前没有有效的药物治疗,特别是肺癌、肝癌又易早期转移,大多数患者不能接受手术治疗,包括根治性切除。此外,由于肿瘤的高复发性和转移性,致使手术疗效依然不佳。因此,了解疾病的分子学基础是恶性肿瘤预防和治疗非常可取的新策略。目前已有研究证实,同源异型盒基因(homeobox,HOX)是一个含有至少200个转录因子的家族,含有一个高度保守的由61个氨基酸同源结构域缠绕而成的DNA。人类HOX家族由39个成员组成,共分为A、B、C、D 4类,存在于7、17、12、2号染色体上,“形似性”用于描述不同种群中基因的关系,以证明在染色体中存在最大的相同序列也就是相同的基因排列(如HOXA5、HOXB5、HOXC5)。而有13个形似性群体存在,不是说HOX基因簇存在于所有13组里,而是每组包含2~4名成员。HOX家族是发育调控基因,其在组织发育和分化过程中发挥着重要调节作用,在组织复制中起关键作用。在多种癌症包括肺癌、白血病、乳腺癌、结肠癌、肾癌、卵巢癌、前列腺癌[3-9]中发现HOX基因失调。HOX家族成员HOXC6在肺癌、卵巢癌、食管癌、乳腺癌和前列腺癌中异常表达,HOXC6表达水平也与淋巴结转移相关[10-12]。同时有研究表明,胃癌、食管鳞状细胞癌患者HOXC6过表达术后有效生存期明显缩短,并证实HOXC6可作为胃癌及食管鳞状细胞癌术后效果评估的指标[13]。HOXC6通过调节其生物学目标起作用,如骨形态发生蛋白7(bone morphogenetic protein-7,BMP7)、成纤维细胞生长因子受体2(fibroblast growth factor receptor 2,FGER2)、血小板源性生长因子受体α多肽(platelet derived growth factor receptor,PEGFRA)。它也调节磷脂酰肌醇3-激酶/丝氨酸/苏氨酸蛋白激酶信号通路。以往研究表明,HOXC6 siRNA敲除诱导细胞凋亡,HOXC6过表达导致细胞增生和凋亡减少。本研究通过干扰肝癌细胞中HOXC6的表达观察其对肿瘤细胞活性的影响,并揭示HOXC6在肿瘤细胞中的作用途径,旨在为深入研究肿瘤发生的分子机制提供研究线索,并为临床肿瘤治疗提供一个潜在的靶点。现报告如下。
1材料与方法
1.1实验材料人肝癌细胞株Huh-7、HepG2购自美国模式菌种收集中心。达尔伯克必需基本培养基(Dulbecco minimum essential medium,DMEM)和胎牛血清购自美国Invitrogen公司,哺乳动物细胞表达载体pcDNA3.1(+)和4′,6-二脒基-2-苯基吲哚购自美国Invitrogen公司、兔多克隆抗体HOXC6(1∶1 000)购自英国Abcam公司,磷酸化蛋白Smad2(1∶1 000)和Smad2/3(1∶1 000)购自美国Cell signaling公司,红外线标记的兔抗人二抗购自德国LI-COR公司,Odyssey双色红外荧光成像仪购自德国LI-COR公司。
本研究经医院医学伦理委员会批准。
1.2肝癌细胞复苏及培养人肝癌细胞株Huh-7、HepG2从液氮罐中取出,置于恒温水浴箱中(37 ℃),使冻存细胞悬液溶解后加入37 ℃温育的培养基DMEM中。1 000 r/min,离心5 min,弃上清液,常规置于DMEM培养基中(含10%胎牛血清和1%青霉素/链霉素),37 ℃,5% CO2加湿空气培养。
1.3质粒构建利用HepG2细胞株的总DNA 逆转录聚合酶链反应得到全长的HOXC6 cDNA。引物序列为:正向5′-GGATCCATGAATTCCTACT-TCACT-3′;反向5′-CTCGAGTCACTCTTTCTG-CTTCT-3′。聚合酶链反应产物克隆到哺乳动物细胞表达载体pcDNA3.1(+)的BamH Ⅰ和Xho Ⅰ酶切位点上。建立HOXC6 siRNAs表达载体。用荧光标记梯度浓度的siRNA转染至肝癌细胞株Huh-7,转染后于37 ℃ 5% CO2及饱和湿度的细胞培养箱中培养10 h,更换培养液继续培养72 h,在800 mg/L G418溶液中筛选HOXC6过表达的Huh-7细胞系。
1.4免疫荧光实验将细胞置于含4%多聚甲醛的磷酸盐缓冲液玻璃皿中培养30 min。在室温下以0.1%的Triton X-100渗透化细胞30 min并以0.5%牛血清白蛋白封堵30 min。用磷酸盐缓冲液冲洗后,和一抗于4 ℃培养过夜。再次用磷酸盐缓冲液洗涤,在室温下和用共轭异硫氰酸荧光素标记的二抗培养1 h,然后用4′,6-二脒基-2-苯基吲哚染色。以OLYMPUS显微镜成像,拍摄照片。
1.5Western blot检测每个样本加入30 μg裂解液,用10%聚丙烯酰胺凝胶电泳分离并转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上,随后培养于兔多克隆抗体HOXC6(1∶1 000),Smad2(1∶1 000)、Smad2/3(1∶1 000),4 ℃过夜。二抗孵育:以Tris缓冲液(Tris-buffered saline and tween 20,TBST)洗膜,10 min×3次,然后加入1∶10 000稀释的红外线标记的兔抗人二抗,37 ℃孵育1.5~2.0 h。成像:采用德国LI-COR公司Odyssey双色红外荧光成像仪成像,分析条带的OD,计算目的产物条带OD/β-actin产物条带OD,作为目的产物的相对含量。
1.6Transwell实验用Transwell实验检测肝癌细胞的侵袭能力。Matrigel-coated transwell 小室上室中以无血清培养基培养1×105细胞,下室则含完全培养基(10%胎牛血清)。在37 ℃,5% CO2培养24 h后,黏附到膜表层的细胞以棉签清除,迁移到底部的细胞以70%甲醇固定并用结晶紫染色。对迁移到膜底部的细胞进行倒置显微镜拍摄照片和计数。

2结果
2.1HOXC6过表达能够增强肝癌细胞的侵袭及转移能力将HOXC6低表达的肝癌细胞系Huh-7 转染HOXC6,然后应用Transwell实验检测肝癌细胞的侵袭能力,结果显示过表达HOXC6肝癌细胞Huh-7细胞迁移数明显高于未转染HOXC6组(P<0.01),见表 1。

表1 肝癌细胞转染HOXC6后侵袭能力的变化 ,个)
2.2HOXC6能够通过激活TGF-β信号通路增强肝癌细胞的侵袭及转移能力应用Western blot检测TGF-β信号通路中关键蛋白Smad2,结果发现过表达HOXC6肝癌细胞Huh-7中磷酸化Smad2表达明显高于未转染HOXC6组(P<0.01),而Smad2/3表达明显少于未转染HOXC6组(P<0.01),见表2。
应用免疫荧光实验检测肝癌细胞Huh-7转染HOXC6后Smad2在细胞内定位的变化,结果发现过表达HOXC6的肝癌细胞Huh-7与未转染HOXC6的肝癌细胞Huh-7 相比Smad2在细胞核中表达强 (图1)。

表2 肝癌细胞转染HOXC6后Smad2及
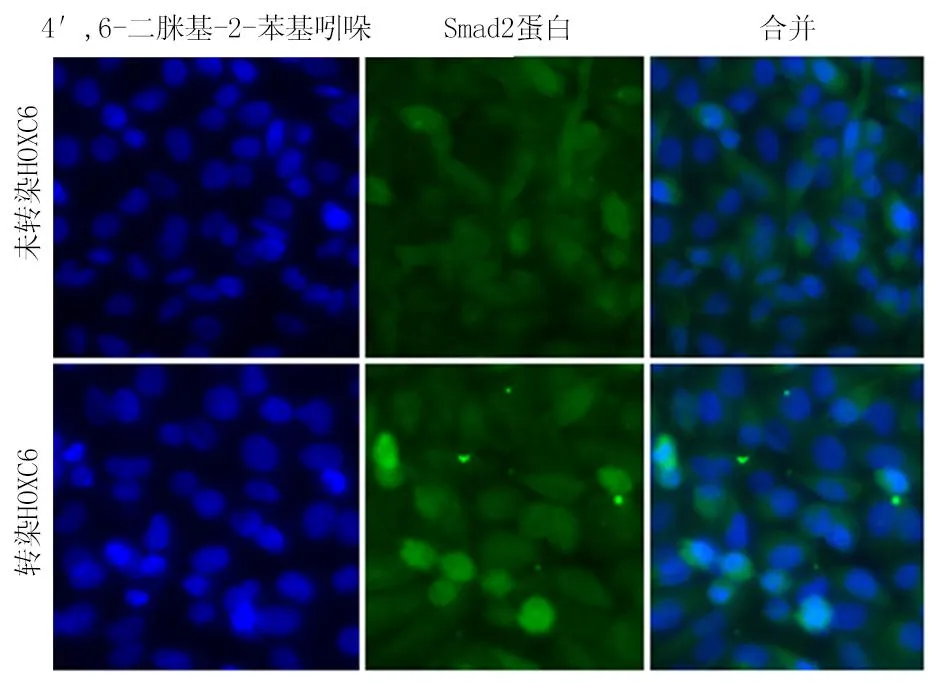
图1肝癌细胞Huh-7转染HOXC6后Smad2在细胞内定位的变化(免疫荧光 ×100)
3讨论
很多分子途径通过控制胚胎发育过程参与肿瘤形成。HOX转录因子在胚胎发育中必不可少,且在细胞关键的分化和增殖中起决定性作用。已有报道称在畸形和恶性肿瘤中HOX基因表达异常,故HOX基因的表达在恶性肿瘤诊断和治疗中可能很重要[14]。无论在体内还是体外,HOX过表达都能使哺乳动物的细胞改变,且在许多肿瘤类型中都发现了HOX基因的表达。正常HOX基因的表达被破坏,通过多种途径促进肿瘤形成和转移。
不同种类HOX基因失调与人类数种癌症相关,包括肺癌、肝癌、白血病、大肠癌、乳腺癌、肾癌、黑色素瘤和皮肤鳞状细胞癌等[3-8]。因为各个基因并不一致,所以考虑HOX不是一个单一的致病基因,而是组织特异性干扰已有的HOX导致其表达失调来致病。在人体内,HOX基因构成数个最大的基因家族,包含一个序列,称为同源异型盒。同源异型盒首先在果蝇的同源基因中确定。HOX基因是高度保守的,它跨越的范围很广,从秀丽隐杆线虫、果蝇到人类。1992年,建立了脊椎动物的统一命名系统,按规定人类基因用大写字母(HOXA1),小鼠基因用小写字母(Hoxa1)。小鼠基因破坏的研究表明,在发育过程中基因有一定程度的功能性合作,这些研究正在扩展到人体组织。然而,由于旁系关系复杂,个人HOX基因的重要性目前未知。事实上,越来越多证据表明,同样的HOX基因在不同组织中功能不同,这种蛋白结构的特异性很重要。
HOXC6是HOX家族成员,据猜测它的功能可能是通过位于其N端的DNA同源结构域直接结合到DNA的启动子元件上。HOXC6在肺癌、卵巢癌、食管癌、乳腺癌和前列腺癌中异常表达,HOXC6表达水平也与淋巴结转移相关。在前列腺细胞中,HOXC6直接调节 BMP7、FGFR2、胰岛素样生长因子结合蛋白3和PDGFRA的表达,间接影响糖蛋白Wnt信号通路;抑制PDGFRA可以抑制前列腺癌细胞增殖,而它的过表达能够对抗PDGFRA抑制的影响[9]。HOXC6过表达可导致胃癌、食管鳞状细胞癌患者术后有效生存期明显缩短,HOXC6可作为胃癌及食管鳞状细胞癌患者术后效果评估的指标。HOXC6表达增加有促进癌症淋巴结转移的倾向,HOXC6 siRNA敲除诱导细胞凋亡,HOXC6过表达导致细胞增生和凋亡减少。提示HOXC6可能在肿瘤转移中起重要作用。
TGF-β是一种以二硫键链接的多肽,在其结构中有9个半胱氨酸残基通过二硫键链接组成半胱氨酸的刚性结构,目前已发现TGF-β在哺乳动物中存在TGF-β1、TGF-β2、 TGF-β3共3个亚单位,它们的核苷酸序列具有高度的同源性。其中TGF-β1位于人类第19号染色体上,是一种多效性细胞因子,有助于切口愈合、血管生成、纤维化等。越来越多证据表明,TGF-β1既可以作为肿瘤抑制因子,又能通过SMAD蛋白依赖和非依赖级联反应促进肿瘤启动。事实上TGF-β1的功能取决于肿瘤的分期。在正常的上皮细胞,它作为肿瘤抑制因子,抑制细胞增殖和诱导凋亡;反之,当肿瘤已存在时,则加快癌症进展。TGF-β可以作为任一种肿瘤的抑制因子或启动子。在肿瘤发生初期TGF-β通过上调细胞周期蛋白激酶抑制剂的水平来抑制肿瘤细胞生长,但随着恶性肿瘤的进展,细胞周期蛋白激酶抑制剂水平不能抑制肿瘤生长时,肿瘤细胞开始产生大量的TGF-β,这时TGF-β成为肿瘤启动子并通过Smad蛋白依赖性和非依赖性途径诱导上皮向间质转变,从而促进肿瘤的生长和转移。此外,TGF-β在间质细胞和肿瘤细胞的相互作用中发挥着中介作用,且TGF-β调节肿瘤微环境。目前有研究发现,乳腺癌小鼠模型接受放疗或化疗后体内TGF-β1表达水平明显增高并促进了肿瘤细胞的侵袭、转移,应用抗TGF-β的单克隆抗体处理后乳腺癌小鼠模型中肿瘤的侵袭和转移明显得到抑制[15-16]。证实TGF-β1水平高表达可促进肿瘤的进展。
那么HOXC6是否也可以通过TGF-β信号通路参与肿瘤的进展。本研究结果显示过表达HOXC6肝癌细胞Huh-7细胞迁移数明显高于未转染HOXC6肝癌细胞Huh-7,证实肝癌细胞的侵袭能力明显增强;行Western blot检测及免疫荧光实验,结果显示过表达HOXC6肝癌细胞Huh-7与未转染HOXC6肝癌细胞Huh-7相比,磷酸化Smad2表达明显增加,Smad2/3表达则明显减少,并且Smad2易位于细胞核。证实TGF-β信号通路中的关键蛋白Smad2被活化,TGF-β信号通路活性明显增加。
综上所述,在肝癌细胞中过表达HOXC6可以通过激活TGF-β信号通路增强其侵袭能力,证实HOXC6可以通过诱导TGF-β信号通路在肿瘤发生发展过程中起着重要作用,这些将有可能为临床肿瘤的治疗提供一个潜在靶点,但TGF-β信号具体通过诱导那些基因发挥其作用,尚需进一步深入研究来确定。
[参考文献]
[1]杨涛,孙轶飞,王立伟,等.KIF14过表达与肝细胞肝癌手术预后密切相关[J].河北医科大学学报,2014,35(3):263-265.
[2]刘宏侠,孙玉满,谷守琦,等.促红细胞生成素及其受体在非小细胞肺癌中的表达及临床意义[J].临床荟萃,2011,26(15):1321-1325,封2.
[3]Morgan R,Boxall A,Harrington KJ,et al.Targeting HOX transcription factors in prostate cancer[J].BMC Urol,2014,14:17.
[4]Ando H,Natsume A,Senga T,et al.Peptide-based inhibition of the HOXA9/PBX interaction retards the growth of human meningioma[J].Cancer Chemother Pharmacol,2014,73(1):53-60.
[5]Daniels TR,Neacato II,Rodriguez JA,et al.Disruption of HOX activity leads to cell death that can be enhanced by the interference of iron uptake in malignant B cells[J].Leukemia,2010,24(9):1555-1565.
[6]Errico MC,Felicetti F,Bottero L,et al.The abrogation of the HOXB7/PBX2 complex induces apoptosis in melanoma through the miR-221&222-c-FOS pathway[J].Int J Cancer,2013,133(4):879-892.
[7]Li Z,Zhang Z,Li Y,et al.PBX3 is an important cofactor of HOXA9 in leukemogenesis[J].Blood,2013,121(8):1422-1431.
[8]Morgan R,Boxall A,Harrington KJ,et al.Targeting the HOX/PBX dimer in breast cancer[J].Breast Cancer Res Treat,2012,136(2):389-398.
[9]Hussain I,Bhan A,Ansari KI,et al.Bisphenol-A induces expression of HOXC6,an estrogen-regulated homeobox-containing gene associated withbreast cancer[J].Biochim Biophys Acta,2015,1849(6):697-708.
[10]Hamid AR,Hoogland AM,Smit F,et al.The role of HOXC6 in prostate cancer development[J].Prostate,2015,75(16):1868-1876.
[11]Tait DL,Bahrani-Mostafavi Z,Vestal CG,et al.Downregulation of HOXC6 in Serous Ovarian Cancer[J].Cancer Invest,2015,33(7):303-311.
[12]Du YB,Dong B,Shen LY,et al.The survival predictive significance of HOXC6 and HOXC8 in esophageal squamous cell carcinoma[J].J Surg Res,2014,188(2):442-450.
[13]Zhang Q,Jin XS,Yang ZY, et al.Upregulated Hoxc6 expression is associated with poor survival in gastric cancer patients[J].Neoplasma,2013,60(4):439-445.
[14]Wurm M,Kowalski J,Heckl D,et al.Ectopic expression of HOXC6 blocks myeloid differentiation and predisposes to malignant transformation[J].Exp Hematol,2014,42(2):114-125.
[15]Li Y,Rouhi O,Chen H,et al.RNA-Seq and network analysis revealed interacting pathways in TGF-beta-treated lung cancer cell lines[J].Cancer Inform,2015,13(Suppl 5):129-140.
[16]Rajput S,Kumar BN,Banik P,et al.Hymoquinone restores radiation-induced TGF-beta expression and abrogates EMT inchemoradiotherapy of breast cancer cells[J].J Cell Physiol,2015,230(3):620-629.
(本文编辑:赵丽洁)
[中图分类号]R394.26
[文献标志码]B
[文章编号]1007-3205(2015)12-1420-05
[作者简介]曹晓玮(1977-),女,河北邢台人,河北省石家庄市第一医院副主任医师,医学博士研究生,从事呼吸系统疾病诊治研究。*通讯作者。E-mail:xi-xin-yan@163.com
[基金项目]石家庄市科学技术研究与发展指导计划(141463243)
[收稿日期]2015-11-18;[修回日期]2015-12-04
