血清淀粉酶、降钙素原联合C反应蛋白在急性胰腺炎诊断中的意义
2015-03-07牛敏,刘雷
牛 敏,刘 雷
(1.安徽医科大学外总实验室,安徽 合肥 230032;2.安徽医科大学第一附属医院急诊外科,安徽 合肥 230022)
血清淀粉酶、降钙素原联合C反应蛋白在急性胰腺炎诊断中的意义
牛敏1,刘雷2
(1.安徽医科大学外总实验室,安徽 合肥230032;2.安徽医科大学第一附属医院急诊外科,安徽 合肥230022)
摘要:目的探讨联合检测血清淀粉酶(AMY)、C反应蛋白(CRP)和降钙素原(PCT)对急性胰腺炎(AP)早期诊断的意义。方法分别检测60例轻型胰腺炎(MAP)患者和9例重型胰腺炎(SAP)患者和48例健康人的血清AMY、CPR、PCT水平,比较各组结果。同时,对单项指标和联合检测指标进行灵敏度、特异度的比较,并通过受试者工作特征曲线(ROC曲线)分析其诊断价值。结果AP患者血清中的CRP水平高于对照组,且入院时SAP患者血液中的CRP比MAP患者高(P<0.05),ROC曲线中血清AMY、PCT的曲线下面积(AUC)较高,三项指标联合检测对AP的诊断效果最佳。结论联合检测AMY、CRP和PCT可提高AP诊断的灵敏度。
关键词:急性胰腺炎;淀粉酶;降钙素原;C反应蛋白
随着人们生活水平的不断提高,使得急性胰腺炎(AP)的发病率逐年增高。临床上大部分急性胰腺炎为轻型胰腺炎(MAP),恢复后可无后遗症;约20%患者为急性重型胰腺炎(SAP),可引起严重的全身炎症反应,对器官损害严重[1-2]。提高对急性胰腺炎的早期诊断和治愈率,成为临床工作和实验研究的难点。
1资料与方法
1.1一般资料所选病例均为2013年1月—2014年2月间就诊于安徽医科大学第一附属医院急诊科的69例AP患者。并将AP组分为MAP、SAP,同时排除其他急腹症,如消化道溃烂穿孔等。其中MAP 60例,男25例,女35例,平均年龄(52.8±16.6)岁;SAP 9例,男5例,女4例,平均年龄(54.1±22.2)岁。选取48例健康体检者作为对照组,男16例,女32例,平均年龄(51.8±16.7)岁。AP组与对照组在年龄、性别构成等方面无统计学意义(P>0.05)。
1.2标本的收集和处理AP患者和体检者均于就诊当日采集空腹外周静脉血5 mL置于真空肝素抗凝管,使用离心机3 000 r·min-1的速度离心10 min。
1.3检测方法AMY测定使用酶法(罗氏公司试剂盒);PCT测定采用免疫荧光法(梅里埃公司试剂盒);CRP测定采用乳胶免疫比浊法(德赛公司试剂盒)。测定时严格按照说明书进行操作。
各指标参考范围:AMY(20~110 U·L-1)、PCT(0~0.5 μg·L-1)、CRP(0~3 mg·L-1)。
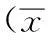
2结果
2.1各组间患者血清AMY、CRP、PCT水平的比较AP患者的血清AMY、PCT、CRP水平均高于正常对照组,差异有统计意义(P<0.05),表1;SAP患者的CRP水平显著高于MAP患者,差异有统计意义(P<0.05),同时血清AMY、PCT在两组中的差异无统计学意义(P>0.05),表2。

表1 AP组和正常对照组间患者血清AMY、
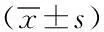
表 2 SAP和MAP组间患者血清AMY、
2.2血清AMY、CRP、PCT水平在ROC曲线中的表现AMY、PCT对AP的诊断都具有一定的准确性(0.7 2.3血清AMY、CRP、PCT水平对AP诊断的灵敏度、特异度三个指标对AP诊断的ROC曲线可见,AMY的曲线较PCT和CRP更靠近参考线的左上方,见图1。通过计算,联合AMY和PCT的AUC=0.918,AMY和CRP联合的AUC=0.902,联合PCT、CRP得到AUC=0.872,联合AMY、CRP及PCT可以得出AUC=0.936,见表3。以上说明联合检测该三个指标对AP的早期诊断有重要价值。 表 3 ROC曲线的AUC 3讨论 AP是临床常见的急腹症,随诊生活水平的提高,我国AP的发病率明显升高,引起AP升高的相关因素有高脂血症、饮酒、药物、胆道疾病及ERCR相关手术等。引起胰腺炎的机理是胰酶在胰腺腺体内被激活,引起胰腺自身消化、出血、水肿、甚至出现坏死的炎症反应。AP分为轻型胰腺炎(MAP)和重型胰腺炎(SAP),大部分患者为MAP,以胰腺组织水肿为主,经及时治疗后,预后相对较好,但仍有25%的患者可发展为SAP,表现为胰腺坏死、出血,继发细菌感染、败血症、多器官功能衰竭等,死亡率较高。因此,对AP的早期诊断、严重程度的早期预测和及时采取有效的治疗至关重要。临床中,评估AP严重程度的方法,常用的有Ranson、APACHEII评分预测系统等[3-4],增强CT对AP坏死的诊断具有较高的敏感性和特异性,但检查费用相对较高,寻找一种廉价、方便、快捷、敏感性和特异性均较好的检查方法很有必要。 AMY是诊断AP最为常用的生化指标,一般在AP起病后的6~12 h开始升高,48 h开始下降,持续3~5 d,血清淀粉酶超过正常参考值的3倍以上可确诊[5]。当胰腺炎发展为SAP时,血清AMY可能不升高或者降低,其他一些疾病如消化道穿孔、肠梗阻、胆道疾病也可以引起血清AMY升高,还有血清AMY水平与疾病的严重程度无相关性,不能用于评估严重程度[5]。 CRP对炎症、感染性疾病的预测非常敏感,且血清CRP检测具有快速、廉价,采集标本容易的优点,已被广泛应用于多种感染、炎症性疾病的早期诊断中。近年来,研究表明,CRP对AP的早期诊断及严重程度的预测有重要临床参考价值[6],Bezmarevic等[7-8]研究表明,AP患者血清CRP水平较正常对照组明显升高,SAP患者在入院24 h内血清CRP水平较MAP组明显升高,且死亡的患者较存活患者CRP水平也明显升高,入院24 h内对胰腺炎严重程度预测的敏感度和特异度分别为75%、86%。Ai[9]研究表明血清CRP水平与AP的进展、严重程度及预后具有相关性。 由于CRP检测不具有疾病特异性,大部分的炎症、感染行疾病都能引起CRP升高,因此,需联合其他指标,才能发挥其临床诊疗价值。近些年,有较多关于多指标联合检测对AP的早期诊断和预测严重性的研究,Mentula[10]研究,联合白介素-10和钙可用于预测胰腺炎器官衰竭的发生,这些联合指标检测明显优于其他任何单一的指标检测或者APACHE II评分,敏感性88%,特异性93%,诊断优势比94。Pearce等[11]研究,关于弹性蛋白酶和CRP的联合检测的在预测AP严重程度上的准确性为97%。本研究结果中,AP患者血清CRP含量显著升高,且SAP组CRP水平均高于MAP组,差异具有统计学意义(P<0.05)。 降钙素原(procalcitonin,PCT)是最近应用于临床监测炎症、感染的常用指标,研究证实临床监测PCT水平对全身炎症反应综合征和全身性感染有较高的诊断价值[12-13]。在各种炎性因子作用下,分泌PCT的相关基因的过度表达,全身相关的组织器官产生大量的PCT,使血清PCT水平显著升高,其中,细菌内毒素在诱导PCT大量产生中起非常重要的作用[14]。在人体出现炎症、感染等疾病时,PCT出现较早,有研究表明[15-16],在出现感染后的2~4 h内已经能检测到血清PCT,在6~12 h即可达到高峰,人体内PCT的半衰期约25~30 h,离体状态下较稳定,炎症控制后,血清PCT浓度很快下降,其水平的高低与疾病的严重程度有相关性,可用于炎症、感染性疾病的早期诊断及严重程度的评估。因此,也有少量关于PCT用于胰腺炎早期诊断及评估严重程度的研究,Rau等[16]研究表明,监测PCT水平能早期并且可靠地评估AP患者临床相关的胰腺感染及总体预后。Bezmarevic等[7]研究表明,入院24 h内,胰腺炎患者PCT浓度较正常人明显升高,在入院24 h内死亡患者的PCT浓度明显高于生存的患者。而且,在入院24 h内重症胰腺炎患者的PCT浓度明显高于轻型胰腺炎患者。黄家财等[17]研究表明,PCT相对于CRP等其他的检测指标,能更早的对胰腺炎进行诊断,病程中连续的监测PCT有助于预测疾病的预后。我们的研究中,AP患者血清PCT水平较对照组明显升高,联合检测AMY、PCT两项指标可以明显提高AP早期诊断的灵敏度、特异度,由此可见,联合检测血清AMY和PCT对AP的诊断具有积极意义。 根据ROC曲线可得出:在对AP的诊断上,AMY和PCT都具备一定的准确性,然而CRP的准确性最低(0.5 综上所述,我们认为AMY、PCT和CRP三项指标单独应用的诊断价值不能达到最大,三者的联合可使诊断价值达到最优。三者的联合检测对AP的诊断存在互补价值,既可提高诊断特异性,又不会明显降低敏感性,值得临床推广。 参考文献: [1]何满西,张擎达,刘续宝,等.重症急性胰腺炎病死原因分析:附144例[J].中华肝胆外科杂志,2010,16(6):404-406. [2]Whitcomb DC.Cilnical practice:acute pancreatitis[J].N Engl J Med,2006,354(20):2142-2150. [3]Abu-Eshy SA,Abolfotouh MA,Nawar E,et al.Ranson’S Criteria for Acute Pancreatitis in High Altitude:Do they Need to be Modified[J].Saudi J Gastroentero,2008,14(1):20-23. [4]Gravante G,Garcea G,Ong SL,et al.Prediction of Mortality in Acute Pancreatitis:A Systematic Review of the Published Evidence[J].Pancreatology,2009,9(5):601-614. [5]陆再英,钟南山,钱家鸣.急性胰腺炎//钱家鸣.内科学[M].北京:人民卫生出版社,2008: 469-478. [6]Wu BU,Johannes RS,Sun X,et al. Early changes in blood urea nitrogen predict mortality in acute pancreatitis[J].Gastroenterology,2009,137(1): 129-135. [7]Bezmarevic M,Kostic Z,Jovanovic M,et al.Procalcitonin and BISAP score versus C-reactive protein and APACHE II score in early assessment of severity and outcome of acute pancreatitis[J].Vojnosanitetski Pregled,2012,69(5): 425-431. [8]Bezmarevic M,Mirkovic D,Soldatovic I,et al.Correlation between procalcitonin and intra-abdominal pressure and their role in prediction of the severity of acute pancreatitis[J].Pancreatology,2012,12(4): 337-343. [9]Ai X,Qian X,Pan W,et al.Ultrasound-guided percutaneous drainage may decrease the mortality of severe acute pancreatitis[J].J Gastroenterol,2010,45:77-85. [10] Mentula P,Kylanpaa ML,Kemppainen E,et al.Early prediction of organ failure by combined markers in patients with acute pancreatitis[J].Br J Surg,2005,92:68-75. [11] Pearce CB,Gunn SR,Ahmed A,et al.Machine learning can improve prediction of severity in acute pancreatitis using admission values of APACHE II score and C-reactive protein[J].Pancreatology,2006,6:123-131. [12] Bell K,Wattie M,Syth K,et al.Procalcitonin:a Balker of bacteremia in SIRS [J].Anacsth Intensive Care,2003,31(6):629. [13] Balcl C,Sungurtekin H,Gurses E,et al.Usefulness of proealcitonin for diagnosis of sepsis in the intensive careunit[J].Crit Care,2003,7(1):85. [14] Fung YL,Fraser JF,Wood P,et al.The systemic inflammatory response syndrome induces functional changes and relative hyporesponsiveness in neutrophils.J Crit Care 2008,23(4): 542-549. [15] 李喜燕,季海生.降钙素原(PCT)的测定及临床意义[J].齐鲁医学检验,2005,6(16):92-94. [16] Rau BM.Predicting severity of acute panceratitis[J].Curr Gastroenterol Reo,2007,9(2):107-115. [17] 黄家财.急性胰腺炎患者血浆降钙素原的变化及其意义[J].内科,2012,7(5): 463-464. (收稿日期:2015-02-08,修回日期:2015-04-20) doi:10.3969/j.issn.1009-6469.2015.09.042
