MgH2BH4和Mg2对硝酸铵热分解过程的影响
2015-03-05魏亚杰陈利平彭金华
魏亚杰,陈利平,姚 淼,彭金华
(南京理工大学化工学院,江苏南京210094)
MgH2BH4和Mg2对硝酸铵热分解过程的影响
魏亚杰,陈利平,姚淼,彭金华
(南京理工大学化工学院,江苏南京210094)
摘要:为探索金属氢化物(MgH2和Mg(BH4)2)对硝酸铵(AN)热稳定性的影响,在升温速率分别为2、5、10和20 ℃/min条件下,用DSC测试了纯AN及其与MgH2或Mg(BH4)2混合物的热分解特性,根据DSC数据计算了热分解反应的表观活化能和指前因子等动力学参数,分析了加入金属氢化物引起AN热稳定性的变化机理。结果表明,加入MgH2后,AN分解反应的表观活化能变化较大,初始分解温度大大降低, AN的分解机理发生了改变;而加入Mg(BH4)2对AN的热分解过程影响不大,且表观活化能没有明显变化。
关键词:物理化学;热稳定性;金属氢化物;DSC;硝酸铵;AN; MgH2;Mg(BH4)2
引言
氢能是理想的高能清洁燃料,各国一直非常重视储氢材料的研究,而金属储氢材料由于其储氢密度高等特点得到广泛研究和应用[1]。金属元素中镁(Mg)的储氢能力最大,金属氢化物MgH2是一种新型储氢材料,其理论含氢量高达7.6%[2]。Mg(BH4)2是一种新型配位储氢材料,它的质量储氢密度为14.8%,体积储氢密度为112g/L[3]。由于这些金属氢化物有较大的储氢密度和反应热值及较高的反应活性,可尝试将其作为燃料组分应用于高性能火炸药中[4-5]。姚淼等[6]探索了金属氢化物MgH2和Mg(BH4)2对RDX热稳定性的影响,发现加入Mg(BH4)2不能明显降低RDX的热稳定性,而加入MgH2使RDX的热稳定性降低;JIN Li-mei[7]通过ARC测试研究了MgH2对硝化棉(NC)热分解特性的影响,发现加入MgH2后NC的反应速度大大提高,催化了NC的分解。
大部分含能材料的氧平衡均为负值,而储氢材料的燃烧和爆炸也需要大量的氧。因此许多学者开始探讨氧化剂与储氢材料的混合效果。刘磊力等[8]用DSC研究了氢化镁(MgH2)对高氯酸铵(AP)热分解过程的影响,结果表明,MgH2可以显著降低AP的分解温度,增大其表观分解热,对AP热分解具有显著的催化促进作用。李艺等[9]用DSC探索了添加剂对AN常温安定性和高温热活性影响的途径和机理,结果表明,在AN中加入木粉、棉纤维、KCl等添加剂后,其热分解温度降低,放热过程更加剧烈,热稳定性降低;王光龙等[10]在研究AN热稳定性时,发现硝酸、硫酸和磷酸的存在都会降低系统的热稳定性,明显加快AN的分解速度。因此,将MgH2和Mg(BH4)2加入AN之前,有必要了解其对AN热稳定性的影响。
本研究采用差示扫描量热仪(DSC)对AN及其与MgH2和Mg(BH4)2混合物样品进行分析,并基于获得的不同升温速率的DSC曲线进行动力学计算,得到活化能等动力学参数,以期得到MgH2和Mg(BH4)2对AN热稳定性的影响。
1实验
1.1材料及仪器
MgH2和Mg(BH4)2,同文献[5]所用材料,由上海交通大学材料科学与工程学院提供。
DSC1型差示扫描量热仪,瑞士梅特勒-托利多(METTLER TOLEDO)公司,动态高纯氮气氛围,流量30mL/min。其中样品池为体积30L的不锈钢密闭坩埚,样品质量约为1.3mg。升温速率分别为2、5、10、20℃/min,温度范围25~400℃。
1.2样品制备
分别采用直流电弧等离子体法和液相离子交换法,在高能球磨工艺条件下制备MgH2和Mg(BH4)2,将AN在60℃下烘干至恒重。将AN分别与MgH2和Mg(BH4)2按90∶10的质量比均匀混合制成样品,最后将样品放在保干器中保存。
2结果与讨论
2.1热分解过程
AN及其混合物吸热放热峰的起始分解温度(Ti)、峰温(Tp)等相关数据见表1, DSC曲线见图1。由于本研究主要考察加入金属氢化物对硝酸铵放热分解部分的影响,所以图1仅给出90~360℃的测试结果。图1中的(a)、(b)、(c)分别为同种样品在不同升温速率下的DSC曲线,图1 (d)为3种样品在同一升温速率下(5℃/min)的DSC曲线。
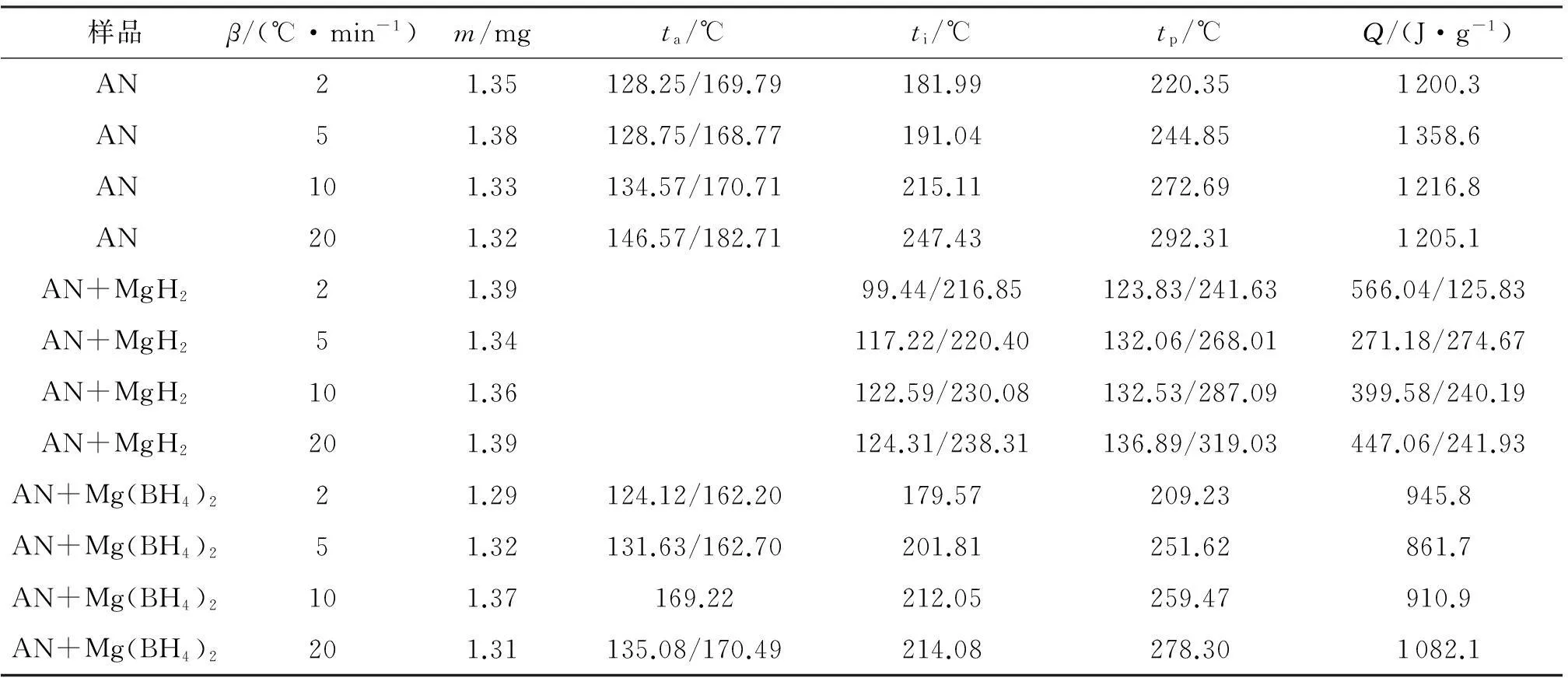
表1 3种样品的DSC结果
注:β为升温速率;m为样品质量;Ta为吸热峰峰值温度;Ti为起始分解温度;Tp为放热峰的峰值温度;Q为比放热量。
由文献[6]可知, Mg(BH4)2和MgH2的释氢吸热峰分别出现在490℃和480℃左右。
由表1和图1(a)可看出,纯AN在100~180℃之间出现了两个吸热峰,分别为AN的晶型转变和熔融过程(AN在-54~180℃之间有4个转晶吸热峰和一个熔融吸热峰[11])。升温速率为2℃/min时,AN在181.99℃开始出现放热。
由图1(b)可知,AN中加入MgH2后其DSC曲线出现了两次明显的放热过程。与纯AN相比,相同升温速率下,第一个放热峰出现在AN熔融之前,起始分解温度和峰温都有大幅度的降低,如升温速率2℃/min下起始分解温度降低了100℃,可能是MgH2与AN的反应放热峰;第二个放热峰的位置与纯AN的放热位置基本一致,可能是剩余未反应的AN继续在此温度段分解所致。从放出热量来看,MgH2的加入使AN的分解热从1200J/g降至692J/g(以升温速率2℃/min为例),即加入MgH2会使AN的产生的热量下降。
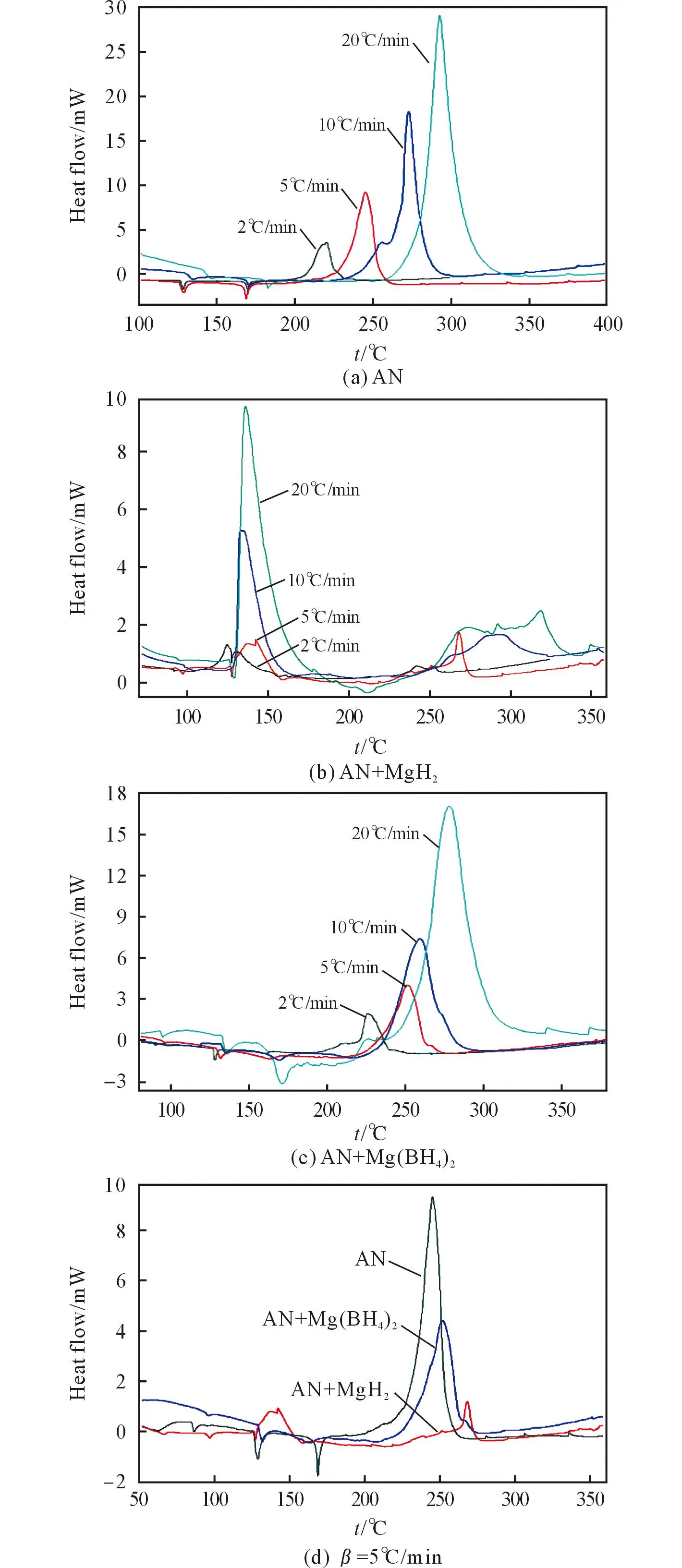
图1 3种样品的DSC曲线Fig.1 DSC curves of the three samples
在AN中加入Mg(BH4)2后,吸热峰以及放热峰的起始分解温度和峰温变化不大。
2.2动力学参数计算
为进一步研究AN及其与MgH2、Mg(BH4)2混合物的热危险性,采用Kissinger法和Friedman法对样品的DSC放热峰进行动力学分析,求得AN及其混合物的热动力学参数:表观活化能Ea和指前因子A。其中混合物AN+MgH2的放热分为两部分,Kissinger法中仅选取第一个放热峰进行动力学计算,而Friedman法则对两个放热峰分别进行了活化能计算。
Kissinger法采用的动力学方程为[12]:
(1)
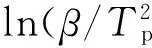
Friedman法采用的动力学方程为[13]:
(2)
式中:α为反应深度或转化率;T为相同α下的温度,单位为K;f(α)表示反应机理函数的微分形式。
在一组升温速率β下的DSC曲线中,选取尽量多个反应深度α。将每个α相对应的一组ln(dα/dt)和1/T值进行线性拟合可分别得到一条直线,利用直线斜率(-Ea/R)即可求得相应的活化能值Ea,从而得到活化能随着反应深度变化而变化的曲线。这种方法可靠性高,但计算繁琐,本研究使用AKTS- Thermokinetics软件自带的Friedman等转化率微分法对DSC数据进行处理。该软件认为无数个基元反应的热效应综合形成了热分析曲线,即整个放热过程中活化能Ea随着α不断变化[14]。
Kissinger法求得的动力学参数见表2。

表2 由Kissinger法求得的动力学参数
注:r为拟合直线的相关系数,AN+MgH2的计算采用第一个放热峰数据。
图2为采用Friedman法得到的活化能随转化率变化的曲线。其中,AN+MgH2(1)和AN+ MgH2(2)分别表示混合物AN+MgH2两个放热峰的活化能。由于DSC曲线在处理分析时基线的选取具有一定的人为性,所以很容易造成计算结果的误差,尤其是反应初期和反应结束的时候,因此只选取反应深度0.1~0.9之间的部分进行分析。
图2中AN、AN+MgH2(1)、AN+MgH2(2)、AN+ Mg(BH4)24条曲线拟合的相关系数分别为0.9627、0.9354、0.9611和0.9686。拟合的相关系数较低,主要由两个原因导致:(1)所用硝酸铵为工业纯,杂质含量较高;(2)MgH2和Mg(BH4)2与AN混合时是将两种固体样品按比例研磨混合,所以DSC实验时的取样难以保证均匀一致。
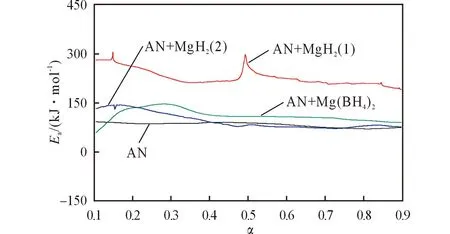
图2 Ea-α关系曲线Fig.2 The Eavs. α relation curves
由图2可知,纯AN的活化能约为65kJ/mol,与Kissinger法的计算值较接近。AN+MgH2的放热分为两部分来处理,因为它的两个放热峰完全脱离。第一部分的活化能值先由260kJ/mol下降到大约190kJ/mol,在反应深度为0.5处出现一个向上的尖峰,后基本维持在180kJ/mol左右;第二部分的活化能值由90kJ/mol逐渐降至60kJ/mol,与纯AN活化能基本一致,所以此处可能是剩余的AN发生了分解反应。可见MgH2的加入使得AN的反应变得更加复杂。AN+Mg(BH4)2的活化能基本维持在90kJ/mol左右,略高于Kissinger法的计算值。
2.3AN+MgH2的热分解过程分析
与纯AN相比,同一升温速率下,向AN中加入Mg(BH4)2后混合物样品的起始分解温度和峰温变化不大;而加入MgH2却使得AN的初始分解温度和峰温均降低了约100℃,导致AN在升温条件下更容易发生分解。这可能是由于MgH2的加入改变了AN的分解机理。
虽然AN的结构简单,但是其分解过程相当复杂,刘子如[15]结合AN的热分解动力学参数和产物分析,推断了可能的分解机理。其分解结果可近似表示为[16]:
6NH4NO3→N2O+10H2O+NH4NO3+3N2+2NO2
(3)
文献认为[17],AN在熔融之前就己经发生了少量分解,生成氨和硝酸(见式(4))。在之后的升温过程中,AN继续分解,同时存在HNO3和NH3的继续分解,它们相互作用或中间产物之间的相互作用生成各种可能的产物(见式(5)和(6))。关于式(6)NO2可氧化AN的离解物NH3的反应,可参见文献[18-19]。根据以上理论分析,认为AN可能的分解步骤有[16]:
NH4NO3→NH3+HNO3
(4)
4HNO3→4NO2+2H2O+O2
(5)
2NH3+2NO2→N2O+N2+3H2O
(6)
MgH2的热分解,即释放出氢气和镁粉的过程发生在480℃左右[6],而纯AN的热分解温度在300℃之前。MgH2又是很强的还原剂,因此认为在AN+MgH2混合物体系中,第一个放热峰的出现可能是由于在升温过程中MgH2和固态AN发生反应。
为了证实上述推测,做了硝酸和MgH2反应实验,在室温下将少量硝酸滴在MgH2粉末上,立即发生剧烈反应,生成棕红色气体。这意味着如果在熔融前硝酸铵就分解生成HNO3,那么MgH2的加入会立即与硝酸反应,并促进式(4)AN分解的平衡反应向右进行,使得AN和MgH2能够反应完全。由此推测第一个放热峰的反应可能为:
MgH2+4NH4NO3→Mg(NO3)2+2NO2+H2+
2H2O+4NH3
(7)
3结论
(1)MgH2对AN的热分解有明显的促进作用,使AN的分解热下降,不利于爆炸反应的发生。因此,MgH2不宜与AN混合使用。
(2)Mg(BH4)2使AN的表观活化能变化不明显,且使AN的初始分解温度和峰温的移动也不明显。Mg(BH4)2的加入对AN的热分解过程影响不大。
参考文献:
[1]Johnston B, Mayo M C, Khare A, et al. Hydrogen: The energy source for the 21st century[J]. Technovation, 2005, 25(6): 569-585.
[2]程扬帆,马宏昊,沈兆武. 氢化镁储氢型乳化炸药的爆炸特性研究[J]. 高压物理学报,2013, 27(4): 45-50.
CHENG Yang-fan, MA Hong-hao, SHEN Zhao-wu. Detonation characteristics of emulsion explosives sensitized by MgH2[J]. Chinese Journal of High Pressure Physics, 2013, 27(4): 45-50.
[3]陈君儿,熊智涛,吴国涛,等. 配位氢化物储氢材料Mg(BH4)2的研究进展[J]. 材料科学与工程学报,2011, 29(4): 639-646.
CHEN Jun-er, XIONG Zhi-tao, WU Guo-tao, et al. Review on hydrogen storage in Mg(BH4)2[J]. Journal of Materials Science and Engineering, 2011, 29(4): 639-646.
[4]范士峰. 金属储氢材料研究进展[J]. 化学推进剂与高分子材料,2010, 8(2): 15-19.
FAN Shi-feng. Research progress on preparation process and stability of aluminum trihydride[J]. Chemical Propellants and Polymeric Materials, 2010, 8(2): 15-19.
[5]窦燕蒙,罗运军,李国平,等. 储氢合金/AP/HTPB推进剂的热分解性能[J]. 火炸药学报, 2012, 35(3): 66-70.
DOU Yan-meng, LUO Yun-jun, LI Guo-ping, et al. Thermal decomposition properties of hydrogen storage alloy/AP/HTPB propellant[J]. Chinese Journal of Explosives and Propellants, 2012, 35(3): 66-70.
[6]姚淼,陈利平,堵平,等. Mg(BH4)2和MgH2对RDX热分解特性的影响[J]. 中国安全科学学报,2013, 23(1): 1-6.
YAO Miao, CHEN Li-ping, DU Ping. Effect of Mg(BH4)2and MgH2on thermal decomposition performance of RDX[J]. China Safety Science Journal, 2013, 23(1): 1-6.
[7]JIN Li-mei, DU Ping, YAO Miao. The influence of magnesium hydride on the thermal decomposition properties of nitrocellulose[J]. Journal of Energetic Materials, 2014, 32(1): 13-21.
[8]刘磊力,李凤生,支春雷,等. MgH2的制备及对高氯酸铵热分解过程的影响[J]. 稀有金属材料与工程,2010, 39(7): 1289 -1292.
LIU Lei-li, LI Feng-sheng, ZHI Chun-lei, et al. Synthesis of magnesium hydride and its effect on thermal decomposition of AP[J]. Rare Metal Materials and Engineering, 2010, 39(7): 1289-1292.
[9]李艺,惠君明. 几种添加剂对硝酸铵热稳定性的影响[J]. 火炸药学报,2005, 28(1): 76-80.
LI Yi, HUI Jun-ming. Effect of several additives on thermal characteristics of ammonium nitrate[J]. Chinese Journal of Explosives and Propellants, 2005, 28(1): 76-80.
[10]王光龙,许秀成. 硝酸铵热稳定性的研究[J]. 郑州大学学报(工学版),2003, 24(1): 47-50.
WANG Guang-long, XU Xiu-cheng. Study on Thermal stability of ammonium nitrate[J]. Journal of Zhengzhou University (Engineering Science), 2003, 24(1): 47-50.
[11]Enoksson E. Mechanical instability of ammonium nitrate duo to phase transitions[C]∥ Chemical Problems Connected with the Stability of Explosives, Sixth Symposium. Sweden:[s.n.], 1982: 487-512.
[12]蔡正千. 热分析[M]. 北京:高等教育出版社,1993: 235-236.
[13]胡荣祖,高胜利,赵凤起,等. 热分析动力学[M]. (第二版). 北京:科学出版社,2008: 305-308.
[14]俞进阳,陈利平,姜夕博,等. AKTS模拟分析常用绿焰剂的热稳定性[J]. 火工品,2012( 5): 48-51.
YU Jin-yang, CHEN Li-ping, JIANG Xi-bo, et al. Research on thermal stability of the common green flame pyrotechnics based on AKTS[J]. Initiators and Pyrotechnics, 2012(5): 48-51.
[15]刘子如. 含能材料热分析[M]. 北京:国防工业出版社,2008: 164-166.
[16]Patil D G, Jain S R, Brill T B. Thermal decomposition of energetic materials 56. On the fast thermolysis mechanism of ammonium nitrate and its mixtures with magnesium and carbon[J]. Propellants, Explosives, Pyrotechnics, 1992, 17: 99-105.
[17]Russell T P, Brill T B. Thermal decomposition of energetic materials 31-Fast thermolysis of ammonium nitrate, ethylenediammonium dinitrate and hydrazinium nitrate and the relationship to the burning rate[J].Combustion and Flame, 1989, 76(3/4): 393-401.
[18]Beford G, Thomas J H. Raection between ammonia and nitrogen dioxide[J]. Journal of the Chemical Society, Faraday Transactions, 1972(1): 2168.
[19]Brill T B, Brush P J, Patil D G. Thermal decomposition of energetic materials 58.Chemistry of ammonium nitrate and ammonium dinitramide near the burning surface temperature[J]. Combust Flame, 1993, 92: 178-186.
Effect of MgH2and Mg(BH4)2on Thermal Decomposition Process of Ammonium Nitrate
WEI Ya-jie,CHEN Li-ping,YAO Miao,PENG Jin-hua
(School of Chemical Engineering, Nanjing University of Science and Technology, Nanjing 210094, China)
Abstract:To explore the effect of addition of metal hydrides (MgH2, Mg(BH4)2) on the thermal stability of ammonium nitrate(AN), the thermal decomposition characteristics of pure AN and the mixture of AN with MgH2or Mg(BH4)2were measured by DSC at heating rates of 2, 5, 10 and 20℃/min. Thermal decomposition kinetic parameters such as activation energy and pre-exponential factor etc. were calculated by DSC data. The change mechanisms of thermal stability of AN caused by adding metal hydrides were analyzed. The results show that the addition of MgH2makes the apparent activation energy of AN decomposition reaction change greatly and the initial temperature of decomposition reaction reduce greatly and the decomposition mechanism of AN change. The addition of Mg (BH4)2has no obvious effect on the thermal decomposition process of AN, and the apparent activation energy of AN decomposition reaction does not change obviously.
Keywords:physical chemistry; thermal stability; metal hydride; DSC; ammonium nitrate; AN; MgH2; Mg(BH4)2
通讯作者:陈利平(1981-),女,博士,讲师,从事危险物质热分析的研究。
作者简介:魏亚杰(1989-),女,硕士研究生,从事含能材料热分析方向的研究。
收稿日期:2014-09-09;修回日期:2014-11-05
中图分类号:TJ55; O64
文献标志码:A
文章编号:1007-7812(2015)01-0059-05
DOI:10.14077/j.issn.1007-7812.2015.01.014
