miRNA-182通过调节EMT 相关分子ZEB2而抑制肺癌细胞转移和侵袭
2015-03-04朱志军薛亚军朱佳龙石河子大学医学院第一附属医院心胸外科新疆石河子832000
朱志军 薛亚军 朱佳龙(石河子大学医学院第一附属医院心胸外科,新疆 石河子 832000)
miRNA-182通过调节EMT 相关分子ZEB2而抑制肺癌细胞转移和侵袭
朱志军薛亚军朱佳龙
(石河子大学医学院第一附属医院心胸外科,新疆石河子832000)
〔摘要〕目的探讨微小RNA(miRNA) -182对肺癌细胞转移和侵袭的影响及其相关机制。方法采用荧光定量PCR方法检测肺癌细胞系和组织标本中miRNA-182表达情况;对miRNA-182表达情况与肺癌临床病理特征关系进行分析;通过Boyden小室分析和伤口愈合实验检测miRNA-182对肺癌细胞转移和侵袭能力的影响;生物信息学方法预测miRNA-182可能的靶基因,并采用荧光素酶报告基因实验验证预测的靶基因E盒结合锌指蛋白2(ZEB2)是miRNA-182的靶基因; Western印迹方法检测ZEB2、E-钙黏蛋白和波形蛋白的表达情况。结果四种肺癌细胞系miRNA-182 mRNA的表达情况为高转移能力的肺癌细胞系95D和L9981其miRNA-182 mRNA表达显著低于转移能力较弱的肺癌细胞系NL9980或95C(P<0.05),且同原发性肺癌组织相比,淋巴结转移癌组织中miRNA-182表达亦显著下调(P<0.05) ;临床病理特征关系分析结果显示,miRNA-182表达仅与是否存在淋巴结转移相关。转染miRNA-182可显著抑制肺癌细胞系95D和L9981的转移(P<0.05),同时,转染miRNA-182可显著抑制肺癌细胞系95D和L9981的侵袭能力(P<0.05),而转染miRNA-182抑制剂可增加肺癌细胞系95D和L9981的侵袭能力(P<0.05)。生物信息学预测显示ZEB2为miRNA-182的功能性靶基因,且得到荧光素报告实验结果证实。Western印迹结果显示转染miRNA-182可显著抑制肺癌细胞系95D和L9981中ZEB2和波形蛋白的表达,上调E-钙黏蛋白的表达。结论miRNA-182可通过调节ZEB2、E-钙黏蛋白和波形蛋白的表达,进而抑制肺癌细胞的转移和侵袭。
〔关键词〕肺癌; miRNA-182 ;细胞转移;细胞侵袭; E盒结合锌指蛋白2
第一作者:朱志军(1979-),男,硕士,主治医师,主要从事心胸外科相关疾病。
微小RNA(microRNA,miRNA)可在转绿后水平对基因的表达进行负调控〔1〕。miRNA在许多生物过程,包括发育、分化、凋亡、代谢、免疫和肿瘤进展中具有重要的作用。越来越多的证据表明,miRNA可调控肿瘤的发生和发展,并在肿瘤细胞的转移和侵袭中具有重要的作用〔2,3〕。因此,miRNA可能参与调解肺癌的发生、发展的重要环节。然而,关于miRNA-182在肺癌发生发展中的具体作用及相关机制尚未明确。本研究通过观察肺癌细胞和组织标本中miRNA-182表达情况,分析其与肺癌临床病理特征的关系,并在体外转染miRNA-182后观察肺癌细胞转移和侵袭能力的变化,验证miRNA-182的靶基因E盒结合锌指蛋白2(ZEB2),检测miRNA-182对ZEB2、E-钙黏蛋白和波形蛋白表达水平的影响,进而探讨miRNA-182在肺癌发生发展中的作用及相关机制。
1 材料与方法
1.1细胞及主要试剂人肺癌细胞系NL9980和L9981由四川大学华西医院四川省肺癌分子重点实验室惠赠,95C和95D由上海复旦大学生物化学与分子生物学重点实验室惠赠,细胞培养于含10%胎牛血清(BSA)的RPMI-1640培养基中。转染试剂Lipofectamine2000及TRIzol购自美国Invitrogen公司,SYBR Green PCR试剂盒、miRNA-182、阴性对照(NC)、antimiRNA-NC和anti-miRNA-182购自Ambion公司;侵袭实验用Boyden小室购自美国Millipore公司;荧光素酶检测试剂盒购自美国Promega公司; ZEB2、E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)和β-actin抗体购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的二抗购自北京中杉金桥生物技术有限公司。
1.2荧光定量PCR Trizol提取细胞总RNA,反转录成cDNA。PCR反应条件: 95℃5 min,95℃10 s,60℃20 s,共40个循环。引物序列: miRNA-182上游引物: 5'-TTTGGCAATGGTAGAACTCACACT-3',下游引物: 5'-GTCGTATCCAGTGCAGGGTCCGAG-3';内参照U6上游引物: 5'-GCTTCGGCAGCACATATACTAAAAT-3',下游引物: 5'-CGCTTCACGAATTTGCGTGTCAT-3'。得到的数据通过比较Ct值法(2-△△Ct)进行定量分析。
1.3细胞转染细胞长至70%融合时可用于转染。严格按照Lipofectamine2000转染说明书进行操作,转染36 h后可用于功能实验。
1.4转移和侵袭能力检测采用伤口愈合实验方法检测细胞转移能力,具体操作方法参见文献报道〔4〕。采用Boyden小室分析检测细胞侵袭能力,具体步骤:用于实验的细胞采用台盼蓝染色计数并重悬。将1×105个细胞置于小室上层,并补加培养基至300 μl。下层小室中加入含10%胎牛血清的培养基500 μl。孵育12 h后,未发生侵袭的细胞用棉拭子从上层腔室除去。下层小室中的细胞以0.1%结晶紫固定染色,计算出现侵袭的细胞数。
1.5生物信息学方法预测miRNA-182靶基因通过靶基因预测软件联合筛选出ZEB2作为miRNA-182的靶基因。
1.6荧光素酶报告基因验证靶基因miRNA靶点预测软件提示ZEB2 mRNA的3'端的非翻译区(3'UTR)的位点1303~1310 是miRNA-182的可能结合位点(BS),体外合成含该位点的DNA片段及含该位点突变体的DNA片段,克隆至双荧光素酶启动子载体pMIR: pMIR-ZEB2-3'-UTR-wt和pMIR-ZEB2-3'-UTR-mut。将pMIR-ZEB2-3'-UTR-wt或pMIR-ZEB2-3'-UTR-mut 及miRNA-182共同转染至肺癌细胞中,培养48 h后,用荧光素酶检测试剂盒检测荧光素酶活性。
1.7Western印迹等量提取细胞蛋白经8%~10%十二烷基硫酸钠-聚丙烯酸铵凝胶(SDS-PAGE)分离胶和5%浓缩胶分离后,半干转印至硝酸纤维素膜上,以含5% BSA的Tris盐酸缓冲液(TBST)室温封闭1 h,加入一抗4℃过夜孵育。第2天用0.1% TBST洗膜3次,5 min/次,加入相应的HRP标记的二抗,室温孵育1 h。0.1% TBST洗膜后,硝酸纤维素膜以Supersignal West Femto HRP敏感化学发光底物对条带进行显色。β-actin作为内参对照。所有实验至少重复3次。
1.8统计学方法应用SPSS16.0软件进行t检验。
2 结果
2.1肺癌细胞和组织标本中miRNA-182表达情况四种具有不同转移能力的肺癌细胞系miRNA-182表达高低不同,同转移能力较弱的肺癌细胞系NL9980(0.36±0.03)或95C(0.19± 0.03)相比,具有高转移能力的肺癌细胞系95D(0.05±0.02)和L9981(0.04±0.02)其miRNA-182 mRNA表达显著下调(P<0.05)。同时,与原发性肺癌组织(0.11±0.06)相比,淋巴结转移癌组织中miRNA-182 mRNA表达亦显著下调(P<0.05)。
2.2miRNA-182表达与肺癌临床病理特征的关系miRNA-182在肺癌组织的表达水平仅与患者有无淋巴结转移密切相关(P<0.05),而与患者年龄、性别、是否吸烟和临床分期均无明显关系(P>0.05)。见表1。
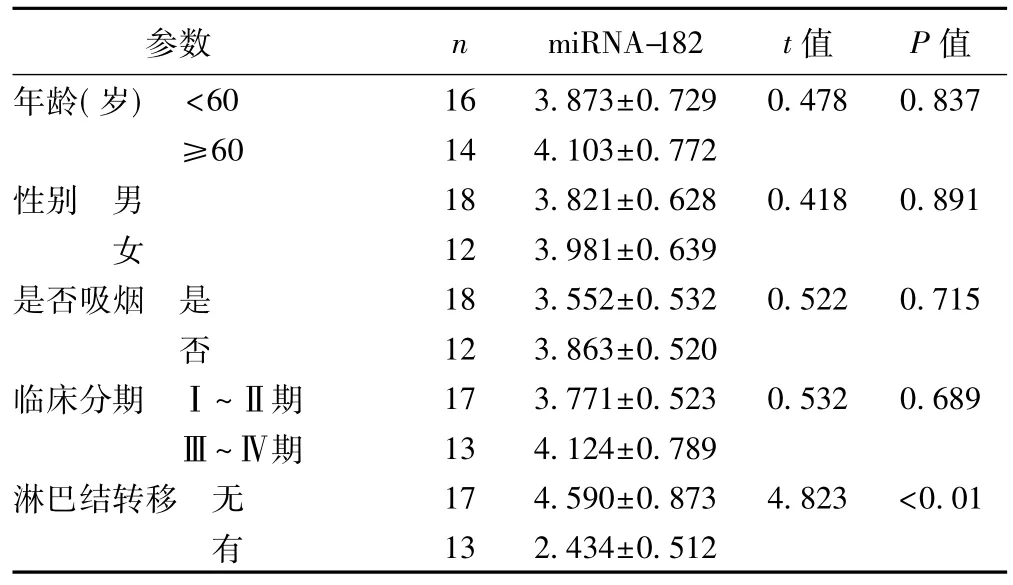
表1 miRNA-182表达量与肺癌组织临床病理特征的关系
2.3miRNA-182对肺癌细胞转移和侵袭的影响伤口愈合实验显示,与对照组相比,miRNA-182可显著抑制肺癌细胞系95D和L9981的转移(P<0.05) (图2A)。与对照组相比,转染miRNA-182可显著抑制肺癌细胞系95D和L9981的侵袭能力(P<0.05),而转染miRNA-182抑制剂可增加肺癌细胞系95D 和L9981的侵袭能力(P<0.05) (图2B)。
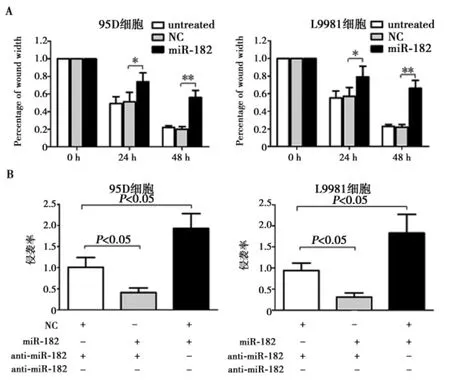
图1 miRNA-182对肺癌细胞转移和侵袭的影响
2.4miRNA-182靶基因预测通过靶基因预测软件寻找miRNA-182可能作用的靶基因,结果提示ZEB2可能为miRNA-182的功能性靶基因,且为感兴趣的基因。miRNA-182预测结合的ZEB2 3'-UTR的靶位点见图2。为确定miRNA-182是否和ZEB2间存在直接的相互作用,构建了含野生型和突变型ZEB2 的3'-UTR序列的pMIR载体。结果显示,与对照组(1.01± 0.13)相比,共转染野生型pMIR-ZEB2 3'-UTR载体和miRNA-182,荧光素酶活性(0.57±0.04)显著降低(P<0.05) ;与对照组(1.02±0.2)相比,共转染突变型pMIR-ZEB2 3'-UTR载体和miRNA-182的荧光素酶活性(1.12±0.16)未出现显著性改变(P>0.05)。
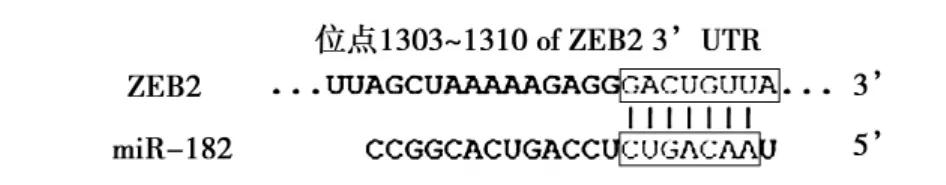
图2 miRNA-182靶基因预测及验证
2.5miRNA-182对肺癌细胞ZEB2表达的影响miRNA-182 miRNA-182可显著抑制肺癌细胞系95D和L9981中ZEB2的表达,上调与上皮-间质转化(EMT)相关E-cadherin表达,并下调EMT相关Vimentin的表达。见图3。
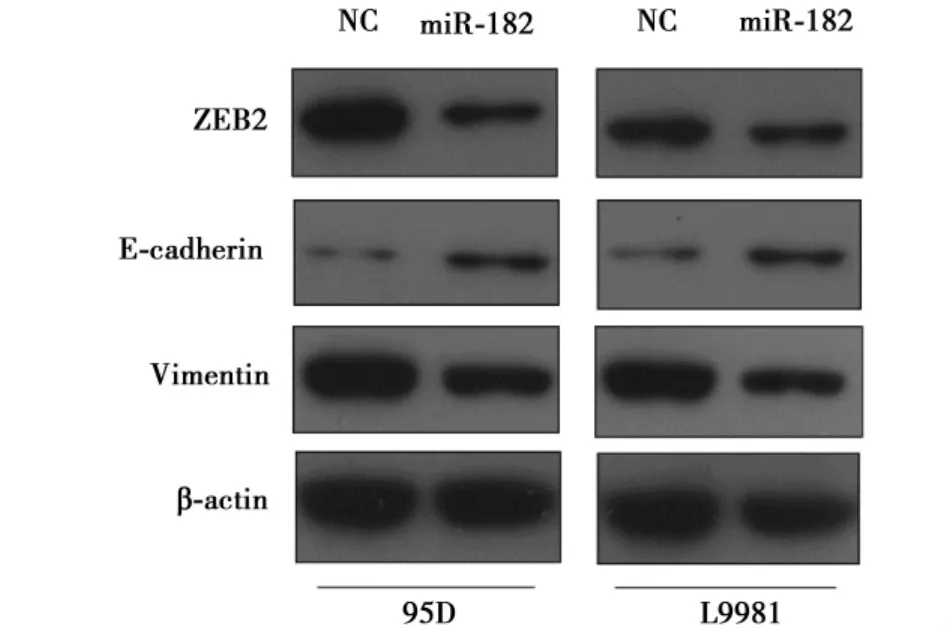
图3 Western印迹检测miRNA-182对肺癌细胞中EMT相关蛋白表达的影响
3 讨论
miRNA是一类小的,非编码RNAs,长度约为19~25个核苷酸。近年来,许多研究表明miRNA在人类癌症的发生发展中具有重要的作用。然而关于miRNA-182在肺癌发生发展中的作用及相关机制尚未研究清楚。关于miRNA-182在恶性肿瘤中表达及作用的文献报道还很少,且存在矛盾之处。Moskwa等〔5〕的研究证实,在恶性度较高的乳腺癌细胞中miRNA-182的表达显著低于恶性度较低的乳腺癌细胞;结果与Patryk等的研究结果基本一致。其他文献报道〔6〕,高表达miRNA-182的ER+乳腺癌患者,其对内分泌治疗敏感,无复发,生存期长,且miRNA-182与淋巴结转移呈负相关,结果与文献报道一致。然而也有文献报道〔7~9〕,在结直肠癌、前列腺癌、卵巢癌等癌组织中miRNA-182表达显著上调。这可能是由于miRNA-182在不同的肿瘤组织中其调控的靶基因不尽相同,而其下游靶基因的生物学效应决定了miRNA-182的作用〔10〕。同时,实验样本的选取和实验方法的不同也可能会造成结果的不一致。
正因为miRNAs下游靶基因的生物学效应决定了miRNAs的作用。本研究通过靶基因预测软件联合筛选出miRNA-182的靶基因,在众多靶基因中,因ZEB2在人类癌症的发生发展中具有重要的作用,而成为我们感兴趣的靶基因。ZEB2已证实在多种癌症的发展中发挥着重要的作用,如胃癌,卵巢癌,鳞状细胞癌和非小细胞肺癌〔11〕。在EMT过程中,ZEB2通过结合于E-钙黏蛋白启动子区的CACCT(G)基序而特异性地抑制E-钙粘蛋白的表达〔12〕。本研究结果提示miRNA-182可能是通过调节ZEB2的表达而抑制肺癌细胞的转移和侵袭能力。EMT过程是肿瘤转移的主要机制。肿瘤细胞从原发灶穿透基底膜而转移至血液循环,这一过程包括了上皮特异性E-钙黏蛋白和间质标志物波形蛋白的重新分布。
综上,miRNA-182可能是一类新的肿瘤抑制miRNA。miRNA-182可通过调节EMT相关ZEB2而抑制肺癌的转移和侵袭,为肺癌的发生发展提供了一种新的见解。此外,在肺癌治疗中,miRNA-182可作为一种潜在的治疗靶点。
4 参考文献
1鲁艳明,银铎,王宁,等.miRNA-200c对卵巢癌细胞侵袭能力影响观察〔J〕.中华肿瘤防治杂志,2014; 21(10) : 732-5.
2王球玉,唐珺,周欣想,等.miR-129在乳腺癌中表达下调及其对乳腺癌细胞迁移运动的影响〔J〕.生理学报,2012; 64(4) : 403-11.
3Lin Y,Wu J,Chen H,et al.Cyclin-dependent kinase 4 is a novel target in micoRNA-195-mediated cell cycle arrest in bladder cancer cells〔J〕.FEBS Lett,2012; 586(4) : 442-7.
4Liu S,Li L,Zhang Y,et al.The oncoprotein HBXIP uses two pathways to up-regulate S100A4 in promotion of growth and migration of breast cancer cells〔J〕.J Biol Chem,2012; 287(36) : 30228-39.
5Moskwa P,Buffa FM,Pan Y,et al.miR-182-mediated downregulation of BRCA1 impacts DNA repair and sensitivity to PARP inhibitors〔J〕.Mol Cell,2011; 41(2) : 210-20.
6Rodríguez-González FG,Sieuwerts AM,Smid M,et al.MicroRNA-30c expression level is an independent predictor of clinical benefit of endocrine therapy in advanced eatrogen receptor positive breast cancer〔J〕.Breast Cancer Res Treat,2011; 127(1) : 43-51.
7Sarver AL,French AJ,Borralho PM,et al.Human colon cancer profiles show differential microRNA expression depending on mismatch repair status and are characteristic of undifferentiated proliferative states〔J〕.BMC Cancer,2009; 9: 401.
8Schaefer A,Jung M,Mollenkopf HJ,et al.Diagnostic and prognostic implications of micro RNA profiling in prostate carcinoma〔J〕.Int J Cancer,2010; 126(5) : 1166-76.
9Nagaraja AK,Creighton CJ,Yu Z,et al.A link between mir-100 and FRAP1/mTOR in clear cell ovarian cancer〔J〕.Mol Endocrinol,2010; 24 (2) : 447-63.
10李谦平.miR-16-1抑制A549细胞株生物学行为及非小细胞肺癌ARID1A基因表达的研究〔D〕.上海:华中科技大学,2012: 27-9.
11Gemmill RM,Roche J,Potiron VA,et al.ZEB1-responsive genes in nonsmall cell lung cancer〔J〕.Cancer Lett,2011; 300(1) : 66-78.
12Comijn J,Berx G,Vermassen P,et al.The two-handed E box binding zinc finger protein SIP1 downregulates Ecadherin and induces invasion 〔J〕.Mol Cell,2001; 7(6) : 1267-78.
〔2015-03-19修回〕
(编辑袁左鸣)
通讯作者:朱佳龙(1968-),男,硕士,主任医师,主要从事心胸外科相关疾病。
〔中图分类号〕R73
〔文献标识码〕A
〔文章编号〕1005-9202(2015) 15-4182-03;
doi:10.3969/j.issn.1005-9202.2015.15.032
