湖北地区丙型肝炎患者HCV基因分型及HCV NS5B耐药突变位点分析
2015-03-03卢恩昌童永清
卢恩昌 童永清 李 艳 吴 青
湖北地区丙型肝炎患者HCV基因分型及HCV NS5B耐药突变位点分析
卢恩昌 童永清 李 艳*吴 青
目的:检测湖北地区丙型肝炎(丙肝)患者丙肝病毒(HCV)基因分型及HCV NS5B基因耐药突变位点的分布特征。方法:收集自2011-03-2014-05在本院确诊的来自湖北地区的丙肝患者外周静脉血标本273例,采用一代测序法检测每例样本的HCV和NS5B基因序列,将测得的序列与Blast进行在线比对后,统计分析HCV基因型和各亚型检出率,以及HCV NS5B耐药突变位点在HCV各基因亚型中的分布差异。结果:273例丙肝患者共检出1、2、3、6四种基因型和1a、1b、2a、3a、3b、6a六种基因亚型,其中1b亚型检出率较高,占76.19%(208/273),其次是2a亚型,占15.02%(41/273),其它各亚型检出率均不超过4.40%,各亚型检出率差异有统计学意义(P<0.05)。HCV NS5B基因以L159F突变率较高,占17.95%(42/234),与其它位点的基因突变率差异有统计学意义(P<0.05)。同时各个位点的耐药突变发生在2a亚型中的比例较高,达57.26%(134/234),显著高于其它亚型的耐药突变(P<0.05)。结论:分析湖北地区丙肝患者HCV基因分型及HCV NS5B耐药突变位点的分布特点,可为该地区丙肝患者的个体化治疗提供指导依据。
丙肝病毒; 基因型; NS5B基因耐药突变
丙型肝炎病毒(Hepatitis C Virus, HCV )感染是导致慢性肝脏疾病的主要原因之一,全世界丙型肝炎(丙肝)患者超过1.8亿人[1,2],中国HCV 的感染者约4000万[1]。预计到2025年,与HCV感染相关的人类死亡率将会增至目前的3倍[1],因而成为严重的公共卫生问题。近年来随着直接抗病毒药物(DDAS)的临床应用, 抗HCV治疗有了新的方案和进展,但HCV的耐药性也由此产生,其原因可能由于HCV RNA依赖性RNA聚合酶(HCVRdRp)NS5B复制的精确性差,使HCV出现高度变异性和新的变种,部分变种还会在患者体内存活下来并对治疗药物产生耐药性。所以,检测分析NS5B RNA依耐性RNA聚合酶(NS5BRdRp)耐药位点对丙肝的DDAS治疗显得非常重要。本文收集湖北地区丙肝患者样本进行NS5B基因测序,分析其突变位点和突变率,为临床抗HCV的耐药性研究和个性化治疗提供科学数据和支持。
1 资料与方法
1.1 临床资料
收集自2011-03—2014-05在本院首诊的273例湖北地区汉族人群丙肝患者的相关资料,其中男113例,女160例,年龄18-75岁,生活环境和习惯均无异常。丙肝诊断参照2004年中华医学会《丙型肝炎防治指南》诊断标准[3],所有患者此次就诊前均未进行过抗病毒治疗。
1.2 主要试剂和仪器
1.2.1 试剂和仪器:核酸提取试剂盒(深圳匹基公司),ABI系列PCR仪(美国)、ABI3130测序仪(美国)、PCR电泳仪(JY1600C,北京)、凝胶成像系统(BIO-PROFILE,法国)。
1.2.2 引物:采用Primer express 2.0软件设计引物,由上海生工合成,上游引物:5’-ACG CTA CTG ACT A-3’,下游引物:5’-ACT GAT CTG CGT A-3’。
1.3 PCR方法
采集患者抗病毒治疗前静脉血5ml,按PCR常规方法进行样本处理→试剂准备→核酸提取→逆转录→PCR核酸扩增→扩增产物凝胶电泳和产物胶回收。
1.4 基因测序、分型和耐药位点比对
对273例胶回收PCR产物纯化后进行基因测序,严格按仪器和试剂盒要求方法进行。将测序结果与http://www.ncbi.nlm.nih.gov/projects/genotyping/formpagex.cgi已公布的HCV基因亚型及耐药位点进行比对,确定基因分型及耐药突变位点。
1.4.1 HCV基因亚型:互联网http://www.ncbi.nlm.nih.gov/nuccore已公布HCV基因亚型及编号(GI)有AF009606.1a(GI:2316097)、D90208.1b(GI:221610)、AB049088.1b(GI:11559442)、AF139594.1b(GI:23957856)、AF356827.1b(GI:15487693)、AF169004.2a(GI:6707283)、D00944.2a(GI:221650)、 AB047641.2a(GI:13122265)、AF046866.3a(GI:2895898)、 D17763.3a(GI:514395)、 D49374.3b(GI:676877)、Y12083.6a(GI:2326454),共12个核苷酸序列及6种亚型,据此比对本文所测样本的HCV亚型检出率。
1.4.2 NS5B耐药突变位点:对照Pub Med数据库已经确认的30个耐药突变位点(表1,1-5为主要耐药位点,6-24为次要耐药位点,25-30为少见耐药位点),将本文273例样本的测序结果与之在线比对,确定所测样本NS5B的耐药位点和突变情况。
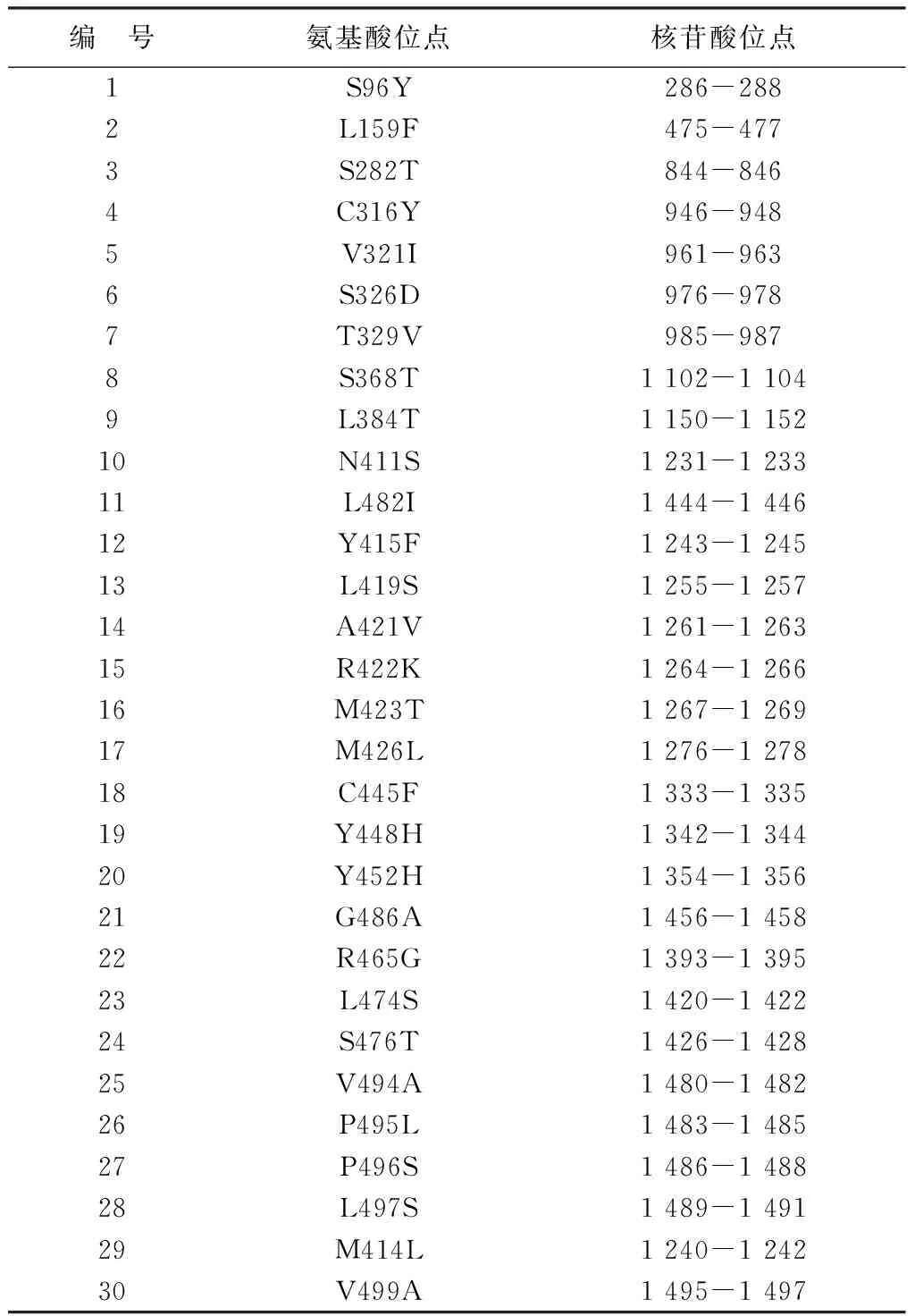
表1 Pub Med数据库NS5B 30个耐药突变位点
1.5 统计学处理
应用SPSS 13.0统计学软件。计数资料采用百分率表示,组间差异比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 HCV基因型及亚型检出率
经比对互联网已公布的HCV 基因型(亚型),本文273例患者检出1、2、3、6 四种基因型和1a、1b、2a、3a、3b、6a 六种亚型,其中1a亚型 3例(1.10%)、1b亚型208例(76.19%)、 2a亚型41例(15.02%)、 3a亚型3例(1.10%)、3b亚型12例(4.40%)、6a亚型6 例(2.20%); 1b亚型检出率最高,与其它亚型检出率比较,差异有统计学意义(χ2=719.20,P<0.05)。
2.2 HCV NS5B耐药突变位点检出率及在HCV各基因亚型中的分布
对照表1所列30个NS5B耐药突变位点,本文273例HCV样本共检出除S96Y(286-288)、L482I(1444-1446)和G486A(1456-1458)之外的27个耐药位点共234处基因突变,其中以L159F突变率较高,占17.95%(42/234),与其它位点的基因突变率比较,差异有统计学意义(χ2=272.32,P<0.05)。不同HCV基因亚型耐药位点不同,基因变异数量也有差异,2a 亚型的耐药位点和变异数量多于其它亚型,共有134处变异,占57.26%(134/234),其它由高到低依次为1b亚型、 1a亚型、3b亚型、3a亚型。统计分析表明,六种HCV基因亚型的耐药位点变异发生率差异有统计学意义(χ2=53.07,P<0.05)。主要、次要和少见耐药位点在HCV各基因亚型中的分布情况见表2-表4。
3 讨 论
目前至少有Okomoto、Kanazawa、Cha和Simmonds四类HCV基因型命名系统,以Simmonds比较通用,该系统将HCV遗传变异性分为6种基因型,每种基因型又分为若干亚型[4]。分型方法也较多,最经典可靠的方法是核苷酸测序法。HCV基因分型对丙肝个体化治疗至关重要[5]。达到持续病毒学应答(SVR)是治疗HCV感染的目的,也是最重要的治疗目标[6-8]。近年来抗HCV药物研究取得了快速进展,特别是DAAS。DAAS根据HCV基因组序列及酶的作用方式确定作用靶点,主要靶点包括HCV NS2和NS3蛋白酶、NS4A、NA4B、NS5A和NS5B RNA依赖性RNA聚合酶,分别通过抑制病毒蛋白生理裂解、病毒复制复合体形成以及病毒复制来达到直接抗病毒作用[9]。HCV NS5B区是RNA依赖的RNA聚合酶编码区,与HCV复制和致病性密切相关[10]。目前以HCV NS5BRdRp为特定作用靶点的药物主要有两种,一种是直接结合于NS5BRdRp催化活性位点的分子,这些分子可以竞争性结合核糖核苷三磷酸,通过阻断RNA复制来终止RNA延长,从而终止病毒复制[12],即核苷类聚合酶抑制剂。另一种是结合于变构位点的分子,与变构位点结合后产生变构效应,阻止RNA复制起始,终止病毒复制[11],即非核苷类聚合酶抑制剂。这些基因位点中有部分位点与耐药性显著相关,并且容易发生变异,因此对丙肝相关疾病的个体化治疗有重要意义。

表2 NS5B 4个主要耐药突变位点在HCV各亚型中的分布

表3 NS5B 17个次要耐药突变位点在HCV各亚型中的分布
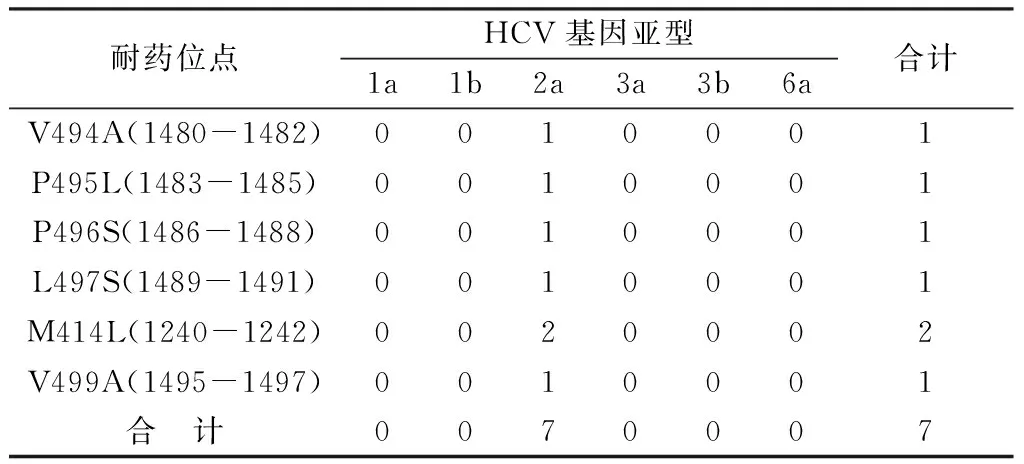
表4 NS5B 6个少见耐药突变位点在HCV各亚型中的分布
HCV基因型有明显地域性,我国内地HCV基因型以1b、2a亚型为主,南方和北方存在明显差别[12-14]。本文中的273例湖北地区丙肝患者以1b、2a 亚型为主,达90%,与我国北方地区流行情况相似;同时也有1a、3a、3b和6a亚型出现,也与苏迎盈等[15]调查的华中地区以1b、2a 亚型为主的结果较一致。但本文样本数量有限,结果有一定局限性,所测HCV NS5B核苷酸序列也并非NS5B完整核苷酸序列,在线比对结果可能与实际情况存在差异。不过,273例患者的HCV NS5B核苷酸序列中有很多耐药突变位点,且不同基因亚型耐药突变位点有较大差异,其中41例2a亚型中发现27个耐药突变位点,耐药位点总数达134处(57.26%),6个少见突变位点也仅见于2a亚型,该结果与Gane等[16]的研究结果相似,这些结果对2a亚型丙肝患者的临床抗病毒治疗有重要意义,至少可提示临床选择不以这些突变位点为作用靶点的药物以达到较好治疗效果。而在我国流行较广的1b亚型,本次检测表明, 208例1b亚型样本中有34处(14.53%)变异,耐药突变位点包括L159F、C316Y及L419S。提示1b亚型丙肝患者的临床DDAS治疗可供选择的方案较2a亚型丙肝患者广泛,因此临床疗效也可能较高。
本文中其它HCV亚型大都存在着不同数量和不同位点的耐药变异,情况较复杂,但由于本次检测样本较少,对于其耐药突变位点的分布尚不能总结出可供参考的流行趋势和特点,还有待大样本、大范围检测论证。
◀
本文第一作者简介:
卢恩昌(1985-),男,汉族,硕士研究生,主要从事临床微生物检验
1 Thomas D L. Global control of hepatitis C:where challenge meets opportunity[J]. Nat Med,2013,19(7):850-858.
2 秦倩倩,郭 巍,王丽艳,等.1997-2011年中国丙型肝炎流行特征分析[J].中华流行病学杂志,2013, 34(6):548-551.
3 中华医学会肝病学分会,中华医学会传染病与寄生虫病学分会.丙型肝炎防治指南[J].中华传染病杂志,2004,22(2):131-136.
4 Simmonds P, Holmes EC, Cha TA, et al. Classification of hepatitis C virus into six major genotypes and a series of subtypes by phylogenetic analysis of the NS-5 region[J]. J Gen Virol, 1993, 74(Pt11):2 391-2 399.
5 Dal Mo lin G, Ansaldi F ,Biagi C, et al. Changing molecular epidemiology of hepatitis C virus infection in Northeast Italy[J].Journal of Medical Virology,2002,68(3):352-356.
6 European association for the study of the liver. EASL clinical practice guidelines: management of hepatitis C virus infection[J]. Journal of Hepatology,2011,58(2):245-264
7 Mchutchison JG, Lawitz EJ, Shiffman ML, et al. Peginterferon alfa-2b or alfa-2a with ribavirin for treatment of hepatitis C infection[J]. New England Journal of Medicine,2009,56(6):580-593.
8 胡汉宁,童秀峰,陈 薇,等.丙型肝炎患者血清游离脂肪酸水平与丙肝病毒RNA载量及肝损伤的关系[J].微循环学杂志,2013,23(4):51-52.
9 Lee JH, Nam IY, Myung H, et al. Nonstructural protein 5B of hepatitis C virus[J]. Molecules and Cells,2006,21(3):330-336.
10 Gane EJ, Stedman CA, Hyland RH, et al. Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C[J]. New England Journal of Medicine,2013,368(1):34-44.
11 Pockros P, Jensen D, Tsai N, et al. First SVR data with the nucleoside analogue polymerase inhibitor mericitabine (RG7128) combined with peginterferon/ribavirin in treatment-naive HCV G1/4 patients: interim analysis from the JUMP-C trial[J]. Journal of Hepatology,2011,(Suppl 1):S538.
12 Liu F, Chen K ,He Z ,et al. Hepatitis C seroprevalence and associated risk factors, Anyang, China[J]. Emerging Infectious Diseases,2009,112(11):1819-1822.
13 Zhang M ,Sun XD, Mark SD, et al. Hepatitis C virus infection,Lin xia, China[J]. Emerging Infectious Diseases,2005,54(1):17-21.
14 Shan H ,Ren FR ,Zhao HY, et al. A multi-Chinese blood center study testing serologic-negative donor samples for hepatitis C virus and human immunodeficiency virus with nucleic acid testing[J].Transfusion,2007,22(11):2011-2016.
15 苏迎盈,刘慧鑫,汪 宁.中国丙型肝炎病毒基因型分布[J].中华流行病学杂志,2013, 34(1):80-84.
16 Gane EJ, Stedman CA, Hyland RH, et al. Nucleotide polymerase inhibitor sofosbuvir pius ribavirin for hepatitis C[J]. N Engl J Med,2013,368(1),34-44.
Genotyping and Analysis for Mutation Loci of Drug Resistance of HCV NS5B in Hubei Province
LU En-chang, TONG Yong-qing, LI Yan*, WU Qing
Department of Clinical Laboratory,Renming Hospital of Wuhan University,Wuhan 430060,China;*Correspanding author
Objective: To detect genotypes of HCV and distribution characters of gene mutation loci of drug-resistant of HCV NS5B in hubei province. Method: Venous blood samples of 273 patients, since March 2011 to May 2014 diagnosed in our hospital from hubei province, were collected and detected for HCV and NS5B gene sequence by generation sequencing assay. Then we compared detected sequences with BLAST online, and analyzed statistically detection rates of each genotype and subtype of HCV and distribution differences of drug-resistant mutation loci of HCV NS5B.Results: There were 1,2,3 and 6 four kinds of genotypes and 1a,1b,2a,3a,3b and 6a six kinds of genetic subtypes in 273 cases. Of those, the detection rate of 1b was higher, accounting for 76.19%(208/273), followed by 2a subtype was 15.02%(41/273), the detection rate of other subtypes was not over 4.40%, and the difference of each subtype detection rates was statistically significant (χ2=719.20,P<0.05). The gene mutation rate of L159F site in HCV NS5B was higher, accounting for 17.95% (42/234), compared with mutation rates of other sites, the difference was statistically significant (χ2=272.32,P<0.05). While all the sites of gene mutations in HCV 2a subtype was in a higher proportion up to 57.26% (134/234), significantly higher than mutation rates of other subtypes(χ2=53.07,P<0.05).Conclusion: Analysis of genotypes of HCV and distribution characters of drug-resistant mutation loci of HCV NS5B in hubei province could provide basis for individualized treatment in the area.
Hepatitis C Virus;Genetypes;NS5B drug-resistance mutation
武汉大学人民医院检验科, 武汉 430060;*
,E-mail: yanlitf1120@163.com
本文2014-07-11收到,2014-11-24修回
R446.9
A
1005-1740(2015)01-0042-04
