细胞穿透肽PEP-1介导血红素加氧酶1预处理对大鼠肝脏缺血再灌注损伤的保护作用*
2015-03-03王卫星师贞宗陈先祥
王卫星 师贞宗 陈先祥
细胞穿透肽PEP-1介导血红素加氧酶1预处理对大鼠肝脏缺血再灌注损伤的保护作用*
王卫星1师贞宗1陈先祥2,#
目的:探讨细胞穿透肽PEP-1介导的血红素加氧酶-1(HO-1)对大鼠肝脏缺血再灌注损伤(HIRI)的保护作用。方法:(1)用基因工程学方法人工合成融合蛋白PEP-1-HO-1。(2)选择雄性SD大鼠,随机分为三组(n均=8):假手术组(S组)只开腹,不予干预。HIRI模型组(HIRI组),采用夹闭肝动脉和门静脉30min后恢复血流;HIRI+PEP-1-HO-1预处理组(HIRI+HO-1组),夹闭肝动脉和门静脉前经门静脉注射PEP-1-HO-1蛋白1mg,其余处理同HIRI组。(3)实验完成后,取三组大鼠下腔静脉血,采用自动生化分析仪测定血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转肽酶(γ-GT)、总胆红素(TBIL)等肝功能指标。处死大鼠,取部分肝脏进行组织切片、HE染色,观察各组肝组织病理学变化。结果:成功制备高纯度PEP-1-HO-1融合蛋白。HIRI组大鼠各项肝功能指标均显著高于S组(P<0.01), HIRI+HO-1组各项肝功能指标值明显低于HIRI组(P<0.01),但仍高于S组(P<0.05)。HIRI组肝细胞肿大或呈球形,胞浆疏松水样变或完全透明,伴炎细胞浸润,可见片状坏死。HIRI+HO-1组肝脏损伤程度较HIRI组明显改善,炎性细胞浸润及肝细胞坏死程度明显减轻,但与 S组比较,肝脏组织损伤仍明显。结论:用细胞穿透肽PEP-1介导HO-1预处理能有效保护肝细胞,明显减轻肝功能损害。
细胞穿透肽PEP-1;血红素加氧酶1;肝脏缺血再灌注损伤;大鼠
肝脏移植术已成为终末期肝病的最佳治疗手段,但手术过程中的缺血再灌注(IR)造成的肝脏损伤比较突出,成为亟待解决的重要课题。目前已有研究[1]显示血红素加氧酶1(HO-1)可在肝脏缺血再灌注损伤(HIRI)中起重要作用,能明显减轻HIRI、并能延长移植器官保存时限。本实验采用分子生物学方法,用人HO-1cDNA质粒与细胞穿透酶PEP-1连接形成的活性PEP-1-HO-1融合蛋白预处理HIRI大鼠,结果显示其有明显改善肝功能和减轻肝组织损伤的功效,且目的蛋白剂量易于控制,应用时限易于掌握。结果报道如下。
1 材料与方法
1.1 主要仪器及试剂
台式高速冷冻离心机(Hettich,Universal 32R,德国),超速冷冻离心机(HITACHI himac CP80MX,日本),倒置显微镜(Nikon,日本),水浴恒温摇床(SHY-2,中国江苏),全自动生化分析仪(HITACHI,日本);异丙基硫化-β-D-半乳糖苷(IPTG,美国Promega公司),Ni2+-NTA-树脂(美国Qigen公司),PEP-1肽DNA序列(KETWWETWWETWSQPKKKRKV)由北京赛百盛基因技术有限公司合成,大肠杆菌Rosetta(DE3)pLysS为湖北医药学院临床研究所赠送,其余试剂为国产分析纯。
1.2 PEP-1-HO-1融合蛋白的制备
按照颜学韬等[2]的方法制备融合蛋白PEP-1-HO-1。将构建的原核表达质粒pET15b-PEP-1-HO-1转化感受态宿主菌大肠杆菌Rosetta(DE3)pLysS,用IPTG诱导表达PEP-1-HO-1靶蛋白,采用Ni2+-NTA对其纯化,取纯化后的蛋白样品进行SDS-PAGE电泳,将样品蛋白转移到NC膜上,用抗His-tag抗体孵育,采用Western Blotting显示分析。以牛血清白蛋白(BSA,1mg/ml)进行标准对照,采用Bradford法进行蛋白浓度测定,获得稳定表达纯度的PEP-1-HO-1融合蛋白溶液,分装后存放于冰箱(-21℃)保存备用。
1.3 实验动物及分组处理
24只SD雄性大鼠(湖北医药学院实验动物中心购进),体重220-250g。采用随机数字表法分为三组,每组8只,术前禁食12h,自由饮水。(1)假手术组(S组):只开腹,不予干预;(2)HIRI模型组(HIRI组):参照Yamada等[4]的方法,将实验动物乙醚吸入麻醉后开腹,腹腔内滴10%水合氯醛1ml补充麻醉,分离暴露第一肝门见肝动脉、门静脉及胆总管,用无损伤血管夹夹闭肝动脉及门静脉(不夹胆管),30min后恢复血流灌注;(3)HIRI+PEP-1-HO-1预处理(HIRI+HO-1组):夹闭肝动脉和门静脉前,每只大鼠均经门静脉一次性注入PEP-1-HO-1融合蛋白1mg,其余操作同HIRI组。
1.4 检测指标及方法
1.4.1 血液学检测:各组大鼠均在实验完成后经下腔静脉取血5ml,加入含肝素抗凝管中,常温下1 500r/min离心5min,取血清4℃保存。由本院生化室主管技师按常规操作测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、γ-谷氨酰转肽酶(γ-GT)、总胆红素(TBIL)等肝功能指标水平。
1.4.2 组织病理学检测:下腔静脉取血后断头处死大鼠,立即取肝左叶部分组织置于40g/L多聚甲醛液中固定,石蜡包埋,连续切片(5μm),常规HE染色,显微镜观察各组肝脏组织病理变化。
1.5 统计学处理

2 结 果
2.1 融合蛋白PEP-1-HO-1的检测及纯度
电泳凝胶用考马斯亮蓝R-250染色。结果显示,在分子量35KD处见一明显条带,即融合蛋白PEP-1-HO-1(图1)。经Bradford法测定PEP-1-HO-1融合蛋白浓度为1.6mg/ml。
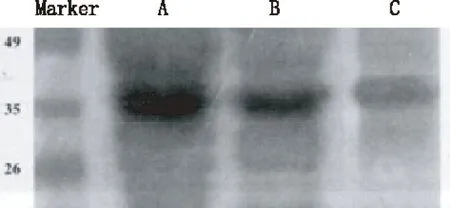
图1 SDS-PAGE电泳图
A,纯化前PEP-1-HO-1蛋白(峰值);B,纯化前PEP-1-HO-1蛋白(均值);C,纯化后PEP-1-HO-1蛋白
2.2 各组肝功能指标比较
三组肝功能指标间差异有统计学意义(P<0.05)。两两比较表明,HIRI组和HIRI-HO-1组各项指标测定值均显著高于S组(t值均>3.016,P<0.05或P<0.01),但HIRI+HO-1组显著低于HIRI组(t值均>5.378,P均<0.05)。见表1。

表1 各组肝功能指标均=8)
注:与S组比较,1)P<0.05,2)P<0.01;与HIRI组比较,3)P<0.05
2.3 各组肝脏组织学变化
大体观察:S组大鼠肝脏表面颜色红润,色泽均匀,富有弹性;HIRI组肝脏缺血30min后,肝脏明显苍白,但仍有弹性;恢复灌注瞬间,缺血肝组织立即呈暗红色,且色泽均匀,再灌注后肝叶表现为表面小叶灌注不良,呈散在小叶状分布。HIRI+HO-1组大鼠肝脏颜色仍较红润,色泽大体均匀,弹性较好,散在少许点状苍白。
显微观察:S组肝脏组织结构清晰,小叶中央静脉、肝细胞索、肝窦、汇管区结构清晰,无明显炎性细胞浸润。HIRI组大鼠恢复灌注后缺血肝叶组织呈现肝细胞肿大,胞浆疏松呈网状、半透明呈水样变性或肝细胞胀大呈球形,胞浆几乎完全透明,呈气球样变,伴大量嗜酸性小体形成及嗜酸性坏死或灶状或片状坏死,且伴明显炎性细胞浸润。HIRI+HO-1组较HIRI明显改善,但仍见肝细胞部分气球样变、肝索紊乱;少量嗜酸性小体形成及嗜酸性坏死或点状坏死或片状坏死,且伴少量炎性细胞浸润。见图2。
[本文图2见封3]
3 讨 论
HIRI是影响肝脏外科手术,尤其肝移植存活率和远期疗效的重要因素之一。因其不仅可以引起超急性排斥期移植器官功能障碍,而且可以增加急性和慢性排斥反应的发生[5]。氧自由基、中性粒细胞及内皮细胞的激活在HIRI中起着十分重要的作用[6,7]。如何应对HIRI成为目前研究的热点,HO-1作为保护性蛋白也愈来愈受到关注。
临床研究[8]显示,HO-1在肝、肺、肾等血管比较丰富的脏器组织IRI中表达显著增强,对IRI有明显保护作用。动物实验发现HO-1的表达上调在许多动物移植模型中具有减轻移植物IRI和排斥反应的作用,表现为多形核中性粒细胞、T淋巴细胞、巨噬细胞浸润明显减轻,促炎因子如白细胞介素1(IL-1)、IL-6、单核细胞趋化蛋白-1(MCP-1)及巨噬细胞炎性蛋白2(MIP-2)水平显著下降,而且HO-1高表达还可以抑制内皮细胞凋亡,增加局部血液灌注量,改善微循环障碍[9],从而明显延长移植器官的存活时间。进一步研究[10]表明,应用细胞穿透肽PEP-1转导HO-1进入人肝细胞株LO2,对缺氧复氧模型的肝细胞有良好保护作用,并且其效果与融合蛋白PEP-1-HO-1有一定的浓度及时间依赖关系。通过不同方法建立HIRI模型后,用腺相关病毒介导HO-1进入动物体内,对HIRI也有改善作用[11]。本实验成功复制HIRI模型,并采用细胞穿透肽PEP-1作为分子载体,将有活性的融合蛋白PEP-1-HO-1成功转导进入肝细胞,有效地改善了HIRI后肝功能和肝组织损害。与上述研究结果相一致。
天然有活性的HO-1在生物体内没有特异性通道或介质进入细胞内,需要一种介质导入细胞才能发挥作用。既往研究中,有人利用腺病毒作为载体转染HO-1基因的方法进行大鼠HIRI的干预研究,获得一定效果,但该方法存在基因导入率低,导入可控性差,安全性不确定等不足之处[11],从而限制了该方法的应用。本文选择安全、高效、无毒的PEP-1[12]作为转导介质,运用生物工程学方法将人HO-1的cDNA与介质质粒pET-15PEP-1-HO-1链接,然后转入宿主菌大肠杆菌Rosetta内,成功高效表达具有天然活性PEP-1-HO-1蛋白,并在上述动物实验中显示出良好的抗HIRI作用。其机制可能是HO-1能控制细胞内自由铁水平,降解胆色素,释放一氧化碳(CO),进而表现出抗氧化、维持肝细胞微循环稳定,抗凋亡、抑制增殖,抗炎与免疫调节等作用[13]。
总之,HIRI是一个复杂的过程,涉及多个细胞类型和多种氧化应激反应。通过对肝脏进行预处理,或通过使用新的抗氧化剂防止氧化应激反应,或许是很有前景的治疗策略。HO-1及其它的应用研究对这一策略的实现有重要意义。今后尚需加强HO-1的作用机制,尤其是分子机制的深入研究,为临床应用提供可靠的理论依据。
◀
本文第一作者简介:
王卫星(1960—),男,汉族,医学博士,主任医师、教授、博士生导师。 主要从事肝胆胰腺外科、微创外科及临床静脉营养的研究,并致力于胰腺癌和胰腺炎的基础研究
1KerrJF,WyllieAM,CurrieAR.Apoptosis:basicbiologicalphenomenonwithwide-rangingimplicationsintissuekinetics[J].BRJCancer,2012,26(4):239-257.
2 颜学滔,王焱林,王家宁,等.血红素加氧酶-1融合蛋白PEP-1-HO-1的制备及在大鼠H9c2心肌细胞的转导[J].武汉大学学报(医学版),2010,31(4):21-25.
3YinDP,SankaryH,ChongA,etal.Protectiveeffectofischcmicpreconditioningonliverpreservation-reperfusioninjuryinrats[J].Transplantation, 2010,66(2):152-157.
4YamadaF,SaitoT,AbeT,etal.Ischemicpreconditioningenhancesregenerativecapacityofhepatocytesinlong-termiscbemicallydamagedratlivers[J].GastroenterolHepatol,2011,22(11):1 971-1 977.
5SinhaS,BastinME,WhitleIR,etal.DifusiontensorMRimagingofhighgradecerebralgliomas[J].AJNR,2002,23(4):520-527.
6 吕 平,陈道达,田 源,等.肝缺血再灌注损伤预处理保护作用与一氧化氮/内皮素-1系统有关[J].中国病理生理杂志,2000,6(10):901-905.
7 王万铁,林丽娜,谢克俭,等.异丙酚对兔肝缺血再灌注损伤中一氧化氮和内皮素的干预[J].中国急救医学,2004,24(1):4-6.
8MasiniE,VannacciA,MarzoeeaC,etal.Hemeoxygenase-1andtheischemia-reperfusioninjuryintheratheart[J].ExpBiolMcd(Mavwood),2013,22(8):546-549.
9KatoriM,AnselmoDM,BusunnilRW,etal.Anovelstrategyagainstischemiaandreperfusioninjury:cytopmtoctionwithhcmeoxygenasesystem[J].TransplantImmunol,2012,9(24):227-233.
10 陶绍富,王春锋,丁 晶,等.上调肝脏HO-1抑制肥大细胞脱颗粒减轻大鼠肝脏缺血再灌注损伤[J].中华普通外科杂志,2011,26(9):766-769.
11 王 云,沈 健,许永华,等.血红素加氧酶1诱导自噬减轻小鼠肝脏缺血再灌注损伤[J].中华消化外科杂志,2013,12(7):538-543.
12MadaniF,LindbergS,LangerlU,etal.Machenismofcellularuptakecell-penetratingpeptides[J].Biophys,2011,20(11):414-729.
13KatofiM,BusutilRW,Kupiec-WeglinskiJW.Hemeoxygenase-1systeminorgantransplantation[J].Transplantation,2012,74(7):905-912.
Cell Penetrating Peptides PEP-1 Mediated Heme Oxygenase 1 Pretreatment on the Protection of Hepar Ischemia-reperfusion Injury in Rats
WANG Wei-xing1,SHI Zhen-zong1,CHEN Xian-xiang2,#
1Department of General Surgery,Renmin Hospital of Wuhan University,Wuhan 430060,China;2Department of General Surgery,Renmin Hospital of Shiyan City Affiliated Hubei Medical College,Shiyan 442000,China;#
Objective: To study liver protection of PEP-1 mediated heme oxygenase 1(HO-1) in rat hepar ischemia-reperfusion injury(HIRI). Method: (1)Synthetic protein (PEP-1-HO-1) was made by genetic engineering methods. (2)24 male SD rats were randomly assigned to three groups:the sham group(S group), HIRI model group(HIRI group), HIRI and PEP-1-HO-1 pretreatment group(HIRI+HO-1 group).(3) After experiment completely,extraction of three groups of inferior vena venous blood of rats by automatic biochemical analyzer determine serum:cereal third transominase (ALT), aspertate aminotransferase (AST), gamma glutamyl transpeptidase(γ-GT), total bilirubin (TBIL) and liver function indicators.Taking part executed in rats after the liver biopsy HE staining,each group liver tissue pathological changes were observed. Results: Successful preparation of high purity PEP-1-HO-1 fusion protein. Rats liver function index HIRI group were significantly higher than S group (P<0.01),HIRI+ HO-1 set of various liver function index was lower than that in group HIRI (P<0.01),but it was still higher than the group S (P<0.05).HIRI+HO-1 set of HIRI group significantly reduced degree of liver injury, inflammatory cell infiltration and necrosis of liver cells was significantly reduced,but compared with the group S ,the liver tissue damage was still obvious.Conclusion: It can pretreatment effectively protect the liver cells with cell penetrating peptides PEP-1 mediated heme oxygenase 1,significantly reduce liver damage.
PEP-1;HO-1;Hepar ischemia-reperfusion injury;Rat
湖北省教育厅科学技术研究计划重点项目(编号D20082045)
1武汉大学人民医院普外科,武汉 430060;2湖北医药学院附属十堰市人民医院普外科,十堰 442000;#
,E-mail:chenxian881@hotmail.com
本文2014-11-08收到,2014-12-28修回
R575
A
1005-1740(2015)01-0014-04
