胶质母细胞瘤患者血浆miRNA表达谱研究
2015-03-02汪志强王辉云邓美玲吴少雄
汪志强 王辉云 邓美玲 吴少雄
作者单位:510060 广州市中山大学肿瘤防治中心
·基础研究·
胶质母细胞瘤患者血浆miRNA表达谱研究
汪志强王辉云邓美玲吴少雄
作者单位:510060 广州市中山大学肿瘤防治中心
【摘要】目的采用microRNA(miRNA) 基因芯片分析在胶质母细胞瘤(GBM)患者血浆中表达的miRNA,寻找GBM血液中的分子生物学标志物。方法分别收集22例GBM患者和8例健康志愿者血液标本,试剂盒提取总RNA,与基因芯片进行杂交,检测GBM患者和健康志愿者血浆中miRNA表达谱,筛选差异表达的miRNA。采用Kaplan-Meier方法分析差异表达的miRNA与GBM生存期的关系。结果miRNA表达谱分析发现在GBM差异表达的miRNA共19个,其中上调3个,下调16个。生存分析显示,miR-30c-2-3p高表达组患者中位无疾病进展时间较低表达组明显缩短(P=0.016)。结论通过基因芯片的方法发现了在GBM患者血浆中19个差异表达的miRNA。miR-30c-2-3p的高表达与GBM的不良相关,可能是潜在的GBM预后预测分子标记物。
【关键词】胶质母细胞瘤;血浆;微RNA;基因芯片
(ThePracticalJournalofCancer,2015,30:475~478)
近年来,颅内胶质瘤发病率逐年递增。国内报道胶质瘤约占全部脑肿瘤的35%~60%[1]。其中,原发性恶性(WHO Ⅲ、Ⅳ级)胶质瘤占35%~60%,以胶质母细胞瘤(glioblastoma,GBM)最常见。GBM属高度恶性肿瘤,生长呈浸润性,无明显边界,手术难以彻底切除,预后很差。即使给予积极治疗,50%的患者在诊断后1年内死于肿瘤复发[2-4]。因此,找到能够早期诊断、预测预后生物学标记物尤为重要。
microRNA(miRNA)是1类内源性的具有调控功能的小分子、单链非编码RNA,在细胞代谢、分化、增殖和凋亡等生物学过程中发挥着重要的调控作用。研究表明miRNA在恶性肿瘤发生发展中起着重要的作用。此外,miRNA在体液(血浆/血清等)中能稳定的存在,而且部分体液miRNA具有肿瘤特异性和预后价值,使其可能成为潜在的非侵入性肿瘤标志物[5]。早期在脑胶质瘤的miRNA表达谱研究多基于组织学或细胞系展开的[6-7],miRNA在血液或脑脊液的研究鲜有报道。本研究通过采用基因芯片的方法检测在GBM患者血浆的miRNA,筛选差异表达的miRNA,寻找能够早期诊断和预测预后的无创性分子生物学指标,为进一步探索GBM发生发展的可能机制提供线索。
1材料与方法
1.1病例与临床资料的收集
收集中山大学附属肿瘤医院2010年10月-2014年3月收治的经病理检查确诊的22例GBM患者和8例健康志愿者的静脉血液标本。GBM患者年龄29~76岁,平均50.7岁,其中男性8例,女性14例。健康志愿者年龄36~55岁,平均48岁,男性3例,女性5例;所有血液标本均为EDTA抗凝管空腹采集,1~2 h内离心分离获得血浆转入-80 ℃保存备用。所有患者和志愿者均签署知情同意书。
1.2RNA的提取
按照Norgen’s Plasma/Serum Circulating RNA Purification 试剂盒(Norgen Biotek公司)说明书步骤抽提血浆总RNA,Nanodrop ND-1000微量紫外分光光度计测定总RNA浓度。
1.3MiRNA芯片制备
根据miRNA数据库18.0选取1 849个miRNA设计高灵敏高特异性互补靶RNA结合的探针,使用芯片点样仪SmarArrayerTM136(CapitalBio公司)点制miRNA芯片。
1.4荧光标记连接与芯片杂交
取0.3 μg总RNA,碱性磷酸酶去磷酸化,二甲基亚砜(DMSO)变性,T4 RNA连接酶标记Dy 547(Dharmacon公司)。采用Micro Bio-Spin 6 column (BioRad公司)纯化滤过并浓缩成粉,溶于杂交液中,加入微阵列中,46 ℃杂交过夜。
1.5清洗芯片、信号数字化处理
杂交结束后进行芯片清洗。芯片甩干后用共聚焦激光扫描仪LuxScanTM10K(CapitalBio公司)进行图像扫描,应用GenePix pro V6.0 软件进行数据处理和分析。
1.6随访时间
所有患者均接受随访,随访截止时间是2014年10月1日,中位随访时间是14个月(3~42个月)。
1.7统计学方法
miRNA芯片数据标准化后,应用Significance Analysis of Microarrays软件和非配对t检验分析GBM患者和健康志愿者血浆miRNA 表达差异,筛选差异表达在1.5倍以上和P<0.05的miRNA。将各差异表达miRNA芯片检测的相对表达量中位数作为分界值,分别将患者分为低表达组和高表达组。采用Kaplan-Meier方法进行生存分析,并采用Log-rank检验比较两组生存率。应用SPSS 20.0统计软件进行统计学分析。P<0.05为差异有统计学意义。
2结果
2.1MiRNA表达谱
与健康志愿者相比,GBM患者血浆中表达上调1.5倍以上的miRNA有3种,表达下调1.5倍以上的miRNA有16种, 两组miRNA相对表达值见表1。
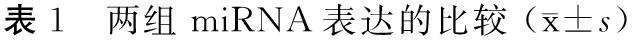
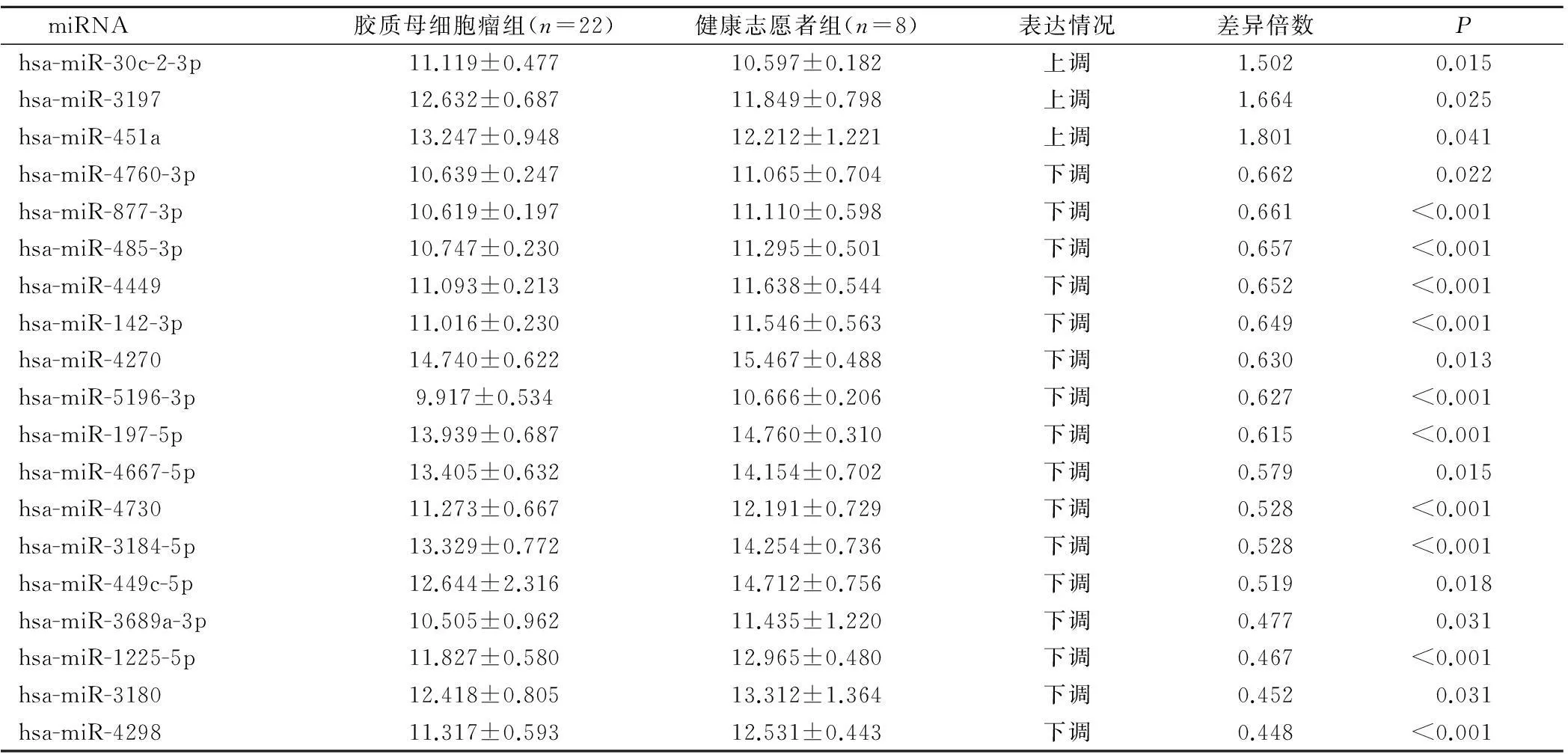
miRNA 胶质母细胞瘤组(n=22)健康志愿者组(n=8)表达情况差异倍数Phsa-miR-30c-2-3p11.119±0.47710.597±0.182上调1.5020.015hsa-miR-319712.632±0.68711.849±0.798上调1.6640.025hsa-miR-451a13.247±0.94812.212±1.221上调1.8010.041hsa-miR-4760-3p10.639±0.24711.065±0.704下调0.6620.022hsa-miR-877-3p10.619±0.19711.110±0.598下调0.661<0.001hsa-miR-485-3p10.747±0.23011.295±0.501下调0.657<0.001hsa-miR-444911.093±0.21311.638±0.544下调0.652<0.001hsa-miR-142-3p11.016±0.23011.546±0.563下调0.649<0.001hsa-miR-427014.740±0.62215.467±0.488下调0.6300.013hsa-miR-5196-3p9.917±0.53410.666±0.206下调0.627<0.001hsa-miR-197-5p13.939±0.68714.760±0.310下调0.615<0.001hsa-miR-4667-5p13.405±0.63214.154±0.702下调0.5790.015hsa-miR-473011.273±0.66712.191±0.729下调0.528<0.001hsa-miR-3184-5p13.329±0.77214.254±0.736下调0.528<0.001hsa-miR-449c-5p12.644±2.31614.712±0.756下调0.5190.018hsa-miR-3689a-3p10.505±0.96211.435±1.220下调0.4770.031hsa-miR-1225-5p11.827±0.58012.965±0.480下调0.467<0.001hsa-miR-318012.418±0.80513.312±1.364下调0.4520.031hsa-miR-429811.317±0.59312.531±0.443下调0.448<0.001
2.2差异表达miRNA与GBM患者生存的关系
应用Kaplan-Meier方法对22例GBM患者进行生存分析。结果显示:miR-30c-2-3p高表达组患者中位无疾病进展时间(progression-free survival,PFS)为11.9个月,较低表达组患者(未达到)明显缩短,两组的差异有统计学意义(Log-rank检验:P=0.016)(图1),而中位总生存时间(overall survival,OS)的差异接近有统计学意义(P=0.073)。另有两个差异性表达的miRNA(miR-4667-5p和miR-3180)的低表达组患者中位PFS和中位OS,较高表达组患者缩短,差异接近有统计学意义(表2)。其余差异表达的miRNA未显示出预后价值。

表2 部分差异表达miRNA与GBM患者生存的关系
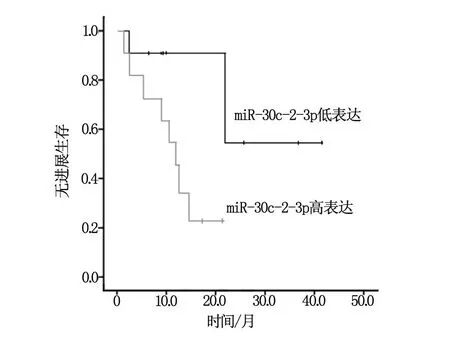
图1 miR-30c-2-3p表达与患者预后的关系
3讨论
miRNA是1类内源性的具有调控功能的小分子、单链非编码RNA,在细胞代谢、分化、增殖和凋亡等生物学过程中发挥着重要的调控作用。 miRNA表达的组织特异性、肿瘤组织和瘤旁组织间差异表达及其调控机制是近年来研究的热点,已成为肿瘤潜在分子生物标志物。本研究利用循环miRNA稳定的特点,通过高通量、涵盖广的miRNA芯片技术,分析发现了19个在GBM患者血浆中差异表达在1.5倍以上的miRNA,其中3个表达上调,16个表达下调。这些差异表达miRNA可能为早期诊断提供了非侵入性的筛选方法。此外,我们的研究发现miR-30c-2-3p高表达与GBM患者不良预后相关。
研究表明,miR-30家族(miR-30a、miR-30b和 miR-30c)不同表达水平与肿瘤细胞增殖和分化,以及药物反应性有关[8]。文献报道miR-30c的低表达在结直肠癌、膀胱癌、肺癌和肾癌等中具有预后价值[9-12]。Wang等[10]研究膀胱癌miRNA差异表达谱发现miR-30c和miR-30e-5p下调。Heinzelmann等[11]研究发现肾透明细胞癌miR-30c的低表达与肿瘤侵袭能力和远处转移有关。但也有文献报道与上述研究结果并不一致。在Shen等[13]的肝细胞癌患者血浆miRNA的研究中,发现miR-30c呈高表达。同样在本研究中,我们发现GBM患者血浆miR-30c-2-3p呈高表达,并且生存分析显示miR-30c-2-3p高表达组患者生存期显著短于低表达组。提示 miR-30c-2-3p可能可以作为早期诊断和预测预后的指标,但仍需要进一步研究验证。
此外,miR-451a也被发现在多种恶性肿瘤中有表达变化。miR-451a在结肠癌、肺癌、肝癌等组织或细胞系低表达[14-16]。同样研究者有不同的结果,发现miR-451a在肿瘤组织或细胞系高表达[17-19]。而在胶质瘤组织学或细胞系的研究中,多数发现miR-451a呈低表达[20-22]。如Gal等[20]研究表明,miR-451在恶性胶质瘤干细胞中低表达,并且发现miR-451联合甲磺酸伊马替尼能抑制胶质瘤干细胞的增殖和分化。miR-45l参与胶质瘤细胞调解机制复杂,至今尚未明确的结论。在我们研究中,发现GBM患者血浆中miR-451a呈高表达,这可能与肿瘤细胞类型来源、分化程度等有关。本研究发现的其他差异性表达的miRNA在国内外文献中鲜有报道。
总之,我们分析了GBM患者与健康志愿者血浆miRNA表达谱,发现了19个存在差异性表达的miRNA。并且miR-30c-2-3p的高表达与GBM的不良相关,可能是潜在的GBM预后预测分子标记物。但本实验中样本例数相对较少,需要扩大样本量进一步深入研究和临床验证。
参考文献
[1]殷蔚伯,谷铣之主编.肿瘤放射治疗学·中枢神经系统肿瘤〔M〕.第3版.北京:中国协和医科大学出版社,2002:1018.
[2]Walker MD,Green SB,Byar DP,et al.Randomized comparisons of radiotherapy and nitrosoureas for the treatment of malignant glioma after surgery〔J〕.N Engl J Med,1980,303(23):1323-1329.
[3]Walker MD,Strike TA,Sheline GE,et al.An analysis of dose-effect relationship in the radiotherapy of malignant gliomas〔J〕.Int J Radiat Oncol Biol Phys,1979,5(10):1725-1731.
[4]Stupp R,Mason WP,van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma〔J〕.N Engl J Med,2005,352(10):987-996.
[5]Markou A,Sourvinou I,Vorkas PA,et al.Clinical evaluation of microRNA expression profiling in non small cell lung cancer〔J〕.Lung Cancer,2013,81(3):88-96.
[6]Calin GA,Sevignani C,Dumitru CD,et al.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers〔J〕.Proc Natl Acad Sci USA,2004,101(9):2999-3004.
[7]Chan JA,Krichevsky AM,Kosik KS,et al.MicroRNA-21 is an antiapoptotic factor in human glioblastoma cells〔J〕.Cancer Res,2005,65(14):6029-6033.
[8]Hand NJ,Master ZR,Eauclaire SF,et al.The microRNA-30 family is required for vertebrate hepatobiliary development〔J〕.Gastroenterology,2009,136(3):1081-1090.
[9]Xi Y,Formentini A,Chien M,et al.Prognostic values of microRNAs in colorectal cancer〔J〕.Biomark Insights,2006,2:113-121.
[10]Wang G,Zhang H,He H,et al,Up-regulation of microRNA in bladder tumor tissue is not common〔J〕.Int Urol Nephrol,2010,42(1):95-102.
[11]Heinzelmann J,Henning B,Sanjmyatav J,et al.Specific m-
iRNA signatures are associated with metastasis and poor prognosis in clear cell renal cell carcinoma〔J〕.World J Urol,2011,29(3):367-373.
[12]Zhong K,Chen K,Han L,et al.MicroRNA-30b/c inhibits -
non-small cell lung cancer cell proliferation by targeting Rab18〔J〕.BMC Cancer,2014,14:703.
[13]Shen J,Wang A,Wang Q,et al.Exploration of genome-wide circulating microrna in hepatocellular carcinoma (HCC):miR-483-5p as a potential biomarker〔J〕.Cancer Epidemiol Biomarkers Prev,2013,22(12):2364-2373.
[14]Li HP,Zeng X C,Zhang B,et al.MiR-451a inhibits cell proliferation in human hepatocellular carcinoma through direct suppression of IKK-β〔J〕.Carcinogenesis,2013,34(11):2443-2451.
[15]Li HY,Zhang Y,Cai JH,et al.MicroRNA-451 Inhibits gro-
wth of human colorectal carcinoma cells via downregulation of Pi3k/Akt〔J〕.Asian Pac J Cancer Prev,2013,14(6):3631-3134
[16]Markou A,Sourvinou I,Vorkas PA,et al.Clinical evaluation of microRNA expression profiling in non small cell lung cancer〔J〕.Lung Cancer,2013,81(3):88-96.
[17]谢海涛,庄俊华,黄宪章,等.结肠癌组织和癌旁组织miRNA表达谱研究〔J〕.肿瘤防治研究,2012,39(1):75-77.
[18]潘峰,闻洋,马士杰,等.血浆miRNA表达谱与胰腺癌相关性的研究〔J〕.南京医科大学学报,2012,32(11):1541-1544.
[19]Bandres E,Bitarte N,Arias F,et al.MicroRNA-451 regulates macrophage migration inhibitory factor production and proliferation of gastrointestinal cancer cells〔J〕.Clin Cancer Res,2009,15(7):2281-2290.
[20]Gal H,Pandi G,Kanner AA,et al.MIR-451and Imatinib -
mesylate inhibit tumor growth of glioblastoma stem cells〔J〕.Biochem Biophys Res Commun,2008,376(1):86-90.
[21]Tian Y,Nan Y,Han L,et al.MicroRNA miR-451 downreg-
ulates thePI3K/AKT pathway through CAB39 in human glioma〔J〕.Int J Oncol,2012,40(4):1105-1112.
[22]Nan Y,Han L,Zhang A,et al.MiRNA-451 plays a role as tumor suppressor in human glioma cells〔J〕.Brain Res,2010,1359(9):14-21.
(编辑:吴小红)
Plasma MicroRNA Expression Profiles in Glioblastoma
WANGZhiqiang,WANGHuiyun,DENGMeiling,etal.SunYat-senUniversityCancerCenter,Guangzhou,510060
【Abstract】ObjectiveTo investigate the expression profiles of microRNA(miRNA) in glioblastoma (GBM) by microarray technique and explore the potential molecular biomarker for GBM.MethodsPlasmas were obtained from 22 cases of GBM and 8 cases of healthy volunteers.Total RNA was extracted by RNA extraction kit and hybridized with miRNA microarrays.The miRNA expression profiles of GBM and healthy volunteers were analyzed and differential miRNA expression was determined.The correlation between differential miRNAs expression and survival was analysed by Kaplan-Meier method.ResultsMiRNA expression profiling was analyzed.19 miRNAs were identified to be deferentially expressed,in which 3 were overexpressed and 16 were underexpressed in GBM.Kaplan-Meier analysis showed that high expression of miR-30c-2-3p was closely associated with a shorter progression-free survival time (P=0.016).Conclusion19 deferentially expressed miRNAs are detected in GBM by microarray method.High expression of miR-30c-2-3p is associated with poor prognosis of patients with GBM.MiR-30c-2-3p may serve as a potential molecular prognosis marker.
【Key words】Glioblastoma;Plasma;MicroRNA;microarray
(收稿日期2015-01-01修回日期 2015-03-10)
中图分类号:R739.91
文献标识码:A
文章编号:1001-5930(2015)04-0475-04
DOI:10.3969/j.issn.1001-5930.2015.04.001
通讯作者:吴少雄
