骨形态发生蛋白4 对反应性星形胶质细胞增殖的影响
2015-03-02吴茉莉汪黎鸿陈晓燕孔庆友程晓馨
吴茉莉,李 萍,汪黎鸿,陈晓燕,孔庆友,程晓馨
(大连医科大学 基础医学院 细胞生物学教研室,辽宁 大连116044)
脱髓鞘是许多中枢神经系统疾病(损伤)如多发性硬化症、急性播散性脑脊髓炎、坏死出血性白质脑炎及脊髓损伤的重要病理特征[1]。研究认为,髓鞘再生依赖于内源性少突胶质前体细胞(oligodendrocyte progenitor cells,OPC)向少突胶质细胞(形成髓鞘)的成熟分化[2]。而骨形态发生蛋白4(bone morphogenic protein 4,BMP4)是抑制OPC 成熟分化的重要因素之一[3],且中枢神经系统脱髓鞘损伤后BMP4 呈高水平表达[4]。有研究报道,BMP4 水平的升高与损伤处反应性星形胶质细胞的高水平表达相关[4];另一方面,损伤病灶周围的星形胶质细胞活化、增殖,形成胶质瘢痕,阻碍神经再生[5-6];这些均是影响中枢神经系统损伤后再生修复的重要因素。有关BMP4 与反应性星形胶质细胞增殖之间关系的报道甚少。本实验利用源于成年SD 大鼠脊髓损伤原代培养的星形胶质细胞模型,探讨BMP4 与星形胶质细胞增殖的关系,以期寻找调节髓鞘再生及抑制胶质瘢痕形成的新途径。
1 材料和方法
1.1 材 料
成年雌性SD 大鼠(200 ~220 g),由大连医科大学实验动物中心提供,NYU 脊髓损伤仪(美国),倒置荧光显微镜(Leica,德国)。所有实验均通过了大连医科大学伦理委员会批准。
1.2 方 法
1.2.1 成年SD 大鼠星形胶质细胞的纯化及处理:采用腹腔内膜注射戊巴比妥钠(50 mg/kg BW)麻醉。于第9 胸椎水平(T9)对大鼠实施背侧椎板切除术暴露脊髓,借助NYU 脊髓损伤仪产生力度为150 kdyn 的脊髓钝性挫伤。损伤后的第7 天,长度为2 cm 的脊髓(含损伤脊髓部分)被解剖取出,于Hanks 平衡盐溶液(含10 mmol/L HEPES)中切成体积为1 mm3的碎块,然后在预先配制的酶溶液(Hanks 平衡盐溶液含10 mmol/L HEPES、0. 01%papain、0.1% trypsin 及0.01% DNase I)中37 ℃消化30 min,随后用等体积的含20% 胎牛血清的DMEM 培养液终止消化过程,用移液管轻柔吹打组织,用70 μm 的尼龙网过滤,离心4 min(1500 r/min),弃上清,加入星形胶质细胞培养液(DMEM +10%FBS+1 ×N2),轻柔吹打,制成细胞悬液(1 ×106),接种于T75 培养瓶中,置入37 ℃、5%CO2的培养箱中。每2 天换液1 次,约10 ~14 d 后细胞汇合,将培养瓶置于振荡器(Thermo Scientific)上,37℃振荡过夜(275 r/min),去除小胶质细胞、少突胶质前体细胞、少突胶质细胞及神经元[7]。培养瓶中的细胞经0.25%胰酶(含0.05% EDTA)消化,以4 ×104的细胞密度接种于多聚赖氨酸(PDL)包被的培养皿中,培养皿预先置入细胞片用于免疫荧光及细胞增殖情况的检测。通过对星形胶质细胞的标记分子波形蛋白(vimentin)染色以确定星形胶质细胞的纯度。
人重组骨形态发生蛋白4(BMP4,R&D Systems Inc.,Minneapolis,USA)以0.1%乙酸作为溶剂制成浓度为10 mg/mL 的贮存液,使用前用培养液稀释至工作液浓度10 ng/mL;Noggin[8](BMP4 拮抗剂,R&D Systems Inc.,Minneapolis,USA)使用前用培养液稀释至工作液浓度100 ng/mL。实验分为4 组:(1)正常对照组,培养液正常培养;(2)BMP4 组:10 ng/mL BMP4 持续处理细胞48 h;(3)Noggin 组:100 ng/mL Noggin 持续处理细胞48 h;(4)BMP4 +Noggin 组:用100 ng/mL Noggin 处理细胞30 min 后加入10 ng/mL BMP4,两者共同处理细胞48 h。实验结束后取各实验组的细胞爬片,用4%的多聚甲醛固定,进行各项指标的免疫荧光染色。为了实验的可信性,每个实验重复至少3 次。
1.2.2 细胞增殖分析:将配制好的5 -溴脱氧尿嘧啶核苷(5 -bromodeoxyuridine,Brdu,Sigma 公司)液体加入细胞培养液中(终浓度为10 μmol/L),各组细胞继续培养24 h[7],收集细胞爬片,行抗Brdu 免疫荧光染色,对星形胶质细胞的增殖情况进行检测和分析。
1.2.3 免疫荧光:取4%多聚甲醛固定的细胞爬片,1 ×PBS 洗涤细胞3 次,用0.01% Triton X -100和羊血清室温封闭1 h,清除封闭液,加含抗BrdU(1∶200)或抗vimentin(鼠单克隆抗体)的一抗溶液,4 ℃过夜,1 ×PBS 清洗细胞3 次,加入相应的荧光标记二抗(1∶200,Jackson ImmunoResearch),37 ℃避光孵育1 h,用DAPI(蓝色荧光)染细胞核;1 ×PBS洗涤细胞3 次,防荧光淬灭的封片剂封片,在荧光显微镜下进行观察、计数及拍照。在10 ×物镜下,任意选取10 个视野,计算Brdu 阳性细胞占星形胶质细胞的百分比。
1.3 统计学方法
采用Prism 5.0 统计软件进行单因素方差分析。以P <0.05 为差异有统计学意义。
2 结 果
经过分离、纯化和培养,98%以上的细胞为vimentin 阳性细胞(星形胶质细胞的标记分子,见图1)。
免疫荧光的结果显示,各实验组中Brdu 阳性细胞占星形胶质细胞的平均百分比分别为:正常对照组3.10%,Noggin 组3.13%,BMP4 组14.03%,BMP4 +Noggin 组3.81%。与正常对照相比较,BMP4 组的Brdu 阳性细胞明显增多(P <0.01)。与BMP4 组相比,BMP4+Noggin 组的Brdu 阳性细胞明显减少(P <0.01)。见图1和图2。
3 讨 论
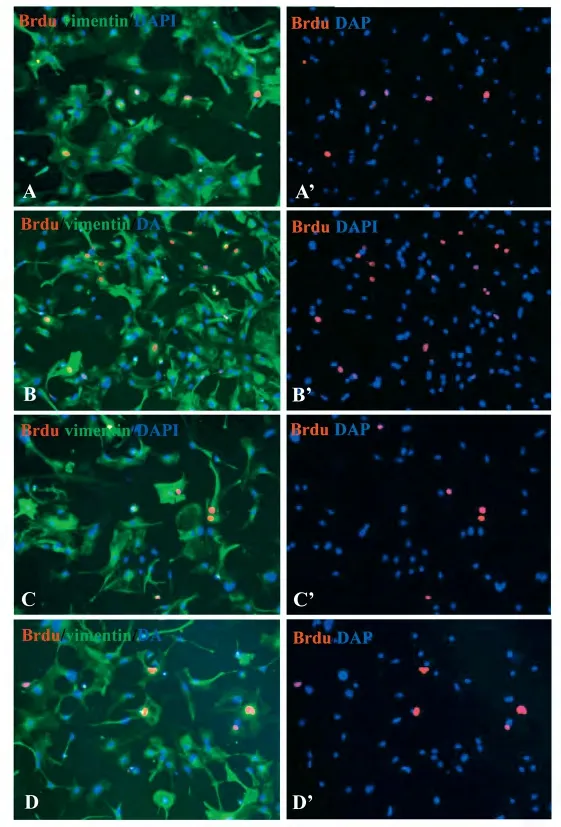
图1 各实验组星形胶质细胞中vimentin 和Brdu 的免疫荧光染色Fig 1 Immunofluorescent stainings of vimentin and Brdu in cultured astrocytes of different groups
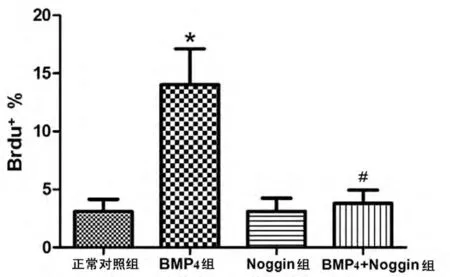
图2 BMP4 对星形胶质细胞增殖的影响Fig 2 The effects of BMP4 on cell proliferation in cultured astrocytes
在中枢神经系统的脱髓鞘疾病中,轴突因表面髓鞘丧失而容易发生变性,而髓鞘再生可使受损的轴突免于进一步变性[9]。有研究显示髓鞘再生需要OPC 向产生髓鞘的成熟少突胶质细胞方向分化[2]。在病理状态下,脱髓鞘损伤处虽然存在少突胶质前体细胞,但这些细胞常常处于未分化状态,无法向少突胶质细胞方向分化[10]。因此,促进少突胶质前体细胞的成熟分化是髓鞘再生的理想策略之一。近年来,越来越多的研究表明,BMP4 是抑制少突胶质前体细胞成熟分化的重要因素,在脊髓脱髓鞘损伤过程中,BMP4 的表达水平升高且与临床疾病的严重程度呈正相关[3-4]。有研究报道BMP4 水平的升高与损伤处活化增殖的星形胶质细胞的分泌相关[4]。本研究利用成年SD 大鼠脊髓损伤原代培养的星形胶质细胞模型发现,活化增殖的星形胶质细胞不仅可分泌BMP4,而且BMP4 还可有效地促进反应性星形胶质细胞的增殖,表明BMP4 与星形胶质细胞增殖之间呈正反馈的关系。鉴于BMP4 与星形胶质细胞在髓鞘病理性损伤中的重要作用,BMP4 有望成为神经退行性疾病及脊髓损伤的潜在治疗靶点。另一方面,胶质瘢痕被认为是脊髓损伤后轴突再生和功能恢复的主要障碍[5-6]。本实验发现BMP4 的拮抗剂——Noggin 可有效地抑制BMP4 对反应性星形胶质细胞的促增殖作用,因此,降低BMP4 的水平或BMP4 的抑制剂也可能成为未来抑制胶质瘢痕形成,从而促进髓鞘再生的新的研究方向。
[1] 胡瑾.激素治疗中枢神经系统炎性脱髓鞘疾病的临床疗效[J].中国老年学杂志,2013,33(24):6262 -6263.
[2] Hammond TR,Gadea A,Dupree J,et al.Astrocyte-derived endothelin-1 inhibits remyelination through notch activation[J].Neuron,2014,81(3):588 -602.
[3] Zawadzka M,Rivers LE,Fancy SP,et al.CNS-resident glial progenitor/stem cells produce Schwann cells as well as oligodendrocytes during repair of CNS demyelination[J].Cell Stem Cell,2010,6(6):578 -590.
[4] Ara J,See J,Mamontov P,et al. Bone morphogenetic proteins 4,6,and 7 are up - regulated in mouse spinal cord during experimental autoimmune encephalomyelitis[J]. J Neurosci Res,2008,86(1):125 -135.
[5] Young W. Spinal cord regeneration[J]. Cell Transplant,2014,23(4 -5):573 -611.
[6] Cregg JM,DePaul MA,Filous AR,et al.Functional regeneration beyond the glial scar[J]. Exp Neurol,2014,253:197 -207.
[7] Cheng X,Wang Y,He Q,et al.Bone morphogenetic protein signaling and olig1/2 interact to regulate the differentiation and maturation of adult oligodendrocyte precursor cells[J].Stem Cells,2007,25(12):3204 -3214.
[8] Hampton DW,Asher RA,Kondo T,et al.A potential role for bone morphogenetic protein signalling in glial cell fate determination following adult central nervous system injury in vivo[J].Eur J Neurosci,2007,26(11):3024 -3035.
[9] Irvine KA,Blakemore WF. Remyelination protects axons from demyelination - associated axon degeneration[J].Brain,2008,131(Pt 6):1464 -1477.
[10] Kuhlmann T,Miron V,Cui Q,et al.Differentiation block of oligodendroglial progenitor cells as a cause for remyelination failure in chronic multiple sclerosis[J].Brain,2008,131(Pt 7):1749 -1758.
