小鼠腹腔巨噬细胞不同分离方法的比较
2015-03-02杜莉莉吕润潇于艳秋金玉楠
杜莉莉,吕润潇,于艳秋,辛 娜,金玉楠
(1.中国医科大学 基础医学院 病理生理教研室,辽宁 沈阳110013;2. 第二军医大学2008 级临床医学8年制,上海200433;3.第二军医大学附属长海医院 脊柱外科,上海200433)
巨噬细胞是机体免疫系统的重要细胞成分,具有抗感染、抗肿瘤和参与免疫应答、免疫调节等生物学功能[1-2]。巨噬细胞来源于骨髓,广泛分布于机体各种组织中,如肝、脾、骨髓、胸腺、胸腔、腹腔等。近年来关于巨噬细胞的研究越来越多,如何获得数量充足、功能良好的巨噬细胞至关重要。小鼠价格便宜,其腹腔巨噬细胞多游离存在于腹水中易于获得,因此,许多实验室在进行巨噬细胞研究时,往往选用小鼠腹腔巨噬细胞为研究对象。建立一种高效分离小鼠腹腔巨噬细胞的方法,是巨噬细胞研究工作者的首要任务。
现有的小鼠腹腔巨噬细胞分离方法有两类,一类为先向腹腔注入刺激物,再通过腹腔灌洗及贴壁培养获得巨噬细胞。另一类为不经刺激直接腹腔灌洗并贴壁培养。但两种方法均有不足之处,前者收集到的细胞与腹腔内未经抗原刺激原始状态的巨噬细胞有很大差异,而后者获得的巨噬细胞数量较少。
本实验对现有方法加以改良,尝试用一种新的简便经济的方法分离小鼠腹腔巨噬细胞。并将新方法提取的巨噬细胞与原有方法提取的巨噬细胞相比较,从获得细胞数量,形态,迁移能力及分泌细胞因子能力等方面,筛选出一种更优化的小鼠腹腔巨噬细胞分离方法,为巨噬细胞的体外研究提供实验基础。
1 材料和方法
1.1 实验动物与仪器
健康昆明小鼠,18 只,18 ~22 g,雌性,6 ~8 周。中国医科大学实验动物部提供。美国Thermo Fisher公司二氧化碳培养箱,日本Olympus 公司倒置显微镜及照相系统,德国Sigma3K30 低温高速离心机,苏州净化设备厂超净工作台。
1.2 试 剂
DMEM 培养基购自美国Gibco 公司,台盼蓝染料购自美国Sigma 公司,LPS 购自美国Sigma 公司,胎牛血清购自美国Gibco 公司,PE 标记的抗小鼠CD14 购自美国BioLegend 公司。
1.3 实验方法
1.3.1 实验分组:随机将18 只小鼠分为3 组,每组6 只。5%淀粉肉汤组:5%淀粉肉汤,注射器注入小鼠腹腔,每次1 mL,每天1 次,注射3 d 后用5 mL 无血清DMEM 灌洗小鼠腹腔,重复灌洗1 次。无血清DMEM 组:直接用5 mL DMEM 液灌洗小鼠腹腔,重复灌洗1 次。75% 血清DMEM 组:将5 mL 75%DMEM 液注入小鼠腹腔,30 min 后回收液体并用5 mL 无血清DMEM 灌洗小鼠腹腔。
1.3.2 5%淀粉肉汤制备:蒸馏水100 mL,牛肉膏0.3 g,蛋白胨1.0 g,氯化钠0.5 g,可溶性淀粉5 g,加热助溶,煮沸灭菌,4 ℃保存。
1.3.3 小鼠腹腔灌洗:颈椎脱臼法处死小鼠,浸入75%酒精溶液5 min。取出小鼠,置于无菌操净台上,仰卧位固定小鼠,无菌条件下将小鼠皮肤剪一小口,眼科镊子提起该处皮肤,双手将皮肤沿着开口向上撕开,暴露腹膜,此时腹膜应完整,向腹腔内注入预冷的无血清DMEM 5 mL,轻柔小鼠腹部5 min后,用吸管反复冲洗腹膜腔后,回收灌洗液。
1.3.4 贴壁纯化培养巨噬细胞:将回收的灌洗液注入干净的离心管中,1000 r/min 离心10 min,连续2次,弃上清液。细胞沉淀经DMEM 培养液洗涤后,用10%血清DMEM 培养液重悬细胞,细胞悬液接种于6 cm 培养皿,置于37 ℃、5%CO2、饱和湿度的培养箱中静置培养,2 h 后,弃培养上清,用10%血清DMEM 培养液轻轻冲洗培养皿1 ~2 次,弃去未贴壁的细胞,获得的贴壁细胞即为巨噬细胞。
1.3.5 巨噬细胞形态观察:细胞培养后每日用倒置显微镜观察细胞形态。
1.3.6 巨噬细胞纯度检测:细胞培养48 h 后,用0.25%胰酶消化,调整细胞浓度为1 ×106/mL,1000 r/min,离心5 min 弃上清。100 μL PBS 重悬细胞,再加入PBS 稀释的50 μL PE 标记的抗小鼠CD14 ,避光作用30 min,1000 r/min,离心5 min,弃上清液后,PBS 洗2 次,然后加入200 μL PBS 吹打混匀细胞,流式细胞仪检测细胞表面CD14 表达水平。每组检测重复3 次。
1.3.7 巨噬细胞数量及存活率检测:细胞培养48 h后,用0.25%胰酶消化,计数。统计每只小鼠腹腔中分离的巨噬细胞数。取细胞悬液0.5 mL,滴加等量0.4%台盼蓝染液置于Eppendorf 管中,混匀,取1滴染色细胞悬液加入细胞计数板中,显微镜下计数。
1.3.8 巨噬细胞迁移能力检测:用marker 笔在24孔培养板背侧划线,0.5 ~1 cm 一道,划线横穿孔,用0.25%胰酶消化巨噬细胞,调整细胞浓度后接种于24 孔板,5 ×104个/孔,每组3 个复孔,过夜。第2天用200 μL 枪头垂直划痕,PBS 洗3 次后换10%血清DMEM 培养液,置于37 ℃,5%CO2,饱和湿度的培养箱6 h、12 h 后显微镜下观察细胞迁移距离。将巨噬细胞不同时间点的迁移距离与0 h 划痕距离相比,计算巨噬细胞迁移指数。
1.3.9 LPS 刺激巨噬细胞分泌细胞因子能力检测:用0.25%胰酶消化巨噬细胞,调整细胞浓度2 ×105个/mL,取100 uL 细胞悬液接种于96 孔板,放入37℃,5%CO2、饱和湿度的培养箱,细胞贴壁后,每孔加入50 μL LPS(1 μg/mL),3 h 或6 h 后收集细胞上清,ELISA 检测TNFα 和IL-1β(3 h)。ELISA 检测IL-6(6 h)。
1.4 统计学方法
实验数据用SPSS19.0 统计软件处理,计量数据用均数±标准差表示,组间比较采用单因素方差分析,P <0.05 为差异有显著性意义。
2 结 果
2.1 巨噬细胞形态观察
不同分离方法提取的巨噬细胞贴壁培养24 h 后显微镜下观察,各组细胞形态相似,均呈圆形,椭圆形,梭形等。体积大,胞浆丰富,少量有伪足,见图1。
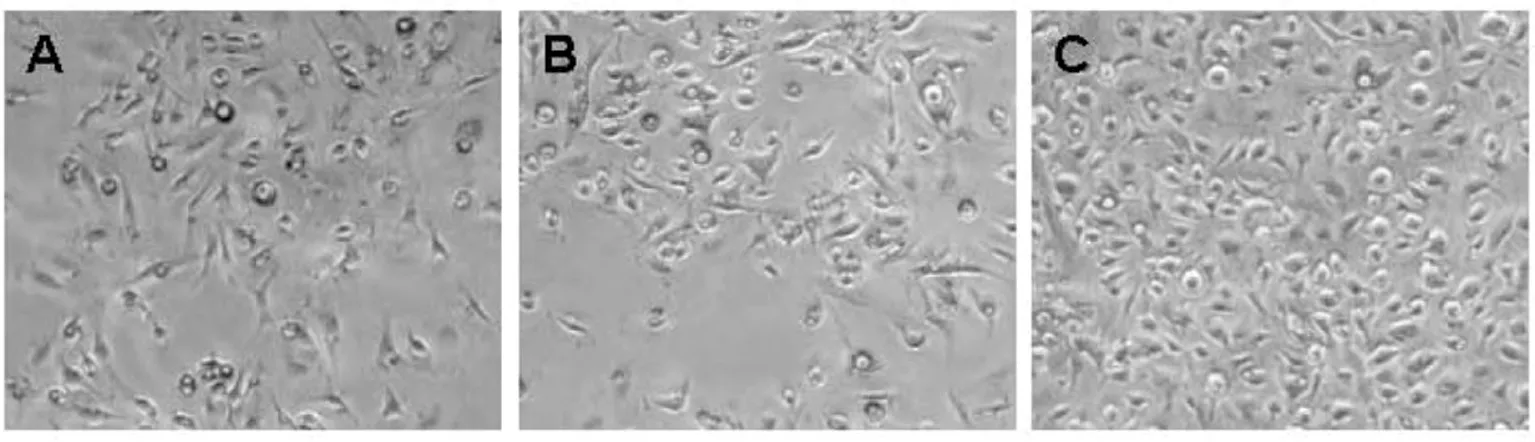
图1 巨噬细胞形态观察(×100)Fig 1 Observation of the morphology of macrophage(×100)
2.2 巨噬细胞纯度检测
流式细胞仪检测各组细胞CD14 的表达情况,5%淀粉肉汤组为(82.40 ±2.45)%,无血清DMEM组为(84. 41 ± 1. 18)%,75% 血清DMEM 组为(81.32 ±2.73)%,各组间比较差异无显著性意义,P >0.05。见图2。
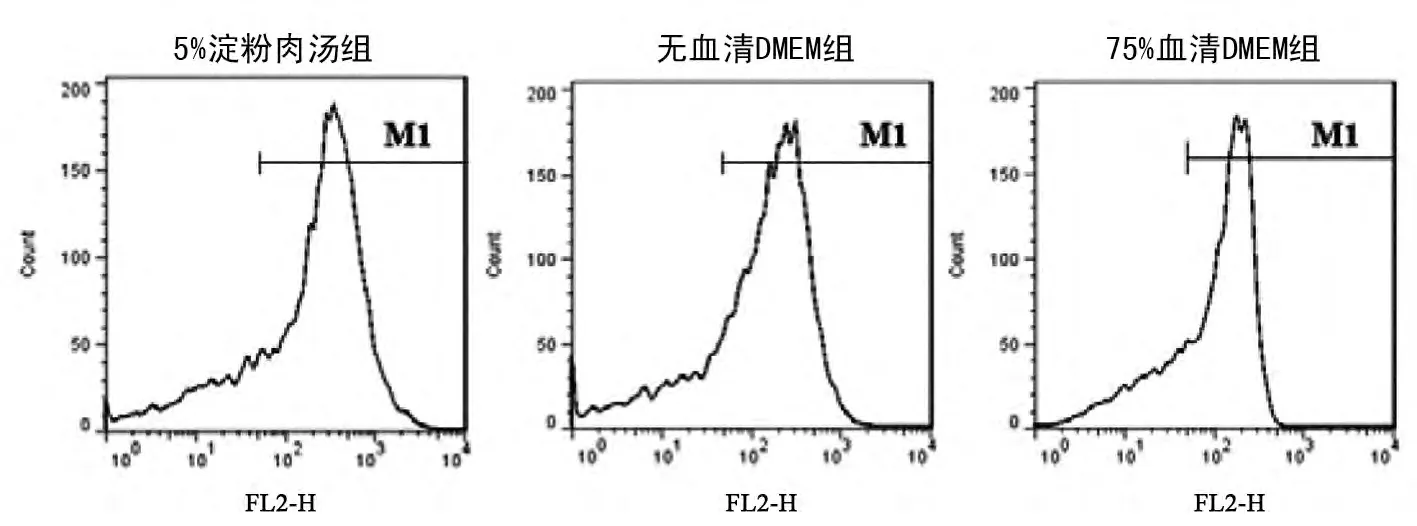
图2 巨噬细胞细胞CD14 表达情况Fig 2 The expression of CD14 of macrophage
2.3 巨噬细胞数量及存活率检测
75%血清DMEM 组分离出的巨噬细胞数量,与其他两组比较差异有显著性意义,P <0.05。5%淀粉肉汤组分离的巨噬细胞数量多于无血清DMEM组,差异有显著性意义,P <0.05。3 组的巨噬细胞存活率比较,差异无显著性意义,P >0.05。见表1。
2.4 巨噬细胞迁移能力检测
划痕实验6 h 后,75%血清DMEM 组巨噬细胞迁移距离远,迁移指数明显高于其他两组,差异有显著性意义,P <0.05。划痕实验12 h后,75%血清DMEM 组划痕各区域均有巨噬细胞,迁移指数高于其他两组,差异有显著性意义,P <0.05。与无血清DMEM 组相比,5%淀粉肉汤组巨噬细胞迁移距离远,迁移指数高,差异有显著性意义,P <0.05。见图3、表2。

表1 巨噬细胞数量及存活率Tab 1 The number and survival rate of macrophage
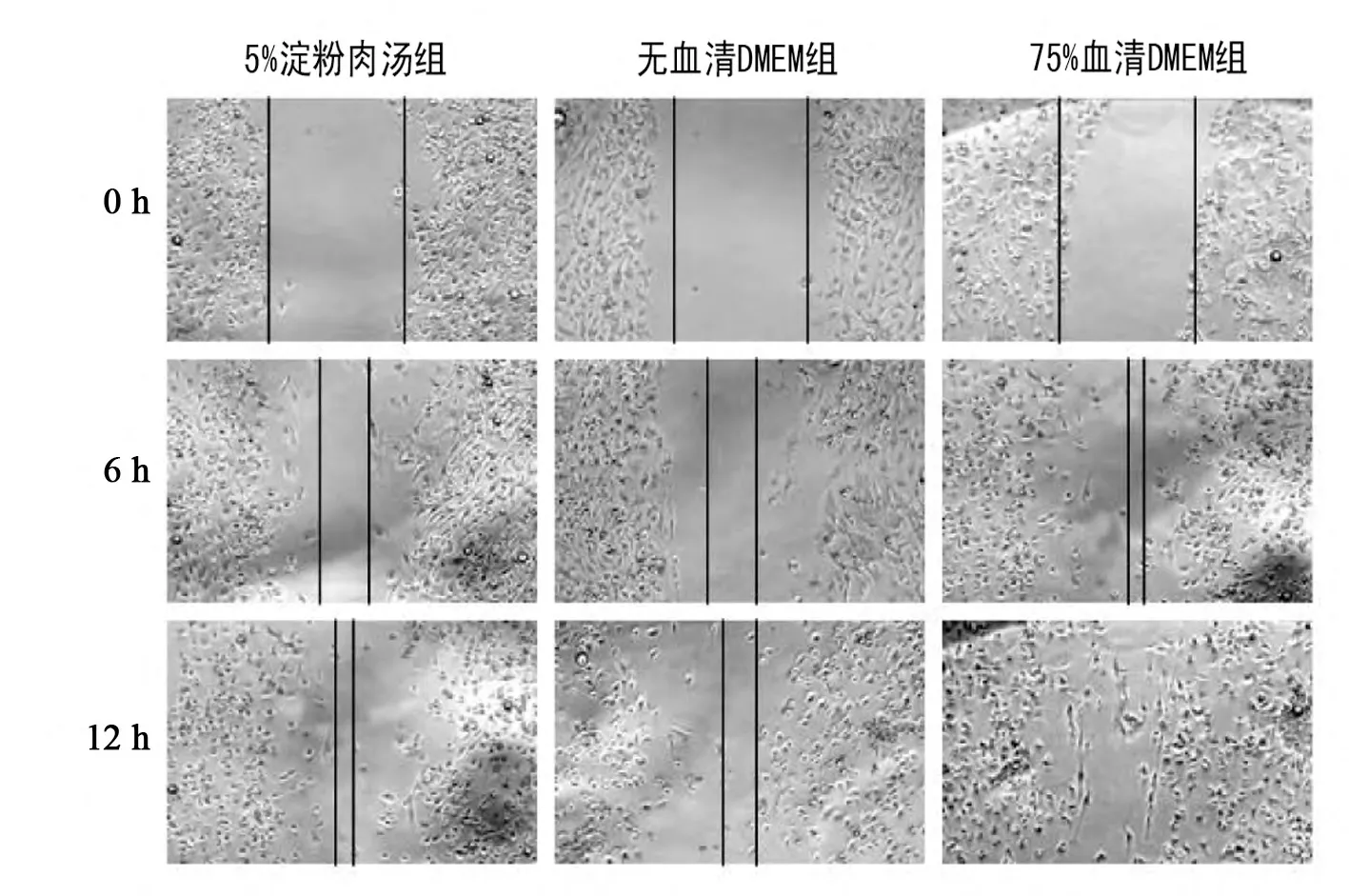
图3 巨噬细胞迁移(×100)Fig 3 The migration of macrophage(×100)

表2 巨噬细胞迁移指数Tab 2 Migration index of macrophage
2.5 LPS 刺激巨噬细胞分泌细胞因子能力检测
75%血清DMEM 组分离的巨噬细胞经LPS 刺激后,分泌TNFα,IL -1β,IL -6 明显多于其他两组,差异有显著性意义,P <0.05。无血清DMEM 组与5%淀粉肉汤组中巨噬细胞分泌的TNFα,IL -6差异均无显著性意义,P >0.05。无血清DMEM 组中巨噬细胞分泌IL-1β 多于5%淀粉肉汤组,差异有显著性意义,P <0.05。见表3。

表3 LPS 刺激巨噬细胞分泌细胞因子能力检测Tab 3 The cytokines secretion ability of macrophage stimulated by LPS
3 讨 论
巨噬细胞属免疫细胞,在机体内可抗感染、抗肿瘤、参与免疫应答及免疫调节,是研究细胞吞噬、细胞免疫和分子免疫学的重要对象。
近年来有关巨噬细胞的研究越来越受到人们的关注。巨噬细胞的提取是体外研究巨噬细胞的前提。随着体外分离培养细胞技术的发展,提取方法越来越多,提取的部位也不尽相同,如肺血管巨噬细胞、肾小球巨噬细胞,骨髓基质巨噬细胞、腹腔巨噬细胞等。小鼠来源容易,价格便宜,腹腔腹水中有很多巨噬细胞存在,因此,小鼠腹腔巨噬细胞成为很好的巨噬细胞来源。
从文献可知,现有的小鼠腹腔巨噬细胞分离方法大致相似,灌洗腹腔后吸出含巨噬细胞的灌洗液,利用巨噬细胞贴壁生长的特点将其分离。但每种方法也各有差异。有研究者先注入腹腔巨噬细胞刺激剂(如淀粉肉汤、LPS 等),吸引大量的巨噬细胞进入腹腔后再用灌洗液灌洗[3]。也有报道直接应用灌洗液灌洗小鼠腹腔分离巨噬细胞[4]。前者虽能收集到大量的巨噬细胞,但由于经过刺激,所获得的巨噬细胞与体内原始状态的巨噬细胞差异较大,不适合做功能方面的研究。而直接灌洗所获得的细胞虽然细胞状态较好,但是数量有限。本实验采用一种新的方法分离小鼠腹腔巨噬细胞,即将预冷的含75%血清的DMEM 液注入小鼠腹腔,按摩30 min 后回收液体并用无血清DMEM 灌洗,贴壁培养分离出其中的巨噬细胞。将此方法获得的巨噬细胞与其他方法分离的巨噬细胞相比较,结果表明,不同方法分离的巨噬细胞在细胞形态及存活率等方面无明显差异。流式细胞仪检测巨噬细胞特异性表面标记CD14[5-6],结果表明各组细胞CD14 的阳性率无明显差异,即所提取巨噬细胞的纯度无差异。但新方法获得的巨噬细胞数量最多,且细胞迁移能力及分泌TNFα、IL-1β 及IL -6 的能力明显增强。炎症发生时,巨噬细胞迁移至炎症局部并释放炎症因子,TNFα、IL-1β 及IL -6 在激活细胞因子级联、趋化炎性细胞[7-8]、催化炎症反应进程[9-10]等方面均起到了重要作用。由于新方法提取巨噬细胞的迁移能力及分泌炎症因子的能力明显增强,因此更有利于体外对其功能的研究。
本实验所用新方法提取的巨噬细胞在数量及功能上都具有优势,该方法在操作时应注意以下几个关键点:(1)小鼠处死前一天应空腹,饥饿至少8 h。(2)剪开小鼠腹部皮肤时,可先在下腹部剪一小口,再用手向上将皮肤撕开,这样既能充分暴露腹膜,也能保证腹膜的完整,减少污染的机会。(3)腹腔注入的75% 血清DMEM 液提前4 ℃预冷效果好。(4)向腹腔注入灌洗液时,应先用小镊子将腹膜提起,在腹膜与肠道的空隙处横向进针,防止刺破肠道出血,避免提取细胞中混入红细胞。(5)回吸灌洗液时,注射器针头容易被肠系膜堵塞,可无菌条件下打开腹腔,利用无针头的注射器,在腹腔最低处回吸灌洗液,这样既可避免针眼被堵塞,也可迅速而又接近完全地回吸灌洗液。关于75%血清DMEM液促进巨噬细胞向腹腔内聚集的机制,本实验并未涉及,需要在以后的实验中进一步探讨。
[1] 徐远义,黄允宁,常越,等.多抗甲素诱导小鼠腹腔巨噬细胞对癌细胞杀伤增强机制的研究[J]. 免疫学杂志,2006,22(4):396 -398.
[2] 李丹,任亚娜,范华骅.巨噬细胞的分类及其调节性功能的差异[J].生命科学,2011,23(3):249 -254.
[3] 余虹.小鼠巨噬细胞吞噬功能测定方法的改进及应用[J].生命科学研究,2013,17(4):316 -320.
[4] 张淑莉,张琪,景晓红.小鼠腹腔巨噬细胞的提取与鉴定[J].国家检验医学杂志,2015,36(2):174 -175.
[5] 范仕郡,刘鑫,黄敏,等.小鼠腹腔巨噬细胞的快速提取及培养[J].局解手术学杂志,2015,24(2):130 -131.
[6] 陈玉惠,周伟光,高晶,等.牛外周血单核巨噬细胞的分离、培养与鉴定[J]. 畜牧与饲料科学,2013,34(5):21 -22.
[7] Ray A,Dittel BN.Isolation of mouse peritoneal cavity cells[J].J Vis Exp,2010,28(35):1485 -1488.
[8] 余功旺,黄文浩,刘爱梅,等.小鼠腹腔巨噬细胞炎症模型的建立[J].广东药学院学报,2014,30(6):765 -770.
[9] 火东晓,陈继华,张石蕊,等.L-茶氨酸对脂多糖诱导的巨噬细胞炎症细胞因子分泌的影响[J]. 营养学报,2014,36(5):499 -501.
[10] 李萌,王磊,张立,等.牡蛎多糖对小鼠腹腔巨噬细胞免疫功能的影响[J].中国药业,2013,22(17):15 -16.
[11] 杨琴,张志仁,姜曼,等.小鼠巨噬细胞功能极化可塑性的初步探讨[J].免疫学杂志,2013,29(2):104 -109.
