新诊断2型糖尿病早期胰岛素联合强化治疗后获得长期血糖缓解2例
2015-03-02柯伟健李延兵
柯伟健 李延兵
中山大学附属第一医院内分泌科
新诊断2型糖尿病早期胰岛素联合强化治疗后获得长期血糖缓解2例
柯伟健 李延兵
中山大学附属第一医院内分泌科
Long-term Glycemic Remission Achieved by Short-term Intensive Combination Insulin Therapies in Newly Diagnosed Type 2 Diabetes: A Report of 2 Cases

柯伟健 医学博士,中山大学附属第一医院内分泌科医师,主要从事短期胰岛素联合治疗的研究,相关论著被J Diabetes Res和Diabetes Res Clin Pract接收及发表。
病例1
患者男,35岁,因“口干、多饮2周”入院。患者于2周前无明显诱因开始出现口干、多饮,无多尿,在当地门诊查空腹血糖(FPG)9.9mmol/L,糖化血红蛋白(HBA1c)14.0%,未予重视;2天前来我院查FPG 15.9mmol/L,餐后2小时血糖(2hPPG)19.7mmol/L,HBA1c 13.8%,空腹C肽1.110 nmol/L,以“2型糖尿病”收入我科。患者起病以来,无四肢肢端麻木、疼痛,无皮肤针刺感、烧灼感,无视物模糊,无发热、咳嗽、咳痰,无恶心、呕吐,无心悸、气促,无腹痛、腹胀、便秘,无尿频、尿急、尿痛,无排泡沫尿,无双下肢浮肿,精神、食欲、睡眠一般,大小便正常,近3月体重较前减轻7.5Kg。既往史无特殊,吸烟20支/天×10年,未戒烟,无饮酒嗜好;家族史无特殊,诊断为“2型糖尿病”。入院后查:
FPG 10.3mmol/L,2hPPG 13.1mmol/L,HbA1c 13.7%,静脉葡萄糖耐量试验(IVGTT) 0-1-2-4-6-10min胰岛素:7.90-6.90-5.70-4.50-3.60-3.10uU/ml,计算得急性胰岛素反应(acute insulin response,AIR)为33.60 uU·min/ml;总胆固醇(TC)4.8mmol/L,甘油三酯(TG)1.87 mmol/ L,低密度脂蛋白胆固醇(LDL-C)3.39mmol/L,高密度脂蛋白胆固醇(HDL-C)0.78mmol/L;胰岛相关抗体阴性,余尿常规、肝肾功能、糖尿病相关并发症筛查未见明显异常。予持续皮下胰岛素输注治疗(continuous subcutaneous insulin infusion,CSII)联合二甲双胍(格华止)0.5 tid、吡格列酮(艾可拓)30mg qd控制血糖并对患者进行每日7次的血糖监测(空腹、早餐后2小时、午餐前、午餐后2小时、晚餐前、晚餐后2小时、睡前),CSII起始胰岛素剂量为0.7u/kg,患者在开始降糖治疗后1天血糖达到控制目标(空腹血糖4.4~6.0mmol/L,餐后2小时血糖4.4~8.0mmol/L),其后CSII维持治疗14天,根据血糖水平调整胰岛素用量,至停用CSII前胰岛素剂量为0.34u/kg。停止CSII治疗后,继续使用二甲双胍(格华止)0.5 tid、吡格列酮(艾可拓)30mg qd,总疗程90天,其后患者仅靠饮食运动控制,血糖在后续1年的随访能维持缓解(FPG<7mmol/L及HbA1c<7%)。基线时、停止CSII治疗、停药(二甲双胍和吡格列酮)、停药1年后血糖控制、胰岛功能情况如表1所示。
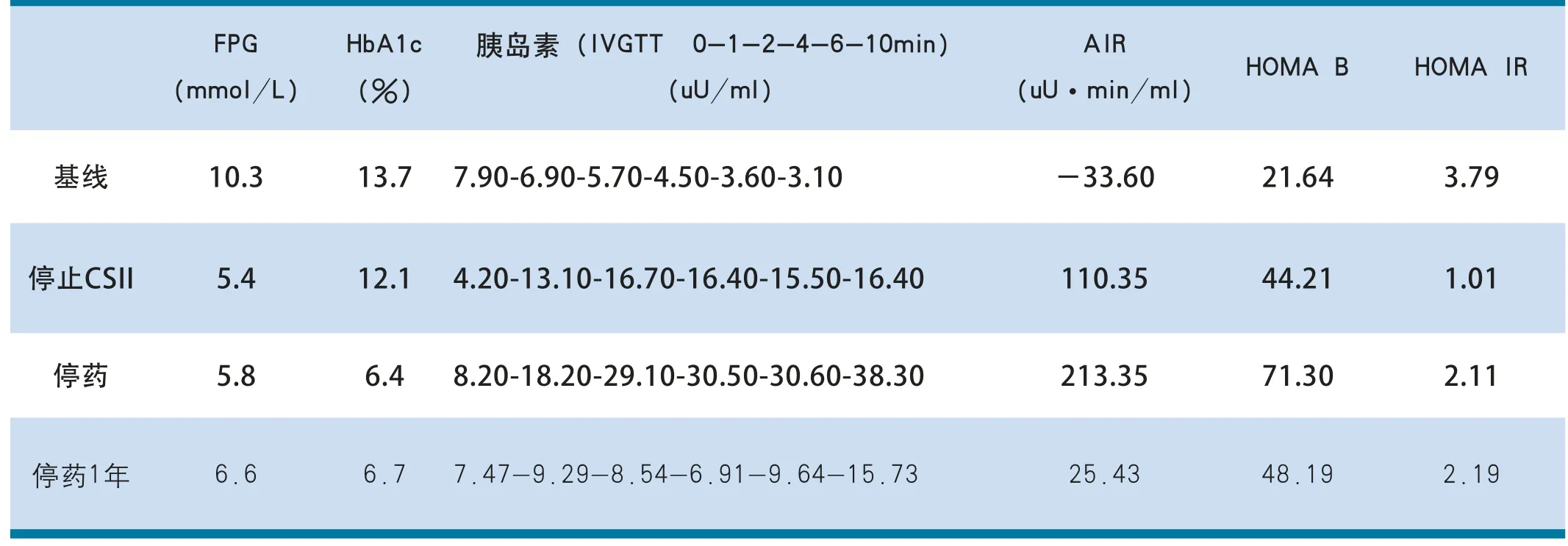
表1
病例2
患者女,53岁,因 “体检发现血糖升高半月,口干、多饮1周”入院。患者入院前半月外院体检时发现空腹血糖升高,达9.7mmol/L,当时未予处理。1周来自觉口干、饮水量较前增多,为求进一步诊治于2012 年12月24日入我科。本次起病来,无视力模糊,无多尿、夜尿增多,无进食增多、消瘦,无四肢感觉异常、头晕、头痛,无心悸、胸痛等。无发热、咳嗽、咳痰,无腹痛、腹胀、腹泻,无尿频、尿急、尿痛,无双下肢水肿。近期体重无明显下降。既往史方面,患者2年前发现“高血压病”,血压最高190/100mmHg,现服用“比索洛尔2.5mg qd,苯磺酸氨氯地平5mg qd”控制血压,平素血压控制在125~140/80~90mmHg;半月前体检发现血脂升高、尿酸高。个人史、家族史无特殊。查体:身高 1.62m,体重 67Kg,BMI 26kg/m2,心肺腹查体未见异常。诊断为“1.2型糖尿病,2.高血压病3级 很高危组”。入院后查:FPG 8.8mmol/L,HbA1c 8.7%,IVGTT 0-1-2-4-6-10min:10.10-11.90-12.10-10.10-9.30-11.80uU/ ml,AIR 5.80 uU·min/ml;TC 5.3mmol/L,TG 0.82mmol/L,LDL-C 3.44mmol/L,HDL-C 1.46mmol/L;胰岛相关抗体阴性,余查尿常规、肝肾功能、糖尿病相关并发症筛查未见明显异常。予CSII联合西格列汀(捷诺维)100mg qd控制血糖并对患者进行每日7次的血糖监测。CSII起始胰岛素剂量为0.7u/ kg,患者在开始降糖治疗后1天血糖达到控制目标,在CSII维持治疗的14天内,根据血糖调整胰岛素剂量,胰岛素剂量逐步减量至停用CSII前用量为0.17u/kg。停止CSII治疗后,继续使用西格列汀90mg qd,总疗程90天,其后患者仅靠饮食运动控制,血糖在后续1年的随访能维持缓解(FPG<7mmol/L及HbA1c<7%)。基线时、停止CSII治疗、停药(西格列汀)、停药1年后血糖控制、胰岛功能情况如表2所示。
讨论
随着生活水平的提高和生活方式的改变,糖尿病已成为最常见的代谢障碍疾病,最新的调查显示我国成人糖尿病的患病率已达11.6%,而作为糖尿病后备军——糖尿病前期的患病率更高达50.1%,也就是说估算我国约有1.14亿糖尿病患者,其中确诊糖尿病的患者中仅有25.8%的患者接受降糖治疗,而这些接受治疗的患者仅有36.7%血糖控制达标[1]。糖尿病作为慢性进展性疾病,随着血糖的恶化,慢性并发症逐渐出现,由此产生的失明、肾功能衰竭、心脑血管疾病等给公共医疗卫生事业带来沉重的负担,2007年我国糖尿病及相关并发症所带来的医疗费用为3220亿美元,而到2030年则预计会上升至5850亿美元[2]。这些触目惊心的数据告诉我们糖尿病的治疗任重道远。
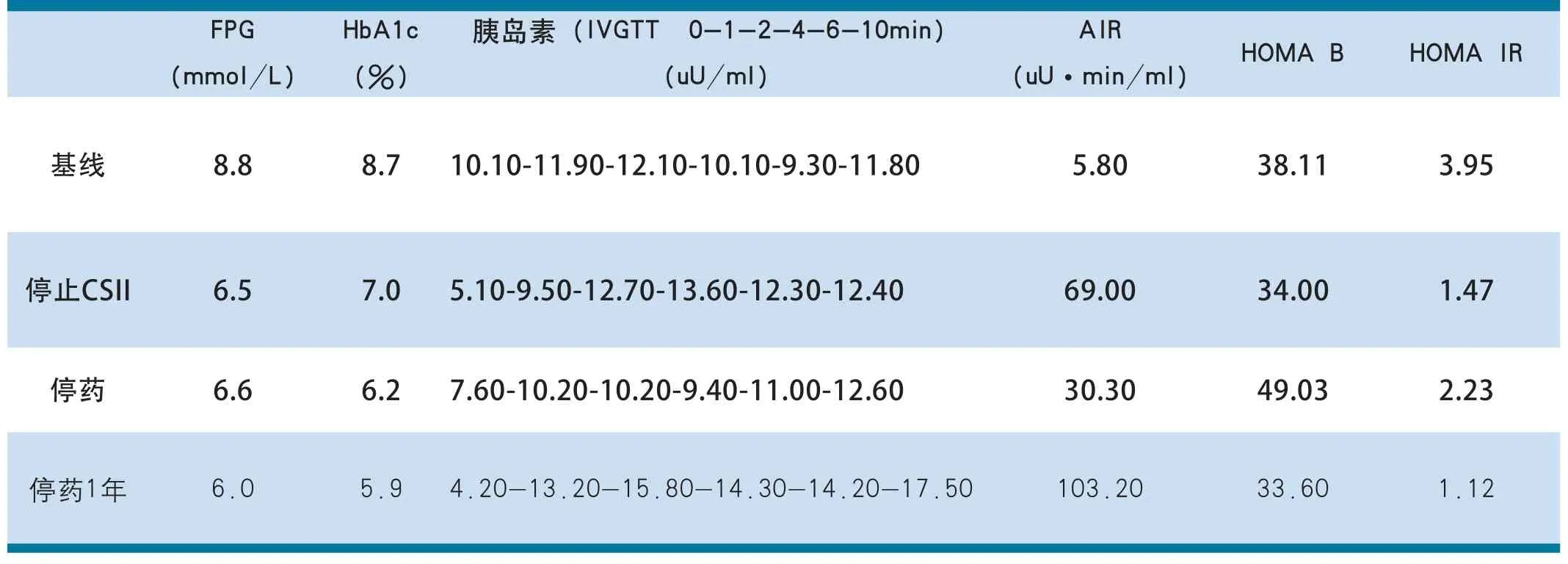
表2
目前认为2型糖尿病的两个主要病理生理机制是胰岛β细胞功能缺陷和胰岛素抵抗,在确诊2型糖尿病时,患者的胰岛β细胞功能已经衰竭近一半,随着病程的进展,胰岛素抵抗的存在,胰岛β细胞功能进一步衰竭[3]。传统的阶梯治疗模式——先饮食、运动控制,随着血糖的升高加用一种到多种口服降糖药物以及最终的胰岛素治疗的模式,干预方案调整常滞后于血糖的恶化,往往不能有效遏制血糖水平的进行性升高,致使胰岛β细胞功能进行性下降,疾病持续进展。所以糖尿病的治疗应该由这种以控制血糖为中心的模式转变为关注胰岛β细胞功能保护和改善胰岛素抵抗,从而延缓疾病的进展和慢性并发症的发生发展。
我们早在2001年就开展了新诊断T2DM的短期胰岛素强化治疗,入选的138例患者FPG均大于11.1mmol/ L,予以为期2周的CSII治疗作为胰岛素强化方案,经过强化治疗后,不仅高血糖状态得以缓解,也明显改善了HOMA B、AIR、胰岛素原/胰岛素比值(PI/ I)等胰岛β细胞功能指标,反映胰岛素抵抗的HOMA IR也有所下降,随访中发现分别有47.1%和42.3%的患者获得了12月、24月的“无药缓解期”[4]。后续我们开展了多中心随机对照研究,探讨短期胰岛素强化治疗(CSII与每日多次胰岛素注射[multiple daily injections,MDI])与常规口服降糖方案对新诊断T2DM患者胰岛β细胞功能和长期血糖缓解的作用,结果提示短期胰岛素强化治疗组较口服降糖药组的1年“无药缓解率”更高,CSII为51.1%,MDI为44.9%,而且这些患者胰岛素第一时相分泌(AIR)保留得更好[5]。一项纳入了7项T2DM早期强化治疗研究的meta分析提示2~3周的的胰岛素强化治疗能明显改善新诊断T2DM患者的胰岛β细胞功能,能使46.3%的患者获得1年的无药血糖控制[6]。新诊断T2DM患者早期使用短期胰岛素强化治疗尤其是CSII通过改善“糖毒性”和“脂毒性”,针对胰岛β细胞功能和胰岛素抵抗这两个主要病理生理机制,明显延缓了糖尿病病情进展。这些研究结果奠定了强化血糖控制在T2DM治疗中的重要地位,2013年版《中国2型糖尿病防治指南》明确了胰岛素强化治疗的地位,若患者在诊断糖尿病时HbA1c大于9%则可开始胰岛素强化治疗。
然而,胰岛素强化治疗对胰岛素抵抗改善的作用有限。我们继续探讨了CSII联合口服药物的短期强化治疗。CSII联合二甲双胍或罗格列酮对新诊断T2DM患者进行强化治疗的研究结果显示,CSII联合二甲双胍患者的AIR、HOMA B改善更为明显,两组患者HOMA IR改善是相似的,考虑是由于二甲双胍减少肝脏葡萄糖输出的作用导致空腹血糖相对更低,减轻肝脏胰岛素抵抗,使AIR改善更明显,通过磁共振氢质子波谱成像(1H-MRS)检测患者比目鱼肌、胫骨肌中的骨骼肌细胞内脂肪(IMCL)含量以评价骨骼肌胰岛素抵抗时发现,CSII联合罗格列酮的患者IMCL改善幅度更大[7]。二甲双胍以改善肝脏胰岛素抵抗为主,而噻唑烷二酮类(TZD)药物以改善骨骼肌胰岛素抵抗为主,二者结合理论上能更好地改善胰岛素抵抗。病例1的患者在CSII基础上,联用二甲双胍、吡格列酮共90天,患者胰岛β细胞功能较基线时有显著的改善,而在停药1年时随访,患者的血糖仍能获得无药缓解,而提示胰岛素抵抗情况的HOMA IR指数未见明显增加。
胰岛素强化治疗未能涵盖肠促胰素的分泌缺陷这一病理生理机制。基于调节肠促胰素作用的DPP-4抑制剂能抑制DDP-4活性,通过提高内源性GLP-1浓度,促进胰岛β细胞释放胰岛素,改善胰岛β细胞功能,同时抑制胰岛α细胞释放胰高血糖素,针对了糖尿病的双重病理机制[8]。病例2的患者使用CSII联合西格列汀的短期强化治疗方案,从随访的数据可见,患者的血糖维持良好控制,胰岛β细胞功持续改善,而胰岛素抵抗改善也非常显著。
综述所述,胰岛素强化治疗,尤其是CSII,能通过降低“糖毒性”和“脂毒性”,能很好地保护新诊断2型糖尿病患者胰岛β细胞功能,改善胰岛素抵抗,患者因此获得长期的血糖控制,结合了口服降糖药的短期联合强化治疗,弥补CSII治疗的缺陷,进一步加强对胰岛β细胞功能、胰岛素抵抗等的改善作用,使患者获得更好的血糖缓解,达到减缓慢性并发症发生、发展的目的。associated with improvement of beta-cell function. Diabetes Care,2004,27(11):2597-2602.
5 Weng J, Li Y, Xu W, et al. Effect of intensive insulin therapy on beta-cell function and glycaemic control in patients with newly diagnosed type 2 diabetes: a multicentre randomised parallel-group trial. Lancet,2008,371(9626):1753-1760.
6 Kramer CK, Zinman B, Retnakaran R. Short-term intensive insulin therapy in type 2 diabetes mellitus: a systematic review and meta-analysis. Lancet Diabetes Endocrinol,2013,1(1):28-34.
7 Huang Z, Wan X, Liu J, et al. Short-term continuous subcutaneous insulin infusion combined with insulin sensitizers rosiglitazone, metformin, or antioxidant alpha-lipoic acid in patients with newly diagnosed type 2 diabetes mellitus. Diabetes Technol Ther,2013,15(10):859-869.
8 Deacon CF. Therapeutic strategies based on glucagon-like peptide 1. Diabetes,2004,53(9):2181-2189.
1 Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in Chinese adults. JAMA,2013,310(9):948-959.
2 Wang W, McGreevey WP, Fu C, et al. Type 2 diabetes mellitus in China: a preventable economic burden. Am J Manag Care,2009,15(9):593-601.
3 Wajchenberg BL. beta-cell failure in diabetes and preservation by clinical treatment. Endocr Rev,2007,28(2):187-218.
4 Li Y, Xu W, Liao Z, et al. Induction of long-term glycemic control in newly diagnosed type 2 diabetic patients is
10.3969/j.issn.1672-7851.2015.06.011
