神经元特异性烯醇化酶在神经元氧糖剥夺损伤模型复氧后的表达变化
2015-03-02徐伟华黄啸元王业忠
徐伟华,赵 冬,戴 晶,刘 祺,许 晖,黄啸元,王业忠
·论著·
神经元特异性烯醇化酶在神经元氧糖剥夺损伤模型复氧后的表达变化
徐伟华,赵 冬,戴 晶,刘 祺,许 晖,黄啸元,王业忠
目的 探讨神经元特异性烯醇化酶(NSE)在体外培养神经元氧糖剥夺损伤模型复氧后的水平变化。方法 体外原代培养24 h内的新生SD大鼠海马区神经元,应用免疫荧光染色及电子显微镜鉴定神经元,应用体外氧糖剥夺建立大鼠海马区神经元缺血低氧损伤模型,分别对复氧1、6、12、24、48、72 h神经元提取蛋白质,Western blotting法检测不同时间点神经元损伤模型中NSE表达水平。结果 培养第4天的细胞免疫荧光染色显示神经元细胞核染色清晰,形态典型,突起走形如网状,阳性率为(93.6±1.6)%。各组NSE蛋白表达比较,差异有统计学意义(F=500.75,P<0.01)。实验组损伤后各时间点NSE蛋白表达高于对照组,细胞培养24、48 h NSE蛋白表达均高于其他时间点(P<0.05)。结论 NSE可作为自发性蛛网膜下腔出血(SAH)后早期脑损伤(EBI)标志物,能够反映脑组织的损伤程度。
蛛网膜下腔出血;原代细胞培养;海马;神经元;氧糖剥夺;神经元特异性烯醇化酶
徐伟华,赵冬,戴晶,等.神经元特异性烯醇化酶在神经元氧糖剥夺损伤模型复氧后的表达变化[J].中国全科医学,2015,18(20):2444-2447.[www.chinagp.net]
Xu WH,Zhao D,Dai J,et al.Changes of the expression of neuron specific enolase after the reoxygenation of neuron model damaged by oxygen-glucose deprivation[J].Chinese General Practice,2015,18(20):2444-2447.
自发性蛛网膜下腔出血(spontaneous subarachnoid hemorrhage,SAH)后早期脑损伤(early brain injury,EBI)是导致SAH患者死亡风险升高和不良预后的首要原因[1],而海马区神经元是脑损伤最敏感的部位。神经元特异性烯醇化酶(neuron specific enolase,NSE)在脑损伤诊断及患者预后评估中起重要作用[2]。本课题前期体外实验通过建立大鼠SAH模型,于伤后1、6、12、24、48、72 h时采用酶标免疫检测法(ELTSA)检测SD大鼠脑组织NSE水平,原位末端转移酶标记(TUNEL)法检测大鼠脑组织海马区神经元凋亡情况,初步证实:NSE表达水平与细胞凋亡数呈正相关。本研究通过体外培养神经元,建立损伤模型,探讨神经元损伤与NSE表达水平变化,判断不同时间点神经元损伤的严重程度,现报道如下。
1 材料与方法
1.1 实验动物 选取新生24 h内SD大鼠3~4只,雌雄不限,SPF级,由新疆医科大学实验动物中心提供。
1.2 主要化学试剂 DMEM/F12(Hyclone公司),Neurobasal A medium(Gibco公司),胎牛血清(FBS,Gibco公司),B-27添加剂(Gibco公司),左旋多聚赖氨酸(PLL,Sigma公司),胰蛋白酶(Amerisco公司),磷酸盐缓冲液(PBS,Hyclone公司),10 000 U/ml青霉素、10 000 U/ml链霉素和L-谷氨酰胺(Gibco公司),NSE多克隆抗体(Gibco公司),无血清培养基:Neurobasal培养基+2% B-27添加剂(50×)+1% L-谷氨酰胺(200 mmol/L)+双抗(100 U/ml青霉素、100 U/ml链霉素),于冰箱4 ℃保存备用;多聚-L-赖氨酸包被液:采用PBS配制1 mg/ml多聚-L-赖氨酸溶液,0.22 μm滤器过滤除菌,4 ℃保存备用。
1.3 大鼠大脑皮质神经元的分离及培养 取SD大鼠,常规碘伏消毒3遍后,75%乙醇消毒3遍,无菌条件下持眼科剪沿正中线剪开头皮与颅骨,暴露两侧大脑半球,用眼科无齿镊迅速取出整个脑组织,放入冰上盛有PBS的玻璃培养皿中,仔细剥离脑组织表面血管及脑膜,去除小脑、脑干,分离大脑皮质,PBS清洗2~3遍(去除红细胞)后,剪碎成1 mm×1 mm×1 mm,以0.25%胰蛋白酶在37 ℃ 5%CO2培养箱中消化10~15 min(其间振荡3次),加入种植培养基(90% DMEM-F12+10% FBS)终止消化3~5 min,去除终止消化液,加入5 ml种植培养基(90% DMEM-F12+10% FBS)后将大脑皮质吸至离心管A中,轻轻吹打10次(切记吹打时不可有气泡产生),冰中静置2 min,吸取2 ml上清液至离心管B中,再次加入2 ml种植培养基(90% DMEM-F12+10% FBS)至离心管A中吹打10次,重复3遍,将装有6 ml上清液的离心管B以1 000 r/min,4 ℃离心5 min,弃上清液后加入种植培养基,200目钢筛过滤,轻轻吹打10次制成细胞悬液。台盼蓝拒染试验,血细胞计数板镜下计数,以1.0×105~1.0×106个/ml的密度接种于多聚-L-赖氨酸包被过的培养皿中,置37 ℃ 5%CO295%湿度培养箱内培养。4~6 h后,将种植培养基全量换成饲养培养基(97% Neurobasal-A+2% B-27+1% L-谷氨酰胺)维持培养,每隔3 d饲养培养基全量换液。
1.4 免疫荧光[3]染色鉴定神经元 神经元培养第4天后首先用0.01 mol/L PBS洗涤5 min×3次。4%多聚甲醛固定30 min,PBS洗涤5 min×3次。0.3% Triton X-100孵育30 min,0.01 mol/L PBS洗涤5 min×3次。5% BSA封闭1 h。孵育NSE多克隆抗体(1∶100,Gibco公司,USA),4 ℃过夜。室温复温5 min,37 ℃恒温30 min。孵育NSE二抗(1∶100,中杉金桥),37 ℃ 1 h。0.01 mol/L PBS洗涤5 min×3次。DAPI(1∶1 000,Sigma,USA)染细胞核5 min,0.01 mol/L PBS洗涤5 min×3次。50%甘油封片。培养板在普通荧光显微镜(Olympus,Japan)下检测。对照实验只加0.01 mol/L PBS和二抗,细胞均为阴性染色。抗体稀释液为0.01 mol/L PBS。
1.5 神经元损伤模型的建立 体外应用氧糖剥夺模型,能够较理想地模拟体内缺血低氧情况。选取培养7 d的神经元,倒去原培养液,用PBS冲洗2遍,加入无糖培养基,置于通入95% N2和5% CO237 ℃的恒温低氧培养箱中,孵育60 min后,去除无糖培养基,重新加入饲养培养基(97% Neurobasal-A+2% B-27添加剂+1% L-谷氨酰胺)置于37 ℃ 5% CO295%湿度培养箱内培养,分别在培养1、6、12、24、48、72 h时提取神经元蛋白质。
1.6 Western blotting法检测NSE蛋白表达水平 提取神经元蛋白质后,经10% SDS-PAGE凝胶分离,采用半干法转膜47 min,然后用5% BSA封闭2 h,加一抗置于摇床上放入4 ℃冰箱内孵育过夜,室温下摇床上孵育二抗2 h,化学发光,曝光,于凝胶成像系统中采集图像分析。
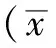
2 结果
2.1 神经元的形态学观察 在倒置显微镜下,初次分离种植的海马神经元呈圆形或椭圆形,胞体透明,体积小,无突起,单个散在分布。培养4~6h,大部分细胞基本贴壁,12h可见部分细胞伸出短小突起,胞体立体感强,发亮。培养1d,突起的长度增加(见图1A);培养3d,细胞明显增多,胞体明显增大,饱满,突起明显增长,多呈双极、多极突起,相互连接交织成网状(见图1B);培养5~7d,胞体聚集,突起纵横交错,增粗、增长,形成神经网络(见图1C、D)。
注:图A、B分别为培养1、3d细胞形态;图C、D为培养5~7d细胞形态
图1 大鼠海马区神经元培养不同时间点形态变化(×200)
Figure1Morphologicalchangesofrathippocampusneuroncellsatdifferenttimepointsduringinvitroculture
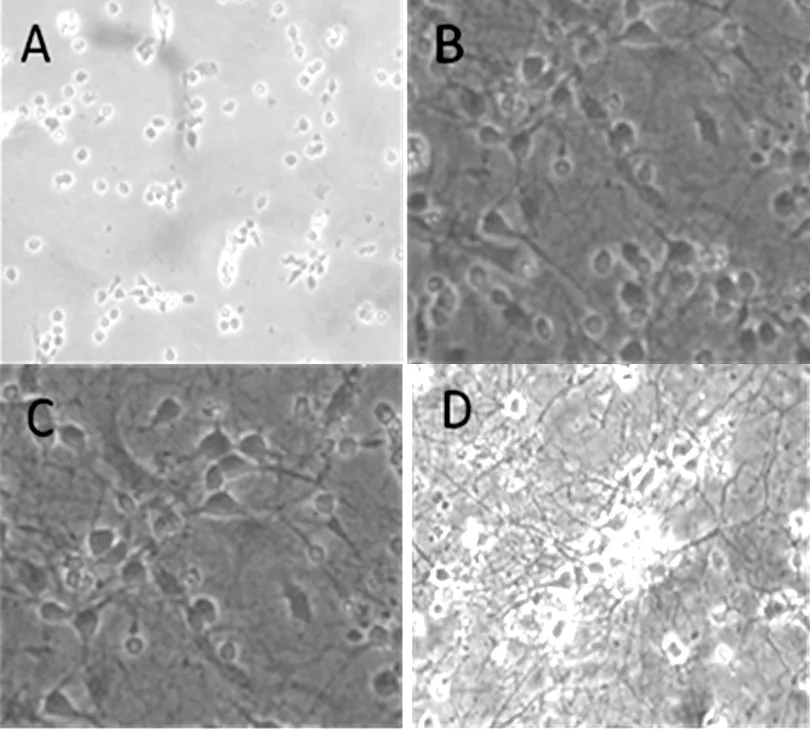
2.2 免疫荧光染色鉴定观察结果 选取培养第4天的细胞(此时细胞形态较为典型,且胶质细胞尚未发育成熟),免疫荧光染色,以胞质和/或突起染成黄绿色为阳性,整个细胞都不被染色为阴性。在20倍物镜下随机选取10个视野范围内的所有细胞,分别统计阳性细胞数和细胞核数(细胞总数),计算阳性率(阳性细胞数/细胞核数),阳性率的平均数代表神经元的纯度[4]。经鉴定,神经元细胞核染色清晰,形态典型,突起走形如网状,阳性率为(93.6±1.6)%,见图2。
注:A为细胞核蓝染,代表细胞总数;B为阳性神经元;C为阴性神经元
图2 免疫荧光染色计数阳性神经元
Figure 2 Neuron cells of positive immunofluorescence staining
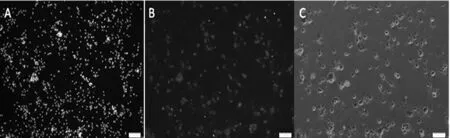
2.3 Western blotting检测NSE蛋白表达 各组NSE蛋白表达比较,差异有统计学意义(F=500.75,P<0.01)。实验组损伤后各时间点NSE蛋白表达高于对照组,细胞培养24、48 h NSE蛋白表达均高于细胞培养其他时间点,差异均有统计学意义(P<0.05,见图3、4)。

注:NSE=神经元特异性烯醇化酶
图3 Western blotting检测不同时间点NSE蛋白表达水平
Figure 3 NSE protein expression levels tested by Western blotting at different time points
注:与对照组比较,aP<0.05
图4 不同时间点NSE蛋白表达水平比较
Figure 4 Comparison of NSE protein expression level at different time points
3 讨论
EBI是指SAH发生后72 h内出现的全脑直接损伤[5],早期海马区神经元即可出现凋亡、坏死及数目减少,在SAH患者预后中起重要作用。因此,EBI的研究在SAH患者的治疗、预防中具有很大的潜力,能有效减轻SAH造成的损伤,对降低SAH后致残率和病死率有重要意义[6]。
近年来,许多临床及实验研究显示,NSE仅存在于神经元及神经内分泌细胞的胞质中,正常情况下,血清和脑脊液中NSE的含量极少,然而在脑损伤后,部分神经元坏死、崩解,从而导致神经元细胞膜破坏,NSE可释放入细胞间隙和脑脊液中,通过血-脑脊液屏障(BBB)进入血液和脑脊液中。因此,NSE在脑损伤中的变化水平目前已成为广大学者的研究热点。有报道认为,脑脊液或血液中增高的NSE与神经元损伤的数目有关[7]。本研究通过Western blotting检测神经元损伤模型中NSE蛋白表达,结果显示,在神经元损伤后1 h即有NSE低表达,而在6 h时NSE表达明显增加,且逐渐增多,24~48 h达到高峰,72 h表达逐渐减少,提示建模1 h后神经元即有损伤并逐渐加重,24~48 h最严重,与本课题前期体内实验结果一致,进一步证实神经元损伤后可引起NSE升高,血液中NSE升高及升高的幅度可以反映脑损伤的程度及范围[8-9]。
有报道认为,脑出血后血肿周围神经元的死亡形式主要以凋亡为主[10-11]。有研究表明,SAH发生后的整个EBI过程中,同侧额叶基底皮质的自体吞噬显著增加,造成了神经元的损伤,并引起一系列的功能障碍[12]。在SAH发生后,凋亡级联反应很早就被激活,引起脑水肿、脑血管痉挛、全脑缺血、免疫炎性反应和氧化应激反应等导致广泛性的细胞凋亡[13],主要包括BBB、海马和血管内皮细胞。在中枢神经系统胚胎发育阶段中神经元凋亡最早出现,成年个体极少见神经元凋亡,一般多发生在病理情况下[14]。探索细胞凋亡在神经系统疾病中发挥的作用,对揭示神经系统疾病的发生机制及病程的进展有重要意义[15]。本课题前期体内实验结果发现,实验组术后6 h即出现大量TUENL染色阳性细胞,24~48 h达到高峰后逐渐下降[16],这与本实验中NSE表达的时间趋于一致,提示在脑损伤发生发展过程中,海马区神经元凋亡发挥了重要的作用,NSE水平升高在一定程度上能够反映脑损伤的严重程度,其机制可能与神经元的凋亡率增高有关。
综上所述,NSE作为一种简便易行的生化监测指标,能够直接反映脑损伤的程度及范围,监测其水平变化在早期脑损伤患者病情判断及临床诊疗过程中存在一定的参考价值。此外,细胞凋亡对SAH后早期脑损伤的发生、发展有着重要作用,抑制海马区神经元凋亡是否能够改善SAH后早期脑损伤患者的预后仍需进一步研究探讨。
[1]Pluta RM,Hansen-Schwartz J,Dreier J,et al.Cerebral vasospasm following subarachnoid hemorrhage:time for a new world of thought[J].Neurol Res,2009,31(2):151-158.
[2]Foerch C,Singer OC,Neumann-Haefelin T,et al.Evaluation of serum S100B as a surrogate marker for long-term outcome and infarct volume in acute middle cerebral artery infarction[J].Arch Neurol,2005,62(7):1130-1134.
[3]Xin G,Su Y,Wang GF,et al.Cultivation of cerebral cortex neuronal cells of newborn BALB/c mice[J].Letters in Biotechnology,2011,22(1):85-88.(in Chinese) 辛岗,苏芸,王革非,等.新生BALB/c小鼠大脑皮质神经元细胞培养方法的建立[J].生物技术通讯,2011,22(1):85-88.
[4]Sun Q,Xu ZW,Ao HQ,et al.In-vitro primary culture and identification of hippocampal neurons from newborn rats[J].Traditional Chinese Drug Research and Clinical Pharmacology,2010,21(5):461-464.(in Chinese) 孙琪,徐志伟,敖海清,等.大鼠海马神经细胞体外原代培养与鉴定[J].中药新药与临床药理,2010,21(5):461-464.
[5]Cahill J,Calvert JW,Zhang JH.Mechanisms of early brain injury after subarachnoid hemorrhage[J].J Cereb Blood Flow Metab,2006,26(11):1341-1353.
[6]邵春香,郭晖,张弘娟,等.蛛网膜下腔出血并发低钠血症36例临床分析[J].中华实用诊断与治疗杂志,2011,25(9):920-922.
[7]Barone FC,Clark RK,Price WJ,et al.Neuron-specific enolase increases in cerebral and systemic circulation following focal ischemia[J].Brain Res,1993,623(1):77-82.
[8]Oksanen T,Tiainen M,Skrifvars MB,et al.Predictive power of serum NSE and OHCA score regarding 6-month neurologic outcome after out-of-hospital ventricular fibrillation and therapeutic hypothermia[J].Resuscitation,2009,80(2):165-170.
[9]Marquardt G,Setzer M,Szelenyi A,et al.Prognostic relevance of serial S100b and NSE serum measurements in patients with spinal intradural lesions[J].Neurol Res,2009,31(3):265-269.
[10]Qureshi AI,Suri MF,Ostrow PT,et al.Apoptosis as a form of cell death in intracerebral hemorrhage[J].Neurosurgery,2003,52(5):1041-1047.
[11]Qureshi AI,Ling GS,Khan J,et al.Quantitative analysis of injured,necrotic,and apoptotic cells in a new experimental model of intracerebral hemorrhage[J].Crit Care Med,2001,29(1):152-157.
[12]Lee JY,He Y,Sagher O,et al.Activated autophagy pathway in experimental subarachnoid hemorrhage[J].Brain Res,2009(1287):126-135.
[13]Sugawara T,Jadhav V,Ayer R,et al.Thrombin inhibition by argatroban ameliorates early brain injury and improves neurological outcomes after experimental subarachnoid hemorrhage in rats[J].Stroke,2009, 40(4):1530-1532.
[14]Savitz SI,Rosenbaum DM.Apoptosis in neurological disease[J].Neurosurgery,1998,42(3):555-574.
[15]孙倩,李净兵.细胞凋亡与神经系统疾病的研究进展[J].河北医科大学学报,2010,31(12):1526-1528.
[16]Wang JP,Wang YZ.Relationship of the changes of neuron specific enolase with neuronal apoptosis in brain injured rats after spontaneous subarachnoid hemorrhage[J].Journal of Chinese Practical Diagnosis and Therapy,2013,27(5):452-454.(in Chinese) 王建璞,王业忠.大鼠自发性蛛网膜下腔出血后脑损伤中神经元细胞凋亡与神经元特异性烯醇酶水平变化的关系[J].中华实用诊断与治疗杂志,2013,27(5):452-454.
(本文编辑:贾萌萌)
Changes of the Expression of Neuron Specific Enolase After the Reoxygenation of Neuron Model Damaged by Oxygen-glucose Deprivation
XUWei-hua,ZHAODong,DAIJing,etal.
MedicalSchoolofShiheziUniversity,Shihezi832000,China
Objective To explore the changes of the expression of neuron specific enolase(NSE)after the reoxygenation of in vitro culture neuron model damaged by oxygen-glucose deprivation.Methods In vitro primary culture was conducted on the neurons in hippocampus area of newborn SD rats within 24 hours.Evaluation of the neurons was carried out by using immunofluorescent staining and electron microscope.By oxygen-glucose deprivation,the damaged neuron model which was ischemic and hypoxic was established.Protein was extracted from the model 1,6,12,24,48 and 72 hours after reoxygenation,and Western blotting method was used to test NSE expression level in the model at different time points.Results On day 4 during in vitro culture,immunofluorescent staining showed clear nuclear staining,typical shape of net with protuberance and deformation and a positive rate of(93.6±1.6)%.The two groups were significantly different in NSE protein expression level(F=500.75,P<0.01).The trial group was higher(P<0.05)than the control group in NSE protein expression at different time points after neuron damage.The NSE protein expression levels at hour 24 and hour 48 during in vitro culture were higher(P<0.05)than those at other time points.Conclusion NSE could be used as an indicator of SAH and EBI,for it could reflect the damage degree of brain tissue.
Subarachnoid hemorrhage;Primary cell culture;Hippocampus;Neurons;Oxygen-glucose deprivation;Neuron specific enolase
国家自然科学基金资助项目(81360185);新疆生产兵团博士基金资助项目(2011BB016)
832000新疆石河子市,石河子大学医学院(徐伟华,黄啸元);石河子大学医学院第一附属医院神经外科(赵冬,戴晶,刘祺,许晖,王业忠)
王业忠,832000新疆石河子市,石河子大学医学院第一附属医院神经外科;E-mail:wangyz2008@126.com
R 743.35
A
10.3969/j.issn.1007-9572.2015.20.020
2015-01-03;
2015-04-20)
