灯盏生脉胶囊含药血清对神经元缺氧复氧损伤的保护作用及机制研究
2015-03-02周子懿卢鸿基陈依萍王立新蔡业峰蔡定芳
周子懿,卢鸿基,向 军,陈依萍,王立新,蔡业峰,蔡定芳
·中医·中西医结合研究·
灯盏生脉胶囊含药血清对神经元缺氧复氧损伤的保护作用及机制研究
周子懿,卢鸿基,向 军,陈依萍,王立新,蔡业峰,蔡定芳
目的 从细胞水平探讨灯盏生脉胶囊(DZSM)含药血清对原代大鼠皮质神经元氧糖剥夺/复氧(OGD/R )损伤模型的保护作用及其可能机制。方法 将出生24 h内SD大鼠的皮质神经元原代培养7 d后随机分为空白对照组、OGD模型组、正常血清对照组、低剂量DZSM组、高剂量DZSM组。空白对照组不进行预处理及造模,其他各组在OGD/R前分别采用0.9%氯化钠溶液、正常大鼠血清、低剂量DZSM含药血清、高剂量DZSM含药血清预处理,在OGD/R后24.0 h用光镜观察神经元形态学变化,采用XTT法测定细胞存活率、流式细胞术测定细胞凋亡率、Western blotting测定缝隙连接蛋白43(Cx43)表达量,并观察OGD/R后0.5、6.0、12.0、24.0 h Cx43表达变化。结果OGD/R后24.0 h,OGD模型组神经元呈现损伤特征,细胞存活率〔(54.6±6.4)%〕较空白对照组(100.0%)降低(P<0.05),细胞凋亡率升高〔(48.6±4.6)%与(8.8±1.0)%〕(P<0.05);OGD/R模型组Cx43在OGD/R后0.5 h表达量升高,并持续整个观察过程(P<0.05)。低、高剂量DZSM组光镜下可见神经元损伤,较OGD模型组减轻;低剂量DZSM细胞存活率为(69.6±7.7)%,高剂量DZSM细胞存活率为(76.1±8.8)%,均较OGD模型组细胞存活率高(P<0.05);低剂量DZSM组细胞凋亡率为(25.0±5.9)%,高剂量DZSM组为(18.2±4.9)%,与OGD模型组〔(48.6±9.2)%〕比较,差异有统计学意义(P<0.05)。OGD模型组、正常血清对照组、低剂量DZSM组和高剂量DZSM组Cx43表达量分别为(72.8±6.9)、(63.1±6.6)、 (21.1±3.2)、(24.4±3.8),低、高剂量DZSM组与OGD模型组相比,Cx43表达均下降(P<0.05)。结论 DZSM含药血清可抑制OGD/R模型神经元凋亡,提高细胞存活率,其机制可能与抑制Cx43的表达有关。
灯盏生脉胶囊;脑缺血;神经细胞;缝隙连接蛋白43
周子懿,卢鸿基,向军,等.灯盏生脉胶囊含药血清对神经元缺氧复氧损伤的保护作用及机制研究[J].中国全科医学,2015,18(20):2458-2463.[www.chinagp.net]
Zhou ZY,Lu HJ,Xiang J,et al.Protective effect of drug serum contained in dengzhan shengmai capsule on oxygen and glucose deprivation/reoxygenation injury of nerve cells and its mechanism[J].Chinese General Practice,2015,18(20):2458-2463.
缺血性脑卒中已成为全球第二大常见死因,每年消耗巨大的医疗资源[1],临床正积极寻找有效的治疗方案,以降低致残率、病死率。灯盏生脉胶囊(DZSM)以灯盏细辛为主要成分,配以人参、五味子及麦冬,具有益气养阴、活血化瘀等功能,已有大型临床研究证明该药对缺血性脑卒中有治疗作用[2],然而其机制尚待进一步探讨。本研究采用体外细胞培养技术结合中药血清药理学方法,利用氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)技术诱导大鼠皮质神经元损伤模型,模拟“脑缺血”状态,观察DZSM对神经元凋亡的抑制作用,在离体状态下验证该药对脑缺血的保护作用,并进一步揭示其可能机制。
1 材料与方法
1.1 实验动物 清洁级标准健康成年雄性SD大鼠,体质量250~280 g。由复旦大学实验动物中心提供,并饲养于该实验动物中心,自由进食、饮水。动物房12 h明暗交替,平均温度22 ℃,相对湿度30%。按照国际实验动物使用准则对动物进行操作,减少实验动物在实验过程中的痛苦。出生24 h内的SD大鼠由中国科学院上海分院实验动物中心提供。
1.2 试剂与药品 主要试剂有neurobasal、B-27添加剂、高糖(20.0 mmol/L) DMEM培养液、低糖(0.5 mmol/L) DMEM培养液、胎牛血清(FBS)、青链双抗溶液、L-谷氨酰胺、0.25%胰蛋白酶和磷酸盐缓冲剂(PBS)粉末均为Gibco产品,L-多聚赖氨酸、PI、XTT均为Sigma产品。一抗Connexin43抗体为Cell singaling Technology产品。二抗FITC标记抗鼠IgG来自Jackson Immuno Research Laboratories(Inc.West Grove,USA)。兔抗tubulin多克隆抗体为Chem Icon产品。羊抗兔IgG- FITC 来自上海康成生物工程公司。6孔、96孔培养板购自Corning公司。DZSM来自云南生物谷灯盏花药业有限公司(批准文号:国药准字20026439)。
1.3 实验方法
1.3.1 DZSM含药血清制备 将SD大鼠按完全随机设计分为3组:空白对照组、低剂量DZSM组、高剂量DZSM组,每组各10只。低剂量DZSM组采用0.36 g/kg(将DZSM颗粒溶于0.9%氯化钠溶液4 ml中制成)、高剂量组采用0.72 g/kg(将DZSM颗粒溶于0.9%氯化钠溶液4 ml中制成)[3]〔按不同种属剂量换算公式:dB=dA×(RB/RA)×(WA/WB),dA为临床成人用量,dB为大鼠每日每公斤用量,RA为人类的体型系数100,RB为大鼠的体型系数90,WA、WB为已知动物、欲求动物体质量值〕DZSM溶液灌胃,2次/d,连续7 d;空白对照组给予等容积蒸馏水。于末次给药后2 h处死,下腔静脉取血,室温下静置1 h,置4 ℃过夜。3 000 r/min离心15 min(离心半径13 cm)。取上清液,经56 ℃30 min灭活,0.22 μm滤膜过滤灭菌,-20 ℃保存备用。
1.3.2 混合培养神经元与神经元的原代培养[4]出生24 h内的SD大鼠,无菌条件下取出胎鼠置于培养皿中,断头取脑分离出双侧大脑皮质,剥除其表面的脑膜组织,快速剪切皮质组织成1 mm ×1 mm × 1 mm大小,置于含0.125%胰蛋白酶的PBS液中,37 ℃消化15 min,加入含20%FBS的DMEM培养液中,反复吹打成单细胞状态,利用200目筛过滤,收集滤液,1 000 r/min离心5 min(离心半径13 cm),弃上清液,接种于0.01% L-多聚赖氨酸包被的培养皿,置37 ℃、5% CO2的培养箱,2 h后可观察到细胞贴壁,部分神经元有突起长出,继续予高糖DMEM培养液,此为混合培养神经元;若此后全量换液成神经元培养液(97%neurobasal + 2%B-27添加剂+1%L-谷氨酰胺)则为神经元的原代培养。之后每隔3~5 d换液1次。培养7 d后进行后续实验。
1.3.3 OGD/R模型的制作[5]OGD/R模型模拟神经元体外缺氧模型:神经元培养至第7天,原培养液全量换成低糖(0.5 mmol/L)DMEM培养液,置于特制缺氧箱内充以99.9%氩气15 min,最终测氧气含量低于0.1%,37 ℃培养2 h,然后恢复原培养环境(原培养液,37℃、95%空气和5% CO2潮湿环境的培养箱)继续培养。
1.3.4 细胞分组及处理 将培养7 d的神经元随机分为5组,分别为空白对照组、OGD模型组、正常血清对照组、低剂量DZSM组、高剂量DZSM组。正常血清对照组和低/高剂量DZSM组添加血清终浓度为10%,OGD模型组以等量0.9%氯化钠溶液替代。随后移至37 ℃特制缺氧箱内按照1.3.3方法培养2 h后取出,立即全量换为神经元培养液(97% neurobasal + 2% B-27添加剂+1% L-谷氨酰胺为神经元培养,若再次置于原培养环境继续培养则为混合神经元培养)。随后置于5%CO2、37 ℃培养箱中复氧,再进行后续检测实验。空白对照组则不经任何处理,继续原有条件培养。
1.3.5 神经元鉴定 β-Ⅲ tubulin免疫荧光:培养7 d的神经元用2%多聚甲醛固定10 min,PBS清洗3遍。每孔加入一抗稀释液,4 ℃孵育过夜。PBS清洗一抗3遍。加入二抗稀释液,室温下避光孵育1 h。PBS清洗二抗3遍,置于荧光显微镜下观察。
1.3.6 细胞形态学观察 采用倒置显微镜观察各组细胞形态学变化。
1.3.7 细胞活性测定与细胞凋亡 采用XTT法[6]测定细胞存活情况。各组神经元在终止培养前每孔加入XTT(最终浓度0.15 g/L),37 ℃、5% CO2孵育4 h,弃上清液,每孔加二甲基亚砜 200 μl,静置10 min。在酶标仪570 nm读取各孔吸光度值(A值)。每组设6个平衡样。细胞存活率(%)以检测组A值/空白对照组A值×100%表示。
采用流式细胞术检测细胞凋亡情况:收集神经元悬液,1 000 r/min,离心5 min (离心半径13 cm),弃上清液,沉淀用70%乙醇悬浮,4 ℃冰箱内固定12 h以上。取固定后的细胞用0.01 mol/L PBS(pH 7.4) 洗2遍并悬浮,加入终浓度为20 mg/L的RNaseA,37 ℃恒浴45 min,再加入PI染液至终浓度为50 mg/L,摇匀后4 ℃避光冷藏1 h,在 FACS 420型流式细胞仪上计数10 000个细胞,测定各期DNA含量并计算凋亡细胞所占比例。实验重复4次,取平均值。
1.3.8 Western blotting检测缝隙连接蛋白(Cx)43的表达 将组内每两皿混合神经元消化后合并为1个样本,每组各6个样本。十二烷基磺酸钠(SDS)直接裂解法提取蛋白,二喹啉甲酸(BCA)法测定蛋白浓度,15%SDS-PAGE电泳,电转法转移到NC膜上,封闭,免疫检测,电化学发光法(ECL)检测,暗室曝光,显影、定影、扫描。用图像处理系统对条带灰度进行分析,免疫印迹条带按面积×灰度计算,计算各组Cx43/GAPDH电泳条带密度比值并进行判断。
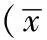
2 结果
2.1 神经元鉴定和DZSM对OGD/R神经元形态学方面的影响 光镜下观察各组神经元形态学变化(见图1A~1E)。OGD模型组多数神经元胞体破裂呈碎片状,胞体空泡化,突起断裂甚至消失,或胞体缩小(见图1B)。正常血清对照组神经元损伤程度与OGD模型组相似,可见部分胞体空泡化,细胞破裂,突起收缩断裂甚至消失(见图1C)。低剂量DZSM组神经元与OGD模型组相比,损伤有所减轻,仅小部分胞体破碎,折光度可(见图1D);高剂量DZSM组大部分细胞形态基本正常,胞体有立体感,少量胞体破碎(见图1E)。采用免疫荧光技术,对体外培养7d的皮质神经元进行鉴定(见图1F)。

注:A=空白对照组,B=OGD模型组,C=正常血清对照组,D=低剂量DZSM组,E=高剂量DZSM组,F神经元鉴定图
图1 倒置相差显微镜高倍镜观察DZSM含药血清对OGD/R后24 h神经元形态学的影响(× 200)及神经元鉴定图
Figure 1 Effects of drug serum of DZSM on the morphological changes of nerve cells at 24 h after OGD/R by the observation through inverted phase contrast microscope and the identification image of neurons
2.2 DZSM含药血清干预对OGD/R后神经元存活率的影响 各组在OGD/R后24 h收获细胞进行XTT检测,OGD/R神经元存活率空白对照组为100.0%,OGD模型组为(54.6 ±6.4)%,正常血清对照组为(55.2±5.8)%,低剂量DZSM组为(69.6 ±7.7)%,高剂量DZSM组为(76.1±8.8)%,各组间差异有统计学意义(F=48.850,P<0.05,见图2);其中空白对照组神经元存活率高于其他4组(P<0.05),低、高剂量DZSM组神经元存活率均高于OGD模型组(P<0.05),低DZSM剂量组和高DZSM剂量组神经元存活率间差异无统计学意义(P>0.05,见图2)。

注:与空白对照组比较,aP<0.05;与OGD模型组比较,bP<0.05
图2 DZSM含药血清对OGD/R神经元存活率的影响(n=6)
Figure 2 Effects of DZSM containing serum on neuronal viability after OGD/R
2.3 DZSM含药血清对OGD/R神经元凋亡率的影响 OGD/R后24 h神经元凋亡率空白对照组为(8.8±1.0)%,OGD模型组为(48.6±4.6)%,正常血清对照组为(48.7±7.8)%,低剂量DZSM组为(25.0±2.9)%,高剂量DZSM组为(18.2±2.5)%,各组间比较差异有统计学意义(F=16.972,P<0.05);其中空白对照组神经元凋亡率低于其他4组(P<0.05),低、高剂量DZSM组神经元凋亡率均低于OGD模型组(P<0.05),差异有统计学意义(P<0.05,见图3)。
2.4 OGD/R损伤后Cx43的表达变化 收集混合培养的神经元采用Western blotting法检测Cx43在OGD/R后0.5、6.0、12.0、24.0 h的表达变化。空白对照组及OGD模型组OGD/R后0.5、6.0、12.0、24.0 h 时Cx43的表达量分别为(8.61±1.24)、 (33.06±4.32)、 (30.92±4.10)、(31.47±4.53)、(32.28±4.61),各组间比较差异有统计学意义(F=6.946,P<0.05);与空白对照组比较,OGD模型组OGD/R后0.5、6.0、12.0、24.0 h 时Cx43的表达量均升高,差异有统计学意义(P<0.05,见图4)。

注:与空白对照组比较,aP<0.05;与OGD模型组比较,bP<0.05
图3 DZSM含药血清对OGD/R神经元凋亡率的影响(n=6)
Figure 3 Flow-cytometric analysis of the effects of DZSM containing serum on OGD-induced neuronal apoptosis

注:与空白对照组比较,aP<0.005
图4 Western blotting法检测OGD/R后不同时间点Cx43的表达
(n=6)
Figure 4 Cx43 expression levels after OGD/R tested by western blotting method in different times
2.5 DZSM含药血清对OGD/R后Cx43表达的影响 各组在OGD/R后24.0 h采用Western blotting法分析Cx43的表达水平,空白对照组、OGD模型组、正常血清对照组、低剂量DZSM组和高剂量DZSM组Cx43表达量分别为(22.7±2.4)、(72.8±6.9)、(63.1±6.6)、(21.1±3.2)、(24.4±3.8),各组间比较差异有统计学意义(F=154.55,P<0.05);其中OGD模型组、正常血清对照组Cx43表达量均较空白对照组升高,低、高剂量DZSM组Cx43表达量均较与OGD模型组降低,差异有统计学意义(P<0.05),低、高剂量DZSM组Cx43表达量间差异无统计学意义(PP>0.05,见图5)。

注:与空白对照比较,aP<0.05;与OGD模型组比较,bP<0.05
图5 Western blot检测OGD/R后各组Cx43的表达(n=6)
Figure 5 Cx43 expression levels after OGD/R tested by western blotting method in different groups
3 讨论
3.1 中药血清药理学是研究中药复方药理作用的理想方法 中药血清药理学以含药血清代替中药粗提物作为药物源加入离体反应系统中,克服了中药复方在体外研究的不便,是深入研究中药复方药理作用的新方法[7]。而离体培养神经元是从细胞水平研究神经元损伤和药物作用的体外模型,与血清药理学方法相结合,避免了药物自身的理化性质对实验造成的干扰,更客观地从分子水平阐明药物作用机制,是目前研究中药复方制剂效果的理想实验方案。
3.2 DZSM在体外缺血缺氧模型中具有神经保护作用 DZSM具有益气养阴、活血通络的功效,临床用于气阴两虚、瘀阻脑络型缺血性卒中的治疗。国内学者总结了DZSM的脑保护机制可能与其抑制炎性免疫反应、抗氧自由基、抑制钙超载、缓解血管痉挛,改善微循环,增加血流量从而保护缺血脑组织有关[8]。在此基础上,本研究利用中药血清药理学方法进一步从细胞水平观察了DZSM含药血清对OGD/R的神经元活力及凋亡的影响。实验结果显示,低剂量DZSM组与高剂量DZSM组原代皮质神经元凋亡率降低,细胞存活率增高,虽然高、低剂量DZSM组间并不存在确切的剂量依赖关系,但高剂量DZSM组皮质神经元凋亡率要低于低剂量DZSM组,表明一定剂量的DZSM具脑保护作用,较大剂量可能取得更好的效果,可以抗缺氧损伤导致的神经元凋亡。这一体外研究结果与李浩等[3]利用大鼠MCAO模型观察DZSM对脑缺血再灌注损伤的影响一致,提示在细胞水平DZSM同样能起到保护神经元的作用。
3.3 缝隙连接细胞间通讯(GJIC)在脑缺血损伤机制中起关键作用 缝隙连接(GJ)的分子基础是Cx,其由2个位于相邻细胞的细胞膜上互相对应的半通道组成[9],可供分子量小于1.2 kD的小分子低选择性地在胞间传递,这种胞间通讯方式即为GJIC[10-11]。目前,有学者认为缺血再灌注损伤时,与神经元凋亡损伤密切相关的GJ功能会异常增强[9]。缺血的神经元可通过GJ以“钙波”形式改变周围细胞内的钙离子浓度,释放谷氨酸盐,使缺血损伤蔓延。如果这种蔓延趋势不被有效阻止,有害物质、凋亡信号等损伤性因素传递至缺血区毗邻的细胞,会使受损细胞增多,并通过GJ向临近的半暗带细胞扩散,使脑梗死区域扩大[12-13]。
Cx家族有许多成员,其中Cx43在中枢神经系统分布最广泛。Thompson等[9]在体外培养的神经元中发现OGD可导致更多缝隙连接通道开放,导致葡萄糖及ATP的外流,加重缺血损伤。类似地,有学者在模拟缺氧缺血模型的脑片及细胞培养研究中,发现Cx43表达增多,GJ功能异常增强会导致细胞凋亡增加,脑损害加重;采用GJ阻滞剂后,星形胶质细胞Cx43表达减少,缺氧缺血后脑损害减轻[14-15]。有学者用DNA原位末端标记等方法发现新生大鼠脑皮质及海马缺血缺氧后Cx43表达逐渐增加,其变化规律与神经元凋亡严重程度及脑损伤相吻合[16]。可以推测,脑缺血缺氧损伤与Cx43表达及其GJ功能变化有关,在缺氧复氧损伤时,神经元之间可通过GJ传递的死亡信号增强细胞凋亡或死亡,抑制GJ功能可对缺氧复氧损伤起到保护作用[17]。本研究在体外神经元培养OGD/R模型中发现,Cx43在OGD复氧后0.5 h表达量开始增高,并一直持续至复氧后的24.0 h,与上述学者离体及体内研究相吻合。低剂量及高剂量DZSM组均能抑制OGD诱导的Cx43增高,这可能与DZSM中一些有效成分可起到抑制Cx43的作用,使得异常增强的GJ功能受到抑制,从而起到神经保护作用。
综上,本研究提示DZSM含药血清可抑制OGD/R模型神经元凋亡,提高细胞存活率,并从GJIC的角度探讨其保护神经元的可能机制,为神经保护作用提供分子生物学线索和依据。
[1]Feigin VL,Forouzanfar MH,Krishnamurthi R,et al.Global and regional burden of stroke during 1990-2010:findings from the Global Burden of Disease Study 2010[J].Lancet,2014,383(9913):245-255.
[2]陈彪,方向华,吴永浩,等.灯盏生脉胶囊对缺血性脑卒中二、三级防治效果[J].中华神经科杂志,2008,41(3):195-200.
[3]李浩,贾建平.灯盏生脉胶囊抗大鼠局灶性脑缺血再灌注损伤作用研究[J].医药导报,2007,26(8):846-850.
[4]郑志竑,林玲.神经细胞培养:理论与实践[M].北京:科学出版社,2002:70-90.
[5]Malagelada C,Xifró X,Badiola N,et al.Histamine H 2- receptor antagonist ranitidine protects against neural death induced by oxygen - glucose deprivation[J].Stroke,2004,35(10):2396-2401.
[6]Kuhn DM,Balkis M,Chandra J,et al.Uses and limitations of the XTT assay in studies of Candida growth and metabolism[J].J Clin Microbiol,2003,41(1):506-508.
[7]黄臣虎,陆茵,高骁君,等.中药血清药理学研究进展[J].中国实验方剂学杂志,2011,17(10):266-271.
[8]邢寅雪,尹少华.灯盏生脉胶囊对缺血性脑组织的保护作用机制[J].广东医学,2014,35(8):1291-1293.
[9]Thompson RJ,Zhou N,MacVicar BA.Ischemia opens neuronal gap junction hemichannels[J].Science,2006,312(5775):924-927.
[10]Colomer C,Martin AO,Desarménien MG,et al.Gap junction-mediated intercellular communication in the adrenal medulla:an additional ingredient of stimulus-secretion coupling regulation[J].Biochim Biophys Acta,2012,1818(8):1937-1951.
[11]Rivedal E,Witz G,Leithe E.Gap junction intercellular communication and benzene toxicity[J].Chem Biol Interact,2010,184(1-2):229-232.
[12]Shintani-Ishida K,Unuma K,Yoshida K.Ischemia enhances translocation of connexin43 and gap junction intercellular communication,thereby propagating contraction band necrosis after reperfusion[J].Circ J,2009(73):1661-1668.
[13]Rackauskas M,Neverauskas V,Skeberdis VA.Diversity and properties of connexin gap junction channels[J].Medicina (Kaunas),2010,46(1):1-12.
[14]Lin JH,Weiqel H,Cotrina ML,et al.Gap-junction-mediated on and amplification of cell injury[J].Nat Neumsci,1998,1(6):494-500.
[15]Cotrina ML,Kang J,Lin JH,et al.Astrocytic gap junctions remain open during ischemic conditions[J].J Neurosci,1998,18(7):2520-2537.
[16]林洁英,林霓阳,黄广.CX43在缺氧缺血新生大鼠脑组织中的表达及意义[J].中国现代医生,2007,45(8):18-21.
[17]Wang X,Ma A,Zhu W,et al.The role of connexin 43 and hemichannels correlated with the astrocytic death following ischemia/reperfusion insult[J].Cell Mol Neurobiol,2013,33(3):401-410.
(本文编辑:赵跃翠)
Protective Effect of Drug Serum Contained in Dengzhan Shengmai Capsule on Oxygen and Glucose Deprivation/Reoxygenation Injury of Nerve Cells and Its Mechanism
ZHOUZi-yi,LUHong-ji,XIANGJun,etal.
TheSecondAffiliatedHospital,GuangzhouUniversityofChineseMedicine,Guangzhou510120,China
Objective To investigate the protective effect of drug serum contained in Dengzhan Shengmai (DZSM) capsule on the oxygen and glucose deprivation/reoxygenation injury model of cortical nerve cells of primary rats and its possible mechanism.Methods The primary culture of cortical nerve cells of newborn SD rats within 24 hours was conducted.On day 7 of the culture,the cells were divided into five groups:blank control group,OGD model group,normal serum control group,low-dose DZSM group and high-dose DZSM group.The blank control group was not administrated with any pretreatment and model building,the other four groups were respectively administrated with 0.9% sodium chloride solution infection,the serum of normal rats,low-dose drug serum of DZSM and high-dose drug serum of DZSM before OGD/R.At 24h after OGD/R,morphological changes of the nerve cells were observed by light microscope,cell viability rates were determined by XTT methods,apoptosis rates were determined by flow cytometry,the expression levels of connexin 43 (Cx43) were determined by Western blotting method,and the protein expression changes of Cx43 were observed at 0.5h,6.0h,12.0h and 24.0h after OGD/R.Results At 24.0h after OGD/R,we noted injury characters in the nerve cells of the OGD model group,and the OGD group was lower in cell viability〔(54.6±6.4)% vs.100.0%;P<0.05〕 and higher in apoptosis rate〔(48.6±4.6)% vs.(8.8±1.0)%;P<0.05〕 than the blank control group;the OGD model group had kept an increasing trend (P<0.05) in Cx43 expression 0.5h after OGD/R through the whole observation process.We observed nerve cell injury in low-dose DZSM group and high-dose DZSM group under light microscope,which was slighter than OGD model group;the cell viability rates of low-dose DZSM group and high-dose DZSM group were(69.6±7.7)% and(76.1±8.8)%,both higher (P<0.05) than that of OGD model group;the apoptosis rates of low-dose DZSM group and high-dose DZSM group were (25.0±5.9)% and (18.2±4.9)% respectively,which were significantly different (P<0.05) from that of OGD group,which was(48.6±9.2)%.The expression levels of Cx43 of OGD model group,normal serum control group,low-dose DZSM group and high-dose DZSM group were (72.8±6.9),(63.1±6.6),(21.1±3.2) and (24.4±3.8),with low-dose DZSM group and high-dose DZSM group lower (P<0.05) than OGD group.Conclusion The drug serum contained in DZSM may inhibit the apoptosis of nerve cells after OGD/R,increase the viability rate of cells.The mechanism may be related with the inhibition of Cx43 expression.
Dengzhan shengmai capsule;Brain ischemia;Nerve cells;Connexin 43
国家自然科学基金资助项目(81403214)
510120广东省广州市,广州中医药大学第二附属医院,广东省中医院脑病一科(周子懿,卢鸿基,王立新,蔡业峰);复旦大学附属中山医院,中西医结合神经病学研究室 (向军,陈依萍,蔡定芳)
蔡业峰, 510120广东省广州市,广州中医药大学第二附属医院,广东省中医院脑病一科;E-mail:caiyefeng@126.com。蔡定芳,200032上海市,复旦大学附属中山医院,中西医结合神经病学研究室;E-mail: doctorcn@hotmail.com
R 743.31
A
10.3969/j.issn.1007-9572.2015.20.024
2015-01-20;
2015-05-10)
