初始硝酸钠浓度对魏氏真眼点藻的生长、形态和油脂积累的影响
2015-02-27何思思高保燕雷学青万凌琳李爱芬张成武
何思思 高保燕 雷学青 万凌琳 李爱芬 张成武
(暨南大学生态学系, 水生生物研究中心, 广州 510632)
初始硝酸钠浓度对魏氏真眼点藻的生长、形态和油脂积累的影响
何思思 高保燕 雷学青 万凌琳 李爱芬 张成武
(暨南大学生态学系, 水生生物研究中心, 广州 510632)
为了确定不同初始氮供应水平对产油微藻——魏氏真眼点藻(Eustigmatos vischeri)生长、形态和油脂积累的影响, 本研究通过在改良的 BG-11培养基中设置 4种不同的初始硝酸钠浓度(17.6、11.7、5.9和3.0 mmol/L)对魏氏真眼点藻(E. vischeri)进行培养。观察结果表明, 魏氏真眼点藻(E. vischeri)的营养细胞为一具裂叶状叶绿体、细胞质中有一红色素体和许多振动颗粒及光滑细胞壁的球形单细胞; 细胞繁殖方式主要是形成二分裂和四分裂的似亲孢子。在低氮条件下, 随着培养时间的延长, 细胞内油体逐步形成, 至培养末期占据细胞的大部分空间, 同时培养物的颜色也由绿色向黄绿色转变, 最终呈橙黄色。实验结果表明, 魏氏真眼点藻(E. vischeri)生物质浓度在17.6 mmol/L组获得最大值为9.14 g/L; 总脂、中性脂和总脂肪酸三者占干重的含量随着初始硝酸钠浓度的降低而升高, 在 3.0 mmol/L组获得最高值, 分别为 60.81%、56.59%和53.47%; 三者的单位体积产率均在5.9 mmol/L组获得最高值, 分别为0.24、0.21和0.20 g/(L·d); 主要脂肪酸组成为棕榈酸(C16:0)、棕榈油酸(C16:1)、油酸(C18:1)和二十碳五烯酸(C20:5ω3, EPA), 其中棕榈油酸的含量最高。上述研究表明, 魏氏真眼点藻(E. vischeri)是一株适合于生产生物柴油和长链不饱和脂肪酸EPA的高产油微藻。
魏氏真眼点藻; 硝酸钠; 生物质浓度; 总脂; 脂肪酸; 单位体积产率
微藻作为第三代生物柴油的生产原料, 具有传统油料作物所没有的优点, 例如生长速率快、油脂含量高以及产生高附加值产物等, 从而成为国内外研究的热点[1—3]。在胁迫条件下, 一些富油微藻细胞内可合成并积累大量的油脂(主要是三酰甘油, TAGs), 约占细胞干重的20%—50%, 有的甚至可高达70%—90%[4,5]。目前, 研究报道的富油微藻主要集中在小球藻属(Chlorella spp.)[6,7]、栅藻属(Scenedesmus spp.)[8]、杜氏盐藻属(Dunaliella spp.)[9]、拟微绿球藻属(Nannochloris spp.)[10]、缺刻缘绿藻(Parietochloris incisa)[11]、富油新绿藻(Neochloris oleoabundans)[12]及布朗丛粒藻(Botryococcus braunii)[13]等。不同属或种微藻之间的生长和油脂含量存在较大差异[4]。在通常情况下, 培养基中的大量营养因子如碳、氮、磷和硫以及微量元素如铁等营养成分的改变会引起微藻细胞内油脂积累的变化[14,15]; 另外, 温度、光照强度、pH和盐度等环境因子的胁迫也能改变微藻细胞的油脂积累量[16—18]。除此之外, 培养周期对微藻细胞内的油脂含量也有影响。Gong等[19]研究了培养周期和营养胁迫对四株富含EPA海洋微藻的影响, 结果在氮胁迫条件下眼点拟微绿球藻(Nannochloropsis oculata)细胞内不断积累 TAGs, 角毛藻(Chaetoceros sp.), 三角褐指藻(Phaeodactylum tricornutum)和绿色巴夫藻(Pavlova viridis)细胞内TAGs含量没有明显变化; 然而, 在氮限制条件下培养5d后角毛藻(Chaetoceros sp.), 三角褐指藻和绿色巴夫藻细胞内总脂肪酸含量增加了一倍, 眼点拟微绿球藻细胞内总脂肪酸含量却增长缓慢。
通过改变培养基中的营养盐浓度或者培养条件等手段, 来改变微藻细胞内脂类、多糖和色素等代谢途径, 往往比通过基因工程手段更经济、有效[20]。氮是微藻细胞生长和代谢的重要营养因子, 也被认为是影响微藻细胞油脂积累最重要的胁迫因子。目前, 微藻培养中氮源供应主要有硝酸盐、亚硝酸盐、铵盐和尿素等, 而硝酸盐是应用最广泛的氮源[20]。在光合作用过程中, 碳固定的速率是氮吸收速率的7—10倍, 这是最适宜细胞内含氮物质合成的比例。在氮限制条件下, 随着氮可吸收量的减少, 微藻细胞光合作用的能力减弱, 其对碳的需求减少, 细胞内多余的碳可转变成储藏性物质, 如脂类和碳水化合物, 蛋白质含量下降, 同时细胞的生长速率也受到限制[5]。若给培养液中重新补加氮的供给, 储藏性物质中的能量将被利用, 其中一部分用于氮的吸收,直至光合作用恢复。因此, 探索适宜微藻生长的最佳培养条件和最佳营养盐浓度, 获得较高的生物质浓度和总脂产率, 平衡生物质浓度、总脂产率和经济效益三者之间的关系, 可对微藻的规模化培养和工业化应用提供重要的参考依据。
本研究选择了真眼点藻纲的一株理想的产油微藻——魏氏真眼点藻(Eustigmatos vischeri)作为研究对象, 硝酸钠作为氮源, 分别从形态学和生理学两方面进行研究, 结合光学显微镜观察低氮条件下该藻细胞内油体形成随时相的变化, 并且考察四种初始硝酸钠浓度水平下其生物质浓度、总脂含量、脂组分和脂肪酸组成及含量的时相变化规律, 进而探讨不同初始硝酸钠浓度对藻细胞生长、形态和油脂积累的影响, 从中确定使魏氏真眼点藻(E. vischeri)获得最大油脂产率的最佳初始硝酸钠平衡浓度。
1 材料与方法
1.1 藻种
魏氏真眼点藻, 由暨南大学水生生物研究中心微藻生物技术与生物能源实验室保藏。
1.2 主要仪器与试剂
光学显微镜(Olympus CX41)、高速冷冻离心机(SORVALL biofuge)、冷冻干燥机(VirTis wizard 2.0)、氮吹仪(N-EVAPTM111)、气相色谱仪(Agilent6890N)、恒温磁力搅拌器(94-2 ThermoFinnigan)等。
正己烷(色谱纯)、硝酸钠、二甲基亚砜、甲醇、乙醚、氯仿、甲苯、丙酮等试剂均为分析纯。
1.3 微藻培养
采用改良的BG-11培养基为基础培养基, 微藻细胞培养于φ3 cm×60 cm柱状光生物反应器, 以加富 1% CO2的压缩空气进行通气培养, 光强为300 μmol phtons/(m2·s)单侧连续光照, 培养温度为(25±1) ,
℃ 分别设置四种不同的初始硝酸钠浓度: 17.6、11.7、5.9和3.0 mmol/L, 藻细胞初始接种浓度为A750=0.55±0.02, 培养周期为18d。每个浓度实验组设置3个平行。
1.4 实验方法
藻细胞形态学的观察 每隔 72h取3.0 mmol/L初始硝酸钠浓度组的藻液制片, 通过Olympus光学显微镜(×100)进行藻细胞形态结构观察, 并拍照记录不同培养时期细胞内油体形成状态和培养物的颜色。
生物质浓度的测定 每隔 24h分别取 5 mL四种初始硝酸钠浓度培养条件下的藻液, 用预先烘至恒重(记为W1)的混合纤维滤膜(0.45 μm)真空抽滤,然后于 105 ℃的烘箱中烘干至恒重, 冷却后记为W2。生物质浓度用单位体积藻体的干重(Dry cell weight, DCW)表示。
DCW(g/L)= 200 ×(W2–W1)
藻粉的制备 每隔3天分别从不同初始硝酸钠浓度组的光生物反应器中取一定体积的藻液, 3000 r/min离心 5min, 收集藻泥置于小塑料瓶中,–20℃结冰后, 放置于冷冻干燥机中冷冻干燥36h以上。冻干的藻粉于4℃冰箱中储存备用。
总脂含量的测定 取冻干的藻粉, 按照改进的 Khozin-Goldberg 等[21]总脂提取方法进行总脂含量的测定。
准确称取一定量的藻粉(记为 M0), 置于预先放入转子的玻璃离心管中, 加入2 mL二甲基亚砜-甲醇混合液(v∶v=1∶9), 50℃水浴搅拌 1.5h, 转入冰浴磁力搅拌1.5h, 3000 r/min离心3min, 转移上清液至事先烘干的玻璃小瓶中。剩余藻渣再加入 4 mL乙醚-正己烷混合液(v∶v=1∶1), 冰浴搅拌抽提1.5h, 3000 r/min离心 3min, 转移上清液至上述小瓶中。重复上述过程至藻渣变成灰白色。合并得到的所有上清液, 加入4 mL蒸馏水, 静置分层。转移上层有机相至另一事先烘干的玻璃小瓶中, 用氮气仪吹干,转移浓缩液至预先称重过的2 mL EP管中(管重记为M1), 用氮气吹干, 记为M2, –20 ℃保存。每个取样点设置两个平行, 利用差重法计算总脂占藻粉干重的百分比, 计算公式为:
总脂含量(% DCW)=(M2–M1)/M0×100%
总脂分级 参考 Alonzo等[22,23]的方法并加以改进, 利用硅胶层析柱(AgelaTechnologoes, Cleanert silica-SPE, 500 mg)将总脂进一步分级分离。分别用三种试剂对样品进行洗脱, 洗脱顺序如下: 先用一定体积的氯仿洗脱得到中性脂(NLs), 再用一定体积的丙酮和甲醇(v/v=9∶1)混合液洗脱得到糖脂(GLs), 最后用一定体积的甲醇洗脱得到磷脂(PLs)。将分离得到的各组分用氮气吹至较小体积后转移至预先称重的2 mL EP管中, 用氮气吹干至恒重, 利用差量法计算出各组分分别占总脂和干藻粉的百分含量。
脂肪酸组成分析 参考Bigogno等[11]的方法并进行改进。
准确称取冻干藻粉 25 mg, 置于预先加入转子的玻璃离心管中, 加入2 mL含有2% H2SO4的无水甲醇-甲苯混合液(v∶v=1∶1), 同时加入50 μL 0.5%的十七烷酸标样, 充氩气后, 置于 80℃恒温磁力搅拌水浴锅中抽提 1.5h, 冷却后加入 1 mL纯水和1 mL正己烷, 振荡混匀后3000 r/min离心5min, 将上层有机相移至另一干净玻璃小瓶中, 用氮气吹干,再用200 μL正己烷转移至气相色谱样品瓶中, 密封保存于–20℃冰箱中待测。利用气相色谱仪, 分析测定各脂肪酸组分及其相对含量。
色谱条件如下: 色谱柱为 CD-2560, 100 m× 0.25 mm×0.20 µm (上海安谱科学仪器有限公司);载气为高纯氮气, 不分流, 流速为23 mL/min; 二阶升温程序: 140℃保留 5min, 然后 4 /min℃ 升温至240 ,℃ 最后240℃保留20min; 进样量为1 µL; 进样口温度250 ; FID℃ 检测器, 温度为260℃。
单位体积总脂、中性脂和总脂肪酸产率 单位体积总脂(中性脂、总脂肪酸)产率 P [g/(L·d)] = (mt×Lt)/t
其中, mt为收获时藻的生物质浓度(g/L), Lt为收获时总脂(中性脂或总脂肪酸)含量(%DCW), t为培养时间。
数据处理与分析 采用Excel 和Origin8.6对数据进行分析处理, 并用 SPSS 13.0软件对数据进行单因素方差分析(Ducan法), P<0.05表示差异显著。
2 结果
2.1 藻细胞的形态变化
利用光学显微镜观察魏氏真眼点藻细胞在不同时相的细胞形态和油脂积累变化(图1)。从图1A和 B可以看出, 魏氏真眼点藻(E. vischeri)为球形或近球形单细胞, 细胞壁光滑, 细胞直径通常在8—10 µm, 有时可以达到 20 µm; 叶绿体为深裂叶状, 细胞质中有一红色色素体(Red pigment body);细胞繁殖方式主要是通过二分裂或四分裂形成似亲孢子, 偶见八分裂或十六分裂的似亲孢子。图1B为3.0 mmol/L初始硝酸钠浓度组藻细胞内油体形成随时相的变化。在培养初期氮充足的情况下,藻细胞内裂叶状叶绿体和振动颗粒物清晰可见,几乎占据了整个细胞体积的一半以上, 第 6天时细胞内开始出现小油滴; 随着培养时间的延长,氮源不断被消耗, 叶绿体逐渐解体, 细胞内出现数目不等、大小不一的油体, 至培养末期, 油体相互融合成更大的油体, 占据细胞的大部分空间,胞内物的颜色也由绿色向黄绿色转变, 最后呈橙黄色。此外, 观察不同初始硝酸钠浓度培养条件下藻细胞培养物颜色的时相变化发现(图 1C), 培养至第3天时, 各浓度组藻细胞培养物的颜色就开始发生明显的变化。随着培养周期的延长, 17.6 mmol/L初始硝酸钠浓度和 11.7 mmol/L初始硝酸钠浓度组藻细胞培养物颜色逐渐由淡绿色转变为墨绿色,而5.9 mmol/L初始硝酸钠浓度和3.0 mmol/L初始硝酸钠浓度组明显可见由淡绿色变为黄绿色, 最后变为橙黄色, 3.0 mmol/L初始硝酸钠浓度组变化最为明显。
2.2 不同初始硝酸钠浓度对魏氏真眼点藻生长的影响
如图 2所示, 在整个培养周期内, 各个浓度组藻细胞的生物质浓度均呈上升的趋势, 但不同硝酸钠浓度对魏氏真眼点藻的生长速率有明显的影响。单因素方差分析表明, 细胞培养早期, 即培养3—4d内, 培养基内营养物质充足, 各浓度组间的生物质浓度没有明显差异(P>0.05)。培养 4d后, 细胞进入对数生长中期, 随着培养时间延长, 各个浓度组间的生物质浓度快速增加, 但从实验结果可明显看出, 3.0 mmol/L初始硝酸钠浓度组藻细胞生长趋势与其他三组相比增长较缓慢。到 14d后, 细胞生长趋于平稳, 进入平台期。各个浓度组均在培养末期, 获得最大生物质浓度。17.6 mmol/L初始硝酸钠浓度组细胞生长最快, 到 18d时, 达到 9.14 g/L,另外三个实验组分别为8.54、7.91和6.51 g/L。

图1 魏氏真眼点藻细胞形态及其培养物颜色随时相的变化Fig. 1 The variation of cell morphology and cultures color of E. vischeri in different cultivation periods

图2 不同初始硝酸钠浓度对魏氏真眼点藻生长的影响Fig. 2 Effects of different initial sodium nitrate concentrations on the growth of E. vischeri
2.3 不同初始硝酸钠浓度对魏氏真眼点藻油脂积累的影响
图3是不同初始硝酸钠浓度培养条件下魏氏真眼点藻细胞内总脂含量随时相的变化。由图可以看出, 随着培养时间的延长, 各个浓度组总脂含量均呈不断上升的趋势, 初始硝酸钠浓度为 5.9和 3.0 mmol/L的这两个低氮浓度组藻细胞内总脂含量明显高于初始硝酸钠浓度为17.6和11.7 mmol/L的高氮浓度组。在培养早期, 藻细胞内总脂含量较低,约占干重的20%。随着培养的持续进行, 4个氮浓度组藻细胞内油脂逐渐积累, 到第18天时, 总脂含量均达到最大值, 对其进行单因素方差分析发现, 初始硝酸钠浓度为17.6和11.7 mmol/L这两个高氮浓度组间总脂含量差异不显著(P>0.05), 初始硝酸钠浓度为5.9和3.0 mmol/L这两个低氮浓度组总脂含量差异显著(P<0.05), 且与前两组相比差异极显著(P<0.001); 同时, 藻细胞内的总脂含量随初始硝酸钠浓度的降低而增加, 其中初始硝酸钠浓度为 5.9和3.0 mmol/L这两个低氮浓度组相对较高, 分别为55.12%和60.82%, 3.0 mmol/L初始硝酸钠浓度组总脂含量增长速度尤为显著。
按照总脂分级方法, 对上述 4个初始硝酸钠浓度培养条件下各个时相获得的总脂进行分级(图4)。图中的a、b、c和d分别代表初始硝酸钠浓度为17.6、11.7、5.9 和3.0 mmol/L 4个浓度组总脂分级结果。结果表明, 魏氏真眼点藻细胞内总脂主要由中性脂(NLs)、糖脂(GLs)和磷脂(PLs)3大组分组成, 其中,中性脂占据主要部分, 且同一浓度条件下随着培养时间的延长其含量在不断增加。氮浓度对总脂各组分含量的影响也较大, 随着氮浓度的降低, 中性脂的含量不断增加, 而糖脂和磷脂的含量随之减少,最高中性脂的相对含量和绝对含量在初始硝酸钠浓度为3.0 mmol/L组在其培养至18d时获得, 分别为93.04%和 56.59%, 此时, 细胞内糖脂和磷脂含量极少。这进一步证实了, 魏氏真眼点藻是一株高产油微藻。

图 3 不同初始硝酸钠浓度条件下魏氏真眼点藻总脂含量的时相变化Fig. 3 The time course changes in total lipid contents of E. vischeri grown in modified BG-11 medium containing four different initial concentrations of sodium nitrate
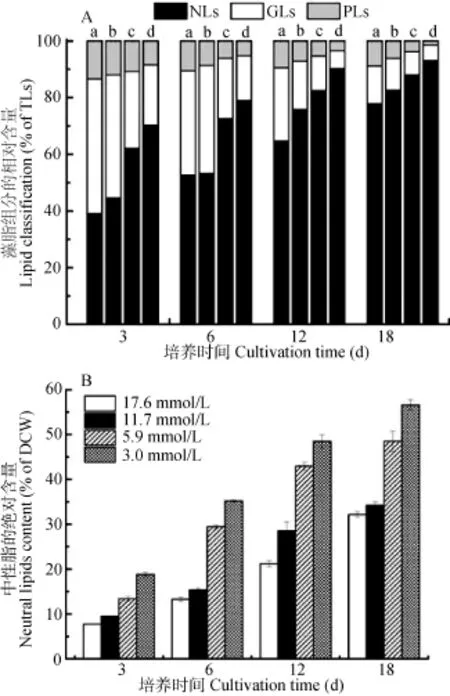
图 4 不同初始硝酸钠浓度条件下魏氏真眼点藻脂组分的相对含量(占总脂)(A)及其中性脂的绝对含量(占细胞干重)(B)的时相变化Fig. 4 The time course variation of lipid fraction contents (% of total lipids) (A) and neutral lipid contents (% of dry biomass) (B) from E. vischeri grown in modified BG-11 medium containing four different initial concentrations of sodium nitrate
2.4 不同初始硝酸钠浓度对魏氏真眼点藻脂肪酸含量的影响
表1和图5分别显示4种初始硝酸钠浓度培养条件下魏氏真眼点藻细胞内脂肪酸组分和含量(分别占总脂肪酸(相对含量)和细胞干重(绝对含量)。从中可以看出, 魏氏真眼点藻细胞内的主要脂肪酸为棕榈酸(C16:0)、棕榈油酸(C16:1)、油酸(C18:1)和二十碳五烯酸 (C20:5ω3, EPA), 其中棕榈油酸含量最高, 占总脂肪酸的35%—55%。由表1可知, 在同一硝酸钠浓度下, 棕榈油酸和油酸的相对含量随时相的变化呈不断上升的趋势, 而棕榈酸和二十碳五烯酸略有减少。由图 5可知, 不同初始硝酸钠浓度下棕榈酸、棕榈油酸和油酸三者的绝对含量均随时相的变化不断升高, 二十碳五烯酸的绝对含量变化不明显(其占细胞干重的含量为: 2.1%— 2.9%)。此外,在同一时相下, 初始硝酸钠浓度为3.0 mmol/L组的各脂肪酸组分占细胞干重的含量明显高于其他3个浓度组, 且各脂肪酸的绝对含量随着氮浓度的降低而增加, 即在初始硝酸钠浓度为3.0 mmol/L组培养至末期时获得最大值, 占细胞干重的54.37%。由此可以看出, 魏氏真眼点藻细胞中储藏性油脂逐步积累的过程实际上表现为脂肪酸的不断合成和积累的过程。
2.5 不同初始硝酸钠浓度对魏氏真眼点藻单位体积总脂、中性脂和总脂肪酸产率的影响
图6表示4种初始硝酸钠浓度组培养至18d时,魏氏真眼点藻的单位体积总脂产率、中性脂产率和总脂肪酸产率。由图可知, 各浓度组间的单位体积总脂产率、中性脂产率和总脂肪酸产率大小顺序排列为: 5.9 mmol/L组 > 3.0 mmol/L组 > 11.7 mmol/L组 > 17.6 mmol/L组, 即在初始硝酸钠浓度为5.9 mmol/L组获得最高单位体积总脂产率、中性脂产率和总脂肪酸产率, 分别为 0.24、0.21和0.20 g/(L·d)。

表1 不同硝酸钠浓度条件下魏氏真眼点藻细胞内各脂肪酸相对含量的时相变化Tab. 1 The time course variation of fatty acid profiles from E. vischeri grown in modified BG-11 medium containing four different initial concentrations of sodium nitrate

图 5 不同硝酸钠浓度条件下魏氏真眼点藻细胞内脂肪酸绝对含量的时相变化Fig. 5 The time course changes in fatty acid contents (% of dry biomass) of E. vischeri grown in modified BG-11 medium containing four different initial concentrations of sodium nitrate

图6 不同初始硝酸钠浓度对魏氏真眼点藻单位体积总脂、中性脂和总脂肪酸产率的影响Fig. 6 Effects of different initial sodium nitrate concentrations on volummetric productivity of total lipids, neutral lipids and total fatty acids of E. Vischeri
3 讨论
生物质浓度、总脂含量和总脂产率等参数是考察微藻作为未来生物柴油可再生生产原料经济可行性的重要指标[12]。目前, 一些微藻由于高生产成本和低总脂产率而阻碍了其工业化生产和商业利用价值。研究者们往往通过优化培养条件(如氮浓度、盐度、光照强度和温度等)来提高藻株的生物质浓度和总脂产率。本研究选择的魏氏真眼点藻是一株潜在的高产油微藻, 隶属于异鞭藻门(Heterokontophyta)真眼点藻纲(Eustigmatophyceae)真眼点藻属(Eustigmatos), 是一种黄绿色单细胞微藻。真眼点藻纲是Hibberd等[24,25]于1970年从黄藻纲(Xanthophyceae)中分离出来而成立的一个新钢。真眼点藻纲能产生游动孢子, 且游动孢子的叶绿体外部有一红色眼点,这是真眼点藻纲区别于黄藻纲的重要特征之一。另外, 二者在色素组成上也略有不同, 真眼点藻纲的藻类含有叶绿素α、β-胡萝卜素以及两种主要的叶黄素—堇菜黄素和无隔藻黄素[26]。目前, 国内外对真眼点藻纲的相关研究还较少, 主要集中在海产的拟微绿球藻属(Nannochloropsis spp.)的研究, 本实验室保藏有除了拟微绿球藻属的真眼点藻纲的其他多株藻株, 并率先对其生长、色素组成、光合生理和油脂积累等特性开展了相关研究[26—28]。
氮素是微藻细胞生长和代谢必不可少的重要元素之一。微藻细胞能利用的氮源形式多种多样, 主要有硝酸盐、铵盐和尿素等。但不同的氮源和浓度对不同微藻的生长和油脂积累的影响有所不同。Li等[12]研究了硝酸钠、尿素和铵盐三种氮源对富油新绿藻(N. oleoabundans)生长和油脂积累的影响, 结果表明, 硝酸钠是该藻生长的最佳氮源, 在10 mmol/L时获得最大生物质浓度为3.15 g/L, 而总脂产率随着硝酸钠浓度的较低而升高, 在5 mmol/L时获得最大值为0.40 g/(L·d)。Adams等[5]研究不同氮浓度处理对6种微藻生长和油脂积累的影响, 结果发现下面3种现象: (1) 在高氮浓度限制时, 富油新绿藻(N. oleoabundans UTEX105)和双形栅藻(Scenedesmus dimorphus UTEX417)总脂含量升高速率快于生物质浓度下降速率, 总脂产率提高; (2) 在低氮浓度限制时, 普通小球藻(Chlorella vulgaris UTEX265)和油面绿球藻(Chlorococcum oleofaciens UTEX105)生物质浓度下降速率快于总脂含量升高速率, 总脂产率仍提高; (3) 根腐小球藻(Chlorella sorokiniana UTEX1602)和纳高栅藻(Scenedesmus naegelii UTEX74)总脂含量升高速率和生物质浓度下降速率保持平衡, 总脂产率也相近。
大量研究表明, 氮限制有利于促进微藻细胞内油脂尤其是 TAGs的合成和积累, 但这往往伴随着蛋白质含量以及生长速率的下降为代价。本研究以硝酸钠为氮源, 分析17.6、11.7、5.9和3.0 mmol/L 4种初始氮浓度对魏氏真眼点藻生长和油脂积累的影响。研究表明, 生物质浓度与氮浓度成正相关关系,初始硝酸钠浓度为17.6 mmol/L是魏氏真眼点藻生长的最适浓度, 培养至 18d时生物质浓度达到9.14 g/L, 但此条件下的总脂含量和总脂产率较低。这与前人的大量研究结果相一致。与富油新绿藻最大生物质浓度相比高出 2.9倍[12]。与魏氏真眼点藻生长趋势有所不同的是, 真眼点藻纲的另一富油藻株——类波氏真眼点藻(Eustigmatos cf. polyphem)在初始硝酸钠浓度为 6.0 mmol/L(低氮组)时获得的生物质浓度为 7.91 g/L, 略高于了初始硝酸钠浓度为18 mmol/L (高氮组)时所获得的生物质浓度(7.46 g/L)[29]。这表明高浓度的初始硝酸钠对类波氏真眼点藻有一定的抑制作用(高浓度基质抑制效应)。研究结果还表明, 魏氏真眼点藻是一株高产油的藻株, 细胞内总脂含量和中性脂含量随着氮浓度的降低而增加, 在初始硝酸钠浓度为3.0 mmol/L时获得最高值。初始硝酸钠浓度为 17.6 mmol/L时藻细胞培养至 18d后, 总脂含量(占干重)和中性脂含量(占总脂)分别为41.35%和77.85%; 初始硝酸钠浓度为3.0 mmol/L组与之相比总脂含量和中性脂含量显著增加(P<0.05), 分别达到了 60.82%和 93.04%,提高了19.47%和15.19%。这说明, 低浓度的初始硝酸钠供应可促进魏氏真眼点藻细胞油脂尤其是中性脂的积累。Griffiths等[30]通过两种氮浓度处理对11种微藻进行培养, 研究结果发现, 与高氮浓度相比,低氮浓度条件下更有利于微藻油脂的合成, 普通小球藻(C. vulgaris)总脂含量(占干重)最高值达到57%,栅藻属(Scenedesmus sp.)为 43%, 拟微绿球藻属(Nannochloropsis sp.)为35%, 三角褐指藻仅为28%。Rodolfi等[31]对4株高生物量和高油脂含量的微藻进行研究, 结果发现, 在氮限制处理后, 拟微绿球藻(Nannochloropsis sp.F&M-M24)总脂含量提高到了60%。可见, 本研究选择的魏氏真眼点藻在油脂合成上具有很大的优势。脂肪酸分析表明, 魏氏真眼点藻脂肪酸组分主要有饱和脂肪酸棕榈酸、单不饱和脂肪酸棕榈油酸和油酸, 以及多不饱和脂肪酸二十碳五烯酸, 这四者的总和占总脂酸的 69%—87%,其中棕榈油酸含量最多, 占 35%—55%。且随着初始硝酸钠浓度的降低, 棕榈酸、棕榈油酸和油酸的绝对含量不断增加, 二十碳五烯酸占细胞干重的含量没有明显变化, 维持在2.1%—2.9%。用作生物柴油的脂肪酸组成以含 16—20个碳的直链脂肪酸为最佳, 因此可以认为魏氏真眼点藻用于生物柴油生产具有较大的潜力。由于魏氏真眼点藻生物质浓度随氮浓度的降低而下降, 总脂含量和中性脂含量随之升高, 最终导致了其总脂产率、中性脂产率以及总脂肪酸产率的随之改变。研究结果表明, 在初始硝酸钠浓度为 5.9 mmol/L时三者均达到了最高值0.24、0.21和0.20 g/(L·d), 因此, 5.9 mmol/L初始硝酸钠浓度是魏氏真眼点藻获得最大总脂产率、中性脂产率以及总脂肪酸产率的最佳平衡浓度。以上的研究结果表明, 魏氏真眼点藻是一株适合于生产生物柴油和高附加值长链不饱和脂肪酸EPA的高产油藻株。
[1] Rodolfi L, Chini Zittelli G, Bassi N, et al. Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J]. Biotechnology and Bioengineering, 2009, 102(1): 100—112
[2] Ren M, Ogden K. Cultivation of Nannochloropsis gaditana on mixtures of nitrogen sources [J]. Environmental Progressand Sustainable Energy, 2014, 33(2): 551—555
[3] Chisti Y. Biodiesel from microalgae [J]. Biotechnology Advances, 2007, 25(3): 294—306
[4] Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances [J]. The Plant Journal, 2008, 54(4): 621—639
[5] Adams C, Godfrey V, Wahlen B, et al. Understanding precision nitrogen stress to optimize the growth and lipid content tradeoff in oleaginous green microalgae [J]. Bioresource Technology, 2013, 131: 188—194
[6] Liu Z Y, Wang G C, Zhou B C. Effect of iron on growth and lipid accumulation in Chlorella vulgaris [J]. Bioresource Technology, 2008, 99(11): 4717—4722
[7] Yeh K L, Chang J S. Effects of cultivation conditions and media composition on cell growth and lipid productivity of indigenous microalga Chlorella vulgaris ESP-31 [J]. Bioresource Technology, 2012, 105: 120—127
[8] Damiani M C, Popovich C A, Constenla D, et al. Triacylglycerol content, productivity and fatty acid profile in Scenedesmus acutus PVUW12 [J]. Journal of Applied Phycology, 2014, 26(3): 1423—1430
[9] Takagi M, Karseno, Yoshida T. Effect of salt concentration on intracellular accumulation of lipids and triacylglyceride in marine microalgae Dunaliella cells [J]. Journal of Bioscience and Bioengineering, 2006, 101(3): 223—226
[10] Simionato D, Block M A, La Rocca N, et al. The response of Nannochloropsis gaditana to nitrogen starvation includes de novo biosynthesis of triacylglycerols, a decrease of chloroplast galactolipids, and reorganization of the photosynthetic apparatus [J]. Eukaryotic Cell, 2013, 12(5): 665—676
[11] Bigogno C, Khozin-Goldberg I, Boussiba S, et al. Lipid and fatty acid composition of the green oleaginous alga Parietochloris incisa, the richest plant source of arachidonic acid [J]. Phytochemistry, 2002, 60(5): 497—503
[12] Li Y, Horsman M, Wang B, et al. Effects of nitrogen sources on cell growth and lipid accumulation of green alga Neochloris oleoabundans [J]. Applied Microbiology Biotechnology, 2008, 81(4): 629—636
[13] Metzger P, Largeau C. Botryococcus braunii: a rich source for hydrocarbons and related ether lipids [J]. Applied Microbiology and Biotechnology, 2005, 66(5): 486—496
[14] Wang B, Lan C Q. Biomass production and nitrogen and phosphorus removal by the green alga Neochloris oleoabundans in simulated wastewater and secondary municipal wastewater effluent [J]. Bioresource Technology, 2011, 102(10): 5639—5644
[15] Khozin-Goldberg I, Cohen Z. The effect of phosphate starvation on the lipid and fatty acid composition of the fresh water eustigmatophyte Monodus subterraneus [J]. Phytochemistry, 2006, 67(7): 696—701
[16] Breuer G, Lamers P P, Martens D E, et al. Effect of light intensity, pH, and temperature on triacylglycerol (TAG) accumulation induced by nitrogen starvation in Scenedesmus obliquus [J]. Bioresource Technology, 2013, 143: 1—9
[17] Juneja A, Ceballos R M, Murthy G S. Effects of environmental factors and nutrient availability on the biochemical composition of algae for biofuels production: a review [J]. Energies, 2013, 6(9): 4607—4638
[18] Zhang H, Zhang G Y, Wen X B, et al. Effects of pH on the photosynthesis , growth and lipid production of Chlorella sp. XQ-200419 [J]. Acta Hydrobiologica Sinica, 2014, 38(6): 1084—1091 [张虎, 张桂艳, 温小斌, 等. pH对小球藻Chlorella sp. XQ-200419光合作用、生长和产油的影响. 水生生物学报, 2014, 38(6):1084—1091]
[19] Gong Y, Guo X, Wan X, et al. Triacylglycerol accumulation and change in fatty acid content of four marine oleaginous microalgae under nutrient limitation and at different culture ages [J]. Journal of Basic Microbiology, 2013, 53(1): 29—36
[20] Procházková G, Brányiková I, Zachleder V, et al. Effect of nutrient supply status on biomass composition of eukaryotic green microalgae [J]. Applied Phycology, 2014, 26(3): 1359—1377
[21] Khozin-Goldberg I, Shrestha P, Cohen Z. Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga Parietochloris incisa [J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2005, 1738(1): 63—71
[22] Alonzo F, Mayzaud P. Spectrofluorometric quantification of neutral and polar lipids in zooplankton using Nile red [J]. Marine Chemistry, 1999, 67(3): 289—301
[23] Zhang J J, Lü X J, Zhang C W, et al. Rapid estimation of lipids in microalgae cells [J]. China Biotechnology, 2012, 32(1): 64—72 [张敬键, 吕雪娟, 张成武, 等. 微藻细胞油脂含量的快速检测方法研究. 中国生物工程杂志, 2012, 32(1): 64—72]
[24] Hibberd D J, Leedale G F. Eustigmatophyceae-a new algal class with unique organization of the motile cell [J]. Nature, 1970, 225(5234): 758—760
[25] Gao B Y, Zhang C W, Wan L L, et al. Systematics, biological characteristic and potential application of Eustigmatophyceae [J]. Acta Hydrobiologica Sinica, 2014, 38(5): 945—956 [高保燕, 张成武, 万凌琳, 等. 真眼点藻纲的系统分类、生物学特性及应用研究. 水生生物学报, 2014, 38(5): 945—956]
[26] Wang Y L, Li Q Y, Li A F, et al. Growth and photosynthetic physiological characteristics of four Eustigmatophycean species [J]. Biotechnology, 2014, 24(2): 91—95 [王元丽, 李其雨, 李爱芬, 等. 4株真眼点藻的生长及光合生理特性.生物技术, 2014, 24(2): 91—95]
[27] Li Z, Sun M, Li Q, et al. Profiling of carotenoids in six microalgae (Eustigmatophyceae) and assessment of theirβ-carotene productions in bubble column photobioreactor [J]. Biotechnology Letts, 2012, 34(11): 2049—2053
[28] Li Q Y, Li A F, Zhang C W. The method of extraction and determination of pigment in Eustigmatophyceae [J]. Ecological Science, 2012, 31(3): 278—283 [李其雨, 李爱芬, 张成武. 真眼点藻类色素的提取与测定方法. 生态科学, 2012, 31(3): 278—283]
[29] Han J. The analysis of main biochemical composition and determination of the enzymes involved in the chrysolaminarin metabolizing of Eustigmatos cf. polyphem [D]. Jinan University, 2013 [韩娟. 类波氏真眼点藻的主要生化组成分析及其金藻昆布糖代谢相关酶的活性测定.暨南大学, 2013]
[30] Griffiths M J, van Hille R P, Harrison S T L. Lipid productivity, settling potential and fatty acid profile of 11 microalgal species grown under nitrogen replete and limited conditions [J]. Journal of Applied Phycology, 2012, 24(5): 989—1001
[31] Rodolfi L, Chini Zittelli G, Bassi N, et al. Microalgae for oil: Strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J]. Biotechnology and Bioengineering, 2009, 102(1): 100—112
EFFECTS OF INITIAL NITROGEN SUPPLY ON THE GROWTH, MORPHOLOGY AND LIPID ACCUMULATION OF OLEAGINOUS MICROALGA EUSTIGMATOS VISCHERI (EUSTIGMATOPHYCEAE)
HE Si-Si, GAO Bao-Yan, LEI Xue-Qing, WAN Ling-Lin, LI Ai-Fen and ZHANG Cheng-Wu
(Research Center for Hydrobiology, Department of Ecology, Jinan University, Guangzhou 510632, China)
This research aimed at analysing the effects of initial nitrogen supply on the growth, morphology and lipids accumulation of an oleaginous microalga of Eustigmatophyceae, Eustigmatos vischeri. E. vischeri was grown in modified BG-11 medium containing four different initial concentrations of sodium nitrate (17.6 mmol/L, 11.7 mmol/L, 5.9 mmol/L and 3.0 mmol/L). The cell morphology and oil droplets formation process of E. vischeri were observed under microscope. It was found that the vegetative cells of E. vischeri were spherical unicellular with smooth cell wall and containing a lobed chloroplast, a red pigment body and many vibrating ganules in cytoplasm. The main reproduction way is by forming autospore such as binary or quadripartition division. With the prolongation of cultivation time, the oil droplets formed gradually under nitrogen depletion. Then, the oil droplets became larger and mutual fusion into larger and larger oil bodies, eventually occupied the main part of the cell. Moreover, the color of cultures changed from green to yellow-green, finally to orange-yellow. The physiological results showed that the highest biomass concentration was occurred at the initial sodium nitrate concentration of 17.6 mmol/L, up to 9.14 g/L. The contents of total lipid (TLs), neutral lipids (NLs) and total fatty acids (TFAs) increased following the reduction of nitrogen concentration. Their maximum contents reached to 60.81%, 56.59% and 53.47% at the basis of dry cell weight, respectively. However, the highest volumetric productivity of TLs, NLs and TFAs were up to 0.24, 0.21 and 0.20 g/(L·d) at 5.9 mmol/L of sodium nitrate, respectively. In addition, the main components of fatty acid were palmic acid, palmitoleicacid , oleic acid and eicosapentaenoic acid, among them, the content of palmitoleicacid was highest one. As a whole, E. vischeri was an oleaginous microalga, suitable for the production of biodiesel and high value-adding of long-chain polyunsaturated fatty acid EPA.
Eustigmatos vischeri; Sodium nitrate; Biomass concentration; Total lipid; Fatty acid; Volumetric productivity
Q819; TK6
A
1000-3207(2015)03-0574-09
10.7541/2015.75
2014-08-25;
2015-01-12
国家“863”主题项目(2013AA065805); 自然科学基金(31170337); 广东省低碳专项(2011-051)、珠海市科技重大项目(PB20041018); 珠海市科技攻关项目(PC20081008)资助
何思思(1990—), 女, 浙江平阳人; 硕士研究生; 研究方向为微藻生物技术和分子生物学。E-mail: zjhesisi@163.com
张成武(1963—), 男, 教授, 博士生导师; 研究方向为微藻生物学和生物技术。E-mail: tzhangcw@jnu.edu.cn
