斑马鱼4个小maf时空表达分析及在调控胰外分泌酶原基因表达中的作用研究
2015-02-27曾俏慧赵浩斌钟雪萍周青春
曾俏慧 吴 纯 卢 飞 赵浩斌 钟雪萍 周青春
(华中师范大学生命科学学院, 湖北省遗传调控与整合生物学重点实验室, 武汉 430079)
斑马鱼4个小maf时空表达分析及在调控胰外分泌酶原基因表达中的作用研究
曾俏慧 吴 纯 卢 飞 赵浩斌 钟雪萍 周青春
(华中师范大学生命科学学院, 湖北省遗传调控与整合生物学重点实验室, 武汉 430079)
Maf蛋白家族作为重要的转录调控因子, 参与细胞众多生命进程。它分为大Maf蛋白和小Maf蛋白, 小Maf蛋白需要与其他B-Zip家族蛋白结合形成异二聚体才能发挥作用。在斑马鱼(Danio rerio)中, 小Maf包括Mafk、Mafg1、Mafg2和Maft, Mafg1和Mafg2是Mafg在鱼类中特有的分化出的两个旁系同源基因。为了研究这4个小maf在物种之间的进化关系及表达模式, 实验对4个小maf进行进化树、染色体线性关系分析, 结果显示4个小maf的分子进化方向与物种进化方向一致, mafk和maff在物种间的更趋于保守, mafg比前两者要相对活跃。同时, 实验选取斑马鱼胚胎发育十个不同时期(1 cell、2 cells、3.5 hpf、6 hpf、12 hpf、24 hpf、36 hpf、48 hpf、72 hpf、96 hpf), 对其表达模式进行了详细的研究, 结果显示4个小maf中, mafg2的表达量最高, maft和mafk的表达量次之, mafg1的表达量最低。在胚胎发育的后期(48 hpf), 除了mafg2在躯干的血液循环处有明显的表达, maft在躯干的血液循环处有较弱的表达, 而除mafk和mafg1在血液循环处没有检测到表达之外, 4个基因的表达部位基本重叠, 都在全身广泛表达, 这可能也与它们之间存在功能叠加和替换有关。利用双荧光素酶检测系统检测了4个小Maf参与调控胰外分泌酶原基因转录的不同功能, 结果显示4个小maf的过表达都能使胰外分泌酶原基因的表达下调。研究结果将为深入研究4个小maf基因的功能叠加和互补作用奠定基础。
斑马鱼; maf; 原位杂交; 胰外分泌酶原基因
Maf (Musculoaponeurotic fibrosarcoma oncogene)蛋白家族作为bZIP(Basic and leucine zipper, bZIP)蛋白家族中的一员, 蛋白结构具有典型的bZIP结构,是V-Maf (Avian musculoaponeurotic fibrosarcoma virus)的同源基因[1,2], 可以与bZIP蛋白家族中其他成员,形成二聚体或者异二聚体, 作为转录调控因子, 调控细胞内众多生命进程。
Maf蛋白家族包括大Maf蛋白(大于200个氨基酸)和小Maf蛋白(小于200个氨基酸)[3,4]。大Maf蛋白包括c-Maf/Maf2[5]、MafB/Maf1[6]、Nrl[7]和L-Maf/ MafA/SMaf[8—10]、Krml1[11]、Zkrml2[12]; 小Maf蛋白包括MafK、MafF[13]和MafG[14], 最早发现是在原鸡(Gallus gallus)中, 后来Yaeko Yakagi等[15]的研究表明, 在斑马鱼中也存在小maf基因, 包括mafk的一个同源基因和mafg的两个同源基因, 即mafg1和mafg2,但是没有找到maff的同源基因, 而发现了一个新的小maf基因, 并命名为maft (small maf in Teleost)。在红鳍东方鲀(Takifugu rubripes)中的搜索结果同斑马鱼类似, 没有发现maff, 只有maft。这些分析表明, mafk和mafg在物种进化过程中比较保守, 而maff可能在鱼类分化时就产生了分支, 并在鱼类基因组中形成了maft。不过maff和maft基因在各自的物种中有没有特殊的功能仍未可知[15]。
在斑马鱼中半定量研究结果显示, maft在成年的斑马鱼(7个月)中全身广泛表达, 特别是脑中表达量最高, 而在鳃、心脏以及肠处表达最少, mafg2除了在膀胱处的表达较弱之外, 其表达模式与maft相似, mafg1在肝脏和睾丸组织中的表达量较其余三个基因的表达量高, 但是也是在斑马鱼全身组织广泛表达, mafk和mafg2的表达模式最相似。并且4个基因在斑马鱼胚胎不同发育时期(8 hpf、12 hpf、24 hpf、48 hpf、4d、7d)的半定量检测结果显示, 4个小maf基因从8 hpf时就都能检测到表达, 但是在胚胎发育早期(48 hpf之前)的表达量较低[15]。
在小鼠(Mus musculus)中, 小maf在胚胎发育过程中, 具有很复杂的表达模式, mafk和mafg虽然在各个组织中的表达分布模式不同, 但是在各个组织中广泛表达, 而maff在肺部具有较高的表达水平,在其他组织中的表达量都很低, 需要注意的是, 在整个胚胎发育过程中, 在造血细胞中都没有检测到maff基因的表达[16]。在人中, mafk在心脏、骨骼肌和胎盘处高表达, 而mafg仅在骨骼肌处较高表达, 在心脏和脑处表达量处于一般水平, 但是两个基因都在所有的造血细胞系中广泛表达; maff在肾脏和妊娠母体子宫肌层表达, 在非妊娠母体的子宫肌层中没有检测到表达[13,17—20]。
大Maf蛋白和小Maf蛋白都通过Maf识别元件MARE (MAF recognition element)调控下游基因的转录, 所不同的是, 大Maf蛋白在N端包含一个转录激活基序, 可以自己直接参与基因的调控, 而小Maf蛋白缺乏转录激活基序, 需要与其他bZIP蛋白家族成员通过形成二聚体或者异二聚体, 才能识别MARE位点对下游基因的转录进行调控[21]。已有的研究表明, Maf-Nrf2/Bach1路径参与调控胰外分泌酶原基因, 当Mafk与Nrf2a形成异二聚体时促进胰外分泌酶原基因的表达, 当Mafk与Bach1形成异二聚体时则抑制胰外分泌酶原基因的表达[22]。
此外, 有研究表明, 在不同物种中, 小 Maf的各旁系同源基因之间的表达模式基本重合, 并且小Maf之间存在功能替换[14,23], 在敲除MAFG蛋白的小鼠体内, 超表达MAFk蛋白可以补偿MAFG的缺失[24]。缺失所有三种小 MAF的小鼠表现为胚胎致死, 同时一系列结果表明, 小MAF蛋白对于应激反应和去毒作用中基因的转录激活具有十分重要的作用[25,26]。但目前, 对4个小maf基因在斑马鱼胚胎发育各个时期详尽的时空表达模式以及除了 Mafk之外的其他3个小Maf对于胰外分泌酶原基因的调控功能尚未见报道[22]。本文采用 RT-PCR、胚胎整体原位杂交技术和双荧光素酶检测系统, 研究斑马鱼4个小maf基因mRNA的时空表达模式, 及其在调控胰外分泌酶原基因转录中的作用研究。
1 材料与方法
1.1 实验材料
实验中使用的斑马鱼由本实验室采用28℃恒温循环水系统饲养、繁殖。人293细胞培养环境为37℃恒温培养, 5% CO2供给, 培养血清剂量为10%。
1.2 实验方法
RT-PCR检测4个小maf基因在斑马鱼不同发育时期的表达 取受精后 12h之内的斑马鱼胚胎, 利用胰蛋白酶(4%浓度)脱膜处理后, 浸泡在0.06%苯硫脲(N-phenylthiourea, PTU)溶液中, 每天早晚各换一次培养液, 每管收集发育至不同阶段的斑马鱼胚胎各20枚, 用Trizol法提取各自的总RNA,具体步骤参照试剂盒说明书进行。Dnase Ⅰ酶解可能残余的基因组DNA。用1%琼脂糖凝胶电泳鉴定所提取RNA的完整性, 紫外分光光度法测定RNA样品的浓度和纯度。将提取得到的各个斑马鱼不同发育时期的RNA用逆转录酶Reverse Transcriptase M-MLV和oligo(dT)合成第一链模板DNA, 然后以cDNA作为模板进行RT-PCR反应, 跨基因3′端设计特异性引物, 对基因进行 RT-PCR扩增。mafk基因RT-PCR反应条件为: 94 ℃ 30s; 63 ℃ 30s; 72 ℃ 1min。mafg1基因RT-PCR反应条件为: 94 ℃ 30s; 54 ℃ 30s; 72 ℃ 45s 。mafg2基因RT-PCR反应条件为: 94 ℃ 30s; 58 ℃ 30s; 72 ℃ 45s 。maft基因RT-PCR反应条件为: 94 ℃ 30s; 58 ℃ 30s; 72 ℃ 1min 。β-actin基因RT-PCR反应条件为: 94℃ 30s; 55℃ 30s; 72 ℃ 1min 。每个基因的表达量以β-actin为参照在凝胶电泳时调节上样量。
地高辛标记的正、反义RNA探针的合成 用与RT-PCR实验中相同的引物对目的基因进行扩增,将目的片段插入pGEM-T Easy载体, 阳性克隆送华大基因测序, 将测序正确的并且是正向插入pGEMT Easy载体的克隆分别命名为 T-mafk、T-mafg1、T-mafg2和T-maft, 作为T7系统合成反义探针的模板。碱裂解法提取T-mafk、T-mafg1、T-mafg2和T-maft质粒, 以M13-F和M13-R为引物, 提取的质粒(稀释到1—10 ng)为模板PCR, 电泳, 切下1000 bp左右大小的条带, 胶回收, 即得到线性化的 mafk、mafg1、mafg2和maft探针转录模板DNA。体外转录mRNA探针的反应体系如下: 10× T7 RNA Polymerase Buffer 2 μL, 50 mmol/L DTT 2 μL, Dig NTP Mix 2 μL, RNase Inhibitor 0.5 μL, Template DNA (0.5—1 μg) 10 μL, T7 RNA Polymerase (正义探针用SP6 RNA Polymerase 替代即可) 1 μL, RNase-free水2.5 μL, 总体系 20 μL。37℃孵育 3h。加入 2 μL DNaseⅠ (RNase free),混匀后37℃孵育30min。加1.2 μL 4 mol/L LiCl (RNase-free)和37 μL 100%的无水 乙 醇 (RNase-free), –20℃ 沉 淀 过 夜 。 4 ℃, 12000 r/min, 离心20min, 弃上清。加入70%的乙醇(RNase-free)800 μL洗涤沉淀, 来回颠倒EP管使沉淀悬浮, 4 ℃, 12000 r/min,离心5min, 风干沉淀。利用 30 μL RNase-free水溶解沉淀, 即为标记好的RNA探针, 紫外分光光度计测定浓度, 1%琼脂糖凝胶电泳鉴定RNA探针的质量, 分装并于–80℃保存。
茼蒿各采样植株的叶片绿素a含量、叶绿素b含量及总叶绿素含量和SPAD-502型叶绿素计测得的SPAD值见表1。
斑马鱼胚胎整体原位杂交 收集刚受精的斑马鱼胚胎, 用郝氏液培养至 6—8 hpf, 再用胰蛋白酶脱掉胚胎膜, 将脱过膜的胚胎用0.06% PTU溶液处理。分别于1—2 cell、6 hpf、12 hpf、24 hpf、36 hpf、48 hpf、72 hpf和96 hpf将胚胎或幼鱼用4%的多聚甲醛处理固定, 备用于原位杂交。整体原位杂交步骤详见文献[27], 采用显色液(NBT、BCIP、 Alkline Tris buffer)进行染色, 显色完成后, 终止液(20% tween-20、0.5 mol/L EDTA、pH5.5 PBS)和PBST各洗涤3次终止染色, 然后用70%甘油进行透化, 置于Leica M165FC体视显微镜下观察拍照。
双荧光素酶检测系统 通过对胰外分泌酶原基因基因组序列进行分析, 定位基因MARE位点后, 提取斑马鱼基因组 DNA, 并设计特异性引物,对胰外分泌酶原基因调控序列进行 RT-PCR扩增, try基因 RT-PCR反应条件为: 94 ℃ 30s; 63 ℃ 30s; 72 ℃ 2min 。并将目的片段插入PGL3-Promoter载体,阳性克隆送华大基因测序, 测序正确的命名为 try-Promoter。同时设计特异性引物(表1), 构建4个小maf基因的超表达载体, mafk基因RT-PCR反应条件为: 94 ℃ 30s; 56 ℃ 30s; 72 ℃ 45s 。mafg1基因RT-PCR反应条件为: 94 ℃ 30s; 54 ℃ 30s; 72 ℃ 45s 。mafg2基因 RT-PCR反应条件为: 94 ℃ 30s; 58 ℃ 30s; 72℃45s。maft基因RT-PCR反应条件为: 94 ℃ 30s; 58℃30s; 72 ℃ 45s 。将目的片段插入pCS2+载体, 阳性克隆送华大基因测序。用一定剂量的质粒转染293细胞后, 具体步骤参照 Dual-Luciferase®Reporter Assay System试剂盒和文献[28], 收集细胞上清, 检测荧光素酶活性。

表1 实验中使用的引物序列Tab. 1 Primers used for all the experiments
2 结果
2.1 斑马鱼4个小maf系统进化分析
扩增得到4个小maf开放阅读框全长, 序列比对结果显示, 本实验扩增得到的4个小maf与NCBI上mafk (NM_001002044.2)、mafg1 (NM_001002045. 3)、mafg2 (NM_212941.1 )和maft (NM_200336.1)序列一致, mafk基因的开放阅读框包括465个碱基, 编码154个氨基酸; mafg1基因的开放阅读框包括489个碱基, 编码162个氨基酸; mafg2基因的开放阅读框包括516个碱基, 编码171个氨基酸; maft基因的开放阅读框包括477个碱基, 编码158个氨基酸。为了研究小 Maf蛋白的进化关系, 本研究用MEGA5的邻接法构建小 Maf蛋白系统进化树, 并用自展法检验(图1)。分析该进化树, 发现斑马鱼的Mafg1和Mafg2与其他鱼类中的Mafg1和Mafg2聚为一支之后, 再与人、小鼠等哺乳动物聚为一支。斑马鱼的Maft先与鱼类中Maft聚为一支后, 再与其他哺乳动物的Maff聚为一支的, 支持斑马鱼的maft是maff同源基因。斑马鱼 Mafk 也是如此, 先与鱼类中的Mafk 聚为一支以后, 再与其他哺乳动物的聚为一支。最后Mafg、Maff和Mafk三个分支再归为一组, 说明这几类 Maf基因均来源于同一祖先。同时小 Maf的分子进化与物种系统进化趋势一致。
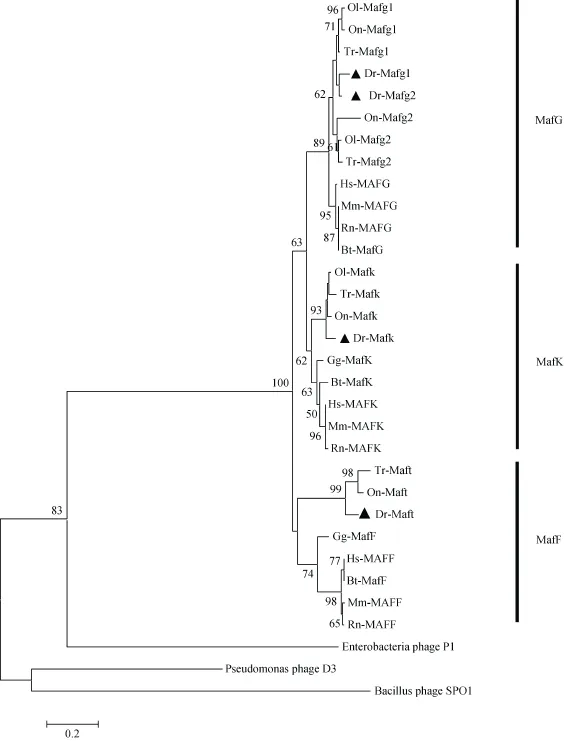
图 1 小Maf蛋白系统进化树Fig. 1 Phylogenetic relationship within the small Maf protein family
2.2 斑马鱼4个小maf染色体线性关系分析
为了进一步探究斑马鱼4个小maf基因的内在联系, 本研究对其在不同物种间的线性关系进行分析(图2)。分析结果显示: (1) mafk与lfng、ttyh3、snx8、nudtl、zfand2a、instl、tmen184a、psmg3等基因在斑马鱼、青(Oryzias latipes)、热带爪蟾(Xenopus tropicalis)、原鸡、牛(Bos Taurus)和人(Homo sapiens)的基因组均位于同一条染色体上(图2A); (2)maff与tefa、zc3h7b、sh3bp1、cdc42ep1、tnrc6b、csnkle、tmem184b基因在热带爪蟾、鸡、牛和人的基因组均位于同一条染色体, 而maft与tefa、zc3h7b、sh3bp1、cdc42ep1、tnrc6b、csnkle、tmem184b基因斑马鱼、红鳍东方基因组也位于同一条染色体(图 2B), 支持鱼类中maft和其他脊椎动物中的maff来源于共同的祖先; (3)mafg1和mafg2与其他基因的同线性明显比mafk和maff要弱 (图2A和C)。同时, 鱼类中的mafg1和mafk基因总是位于同一条染色体上(图2A),而mafg2单独位于另一条染色体上。 mafg1和mafg2作为 mafg基因在鱼类中特有的两个旁系同源基因,这种染色体排列关系是否与基因之间的替换和特有的功能有关, 仍有待于进一步研究。
2.3 斑马鱼4个小maf基因在胚胎发育时期中的时间表达分析
采用RT-PCR的方法检测了4个小maf基因在斑马鱼九个不同发育(1—2 cell、3.5 hpf、6 hpf、12 hpf、24 hpf、36 hpf、48 hpf、72 hpf和96 hpf)时期的时间表达情况(图 3)。结果显示, 4个小 maf都是母源性基因, 在胚胎发育的1—2 cell期就能检测到表达, 并且4个小maf在胚胎发育的各个时期都有表达, 与原位杂交结果(图4)相符。12 hpf以后的表达模式也与Takagi等[15]的结果基本一致。
用地高辛标记的RNA探针探究斑马鱼10个不同发育(1 cell、2 cells、3.5 hpf、6 hpf、12 hpf、24 hpf、36 hpf、48 hpf、72 hpf、96 hpf)时期的空间表达(图4)。结果显示, 4个小maf都是母源性基因, 在胚胎发育1cell期就能检测到mRNA信号, 4个小maf在整个胚胎发育时期都有表达信号外, mafg2和 maft基因在胚胎发育 72h之后, 在内脏消化器官处能看到比较明显的信号(图4B、图4D中箭头所示), 4个基因表达模式基本重合。此外, 值得注意的是, mafg1和mafg2作为mafg基因在鱼类中特有的两个旁系同源基因, mafg2的表达量明显高于mafg1, 与半定量结果相一致, 即 mafg两个拷贝 mafg1和mafg2的表达量有显著差异, 24hpg后, mafg2在部分躯干、内脏和尾部位有较高表达, 而 mafg1在这些部位几乎没有信号。它们表达模式和表达量的明显差异是否与功能的歧化有关, 仍有待于进一步研究。
2.5 4个小Maf参与调控胰外分泌酶原基因的功能分析
已有研究结果显示, Mafk参与调控胰外分泌酶原基因转录的调控[22], 但是对其他3个小Maf是否参与调控胰外分泌酶原基因的表达未见报道, 而小鼠中的研究结果显示, 小 MAF之间具有功能叠加和互补作用[24]。所以, 为了探究斑马鱼中的 4个小Maf, 是否在调控胰外分泌酶原基因方面具有功能叠加和互补作用, 本研究对4个小maf构建超表达载体, 并将胰外分泌酶原基因 try基因上游的调控序列连接到 PGL3-Promoter载体上, 共转染293细胞, 通过检测相对荧光素酶活性来探究因子之间的相互作用。结果如图5显示, 转染100 ng的mafk、mafg1和mafg2质粒都使胰外分泌酶原基因try的表达显著下调, 而转染100 ng的maft, 胰外分泌酶原基因try的表达没有显著变化, 同时, 本研究还发现, try的表达对4个小maf超表达都具有极显著或显著的浓度依赖性, 即小maf超表达量越高, try的表达量被抑制得越大。
3 讨论
3.1 四个小maf的表达模式及分子进化关系

图2 四个小maf同线性分析Fig. 2 The synteny of small maf among different species
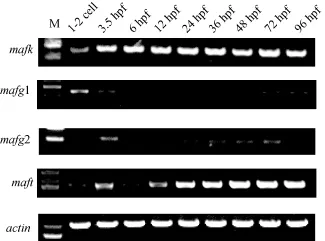
图3 RT-PCR分析4个小maf基因在斑马鱼胚胎不同发育时期中的时间表达Fig. 3 The expression pattern of small maf in different stages of zebrafish embryogenesis by RT-PCR
小Maf作为细胞内重要的调控因子, 参与氧化应激反应和解毒等多种生命活动[29]。目前, 在斑马鱼中对4个小maf基因在胚胎发育各个时期的时空表达模式尚未见报道。本研究利用 RT-PCR和胚胎整体原位杂交技术对4个小maf在斑马鱼胚胎发育中的时空表达模式进行探究, 其半定量和斑马鱼胚胎整体原位杂交结果显示: 4个小maf都是母源性基因。并且在4个基因中, mafg1的表达量最低, mafg2的表达量最高, 其次是maft和mafk基因。鱼类中特有的mafg的两个拷贝, 即mafg1和mafg2的表达量有明显差异, 24 hpf后, mafg2在部分躯干、内脏以及尾部仍有较高的表达, 而 mafg1在这些部位基本上没有表达, 从总体来看, mafg2的表达量明显高于mafg1, 这可能与mafg2与其他物种mafg同源性要高于mafg1有关。mafk基因的表达部位主要集中在头部, 部分躯干也有微弱的表达, 发育后期在躯干部的表达明显降低, maft的表达部位与 mafk相似,在躯干部的表达较mafk强烈。总的来说, 4个小maf的表达部位基本重叠, 这可能与它们之间可以进行功能替换有很大的关联[14,23]。并且有研究表明, 缺失所有3种小maf的小鼠表现为胚胎致死, 所以, 4个小maf都是斑马鱼母源性基因也从另一方面说明了小maf对斑马鱼的胚胎发育的重要作用。
本文系统进化树分析显示, 鱼类Maft先与其他脊椎动物的Maff归为一支, 再与Mafk和Mafg分支汇为一组。加上同线性分析结果, 与鱼类maft在同一条染色体的一组基因, 和其他脊椎动物的maff也在同一条染色体上。而且斑马鱼Maft具有Maf类似的功能[15]。从生物信息学分析和所获得的实验结果来看, 都支持鱼类maft和其他脊椎动物maff是同源基因。因此,作者建议将鱼类的maft更名为maff。
小maf基因的同线性分析显示, mafk和maff基因在物种进化过程的保守性较高, 这种保守性也从另一个方面说明了可能与小maf基因之间存在功能替代有十分重要的关系, 同时暗示在生命活动中具有十分重要的作用。
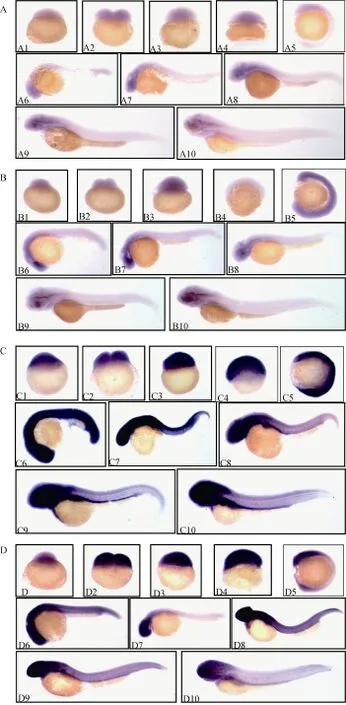
图4 整体原位杂交检测4个小maf mRNA在斑马鱼胚胎发育过程中的时空表达Fig. 4 The spatial-temporal expression patterns of small maf during embryonic development of Danio rerio by whole mount in situ hybridization

图5 四个小maf的超表达对胰外分泌酶原基因try转录的调节Fig. 5 Overexpression of small maf regulates transcription of try
3.2 四个小 maf对胰外分泌酶原基因表达调控的影响
为了探究斑马鱼中的4个小maf是否在调控胰外分泌酶原基因方面具有功能叠加和互补作用, 本研究通过检测相对荧光素酶活性来探究因子之间的相互作用。研究结果显示: 小 maf的超表达使胰外分泌酶原基因的表达下调, 结果与 Igarashi等[23]的研究结论相符, 即小 maf之间形成同源二聚体时,可抑制下游基因的转录。虽然胰外分泌酶原基因try的表达对4个小maf都具有浓度依赖性, 但其抑制能力有差异, mafg1和mafg2在低浓度(100 ng转染量)时对try表达的抑制能力显著高于mafk和mafgt, 并且maft在低浓度(100 ng转染量)时对try表达的没有显著影响。总之, 这4个小maf可能都参与胰外分泌酶原基因的转录调控, 不过对于其功能叠加和互补作用仍有待于进一步研究。
以上结果表明, 4个小maf基因都是母源性基因,并且可能都参与了调控胰外分泌酶原基因的转录表达, 本研究结果将为深入研究小 maf基因的功能及其分子歧化积累了数据。
[1] Nishizawa M, Kataoka K, Goto N, et al. v-maf, a viral oncogene that encodes a “leucine zipper” motif [J]. Proceedings of the National Academy of Sciences of USA, 1989, 86(20): 7711—7715
[2] Kawai S, Goto N, Kataoka K, et al. Isolation of the avian transforming retrovirus, AS42, carrying the v-maf oncogene and initial characterization of its gene product [J]. Virology, 1992, 188(2): 778—784
[3] Motohashi H, Katsuoka F, Engel J D, et al. Small Maf proteins serve as transcriptional cofactors for keratinocyte differentiation in the Keap1-Nrf2 regulatory pathway [J]. Proceedings of the National Academy of Sciences of USA, 2004, 101(17): 6379—6384
[4] Blank V, Knoll J H, Andrews N C. Molecular characterization and localization of the human MAFG gene [J]. Genomics, 1997, 44(1): 147—149
[5] Kataoka K, Nishizawa M, Kawai S. Structure-function analysis of the maf oncogene product, a member of the b-Zip protein family [J]. Journal of Virology, 1993, 67(4): 2133—2141
[6] Kataoka K, Fujiwara K T, Noda M, et al. MafB, a new Maf family transcription activator that can associate with Maf and Fos but not with Jun [J]. Molecular and Cellular Biology, 1994, 14(11): 7581—7591
[7] Swaroop A, Xu J Z, Pawar H, et al. A conserved retina-specific gene encodes a basic motif/leucine zipper domain [J]. Proceedings of the National Academy of Sciences of USA, 1992, 89(1): 266—270
[8] Ogino H, Yasuda K. Induction of lens differentiation by activation of a bZIP transcription factor, L-Maf [J]. Science, 1998, 280(5360): 115—118
[9] Benkhelifa S, Provot S, Lecoq O, et al. MafA, a novel member of the maf proto-oncogene family, displays developmental regulation and mitogenic capacity in avian neuroretina cells [J]. Oncogene, 1998, 17(2): 247—254
[10] Kajihara M, Kawauchi S, Kobayashi M, et al. Isolation, characterization, and expression analysis of zebrafish large Mafs [J]. Journal of Biochemistry, 2001, 129(1): 139—146
[11] Blank V and Andrews N C. The Maf transcription factors: regulators of differentiation [J]. Trends in Biochemical Sciences, 1997, 22(11): 437—441
[12] Schvarzstein M, Kirn A, Haffter P, et al. Expression of Zkrml2, a homologue of the Krml1/val segmentation gene, during embryonic patterning of the zebrafish (Danio rerio) [J]. Mechanisms of Ageing and Development, 1999, 80(2):223—226
[13] Fujiwara K T, Kataoka K, Nishizawa M. Two new members of the maf oncogene family, mafK and mafF, encode nuclear b-Zip proteins lacking putative trans-activator domain [J]. Oncogene, 1993, 8(9): 2371—2380
[14] Kataoka K, Igarashi K, Itoh K, et al. Small Maf proteins heterodimerize with Fos and may act as competitive repressors of the NF-E2 transcription factor [J]. Molecular and Cellular Biology, 1995, 15(4): 2180—2190
[15] Takagi Y, Kobayashi M, Li L, et al. MafT, a new member of the small Maf protein family in zebrafish [J]. Biochemical and Biophysical Research Communications, 2004, 320(1): 62—69
[16] Onodera K, Shavit J A, Motohashi H, et al. Characterization of the murine mafF gene [J]. The Journal of Biological Chemistry, 1999, 274(30): 21162—21169
[17] Marini M G, Chan K, Casula L, et al. hMAF, a small human transcription factor that heterodimerizes specifically with Nrf1 and Nrf2 [J]. The Journal of Biological Chemistry, 1997, 272(26): 16490—16497
[18] Toki T, Itoh J, Kitazawa J, et al. Human small Maf proteins form heterodimers with CNC family transcription factors and recognize the NF-E2 motif [J]. Oncogene, 1997, 14(16): 1901—1910
[19] Blank V, Kim M J, Andrews N C, Human MafG is a functional partner for p45 NF-E2 in activating globin gene expression [J]. Blood, 1997, 89 (11): 3925—3935
[20] Kimura T, Ivell R, Rust W, et al. Molecular cloning of a human MafF homologue, which specifically binds to the oxytocin receptor gene in term myometrium [J]. Biochemical and Biophysical Research Communications, 1999, 264(1): 86—92
[21] Sun J, Brand M, Zenke Y, et al. Heme regulates the dynamic exchange of Bach1 and NF-E2-related factors in the Maf transcription factor network [J]. Proceedings of the National Academy of Sciences of USA, 2004, 101 (6): 1461—1466
[22] Zhang S, Xu M, Huang J, et al. Heme acts through the Bach1b/Nrf2a-MafK pathway to regulate exocrine peptidase precursor genes in porphyric zebrafish [J]. Disease Models & Mechanisms, 2014, 7(7): 837—845
[23] Igarashi K, Kataoka K, Itoh K, et al. Regulation of transcription by dimerization of erythroid factor NF-E2 p45 with small Maf proteins [J]. Nature, 1994, 367(6463): 568—572
[24] Motohashi H, Katsuoka F, Shavit J A, et al. Positive or negative MARE-dependent transcriptional regulation is determined by the abundance of small Maf proteins [J]. Cell, 2000, 103(6): 865—875
[25] Katsuoka F, Motohashi H, Ishii T, et al. Genetic evidence that small maf proteins are essential for the activation of antioxidant response element-dependent genes [J]. Molecular and Cellular Biology, 2005, 25(18): 8044—8051
[26] Yamazaki H, Katsuoka F, Motohashi H, et al. Embryonic lethality and fetal liver apoptosis in mice lacking all three small Maf proteins [J]. Molecular and Cellular Biology, 2011, 32(4): 808—816
[27] Wang H, Zhou Q, Kesinger J W, et al. Heme Regulates Exocrine Peptidase Precursor Genes in Zebrafish [J]. Experimental Biology and Medicine, 2007, 232 (9): 1170—1180
[28] Liu Y, Zhang Y B, Liu T K, et al. Identification and promoter analysis of an IFIT family gene from zebrafish Danio rerio [J]. Acta Hydrobiologica Sinica, 2012, 36(1): 1—8 [刘颖, 张义兵, 刘庭凯, 等. 斑马鱼一个ifit家族基因的鉴定及启动子分析. 水生生物学报, 2012, 36(1): 1—8]
[29] Kannan M B, Solovieva V, Blank V. The small MAF transcription factors MAFF, MAFG and MAFK: Current knowledge and perspectives [J]. Biochimica Et Biophysica Acta-Molecular Cell Research, 2012, 1823(10): 1841—1846
THE SPATIAL-TEMPORAL EXPRESSION PATTERNS OF SMALL MAF AND THEIR EFFECTS ON THE REGULATION OF ZYMOGENS IN ZEBRAFISH
ZENG Qiao-Hui, WU Chun, LU Fei, ZHAO Hao-Bing, ZHONG Xue-Ping and ZHOU Qing-Chun
(Hubei Key Laboratory of Genetic Regulation and Integrative Biology & School of Life Sciences, Huazhong Normal University, Wuhan 430079, China)
The members of musculoaponeurotic fibrosarcoma oncogene (Maf) family are important transcription factors that are involved in many cascades of cell biology. They are classified into large and small Maf proteins. The small Maf proteins of zebrafish include Mafk, Mafg1, Mafg2 and Maff (Maft). Mafg1 and mafg2 are paraloges of mafg that only exist in fish genomes. The phylogenetic tree indicated that the evolution of the small Mafs was conservative. The systemic analyses of different small mafs also showed that mafk and maff were more conservative than mafg. In the present study we analyzed the spatial-temporal expression of these four mafs in the early development of zebrafish embryos using semiquantitative PCR and whole mount in situ hybridization. The expression of all four genes started at the one cell stage, suggesting that these genes were maternal and the expression were ubiquitous in early zebrafish embryos. Mafg2 showed the highest expression level among the four genes, and was specifically expressed in blood circulation after 48 hpf, together with maff. The results of dual-luciferase system also showed that the over expression of the four small Mafs led to down-regulation of the transcription of zymogens in a dose-dependent manner. Our study should contribute to better understanding of the functional superposition and complementarities of small Mafs.
Zebrafish; maf; Whole-mount in situ hybridization of zebrafish; Zymogens
Q344+.1
A
1000-3207(2015)03-0449-10
10.7541/2015.60
2014-06-18;
2014-08-26
国家自然科学基金项目(31071997和30972254)资助
曾俏慧(1989—), 女, 湖南省邵阳市人; 硕士研究生; 研究方向为动物学。E-mail: wszqha1989@163.com
周青春, E-mail: qczhou@mail.ccnu.edu.cn
