池蝶蚌CyPA的应激表达及对Hela细胞生长的影响
2015-02-27春徐灵何静史建伍盛军庆彭扣王军花黄滨洪一江
罗 春徐 灵何 静史建伍盛军庆彭 扣王军花黄 滨洪一江
(1. 南昌大学生命科学与食品工程学院, 南昌 330031; 2. 江西省水产技术推广站, 南昌 330046)
池蝶蚌CyPA的应激表达及对Hela细胞生长的影响
罗 春1徐 灵1何 静1史建伍1盛军庆1彭 扣1王军花1黄 滨2洪一江1
(1. 南昌大学生命科学与食品工程学院, 南昌 330031; 2. 江西省水产技术推广站, 南昌 330046)
研究分析了池蝶蚌(Hyriopsis schlegelii)亲环蛋白A(Cyclophilin A, CyPA)诱导的应激反应和对Hela细胞生长的影响。采用嗜水气单胞杆菌诱导刺激池蝶蚌, 并利用Real-time PCR技术对其肝脏、性腺和血淋巴中CyPA基因mRNA的表达量进行分析, 应激实验表明, 在嗜水气单胞杆菌刺激后血淋巴、肝脏和性腺中的CyPA在诱导 4h出现一个表达峰, 8h后开始下降, 说明池蝶蚌 HsCyPA基因参与免疫防御应答反应; 利用pET-32a(+)表达载体, 根据HsCyPA基因cDNA的序列, 构建了含有完整开放阅读框(ORF)的表达载体并在大肠杆菌BL21(DE3)中进行原核表达, 优化诱导条件后, 通过亲和层析获得了含量较高的上清可溶性蛋白; 采用MTT法, 将原核表达的重组CyPA蛋白稀释到相应(50、100、200、400和800 ng/mL)浓度, 刺激Hela细胞系后发现, 重组池蝶蚌 CyPA蛋白能促进 Hela细胞生长, 刺激浓度为 100 ng/mL时, 达到最大增殖率18.5%。结果初步表明, 池蝶蚌 CyPA是一个既参与免疫应激又对细胞的生长发育具有影响的功能广泛的蛋白质。
池蝶蚌; 亲环蛋白A; Real-time PCR; 原核表达; Hela细胞; MTT法
亲环素家族(Cyclophiins, Cyps)是一类广泛分布于自然界、具有高度保守性的多功能蛋白家族, 它们是免疫抑制剂环孢素A(Cyclophilins, CsA)细胞内受体又称为CsA结合蛋白[1]。当前, 对CyPA主要集中于其在不同生物体内的分布、相关蛋白序列的分析、结构及其重要的生物学功能等领域的研究[2]。诸多研究结果显示CyPA与肿瘤的发生密切相关。Qian等[3]通过RNA干扰技术抑制CyPA在非小细胞肺癌细胞中的表达, 通过细胞增殖实验和克隆形成实验, 发现CypA表达的下调导致了非小细胞肺癌细胞的增殖明显下降。运用蛋白质组学和细胞生物学的方法发现, CyPA在食管鳞癌[4]、男性乳腺癌[5]、前列腺癌[6]、头颈部肿瘤[7]和舌鳞状细胞癌[8]等肿瘤中的表达也明显上调, 参与其恶性的生物学行为。相关研究报道, CypA的分子伴侣功能对在形成肿瘤中不当的信号激活造成的条件复合物的错误折叠和断裂的修复起着很重要的作用, 并且维持蛋白的稳态, 这很可能是肿瘤生存的关键[9]。此外, CyPA基因可作为一个免疫抑制剂参与病毒复制的中间过程,参与机体的免疫机制[12]; 研究还发现, 哺乳动物中的CyPA基因对抵御病毒感染起着重要的角色[13], 表明CyPA基因参与先天免疫机制。近年来研究发现, CyPA在栉孔扇贝以及斑节对虾等水生生物中可能充当一种免疫应激的角色[10,11]。
池蝶蚌属软体动物门、瓣鳃纲、蚌科、帆蚌属,具有优良的育珠及抗病性能[14]。从用灭活的嗜水气单胞菌刺激的池蝶蚌文库中获得了HsCyPA的cDNA全长1229 bp, 完整的开放性阅读框编码164个氨基酸; 池蝶蚌CyPA除了是一种组成型蛋白, 存在肽基脯酰顺反异构酶活性外, 可能在水生生物的病原感染防御中同样发挥重要作用[15]。到目前为此, 还没有淡水贝类中有关CyPA功能研究的报道。本研究用嗜水气单胞菌对池蝶蚌进行诱导, 实时荧光定量PCR检测池蝶蚌肝脏、性腺、血淋巴中的CyPA的表达情况, 初步探讨CyPA基因在池蝶蚌免疫应答中的作用。同时通过原核表达纯化获得的池蝶蚌的融合CyPA, 用MTT法研究其对Hela细胞生长的影响, 为进一步了解淡水珍珠贝类CyPA的功能奠定良好的基础。
1 材料与方法
1.1 材料
嗜水气单胞菌、pET-32a载体、大肠杆菌BL21(DE3)为本实验室永久保存种, 池蝶蚌采自江西抚州市洪门水库的国家级池蝶蚌良种场。池蝶蚌取回后放置于实验室水族箱中暂养, 水温控制在18—25 ℃ ,每天上下午换曝气的水各一次。各组织样品取材于4龄健康池蝶蚌, 诱导组(嗜水气单胞菌刺激2h、4h、8h、16h、24h、48h)。Hela细胞系从康为世纪生物公司购买, 各种分子生物学试剂分别购自ABI、TaKaRa、Invitrogen 及Sigma 等公司。
1.2 RNA的提取和cDNA的合成
取经过菌刺激过后的池蝶蚌的性腺、肝和血淋巴和没经过菌刺激的性腺, 用Invitrogen公司的TRIzol Reagent提取总RNA, 按照Invitrogen公司的Super Script Ⅱ Reverse Transcriptase Kit的方法合成cDNA。然后用琼脂糖凝胶和UV检测RNA纯度。
1.3 PCR引物设计
根据实验室所获得的池蝶蚌 CyPA基因 cDNA全长序列, 设计 CyPA的荧光定量 PCR引物CyPA-1、CyPA-2, 管家基因选择池蝶蚌的β-肌动蛋白基因(β-actin), 设计的引物为A-R-1、A-R-2; 同时选定包括全部ORF在内的大小约为650 bp的片段用于表达蛋白, 设计的引物CyPA-up、CyPA-low加入了EcoRⅠ和XhoⅠ限制性内切酶位点和保护碱基,设计的引物如表1所示。

表1 荧光定量PCR所用CyPA基因荧光定量引物和β-actin的引物及CyPA表达的扩增引物Tab.1 Primers used for Real-time PCR and CyPA Expression in this study
1.4 池蝶蚌CyPA荧光定量PCR检测、蛋白表达目的片段PCR
以菌刺激过的不同时间段的性腺、肝和血淋巴的cDNA作为模板, 进行荧光定量检测, 每个组织做3个平行样, 重复3次实验; 以池蝶蚌性腺组织cDNA为模板, 用特异性表达引物进行PCR反应, 扩增表达蛋白的目的片段。荧光定量PCR的反应体系为25 μL, SYBR Premix Ex TaqTM(2×)8 μL, cDNA模板 2 μL, 上游引物1 μL, 下游引物1 μL, ddH2O 8 μL, 反应条件为95 ℃ 5min, 95 ℃ 30s, 50 ℃ 30s, 72 ℃ 30s, 35个循环; 扩增蛋白表达片段的反应体系为50 μL, 10×PCR buffer 5 μL, dNTP Mix (10 mmol/L) 1 μL, cDNA模板2 μL, 上游引物(10 mmol/L)1 μL,下游引物(10 mmol/L)1 μL, HiFi Polymerase (5 U/μL) 0.5 μL, ddH2O 39.5 μL, 反应条件为94 ℃ 4min, 94℃30s, 58 ℃ 30s, 72 ℃ 30s, 35个循环, 72 ℃ , 10min。扩增片段经过割胶回收后, 再用1%琼脂糖凝胶电泳检测后, DNA–20℃贮存备用。采用2–△△Ct法计算分析定量的相对表达值[16]。运用SPSS软件分析CyPA mRNA在池蝶蚌中的表达情况, P<0.05差异显著, P<0.01差异极显著。
1.5 池蝶蚌pET-32a-CyPA重组质粒的构建与鉴定将回收获得目的片段与具有氨苄青霉素(Amp)抗性的pET-32a Expression Vectors用EcoRⅠ和XhoⅠ两种限制性内切酶进行双酶切处理, 然后用T4 DNA 连接酶将质粒酶切产物与DNA酶切产物进行酶联, 然后将重组质粒转入到感受态细胞中进行转化, 通过在具有氨苄青霉素(Amp)抗性的固体培养基中挑克隆, 通过菌液PCR阳性检测目的片段,阳性克隆菌液送至上海生工生物工程有限公司测序。将正确的阳性克隆接种至20 mL LB培养基, 当菌液A600值约为0.6左右时用质粒小抽提试剂盒提重组质粒, 质粒保存在–20℃冰箱备用。
1.6 池蝶蚌CyPA原核表达及其蛋白纯化
将构建好的重组质粒转化到大肠杆菌BL21(DE3)中, 重组菌于37℃振荡过夜, 取200 μL接种于20 mL LB (50 μg/mL Amp)液体培养基中, 37℃、200 r/min恒温摇床振荡培养至A600为0.6—0.8时, 取出1 mL菌液作为诱导前对照, 其他加入IPTG至终浓度为1 mmol/L, 然后继续以相同培养条件培养, 分别在培养1h、2h、3h、4h、5h、6h、7h和8h后各吸取1 mL菌液作为诱导组菌液, 最后收集菌体,用SDS-PAGE胶进行分析。为了获得蛋白含量较高的上清, 根据闫啸等[17]的方法在蛋白诱导的过程中对其条件进行了相应的优化: 低温诱导和培养基优化。在确定最佳表达条件和时间后, 进行大量诱导,通过超声波破碎收集上清和包涵体, 采用N端带有6个连续组氨酸的亲和层析柱, 利用金属离子螯和柱进行亲和层析纯化。
1.7 MTT法检测池蝶蚌重组CyPA对Hela细胞增殖的影响
用胰酶消化对数生长期的Hela细胞, 按2×103细胞/孔接种于96孔板, 在正常条件下培养过夜, 然后用无血清RPMI-1640培养基洗涤细胞3次后, 加入含0.1%胎牛血清RPMI-1640培养基, 继续培养24h, 使细胞均一化, 同时将活性和煮沸的重组蛋白CyPA用0.1%胎牛血清的RPMI-1640培养基稀释至不同浓度(50、100、200、400、600和800 ng/mL), 在无血清RPMI-1640培养基洗涤细胞3次后, 每孔加入200 μL含不同CyPA蛋白浓度的培养基, 对照组加入等量不含CyPA的0.1%胎牛血清的RPMI-1640培养基, 继续培养, 在细胞培养72h后, 每孔加入5 mg/mL MTT溶液20 μL, 37℃继续孵育4h; 吸去培养基, 每孔加入200 μL DMSO溶液, 摇床避光振摇直至显微镜下观察板孔内蓝色结晶物完全溶解, 然后在酶标仪上检测A570值。
2 结果
2.1 嗜水气单胞菌诱导池蝶蚌CyPA基因在性腺、肝脏和血淋巴中不同时间段的表达
通过荧光定量PCR检测池蝶蚌CyPA基因在嗜水气单胞杆菌诱导下在性腺、肝脏和血淋巴不同时间段的表达差异: 池蝶蚌CyPA基因在性腺、肝脏和血淋巴在诱导2h时, 发现已经开始出现上调, 在诱导4h均达到表达峰值, 除了性腺在诱导48h出现小幅度的上调, 肝脏在16h出现小幅度上调外, 3个组织的表达量基本出现下调趋势, 肝脏和血淋巴在诱导48h后的表达量最低(图1—3)。
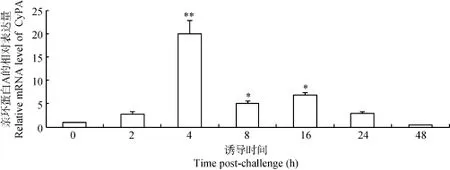
图1 不同诱导时间池蝶蚌肝脏中CyPA表达的变化Fig. 1 Change of CyPA gene expression level in liver of H. schlegelii after A. hydrophila stimulation at different times

图2 不同诱导时间池蝶蚌性腺中CyPA表达的变化Fig. 2 Change of CyPA gene expression level in gonad of H. schlegelii after A. hydrophila stimulation at different times
2.2 CyPA蛋白表达目的片段和目的片段阳性检测及其重组质粒双酶切鉴定
用特异性表达引物进行PCR扩增获得的产物经琼脂糖凝胶电泳检测, 在650 bp左右, 与目的片段大小相同; 菌液PCR阳性检测结果与上海生工测序一致; EcoRⅠ和XhoⅠ双酶切构建好的重组质粒pET-32a-CyPA, 得到了与预期片段大小相符的外源基因片段, 验证了目的表达片段。
2.3 CyPA融合蛋白的诱导表达及其纯化
将重组质粒pET-32a-CyPA转化到大肠杆菌BL21(DE3)中, 重组菌通过IPTG诱导表达CyPA融合蛋白, 未诱导的重组菌作为对照组, 对各诱导时间菌体进行变性不连续SDS-PAGE胶电泳, 发现在1—8h 里均出现了一条相对分子量约37 kD的蛋白条带, 但在对照组0h中没有出现类似的条带, 说明重组菌成功表达了CyPA融合蛋白; 用His-Bind Kit (Novagen公司)纯化带(His)6-标签的CyPA上清, 包涵体用KCL染色切胶回收法, 检测结果表明纯化效果较好, 得到了单一的目的条带。通过比较LB培养基诱导, LB培养基低温诱导和甘露醇培养基低温诱导三者之间纯化的结果, 发现在甘露醇培养基低温诱导条件下蛋白表达量最高。
2.4 池蝶蚌重组CyPA对Hela细胞增殖的影响
MTT法是检测活细胞最直接的实验方法, 实验测得OD值的高低与活细胞成正比。实验用池蝶蚌CyPA刺激Hela细胞, 进行MTT法毒性实验, 通过酶标仪检获得OD值来分析对细胞的生长情况。结果如表2所示, 活性的CyPA对Hela细胞有显著的促进作用(P<0.05), 最佳刺激浓度是100 ng/mL, 此时A570的平均值为1.1509(±0.05), 对照组是0.9704 (±0.05), 通过增长率的计算方法得出最大增殖率为18.5%; 浓度小于100 ng/mL时, 刺激作用逐步上升, 但当浓度大于100 ng/mL时, 刺激效果呈现下降趋势。将CyPA煮沸 5min, 将变性失活的蛋白稀释到相同浓度来刺激Hela细胞, 结果显示, 煮沸后的CyPA蛋白的作用显著降低, A570在0.9160—0.9808。[增殖率=(实验组A570–对照组A570)/对照组A570]
3 讨论

图3 不同诱导时间池蝶蚌血淋巴中CyPA表达的变化Fig. 3 Change of CyPA gene expression level in haemocytes of H. schlegelii after A. hydrophila stimulation at different times

表2 MTT法检测HsCyPA对Hela细胞的促增殖作用结果Tab.2 The results of HsCyPA promoting proliferation of Hela Determined by MTT assay
通过检测池蝶蚌CyPA组织分布表达情况, 发现在肝脏和性腺中表达量显著高于其他组织。研究发现, CyPA在性腺、肝脏和血淋巴中的表达量高于其他组织, 在防御病原菌感染机制中也担当相关角色[13]。在无脊椎动物中并没有发现B细胞抗体介导的体液免疫机制和T细胞介导的细胞免疫反应机制, 主要是通过血淋巴、肝胰腺及一些体液免疫因子参与机体的免疫防御来行使免疫功能[18,19]。通过用嗜水气单胞杆菌对池蝶蚌进行刺激后, 发现CyPA在血淋巴中的mRNA表达量发生显著变化, CyPA mRNA的表达量在诱导4h后显著上升(P<0.01), 并达到峰值,说明CyPA在血细胞免疫防御细菌感染机制中起作用。在性腺中, CyPA mRNA的表达量在诱导4h后显著上升(P<0.01), 并达到峰值, 诱导2h后池蝶蚌性腺CyPA的表达量已经开始上升, 诱导8h后出现下降趋势, 诱导24h后表达量降到最低, 48h表达量出现小幅度的上调, CyPA在肝脏中的表达水平也出现了相似的表达趋势。Song等[12]在研究栉孔扇贝CyPA时同样发现, 经鳗弧菌(Vibrio anguillarum)诱导4h后性腺中CyPA表达量显著增加, 和本实验结果相吻合,进一步证实CyPA在贝类防御细菌感染方面起着重要作用。Yeh等[20]研究中也发现, 经爱德华杆菌诱导的斑点叉尾(Lepisosteus oculatus)卵巢细胞中CyPA表达量明显增加, 表明CyPA在爱德华杆菌感染早期阶段扮演防御的角色。Qiu等[13]发现在斑节对虾(Penaeus monodon)中CyPA基因, 用LPS刺激后在肝胰腺中表达量也出现显著上调, 再次证实CyPA对防御细菌感染起着重要作用。综上得出: 在嗜水气单胞菌刺激后, 池蝶蚌CyPA在性腺、血淋巴和肝脏中表达量很高, 在4h时表达水平达到峰值, 说明池蝶蚌的CyPA在性腺、血淋巴和肝脏的防御外来细菌机制中起着重要作用, 然而CyPA在对贝类免疫机制仍然有许多未知, 仍需要进一步深入研究。
已有报道发现, CyPA在子宫内膜癌、肝癌、乳腺癌等多种癌症组织中表达明显上调, 并证实外源性的 CyPA蛋白能促进宫内膜癌癌细胞、胰腺癌细胞以及肝癌细胞的增殖[21,24], 研究还发现肝癌细胞组织和细胞系中 CyPA表达上调可能参与肝癌细胞趋化作用、远处转移、抗凋亡等过程[25,26]。在研究肺癌过程中 Yang等[27]比较了不同的肺癌细胞系和正常肺细胞系中 CyPA的表达水平情况, 筛选到了一株CyPA相对表达最高的肺癌细胞株H446, 并发现在外源重组CyPA的刺激下对H446细胞的增殖起到了一定的上调作用; Li等[28]证实, CyPA在人胰腺癌细胞中过度表达可通过与其受体EMMPRIN的结合促进肿瘤细胞增殖。在胰腺癌患者中, CyPA的表达与肿瘤大小, TNM分期, 淋巴转移及CA199的表达也相关[29]。为了研究池蝶蚌 CyPA是否具有促进细胞增生功能, 本研究采用池蝶蚌CyPA对Hela细胞进行了体外刺激实验, 通过MTT法毒性实验, 相对于对照组, 发现在加入了高浓度活性重组 CyPA蛋白的Hela细胞生长更快, 这一现象也首次证实了淡水珍珠蚌池蝶蚌CyPA对Hela细胞有一定促进细胞增殖的作用。池蝶蚌CyPA这种对Hela细胞的生长有促进作用, 可能与CyPA具有PPIase活性有关,在氧化应激条件下, 它能介导活性氧递质对细胞外信号调节激酶-1和2的激活, 通过增加癌细胞的增殖和抗凋亡能力, 调整促癌信号来促进细胞有丝分裂, 最终达到 Hela细胞的增殖作用。综上表明, 池蝶蚌 CyPA是一个功能广泛的分子, 相关功能及其作用机制有待更加进一步深入的研究。
[1] Feng W H, Xin Y. Progress in research on cyclophilin A and malignant tumors [J]. Tumor, 2013, 33(10): 928—934 [冯文华, 辛彦. 亲环素A与肿瘤相关性的研究进展.肿瘤, 2013, 33(10): 928—934]
[2] Qian Z, Yue W T, Li B L. Progress of CypA and lung cancer-related research [J]. Chinese Journal of Lung Cancer, 2010, 13(8): 827—831 [钱哲, 岳文涛, 李宝兰. CypA的生物学功能及其与肺癌相关的研究进展.中国肺癌杂志, 2010, 13(8): 827—831]
[3] Qian Z, Zhao X, Jiang M, et al. Downregulation of cyclophilin A by siRNA diminishes non-small cell lung cancer cell growth and metastasis via the regulation of matrix metallopeptidase 9 [J]. BMC Cancer, 2012, (12): 442
[4] Qi Y J, He Q Y, Ma Y F, et al. Proteomic identification of malignant ransformation-related proteins in esophngeal squamans cell carcinoma [J]. Cell Biochemistry, 2008, 104(5): 1625—1635
[5] Chahed K, Kabhage M, Hamrita B, et al. Detection of protein alterations in male breast cancer using two dimensional gel electrophoresis and mass spectrometry: The involvement of several pathways in tumorigenesis [J]. Clinica Chimica Acta, 2008, 388(1—2): 106—114
[6] Chaunmd P, Rahmun M A, Hunt T, et al. Monitoring mouse prostate development by profiling and imaging mass spectrometry [J]. Molecular & Cellular Proteomics, 2008, 7(2): 411—423
[7] Takahashi M, Suzuki S, Ishikawa K. Cyclophilin A-EMMPRIN interaction induces invasion of head and neck squamous cell carcinoma [J]. Oncology Reports, 2012, 27(1): 198—203
[8] Huang C, Sun Z, Sun Y, et al. Association of increased ligand cyclophilin A and receptor CD147 with hypoxia, angiogenesis, metastasis and prognosis of tongue squamous cell carcinoma [J]. Histopathology, 2012, 60(5): 793—803
[9] Lee J. Role of cyclophilin a during oncogenesis [J]. Archives Pharmacal Research, 2010, 33(2): 181—187
[10] Ding Z K, Xin W L, Chen X L, et al. Cloning and expression analysis of cyclophilins A gene from Litop enaeus vannamei [J]. Journal of Wuhan University, 2011, 57(4): 323—328 [丁兆坤, 辛文伦, 陈秀荔, 等. 凡纳滨对虾亲环素A基因的克隆及表达分析. 武汉大学学报, 2011, 57(4): 323—328]
[11] Towers G J. The control of viral infection by tripartite motif proteins and cyclophilin A [J]. Retrovirology, 2007, 4(40): 40—50
[12] Song X Y, Wang L L, Song L S, et al. A cyclophilin A inducible expressed in gonad of zhikong scallop Chlamys farreri [J]. Molecular Biology Reports, 2009, 36(6): 1637—1645
[13] Qiu L, Jiang S, Huang J, et al. Molecular cloning and mRNA expression of cyclophilin A gene in black tiger shrimp (Penaeus monodon) [J]. Fish & Shellfish Immunology, 2009, (26): 115—121
[14] He S H, Peng K, Hong Y J, et al. Molecular properties and immune defense of two ferritin subunits from freshwater pearl mussel, Hyriopsis schlegelii [J]. Fish & Shellfish Immunology, 2013, (34): 865—874
[15] Xie K, Xu L, Sheng J Q, et al. Construction of full-length cDNA library of hemocyte from Aeromonas hydrophila challenged Hyriopsis schlegeli and sequence analysis of cyclophilin A [J]. Acta Hydrobiologica Sinica, 2011, 35(5): 783—789 [谢凯, 徐灵, 盛军庆, 等. 嗜水气单胞菌诱导的池蝶蚌血细胞cDNA文库的构建和亲环蛋白(Cyp A)基因的序列分析. 水生生物学报, 2011, 35(5): 783—789]
[16] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real—time quantitative PCR and the 2(-Delta DeltaC(T)) mehtod [J]. Methods, 2001, 25(4): 402—408
[17] Yan X, Xu L R, Guan Y X, et al. Soluble expression of recombinant cyclophilin A in Escherichia coli [J]. Journal of Zhejiang University (Agriculture & Life Science), 2010, 36(4): 363—369 [阎啸, 徐立仁, 关怡新, 等. 重组亲环蛋白A的可溶性表达. 浙江大学学报, 2010, 36(4): 363—369]
[18] Zhou Y C, Pan J P. Progress on researches of cellular and humoral defense mechanisms in molluscs [J]. Journal of Fisheries of China, 1997, 21(4): 449—454 [周永灿, 潘金培.贝类细胞和体液的防御机制研究进展. 水产学报, 1997, 21(4): 449—454]
[19] He S H. Characteristics and expression analysis of two ferritin subunits from freshwater pearl mussel, Hyriopsis schlegelii [D]. Nanchang University. 2012 [何书豪. 池蝶蚌铁蛋白基因的特征与表达分析.硕士学位论文, 南昌大学. 2012]
[20] Yeh H Y, Klesius P H. Channel Catfish, Ictalurus punctatus, cyclophilin A and B cDNA characterization and expression analysis [J]. Veterinary Immunology and Immunopathology, 2008, 121(3/4): 370—377
[21] Obchoei S, Weakley S M, Wongkham S, et al. Cyclophilin A enhances cell proliferation and tumor growth of liver fluke-associated cholangiocarcinoma [J]. Molecular Cancer, 2011, 10(1): 102
[22] Li Z, Zhao X, Bai S, et al. Proteomics identification of cyclophilin A as a potential prognostic factor and therapeutic target in endometrial carcinoma [J]. Molecular & Cellular Proteomics, 2008, 7(10): 1810—1823
[23] Suzuki J, Jin Z G, Meoli D F, et al. Cyclophilin A is secreted by a vesicular pathway in vascular smooth muscle cells [J]. Circulation Research, 2006, 98(6): 811—817
[24] Wang Y, Yao H, Wen L, et al. Establishment and functional analysis of hepatocellular carcinom a cell line which overexpressed CypA [J]. Modern Oncology, 2010, 18(8): 1473—1476 [王宇, 姚辉, 温丽, 等. 高表达CypA肝癌细胞系的建立及功能的初步研究.现代肿瘤医学, 2010, 18(8): 1473—1476]
[25] Zhang M, Dai C, Zhu H, et al. Cyclophilin A promotes human hepatocellular carcinoma cell metastasis via regulation of MMP3 and MMP9 [J]. Molecular and Cellular Biochemistry, 2011, 357(1—2): 387—395
[26] Lee J. Novel combinational treatment of cisplatin with cyclophilin A inhibitors in human heptocellular carcinomas [J]. Archives Pharmacal Research, 2010, 33(9): 1401—1409
[27] Yang H, Chen J, Yang J, et al. Cyclophilin A is upregulated in small cell lung cancer and activates ERK1/2 signal [J]. Biochemical and Biophysical Research Communications, 2007, 361(3): 763—767
[28] Li M, Zhai Q, Bharedwaj U, et al. Cyclophilin A is overexpressed in human pancreatic cancer cells and stimulates cell proliferation through CDl47 [J]. Cancer, 2006, 6(10): 2284—2294
[29] LIU F H. The mechanism and the effect of interaction of CypA and HIF on the ability of invasion and metastasis of pancreatic cancer [D]. Tianjin Medical University. 2012 [刘凤华. CypA胰腺癌生物学行为的及影响的机制研究.博士学位论文, 天津医科大学. 2012]
THE EXPRESSION OF CYCLOPHILIN A (CyPA) IN HYRIOPSIS SCHLEGELII IN RESPONSE TO PATHOGENS AND ITS EFFECT ON THE GROWTH OF HELA CELLS
LUO Chun1, XU Ling1, HE Jing1, SHI Jian-Wu1, SHENG Jun-Qing1, PENG Kou1, WANG Jun-Hua1, HUANG Bin2and HONG Yi-Jiang1
(1. School of Life Sciences and Food Engineering, Nanchang University, Nanchang 330031, China; 2. Jiangxi Province Fisheries Technology Extension Station, Nanchang 330046, China)
In this study we explored the expression of Hyriopsis schlegelii Cyclophilin A in response to infection and the effect of this protein on the growth of Hela cells. The mRNA level of this gene in the haemocytes, liver and gonad was measured with Real-time PCR after the Aeromonas hydrophila challenge. It was observed that the transcription of HsCyPA in haemocytes, gonad and liver was significantly up-regulated at 4h after the challenge and then decreased at 8h. These results suggested that HsCyPA might be involved in the immune response. The complete ORF of HsCyPA gene was subcloned into pET-32a (+) prokaryotic expression vector, and then expressed in E. coli BL21 (DE3). After the optimization of induction conditions, the soluble fusion protein was purified with Ni-NTA affinity chromatography. To test the effect of this recombinant protein on Hela cells, we diluted it into certain concentrations (50, 100, 200, 400, 800 ng/mL) and applied them into Hela cell strains through MTT assay. It was revealed that the recombinant HsCyPA could promote the proliferation of Hela cells, and the proliferation rate reached the maximum (18.5%) when the HsCyPA concentration was 100 ng/mL. These preliminary results indicated that Cyclophilin A could be a multi-functional protein which might participate in immune responses and cell growth regulation.
Hyriopsis schlegelii; Cyclophilin A; Real-time PCR; Prokaryotic Expression; Hela cell; MTT assay
S944.4
A
1000-3207(2015)03-0475-07
10.7541/2015.63
2014-06-16;
2014-11-05
国家自然科学基金(31160534); 江西省科技落地计划(KJLD12001); 江西省自然科学基金(20122BAB204016)资助
罗春(1988—), 男,江西赣州瑞金人; 硕士; 主要研究方向水生生物遗传育种学。E-mail: 517684206@qq.com
洪一江(1963—),男,福建南安人; 教授, 博导; 主要研究方向为水生动物遗传育种学。E-mail: yijianghong@126.com
