银鲫精巢特异的Ly-6/uPAR相关蛋白的分子克隆及其特征分析
2015-02-27伟刘珍周莉李志桂建芳
王 伟刘 珍周 莉李 志桂建芳
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
银鲫精巢特异的Ly-6/uPAR相关蛋白的分子克隆及其特征分析
王 伟1,2刘 珍1,2周 莉1李 志1桂建芳1
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
Ly-6/uPAR基因超家族(Ly-6 SF)成员广泛地存在于后生动物中, 开展该家族相关功能基因研究具有重要的意义。研究从银鲫(Carassius auratus gibelio)中鉴定到一个该家族新成员, cDNA全长为570 bp, 其中开放阅读框长度为300 bp, 编码99个氨基酸, 生物软件预测该蛋白含有一个LU结构域, 不含GPI锚信号序列, N端含有信号肽, 表明其可能为Ly-6基因超家族中分泌型蛋白。组织表达分析显示, 该基因只在银鲫精巢中特异表达, 且又是Ly-6基因超家族中一员, 因此将其命名为银鲫精巢特异的Ly-6/uPAR相关蛋白(Carassius auratus gibelio testis-specific Ly-6/uPAR related protein, 简称CagTslurp)。原位杂交结果显示, 该基因在银鲫精巢的精原细胞, 初级精母细胞以及次级精母细胞中表达, 精子细胞中存在少量的表达, 而在体细胞中不表达。这种精巢特异的表达模式, 暗示CagTslurp在银鲫精子发生中可能发挥了作用。
银鲫; Ly-6基因超家族; CagTslurp; 精巢特异; 精子发生; 原位杂交
Ly-6基因家族成员被认为在哺乳动物天然免疫和适应性免疫中发挥了重要作用。该家族基因结构特点为至少含有一个保守的 LU结构域, 显著特征是含有 8—10个半胱氨酸残基, 这些半胱氨酸残基会形成4—5对保守的二硫键模式[1,2]。大多数Ly-6家族成员只含有一个 LU结构域, 但是目前研究发现小鼠RoBo-1(Rodent Bone)[3]和人类CD177[4]有两个 LU结构域, 以及人类尿激酶型纤溶酶原激活物受体(Urokinase-type plasminogen activator receptor, uPAR)[5]有三个LU结构域。根据蛋白末端是否含有GPI锚信号, 可以将该家族成员分为两类, 一类为蛋白末端具有 GPI锚信号的膜蛋白, 主要成员包括CD59[6]、前列腺干细胞抗原(Prostate stem cell antigen, PSCA)[7]、精子顶体膜相关蛋白(sperm acrosomal membrane-associated protein 14, SAMP14)[8]等;另一类为蛋白末端不含GPI锚信号的蛋白, 其中大多数为分泌型蛋白, 包括分泌型 Ly-6/uPAR相关蛋白(Secreted Ly-6/uPAR related protein 1, SLURP-1)[9]、SLURP-2[10]、差异调节鳟蛋白(Differentially regulated trout protein 1, Drtp1)[11], 以及蛇神经毒素(Snake neurotoxin)[12]等。
目前, 关于该家族成员的报道在人类、小鼠、果蝇以及蛇中相对较多, 如人类中目前至少存在 45个家族成员[13], 而果蝇中至少存在35个家族成员[14]。鱼类中该家族成员的报道还较为缺乏, 如目前在模式生物斑马鱼中克隆鉴定的 ly-6家族成员, 仅有关于 lypd6、lye、lypd6b和CD59的报道[15,16]。研究认为家族成员的表达模式一般可分为两种, 组织特异表达和广泛性表达[17], 如人类中SLURP-1基因是哺乳动物中最先发现的分泌型蛋白, 在多个组织中表达[8], 而家族成员 SAMP14却为精巢特异表达基因[9]; 如在小鼠中, 家族成员 Lynx-1[18]和 Lynx-2[19]主要在神经系统中表达, 而Robo-1却主要在骨和软骨生长板中表达; 如在果蝇中, 家族成员 boudin、crooked、coiled以及 crimpled主要在胚胎发育外胚层和气管中表达[14,20]。此外, 家族成员之间的同源性较低, 大多数成员氨基酸相似性只有 20%—30%,众多成员的具体功能尚待研究[21]。
银鲫具有单性雌核生殖和有性生殖的多种生殖方式, 已成为脊椎动物发育生物学研究的特殊材料之一[22,23]。在天然种群中, 银鲫存在少量(大约5%—20%)但又极其重要的雄性成员。通过银鲫遗传背景差异较大的两个克隆系间的有性交配, 筛选出优良个体经5 代单性雌核生殖扩群, 培育出“中科3号”新品种, 该品种具有生长快、出肉率高、抗肝脏寄生的吴李碘泡虫以及遗传稳定等特点, 已成为鲫养殖中的主要品种[24—26]。本研究从银鲫“中科3号”中克隆鉴定到CagTslurp, 为 Ly-6基因家族新成员,在精巢组织特异表达, 原位杂交表明 CagTslurp主要在精原细胞, 精母细胞中表达, 而精子细胞有少量的表达。CagTslurp的克隆鉴定可能为进一步研究ly-6基因家族, 以及银鲫精子发生提供新的线索和基础参考。
1 材料与方法
1.1 实验材料
实验所用银鲫“中科 3号”, 均饲养在中国科学院水生生物研究所官桥实验基地。取性成熟银鲫“中科3 号”的性腺(精巢、卵巢)、脑、垂体、脾脏、肝脏、肾脏、肌肉和心脏等9个组织, 液氮速冻, –80℃保存。取未受精卵、4细胞期、256细胞期、sphere时期、30%外包期、75%外包期、出芽期、5体节、26体节、受精后1天、受精后2天的胚胎液氮速冻,–80℃保存。
1.2 银鲫CagTslurp全长cDNA克隆
提取银鲫“中科3号”精巢组织的总RNA, 用购自Clontech公司的SMART cDNA合成试剂盒合成银鲫精巢 cDNA 文库, 具体文库构建步骤可详见SMART cDNA synthesis Kit (Clontech)操作手册。以本实验室银鲫“中科3号”性腺转录组测序获得的序列片段为基础, 设计3′-RACE-F1、3′-RACE-R1和5′-RACE-F1、5′-RACE-R1引物(表1), 按照SMARTTMRACE cDNA Amplification Kit 操作说明书, 进行5′和 3′RACE, 从精巢cDNA文库中扩增CagTslurp的5′端与3′端[27]。PCR反应条件如下: 94℃预变性2min; 94 ℃ 30s; 60 ℃ 30s; 72 ℃ 1min; 35个循环之后72℃10min; 4 ℃ 5min 。PCR产物经1%琼脂糖凝胶电泳分离检测后, 切胶回收相应的目的片段, 并克隆到pMD18-T载体上, 16℃水浴连接4h。连接产物转化DH5α大肠杆菌, 挑单克隆摇菌, PCR筛选阳性克隆送测序, 测序后进行结果比对拼接, 获得 CagTslurp cDNA全长序列。
1.3 银鲫CagTslurp编码的氨基酸序列分析
通过NCBI网络服务器上的ORF Finder软件预测cDNA序列的ORF, 并翻译成氨基酸序列。使用SignalP 3.0 server (http://www.cbs.dtu.dk/services/ SignalP/)预测蛋白信号肽; Smart (http://smart.emblheidelberg.de/)对蛋白的结构域进行预测; 利用PreGPI (http://gpcr2.biocomp.unibo.it/gpipe/index.htm)对蛋白进行 GPI信号预测。ClusterX和 GeneDoc进行氨基酸多重序列比对, MEGA5.0邻位相接法(Neighbor-Joining, NJ)构建家族系统进化树, 置信度(Bootstraps)1000次检验各分支置信度[28]。SWISSMODEL软件进行三维蛋白同源建模结构比较(http://swissmodel.expasy.org/)。

表1 银鲫CagTslurp基因cDNA克隆与表达分析引物Tab. 1 Primers designed for cloning and expression analysis of gibel carp CagTslurp gene
1.4 半定量PCR和荧光定量PCR
采用Trizol与SV Total RNA试剂盒相结合的方法进行 RNA的提取, 1%的琼脂糖凝胶电泳检测RNA的质量。逆转录酶Powerscrit 和oligo(dT)反转录获得银鲫组织和胚胎时序 cDNA, 并以斑马鱼β-actin引物(表1)为内参。以银鲫CagTslurp cDNA序列为基础, 设计特异性跨内含子引物 CagTslurp-F1和CagTslurp-R1(表1), 半定量RT-PCR分析该基因在组织以及胚胎时期的表达状况。荧光定量PCR检测 CagTslurp基因在组织中的相对表达量, 实验中每个样品重复3次并以β-actin基因为内参, 实验结果用2–ΔΔCt方法[29]进行数据处理和分析。
1.5 原位杂交
根据银鲫CagTslurp基因的cDNA全长, 在引物5′端加入T7启动子序列, PCR扩增基因的同一片段,将带有T7启动子的DNA片段连接到pMD18-T载体, 克隆并测序。克隆正确的质粒为模板进行PCR,纯化回收 DNA片段, 体外转录获得带地高辛标记的反义和正义RNA探针, 1%琼脂糖电泳检测RNA探针的质量。原位杂交 PCR引物 CagTslurp-F2、CagTslurp-R2、CagTslurp-F3、CagTslurp-R3(表1)。取银鲫精巢, 于 4% PFA中 4℃环境固定 16—18h,再经30%蔗糖4℃渗透过夜, OTC包埋后进行冰冻切片, 切片的厚度为8 μm。之后利用地高辛标记的RNA探针进行切片原位杂交, 实验过程主要包括:切片复水、蛋白酶消化、PFA固定、杂交、洗脱、抗体孵育、染色、显色等步骤, 具体操作步骤可参照本实验室方法[30—32]。
2 结果
2.1 银鲫CagTslurp cDNA序列与氨基酸序列分析
以银鲫“中科3 号”精巢cDNA文库为模板, 进行3′-RACE和 5′-RACE 扩增, 结果在250—500 bp分别获得单一、明亮的目的片段, 克隆并测序, 结果3′端扩增片段大小为 497 bp, 而 5′端片段大小为343 bp。对序列进行拼接后 PCR验证, 获得银鲫CagTslurp cDNA的全长序列。该序列全长为570 bp,开放阅读框有300个核苷酸, 编码 99个氨基酸, 5′非编码区为 48 bp, 3′非编码区为 222 bp, 位于poly(A)序列上游有加尾信号序列AATAA, Genbank登录号 KP403808。PreGPI预测结果显示该CagTslurp蛋白序列中不含GPI锚信号, Sigal P 3.0 server软件预测结果显示其N端含有一个长度为20个氨基酸的信号肽, 预示着 CagTslurp很可能是一个分泌型蛋白。SWISS- MODEL软件三维蛋白同源建模结构比较结果显示, CagTslurp蛋白的LU结构域和家族成员 Lynx-1[33]蛋白相类似, 都有“三指”结构。Smart protein在线软件对蛋白功能结构域预测分析显示该蛋白第 29—99位氨基酸为 LU结构域,含有10个半胱氨酸残基构成五对二硫键。该蛋白的C 端存在典型的“CCXXXXCN”基序, 提示CagTslurp是Ly-6基因家族中的一名成员。
2.2 银鲫CagTslurp氨基酸同源性分析和系统进化树构建
银鲫CagTslurp氨基酸序列经NCBI中protein blast比对, 首先, 一致性最高的为斑马鱼未知蛋白序列, 有 53.5%的一致性; 其次为罗非鱼(Oreochromis niloticus) CD59B like预测序列, 有37.8%的一致性; 与慈鲷(Pundamilia nyererei) CD59B like序列,一致性为35.6%; 再者为斑马鱼CD59B like预测序列, 一致性为34.7%; 与虹鳟(Oncorhynchus mykiss)和美洲红点鲑 (Salvelinus fontinalis )Drtp1序列, 一致性分别为32.9%和31.8%。同时, 从NCBI数据库中搜索出部分代表性物种的Ly-6基因超家族成员氨基酸序列, 利用ClusterX与GeneDoc进行家族成员序列多重比对, 比对的结果显示家族成员之间氨基酸一致性偏低, 但序列中 8—10个半胱氨酸和末端“CCXXXXCN”基序相对保守。MEGA5.0软件中N-J法构建 Ly-6基因家族系统进化树显示, 银鲫CagTslurp先与斑马鱼未知蛋白在一个分支, 再与罗非鱼以及慈鲷 CD59B like成为一簇, 之后与SLURP1相簇成一个亚支; 而 CD59、Drtp1和Neruotoxin先各自组成一个亚支, 再与CagTslurp所在亚支构成家族系统进化树(图1)。
2.3 银鲫组织中CagTslurp基因表达分析
以各组织cDNA为模板, β-actin为参照基因进行半定量 RT-PCR。结果表明仅在银鲫“中科 3号”雄鱼精巢组织中扩出一条与预期大小一致的条带,而在其他的8个组织中均未扩出条带(图2A), 表明银鲫CagTslurp为精巢特异表达。荧光定量PCR结果进与半定量RT-PCR的结果相同, CagTslurp基因精巢特异表达, 其精巢中的表达量约为β-actin基因的1.4倍(图2B)。以胚胎时序cDNA为模板, β-actin为内参调节模板浓度后进行半定量 RT-PCR, 结果胚胎各时期都未扩出相应的目的条带, 说明该基因在胚胎时期不表达(图未示)。
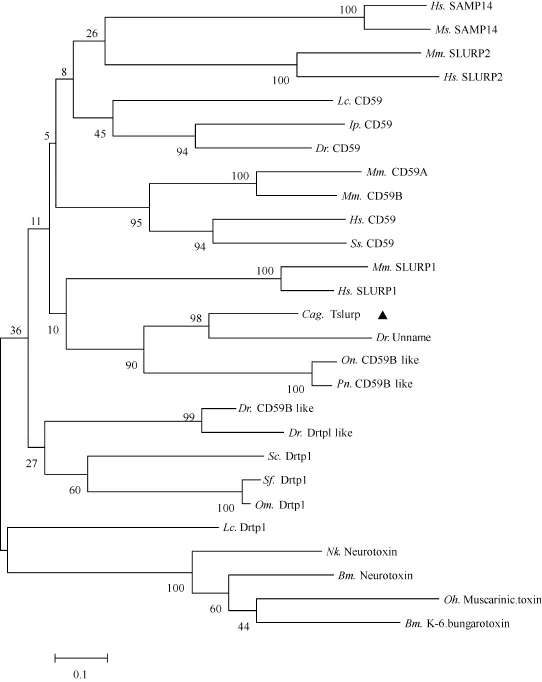
图1 基于NJ法构建的Ly-6家族成员的系统进化树Fig. 1 Phylogenetic tree of Ly-6 superfamily factors based on N-J method
2.4 原位杂交
为了揭示 CagTslurp基因在银鲫精巢组织的哪类细胞表达, 我们进行了原位杂交实验。反义RNA探针结果(图3A)显示, CagTslurp主要在精巢精原细胞、初级精母细胞、次级精母细胞中表达、精子细胞中有少量表达, 体细胞中不表达。从银鲫的精巢中可以观察到, 其中细胞体积较大的为精原细胞, 比精原细胞体积略小的为初级精母细胞, CagTslurp信号在此类细胞中最强; 而体积比初级精母细胞略小的为次级精母细胞, 可分裂形成圆形、细胞体积更小的精子细胞。正义RNA探针作为原位杂交实验对照, 精巢细胞中均未检测到信号(图3B)。

图3 CagTslurp基因在银鲫精巢中表达的原位杂交检测Fig. 3 In situ hybridization detection of CagTslurp gene expression in testis of gibel carp
3 讨论
本研究以银鲫“中科 3号”为研究对象, 获得CagTslurp基因的cDNA全长。氨基酸序列分析显示,第29—99氨基酸为一个LU结构域, 且末端含有保守的“CCXXXXCN”氨基酸基序, 从而提示该基因是Ly-6基因超家族中的一员。家族氨基酸多重序列比对结果显示, 其中一致性最高为斑马鱼未知蛋白序列, 有 53.5%的一致性, 其次为罗非鱼预测的CD59B like, 有37.8%的一致性, 与Drtp1的一致性在20%—33%, 和SLURP、SAMP14以及Neruotoxin等成员一致性更低。构建的系统发育树结果表明, CagTslurp首先与斑马鱼未知蛋白在一个分支, 再和预测的CD59B like以及SLURP簇为一支。对虹鳟CD59 like-1(AAT94063)和CD59 like-2 (CAI54280)的鉴定表明 CD59 like与 CD59一样, 都含有 GPI锚[11,34]。生物信息学分析表明, 银鲫CagTslurp蛋白, N端含有一个信号肽, C端不含GPI锚。因此本研究鉴定的银鲫 CagTslurp不是 CD59B-like, 而应该是Ly-6超家族分泌型相关蛋白中的新成员, 且又为精巢特异表达, 所以该基因命名为CagTslurp。
Ly-6超家族成员被认为与机体的免疫过程有关。随着研究的深入, 性腺中表达Ly-6家族成员也在逐渐被鉴定, 其功能可能是调节或保护性腺中的细胞, 使其免受机体免疫系统的攻击[35]。譬如, 小鼠CD59b在睾丸高度表达, 其他组织仅有微量的表达, 研究显示在精子顶体反应激活和维持精子活力中起重要作用[36,37]; 人类Ly-6超家族成员SAMP14精巢特异表达, 其功能与精子和卵子融合有关[9];在鱼类成熟的卵母细胞以及排出的卵细胞中都能检测到 drtp1转录本, 推测其功能可能与鱼类的繁殖有关[35]。从组织表达分析结果上, CagTslurp与家族成员 SAMP14表达模式相同, 都为精巢特异表达,但两者仅有15.2%一致性, 且成员SAMP14为GPI锚定的膜蛋白, 而 CagTslurp更应该是分泌型蛋白,所以CagTslurp是否会有类似于SAMP14的生物学功能还尚不清楚。
银鲫 CagDzal的克隆鉴定与表达分析显示, 银鲫精子发生是一个极为复杂的细胞分化过程, 始于原始生殖细胞, 相继经历精原细胞、初级精母细胞、次级精母细胞、精子细胞阶段, 最后变态形成精子,会受到许多内在和外在因素的影响[31]。CagTslurp基因精巢组织特异表达, 且原位杂交结果显示CagTslurp主要在精原细胞和精母细胞表达, 精子细胞中有少量的表达, 体细胞中没有表达, 暗示着其可能与银鲫性腺发育过程中的精子发生有关, 可能是一种参与调控银鲫精子发生基因。从原位杂交信号上分析, CagTslurp在精巢的精原细胞和精母细胞中信号更强, 在精子细胞中的信号较弱, 这暗示CagTslurp基因更可能是在银鲫的精子发生过程中精原细胞的增殖和精母细胞的形成阶段起着重要作用。本实验室曾发现 Spindlin基因在银鲫卵巢特异表达并与卵母细胞成熟过程有关[38], 而 CagTslurp基因是精巢特异表达, 具体的功能与机制还有待进一步的研究。
[1] Kong H K, Park J H. Characterization and function of human Ly-6/uPAR molecules [J]. BMB Reports, 2012, 45(11): 595—603
[2] Mallya M, Campbell R D, Aguado B. Characterization of the five novel Ly-6 superfamily members encoded in the MHC, and detection of cells expressing their potential ligands [J]. Journal of Protein Science, 2006, 15(10): 2244—2256
[3] Noel L S, Champion B R, Holley C L, et al. RoBo-1, a ovel member of the urokinase plasminogen activator receptor /CD59/Ly-6/snake toxin family selectively expressed in rat bone and growth plate cartilage [J]. Journal of Biological Chemistry, 1998, 273(7): 3878—3883
[4] Stroncek D F, Caruccio L, Bettinotti M. CD177: A member of the Ly-6 gene superfamily involved with neutrophil proliferation and polycythemia vera [J]. Journal of Translational Medicine, 2004, 2(1): 8
[5] Blasi F, Carmeliet P. uPAR: a versatile signaling orchestrator [J]. Journal of Nature Reviews Molecular Cell Biology, 2002, 3(12): 932—943
[6] Yeh H Y, Klesius P H. Molecular cloning and expression of channel catfish, Ictalurus punctatus, complement membrane attack complexinhibitor CD59 [J]. Veterinary Immunology and Immunopathology, 2007, 120(3—4): 246—253
[7] Martin H, Julie K, David W, et al. Prostate stem cell antigen is an endogenous lynx1-like prototoxin that antagonizes alpha7 containing nicotinic receptors and prevents programmed cell death of parasympathetic neurons [J]. Journal of Neuroscience, 2009, 29(47): 14847—14854
[8] Adermann K, Wattler F, Wattler S, et al. Structural and phylogenetic characterization of human SLURP-1, the first secreted mammalian member of the Ly-6/uPAR protein superfamily [J]. The Journal of Protein Society, 1999, 8(4): 810—819
[9] Shetty J, Wolkowicz M J, Digilio L C, et al. SAMP14, a novel, acrosomal membrane-associated, glycosylphosph-atidylinositol-anchoredmember of the Ly-6/urokinase-type plasminogen activator receptor superfamily with a role in sperm-egg interaction [J]. The Journal of Biological Chemistry, 2003, 278(33): 30506—30515
[10] Tsuji H, Okamoto K, Matsuzaka Y, et al. SLURP-2, a novel member of the human Ly-6 superfamily that is up-regulated in psoriasis vulgaris [J]. Genomics, 2003, 81(1): 26—33
[11] Talbot A T, Smith T J, Cairns M T. Characterisation of the differentially regulated trout protein 1 (DRTP1) gene in rainbow trout (Oncorhynchus mykiss) [J]. Fish and Shellfish Immunology, 2009, 26(4): 589—598
[12] Fleming T J, OhUigin C, Malek T R. Characterization of two novel Ly-6 genes. Protein sequence and potential structural similarity to alpha-bungarotoxin and other neurotoxins [J]. The Journal of Immunology, 1993, 150(12): 5379—5390
[13] Galat A. The three-fingered protein domain of the human genome [J]. Cellular and Molecular Life Sciences, 2008, 65(21): 3481—3493
[14] Hijazi A, Masson W, Waltzer L, et al. Boudin is required for septate junction organisation in Drosophila and codes for a diffusible protein of the Ly6 superfamily [J]. Development, 2009, 136(13): 2199—2209
[15] Özhan G, Sezgin E, Wehner D, et al. Lypd6 enhances Wnt/β-catenin signaling by promoting lrp6 phosphorylation in raft plasma membrane domains [J]. Development Cell, 2013, 26(4): 331—45.
[16] Ji D R, Liu P, Wang F, et al. Identification and expression of a novel member of Ly-6 superfamily in zebrafish Denio rerio [J]. Development Genes and Evolution, 2012, 222(2): 119—124
[17] Gumley T, Mckenzie I, Sandrin M. Tissue expression, structure and function of the murine Ly-6 family of molecules [J]. Immunology and Cell Biology, 1995, 73(4): 277—296
[18] Miwa J M, Ibanez-Tallon I, Crabtree G W, et al. Lynx1, an endogenous toxin-like modulator of nicotinic acetylcholine receptors in the mammalian [J]. Neuron, 1999, 23(1): 105—114
[19] Tekinaya A B, Nong Y, Miwa J M, et al. A role for LYNX2 in anxiety-related behavior [J]. Proceedings of the National Academy of Sciences, 2009, 106(11): 4477—4482
[20] Nilton A, Oshima K, Zare F, et al. Crooked, Coiled and Crimpled are three Ly6-like proteins required for proper localization of septate junction components [J]. Development, 2010, 137(14): 2427—2437
[21] Ni J, Lang Q Y, Bai M, et al. Cloning and characterization of a human LYPD7, a new memberof the Ly-6 superfamily [J]. Molecular Biology Reports, 2009, 36(4): 697—703
[22] Zhou L, Wang Y, Gui J F. Genetic evidence for gonochoristic reproduction in gynogenetic silver crucian carp (Carassius auratus gibelio Bloch) as revealed by RAPD assays [J]. Journal of Molecular Evolution, 2000, 51(5): 498—506
[23] Gui J F, Zhou L. Genetic basis and breeding application on clonal diversity and dual reproduction modes in polyploid Carassius auratus gibelio [J]. Science China Life Sciences, 2010, 53(4): 409—415 [桂建芳, 周莉. 多倍体银鲫克隆多样性和双重生殖方式的遗传基础和育种应用. 中国科学生命科学, 2010, 40(2): 97—103]
[24] Wang Z W, Zhu H P, Wang D, et al. A novel nucleocytoplasmic hybrid clone formed via androgenesis in polyploid gibel carp [J]. BMC Research Notes, 2011, 4(82): 1—13
[25] Gui J F, Zhu Z Y. Molecular basis and genetic improvement of economically important traits in aquaculture animals [J]. Chinese Science Bulletin, 2012, 57(15): 1751—1760 [桂建芳, 朱作言. 水产动物重要经济性状的分子基础及其遗传改良. 科学通报, 2012, 57(19): 1719—1729]
[26] Zhai Y H, Zhou L, Wang Y, et al. Proliferation and resistance difference of a liver-parasitized myxosporean in two different gynogenetic clones of gibel carp [J]. Parasitology Research, 2014, 113(4): 1331—1341
[27] Li X Y, Zhang X J, Li Z, et al. Evolutionary history of two divergent Dmrt1 genes reveals two rounds of polyploidy origins in gibel carp [J]. Molecular Phylogenetics and Evolution, 2014, 78C: 96—104
[28] Wang R, Xiao Q, Gui J F. Molecular cloning and expression analysis of fructose-1, 6-bispho-sphatase in gibel carp [J]. Acta Hydrobiologica Sinica, 2010, 34(6): 1130—1135 [王锐,肖青, 桂建芳. 银鲫果糖-1,6-二磷酸酶的分子克隆与表达分析. 水生生物学报, 2010, 34(6): 1130—1135]
[29] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(–ΔΔCt) method [J]. Methods, 2001, 25(4): 402—408
[30] Yin J, Xia J H, Du X Z, et al. Developmental expression of CagMdkb during gibel carp embryogenesis [J]. International Journal of Developmental Biology, 2007, 51(8): 761—769
[31] Peng J X, Xie J L, Zhou L, et al. Evolutionary conservation of Dazl genomic organization and its continuous and dynamic distribution throughout germline development in gynogenetic gibel carp [J]. Journal of Experimental Zoology Part B, 2009, 312(8): 855—871
[32] Zhong J X, Zhou L, Gui J F, et al. Zebrafish Noxa promotes mitosis in early embryonic development and regulates apoptosis in subsequent embryogenesis [J]. Cell Death and Differentiation, 2014, 21(6): 1013—1024
[33] Lyukmanova E N, Shenkarev Z O, Shulepko M A, et al. NMR structure and action on nicotinic acetylcholine receptors of water-soluble domain of human LYNX1 [J]. Journal of Biological Chemistry, 2011, 286(12): 10618—10627
[34] Papanastasiou D, Georgaka E, Zarkadis I. Cloning of a CD59-like gene in rainbow trout expression and phylogenetic analysis of two isoforms [J]. Molecular Immunology, 2007, 44(6): 1300—1306
[35] Lee P H, Goetz F W. Characterization of a novel cDNAobtained through differential-display PCR of phorbol ester-stimulated ovarian tissue from the brook trout (Salvelinus fontinalis) [J]. Molecular Reproduction and Development, 1998, 49(2): 112—118
[36] Qin X, Dobarro M, Bedford S J, et al. Further characterization of reproductive abnormalities in mCd59b knockout mice: a potential new function of mCd59 in male reproduction. [J]. Journal of Immunology, 2005; 175(10): 6294—6302
[37] Sun C, Wu J, Liu S S, et al. Zebrafsh CD59 has both bacterial-binding and inhibiting activities [J]. Developmental and Comparative Immunology, 2013, 43(3): 850—858
[38] Wang X L, Sun M, Mei J, et al. Identification of a Spindlin homolog in gibel carp (Carassius auratus gibelio) [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2005, 141(2): 159—167
MOLECULAR CLONING AND EXPRESSION ANALYSIS OF TESTIS-SPECIFIC Ly-6/uPAR RELATED PROTEIN IN GIBEL CARP
WANG Wei1,2, LIU Zhen1,2, ZHOU Li1, LI Zhi1and GUI Jian-Fang1
(1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
The members of Ly-6/uPAR superfamily distribute widely in many metazoans. All proteins from this family have at least one conserved Ly-6/uPAR (LU) domain which is composed of about 70 to 100 amino acids, and contain 8 to 10 cysteine residues with a defined disulfide-bonding pattern. The members of Ly-6 family are classified into two subfamilies, namely GPI-anchored membrane proteins and secreted proteins, according to whether they possess the glycophosphatidyl inositol (GPI)-anchored signal sequence in the C-terminus. In this study, we cloned and characterized a new member of Ly-6 superfamily in gibel carp (Carassius auratus gibelio). The full-length sequence of this gene consisted of 570 base pairs that encoded 99 amino acids and had only one LU domain. Our analysis using on-line bioinformatic software showed that this protein might have one signal peptide but no GPI-anchor signal sequence, thus could be a type of secreted protein. We conducted RT-PCR to detect its expression in different tissues and found that this protein was specifically expressed in testis. According to its characteristics, we named the gene Carassius auratus gibelio testisspecific Ly-6/uPAR related protein (CagTslurp). In situ hybridization revealed the expression of CagTslurp in spermatogonia, primary spermatocytes, secondary spermatocytes and spermatids, but not in somatic cells. These results indicated that the CagTslurp gene might play a role in spermatogenesis of gibel carp.
Carassius auratus gibelio; Ly-6 superfamily; CagTslurp; Testis; Spermatogenesis; In situ hybridization
Q344+.1
A
1000-3207(2015)03-0441-08
10.7541/2015.59
2014-04-22;
2014-08-15
国家自然科学基金(31123001); 淡水生态与生物技术国家重点实验室(2011FBZ17)资助
王伟(1989—), 男, 江西上饶人; 硕士研究生; 主要研究方向为发育遗传学。E-mail: ncussww@126.com
桂建芳, E-mail: jfgui@ihb.ac.cn
